Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.14 n.2 Lima dic. 2007
Waldir Estela1,3, Mojmír Rychtera1, Karel Melzoch1, Elena Quillama2 y Erida Egoavil2
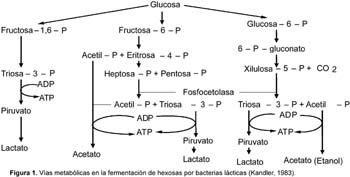
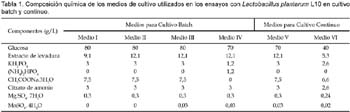
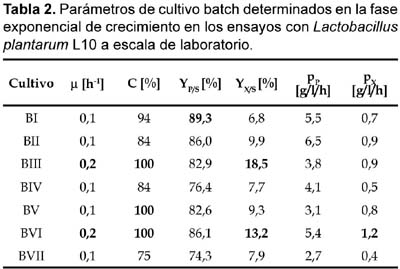
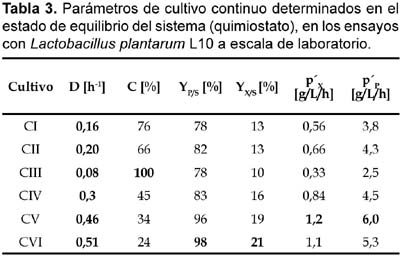
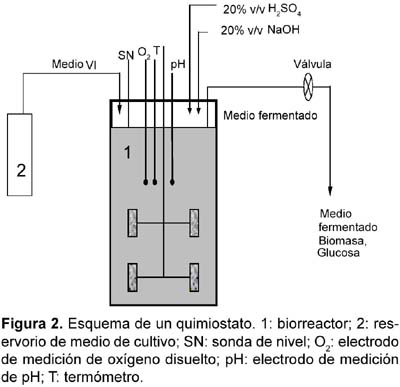
1 Universidad de Tecnología Química, Praga, Departamento de Fermentación Química y Bioingeniería, Praga, República Checa. Resumen Se ha ensayado a escala de laboratorio la cepa Lactobacillus plantarum L10, para la producción de ácido láctico en cultivos batch y continuo; además se ha optimizado la composición del medio y las condiciones de cultivo para este propósito. Los mejores parámetros de producción de ácido láctico encontrados en cultivo batch fueron los siguientes: YP/S 86,1%; PP 5,4 g/L/h; unido a YX/S 13,2%; PX 1,2 g/L/h y n = 0,2 h-1, el cultivo se ha llevado a cabo en un medio conteniendo glucosa 70 g/L; extracto de levadura 12,1 g/L; KH2PO4 1,2 g/L; (NH4)2HPO4 1,2 g/L; citrato de amonio 3,0 g/L; MgSO4. 7H2O 0,3 g/L y MnSO4. 4H2O 0,03 g/L. Así mismo los mejores parámetros de producción de ácido láctico encontrados en cultivo continuo fueron los siguientes: YP/S 96%; P´P 6,0 g/L/h; unido a YX/S 19 %; P´X 1,2 g/L/h; y tasa de dilución (D) 0,46 h-1. Palabras clave: Bacterias lácticas, Lactobacillus plantarum, cultivo batch, cultivo continuo, quimiostato, ácido láctico. Abstract Strain of Lactobacillus plantarum L10 was tested at laboratory scale, in order to evaluate the production of lactic acid on batch and continuous cultivation. Furthermore, optimization of culture medium and cultivation conditions were carried out too. The best parameters obtained for lactic acid production on batch cultivation were: YP/S 86,1%; PP 5,4 g/L/h; joined to YX/S 13,2%; PX 1,2 g/L/h and n = 0,2 h-1, the medium composition was as follows: glucose 70 g/L; yeast extract 12,1 g/L; KH2PO4 1,2 g/L; (NH4)2HPO4 1,2 g/L; ammonium citrate 3,0 g/L; MgSO4. 7H2O 0,3 g/L and MnSO4. 4H2O 0,03 g/L. Respecting to continuous cultivation the best parameters obtained for production of lactic acid were: YP/S 96%; P´P 6,0 g/L/h; joined to YX/S 19%; P´X 1,2 g/L/h; and dilution rate (D) 0,46 h-1. Keywords: Lactic bacteria, Lactobacillus plantarum, batch cultivation, continuous cultivation, chemostat, lactic acid. Introducción El ácido láctico es de amplio uso en la industria; debido a sus características benéficas, se utiliza en la industria alimentaria (en bebidas y como conservante), en farmacia, medicina, textileria, en la industria del cuero y para la producción de plásticos biodegradables (Lederberg, 1992). El Food Chemical Codex en el año 1996 especifica el uso del acido láctico en alimentos con una pureza del 88%. El ácido láctico se puede obtener por síntesis química ó por vía fermentativa. En la actualidad se prefiere la vía fermentativa, debido a la necesidad de obtener ácido láctico opticamente puro (Goksungur y Guvenc, 1999; Szabo y Kirisci, 1998). La principal desventaja de la producción por la vía fermentativa es el alto costo que ocasionan su aislamiento y purificación, por esta razón las investigaciones se han enfocado en la disminución del costo de producción e incrementar la pureza óptica del ácido láctico. Los factores limitantes en la producción de ácido láctico por la vía fermentativa son principalmente, la baja concentración de bacterias lácticas en el sistema y la inhibición del crecimiento por el producto (Monteagudo y Aldavero, 1999; Kulozik, 1998). Las bacterias lácticas están conformadas por un amplio grupo de bacterias no esporuladas, Gram positivas y que metabolizan un amplio rango de azúcares para producir principalmente ácido láctico (Holt et al., 1998; Herrero et al., 1996). Debido al gran número de bacterias lácticas sólo son de interés los géneros altamente productores de ácido láctico. Para la producción industrial de ácido láctico son de mayor importancia las bacterias lácticas homofermentativas, aquellas que sólo producen ácido láctico (Gonzáles et al., 2000; Foo et al., 1993). Los mayores productores de ácido láctico pertenecen a las familias Streptococcaceae (géneros Streptococcus, Lactococcus, Leuconostoc, Pediococcus, Aerobacter y Gemella) y Lactobacillaceae (género Lactobacillus), (Ben Amor et al., 2007; Foo et al., 1993). El género Lactobacillus está comprendida por bacterias en forma bacilar de 0,5 _ 1,2 x 1,0 _ 10,0 nm, comúnmente se asocian en cadenas cortas, son anaerobias facultativas ó microaerófilas, catalasa y citocromo negativos (Foo et al., 1993). Excepcionalmente pueden poseer motilidad, se mueven ayudados por flagelos peritricos. Los lactobacilos son auxótrofos quimioorganotróficos, necesitan medios complejos para su crecimiento, degradan la sacarosa para producir lactato. La temperatura óptima de crecimiento de los lactobacilos está entre 30 _ 40 °C (Foo et al., 1993; Morishita et al., 1981). Su habitat natural es variado pudiéndolos encontrar en el aparato gastrointestinal de mamíferos y aves, incluyen alimentos de origen vegetal y animal (Callon et al., 2004; Holt et al., 1998). El presente trabajo de investigación tiene como objetivo optimizar la producción de ácido láctico utilizando Lactobacillus plantarum L10 cultivado en sistemas batch y continuo, así como también optimizar la composición del medio de fermentación para facilitar el proceso de aislamiento y purificación del producto. Metabolismo de hexosas La fermentación de hexosas se realiza por tres vías metabólicas principales (Fig. 1) (Kandler, 1983). Los lactobacilos homofermentativos como son estreptococos y pediococos utilizan la vía de glucosa EMP, y se caracterizan por degradar fructosa _1,6_difosfato aldosa en dos triosasfosfatos, los cuales son convertidos en lactato (Kandler, 1983; Hiyama et al., 1968). Teóricamente esta vía origina a partir de un mol de glucosa, dos moles de lactato. Sin embargo, el rendimiento real a condiciones de laboratorio e incluso de operación es de aproximadamente el 90% del rendimiento teórico (Bruno_Bárcena et al., 1999; Akeberg et al., 1998). Algunas especies del género Lactobacillus son heterofermentativos facultativos; en condiciones de anaerobiosis y microaerobiosis se comportan como homofermentativos, y en condiciones aeróbicas forman además de ácido láctico, ácido acético, acetoina y peroxido de hidrógeno (Li et al., 2006; Porro et al., 1999). Las bacterias heterofermentativas obligadas como por ejemplo el género Leuconostoc, oxidan la glucosa _ 6 _ fosfato a 6 _ fosfogluconato. El producto final de su metabolismo es una mezcla equimolar de lactato, CO2 y etanol ó acetato (Kandler, 1983). Materiales y métodos Microorganismo utilizado Para los ensayos de cultivo batch y continuo se utilizó la cepa Lactobacillus plantarum L10, adquirida del Instituto de Tecnología de Leche y Grasa de la Facultad de Tecnología de Alimentos de la Universidad Tecnología Química de Praga, República Checa. Conservación de la cepa La cepa Lactobacillus plantarum L10 se conservó a una temperatura de _80 °C en una cámara de congelación profunda. El medio de conservación estuvo compuesto de 2/3 partes de suspensión de bacterias lácticas en medio MRS y de 1/3 parte de glicerol como crioprotector. Las células en suspensión se colectaron en la fase exponencial de su crecimiento. Composición del medio de cultivo Los medios de cultivo para los ensayos de cultivo batch y continuo estuvieron compuestos de glucosa como fuente de carbono, extracto de levadura como fuente compleja de nitrógeno y sales. El pH de los medios se ajustó a 5,8. Los medios con más de 40 g/L de glucosa se esterilizaron por separado tanto la fuente de carbono como la fuente de aminoácidos (extracto de levadura), a fin de proteger de la posible reacción de Maillard. Para los ensayos de cultivo batch se utilizó medios de cultivo con diferentes concentraciones de nutrientes, en algunos de ellos se adicionó menos cantidad de sales de manganeso (ver Tabla 1). Uno de los objetivos de la investigación ha sido optimizar la composición del medio de cultivo para facilitar el proceso de aislamiento y purificación del producto final, esto implicó disminuir el contenido de sales en la composición de los medios de cultivo y por otra parte se buscó minimizar el contenido de glucosa residual en el producto final. En el medio V por esta razón se disminuyó el contenido de KH2PO4 para agregar (NH4)2HPO4 (compuesto menos ácido) y a la vez eliminar la adición de acetato de sodio. Así mismo, para los ensayos de cultivo continuo en quimiostato se utilizó un medio de cultivo con menos concentración en sales para facilitar el aislamiento y purificación del producto final (ver Tabla 1). Esterilización de equipos Para eliminar el riesgo de contaminación se esterilizaron los medios de cultivo, el biorreactor y otros accesorios (tubos capilares, mangueras, embudos, etc.). La esterilización se realizó en autoclave a presión de 0,1 MPa, y 120 °C. Los volúmenes pequeños se esterilizaron durante 20 minutos, y los volúmenes grandes y el biorreactor se esterilizaron durante 45 minutos. Biorreactor y accesorios Todos los ensayos de cultivo se realizaron en un biorreactor de dos litros (B. Braun Biotech Internacional, Alemania), el cual estuvo conectado a una unidad de medición y regulación micro _ DCU _ 300. El biorreactor estuvo provisto también de un agitador de turbina con empaquetaduras mecánicas herméticas y una unidad de regulación MCU _ 200, la cual estuvo provista de tres bombas peristálticas, dos de ellas se usaban para regular el pH, el tercero para la alimentación con algún sustrato ó agente antiespumante. En los ensayos, el pH se reguló on line con soluciones de NaOH y H2SO4 al 20 %v/v. Para la aireación del medio de fermentación, el biorreactor estuvo provisto de un conducto que transportaba aire estéril hacia su interior. La temperatura se controló mediante una sonda que se sumerge en el medio de cultivo dentro del biorreactor. Todos los procesos de cultivo han sido monitoreados ayudado de un software que a la vez coleccionaba los datos en una computadora conectada a la unidad de medición del biorreactor. Métodos de cultivo Preparación del inóculo La propagación de las bacterias lácticas se llevó a cabo en cultivo estático a 37 °C durante 10_12 horas, luego de ello se inoculó en el biorreactor. El inóculo se preparó en dos vasos Erlenmeyer de 250 mL conteniendo en cada uno 100 mL de medio de cultivo MRS (52,2 g/L tal como es recomendado por el proveedor). El biorreactor conteniendo dos litros de medio de cultivo se inoculó asépticamente con 200 mL de inóculo. Cultivo batch Se llevaron a cabo siete ensayos de cultivo batch en biorreactor con un volumen de trabajo de 2200 mL (2000 mL de medio de cultivo y 200 mL de inóculo). Los ensayos BI, BII y BIII se llevaron a cabo sin aireación, utilizando los medios de cultivo I, II y IV respectivamente (ver Tabla 2). Los ensayos BIV, BV y BVI se airearon durante dos horas (flujo de aire 50 L/h) y se cultivaron en los medios II, III y IV. En el caso del cultivo BVII, se burbujeó con nitrógeno gaseoso (flujo 25 L/h) durante ocho horas y se utilizó el medio de cultivo II. En todos los cultivos se determinaron los coeficientes de rendimiento de biomasa (YX/S) y ácido láctico (YP/S) por sustrato consumido; así como también la productividad volumétrica de biomasa (PX) y ácido láctico (PP) en la fase exponencial del crecimiento. Además se determinó la conversión de sustrato (C%) y la velocidad de crecimiento específico (n). Todos los cultivos se llevaron a cabo a 37 °C, pH 5,8; y a velocidad de agitación de 500 rpm. Cultivo continuo en quimiostato Se realizaron seis ensayos de cultivo continuo en régimen de quimiostato en biorreactor a diferentes tasas de dilución (D). Las tasas de dilución ensayadas fueron las siguientes; para el cultivo CI (0,16 h-1); cultivo CII (0,20 h-1); cultivo CIII (0,08 h-1) cultivo CIV (0,3 h-1); cultivo CV (0,46 h-1) y para el cultivo CVI (0,51 h-1) respectivamente (ver Tabla 3). Todos los cultivos se iniciaron como cultivo batch utilizando el medio V; luego de 10 horas (cultivos CI, CII), 9 horas (cultivos CIII, CIV) y 8 horas (cultivos CV, CVI), cuando los cultivos alcanzaron la fase exponencial de crecimiento se comenzó a suministrar el medio VI y evacuar la misma cantidad de medio fermentado para mantener el volumen constante en el biorreactor. Los cultivos batch para los ensayos CI y CII se airearon durante las dos primeras horas (flujo de aire 50 L/h). Los demás cultivos se realizaron sin aireación. En todos los cultivos se determinaron los coeficientes de rendimiento de biomasa (YX/S) y ácido láctico (YP/S) por sustrato consumido; así como también la productividad volumétrica de biomasa (P´X) y ácido láctico (P´P) en el estado de equilibrio en el quimiostato. Además se determinó la conversión de sustrato (C%). Todos los cultivos se llevaron a cabo a 37 °C, pH 5,8; y a velocidad de agitación de 500 rpm. Para determinar los coeficientes de rendimiento y la productividad volumétrica fue necesario alcanzar el estado de equilibrio. El estado de equilibrio se consideró cuando los valores evaluados (concentración de ácido láctico, glucosa y biomasa seca) no se modificaron significativamente al realizar dos mediciones consecutivas. El diagrama del quimiostato se muestra en la figura 2. Métodos analíticos Obtención de muestras En los ensayos de cultivo batch las muestras se colectaron cada dos horas. El volumen mínimo de muestra colectada fue 10 mL. Cuando el crecimiento alcanzó la fase exponencial, se produjo gran cantidad de ácido láctico en el biorreactor, el cual se neutralizó con la adición de NaOH al 20%v/v. En los ensayos de cultivo continuo en quimiostato (CI, CII y CIII), las muestras conteniendo biomasa se colectaron cada dos horas. En cada muestra colectada se determinó el contenido de biomasa seca, concentración de glucosa y concentración de lactato. La concentración de lactato luego se convirtió a su equivalente en ácido láctico. Determinación de glucosa y ácido láctico La concentración de glucosa y lactato de sodio se determinaron por HPLC. Para realizar el análisis fue necesario que las muestras colectadas estuvieran libres de células y otros compuestos en suspensión. El equipo utilizado estuvo provisto de un detector de índice de refracción. El HPLC estuvo conectado además a una computadora para la adquisición de datos. Para la evaluación de los datos obtenidos, se utilizó el programa Chromatography Station for Windows (CSW). Las concentraciones de glucosa y lactato se calcularon finalmente utilizando las curvas de calibración de cada compuesto, las cuales han sido determinados previamente en el laboratorio. Resultados y discusión Cultivo batch Los ensayos de cultivo batch se llevaron a cabo con el objetivo de evaluar las condiciones óptimas de cultivo y a la vez optimizar la composición del medio de cultivo para facilitar el aislamiento y purificación del ácido láctico, esto se consiguió disminuyendo el contenido de fosfato y otras sales en el medio, el cultivo BIII tuvo éxito en este propósito. Los parámetros determinados se muestran en la Tabla 2. Se evaluaron también la influencia de la aireación, la concentración de glucosa en el medio de cultivo, el contenido de extracto de levadura y de la adición de sales de manganeso. Los resultados muestran que en los cultivos BI y BII no hubo una conversión completa del sustrato comparado con los cultivos BIII, BV y BVI. Por otro lado, al airear las dos primeras horas el cultivo BIV, el sistema mostró en promedio valores bajos en los parámetros evaluados. En el caso del cultivo BVII, al sistema se suministró nitrógeno gaseoso durante las primeras ocho horas de cultivo con la finalidad de mantener un estado completamente anaerobio, como resultado este cultivo mostró los peores parámetros de producción de ácido láctico. La adición de poca cantidad de sales de manganeso al medio de cultivo mejoró acentuadamente su desarrollo y la conversión de substrato alcanzó el 100%. El ensayo BIII se realizó en un medio de cultivo con menor contenido de KH2PO4, sin adición de acetato de sodio (medio IV), y sin aireación; el desarrollo de este cultivo fue similar en tiempo al cultivo BVI, sin embargo los parámetros de cultivo obtenidos fueron moderadamente diferentes. El medio de cultivo IV podría ensayarse en sistemas continuos, e inclusive sería de interés ensayarlo con un contenido menor en sales. La mejor productividad volumétrica de ácido láctico en la fase exponencial de crecimiento se consiguió en el cultivo BII. La mejor productividad de biomasa se observó en el cultivo BVI, el cual ha sido aireado durante dos horas. El mejor rendimiento en ácido láctico por sustrato consumido (89,3%) y biomasa (18,5%) se observó en los cultivos BI y BIII respectivamente. La conversión completa de glucosa se observó en los cultivos BV, BVI y BIII, y la mayor velocidad específica de crecimiento en la fase exponencial (n= 0.2 h-1), se observó en los cultivos BIII y BVI. De todos los ensayos realizados, con el cultivo BVI se ha conseguido los mejores resultados esto es; una mayor productividad de biomasa (1,2 g/L/h), alta productividad de ácido láctico (5,4 g/L/h) unido a un alto rendimiento en biomasa y ácido láctico (13,2 y 86,1%) y una conversión completa de la glucosa. Cultivo continuo en quimiostato Los ensayos de cultivo continuo se llevaron a cabo en quimiostato a diferentes tasas de dilución. Los parámetros de cultivo se muestran en la Tabla 3. El objetivo de estos ensayos ha sido evaluar los parámetros de productividad del sistema a diferentes tasas de dilución (D). La conversión completa del sustrato se consiguió a la menor tasa de dilución 0,08 h-1. El mayor rendimiento de ácido láctico por sustrato consumido se consiguió a la tasa de dilución 0,51 h-1; a esta tasa de dilución también se obtuvo el mayor rendimiento de biomasa por sustrato consumido (21%). La productividad de ácido láctico (6 g/L/h) y de biomasa (1,2 g/L/h) alcanzó el máximo valor a la tasa de dilución de 0,46 h-1. Conclusión Una de las principales conclusiones de este trabajo de investigación es la influencia esencial que tiene la presencia de iones de manganeso en la formación de ácido láctico y biomasa en cultivo batch. La presencia de sales de manganeso, fosfatos y la concentración de fuente de carbono, cumplen un rol importante en la conversión completa de la glucosa y en los demás parámetros de producción de ácido láctico. La aireación durante los cultivos batch no tuvo un impacto evidente en el mejoramiento de los parámetros de producción de ácido láctico; más bien la composición del medio de cultivo demostró tener un efecto positivo sobre ello. Las condiciones extremadamente aeróbicas ó anaeróbicas afectaron negativamente los parámetros de producción; por el contrario la incorporación de cantidades mínimas de oxígeno en el sistema tuvo un efecto favorable unido a la velocidad de agitación. En los ensayos de cultivo continuo se evaluaron la dependencia que hay entre los parámetros de producción obtenidos y la tasa de dilución. Según las expectativas, el sistema exhibió los mejores parámetros de producción a altas tasas de dilución. La mejor productividad (ácido láctico y biomasa) se consiguió a D= 0,46 h-1. Por otra parte, el mayor rendimiento en ácido láctico y biomasa por sustrato consumido se consiguió a D= 0,51 h-1. En los cultivos continuos realizados se observó que al disminuir la tasa de dilución aumenta la conversión de glucosa; disminuye el valor de YP/S e incrementa el valor de YX/S; como consecuencia, se incrementa el valor de P´X y disminuye el valor de P´P. Contrariamente a ello, el incremento de la tasa de dilución resultó en la disminución de la conversión de glucosa, en el incremento del valor de YP/S, y de YX/S. La aireación y la tasa de dilución no mostraron guardar una relación entre si que influyan positivamente en los parámetros de producción, tal como sucede en el caso de la tasa de dilución por si misma. Literatura citada Akeberg, C.; K. Hofvendahl; G. Zacchi & B. Hahn _ Hagerdal. 1998. Modelling the influence of pH, temperature, glucose and lactic acid concentrations on the kinetics of lactic acid production by Lactococcus lactis ssp. lactis ATCC 19435 in whole _ wheat flour. Applied Microbiology and Biotechnology, 49: 682 _ 690. Ben Amor, K.; E. E. Vaughan & W. M. de Vo. 2007. Advanced molecular tools for the identification of lactic Acid bacteria. Journal of Nutrition, 137(3): 741 _ 747. Bruno _ Bárcena, J. M.; A. L. Ragout; P. R. Córdoba & F. Sineriz. 1999. Continuous production of L(+) _ lactic acid by Lactobacillus casei in two _ stage systems. Applied Microbiology and Biotechnology, 51(3): 316 _ 324. Callon, C.; L. Millet & M. C. Montel. 2004. Diversity of lactic acid bacteria isolated from AOC Salers cheese. Journal of Dairy Research, 71 (2). 231 _ 244. Foo, E. L.; H. G. Griffin; R. Mollby & C. G. Hedén. (Editors). 1993. The Lactic Acid Bacteria. Horizon Scientific Press. United Kingdom, 89 _ 91. Goksungur, Y & Guvenc, U. 1999. Production of lactic acid from beet molasses by calcium alginate immobilized Lactobacillus delbrueckii. Journal of Chemical Technology and Biotechnology, 74: 131 _ 136. Gonzáles _ Varra, A.; G. Vaccari; E. Dosi; A. Trilli; M. Rossi & D. Matteuzzi. 2000. Enhanced production of L(+) _ lactic acid in chemostat by Lactobacillus casei DSM 20011 using ion _ exchange resins and cross _ flow filtration in a fully automated pilot plant controlled via. Biotechnology and Bioengineering, 67(2): 147 _ 156. Herrero, M.; B. Mayo; B. Gonzáles & J. E. Suárez. 1996. Evaluation of technologically important traits in lactic acid bacteria isolated from spontaneous fermentations. Journal of Applied Bacteriology, 81: 565 _ 570. Hiyama, T.; S. Fukui & K. Kitahara. 1968. Purification and properties of lactate racemase from Lactobacillus sake. Journal of Biochemistry, 64(1): 99 _ 107. Holt, J. G.; N. R. Krieg; P. H. A. Sneath; J. T. Staley & S. T. Williams. 1998. Bergey's Manual of Determinative Bacteriology (9th edition). Págs.: 528, 529, 532, 533, 566. Kandler, O. 1983. Carbohydrate metabolism in lactic acid bacteria. Antonie van Leeuwenhoek, 49: 209 _ 224. Kulozik, U. 1998. Physiological aspects of continuous lactic acid fermentations at high dilution rates. Applied Microbiology and Biotechnology, 49(5): 506 _ 510. Lederberg, J. (Editor). 1992. Encyklopedia of Microbiology (2nd edition), The Rockefeller University New York, NY, Vol.3: 1 _ 17. Li, Z.; S. Ding; Z. Li & T. Tan. 2006. L _ lactic acid production by Lactobacillus casei fermentation with corn steep liquor _ supplemented acid _ hydrolysate of soybean meal. Biotechnology J. 1(12): 1453 _ 1458. Monteagudo, J. M & M. Aldavero. 1999. Production of L _ lactic acid by Lactobacillus delbrueckii in chemostat culture using an ion exchange resins system. Journal of Chemical Technology and Biotechnology, 74: 627 _ 634. Morishita, T.; Y. Deguchi; M. Yajima; T. Sakurai & T. Yura. 1981. Multiple nutritional requirements of lactobacilli: genetic lesions affecting amino acid biosynthetic pathways. Journal of Bacteriology, 148(1): 64 _ 71. Porro, D.; Bianchi, M. M.; Brambilla, L.; Menghini, R.; Bolzani, D.; Carrera, V.; Lievense, J.; Liu, Chi.; Ranzi, B. M.; Frontali, L & Alberghina, L. 1999. Replacement of a Metabolic Pathway for Large _ Scale Production of Lactic Acid from Engineered Yeasts Applied Environmental Microbiology, 65(9): 4211 _ 4215. Szabo, L. P & I. Kirisci, 1998. L(+) _ Lactic acid separation on enantiomodified zeolite membrane. Hungary Journal of Industrial Chemistry, 26(2): 147 _ 149. Correspondencia Email Elena Quillama: equillamap@unmsm.edu.pe Email: Waldir Estela waldirestela@unamba.edu.pe
2 Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Biológicas. Laboratorio de Microbiología Industrial y Biotecnología Alimentaria. Lima, Perú.
3 Universidad Nacional Micaela Bastidas de Apurimac, Facultad de Ingeniería Agroindustrial, Laboratório de Biotecnologia Agroindustrial.
Presentado: 04/07/2007
Aceptado: 21/11/2007