Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.14 n.2 Lima dic. 2007
Fernando Retuerto1, Elena Arbaiza1, Yojana Quiroz-Garrido1, Rolando Estrada2 y José Zavala3
1 Laboratorio de Biología Celular. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Laboratorio de Recursos Genéticos y Biotecnología. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos.
3 Laboratorio de Ecología Marina. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos.
Resumen
El presente trabajo informa sobre características bioquímicas, actividad hemolítica, citotóxica y citolítica de tres fracciones del veneno de la anémona de mar Anthothoe chilensis. Los tentáculos de 78 ejemplares de A. chilensis, provenientes de la Isla Cabinza-San Lorenzo, Lima, fueron procesados obteniendo un filtrado, el cual se fraccionó por precipitación con tres puntos de saturación con acetona fría: I (20%), II (50%), III (80%). El filtrado mostró una concentración proteica de 1,8 mg/mL. Las pruebas de detección de carbohidratos totales demostraron la presencia de 1,401 mg de glucosa/ml de solución en el filtrado; mientras que la electroforesis en gel de poliacrilamida en presencia de dodecil sulfato de sodio (PAGE-SDS) evidenció proteínas de 14 a 94 kDa, de las cuales la mayor parte fueron glicoproteínas. Se encontró actividad hemolítica sobre eritrocitos humanos en las fracciones I y II. La fracción III tuvo la actividad fosfolipásica más alta. Las tres fracciones tuvieron una ligera actividad proteolítica sobre caseína siendo la más activa la fracción I. Los efectos citotóxico y citológico fueron evaluados aplicando el Ensayo de Toxicidad en Embriones de Erizo de mar (SET). Las anormalidades morfológicas fueron evaluadas a las 48 horas de desarrollo. Las anormalidades citológicas fueron evaluadas en el estadio de gástrula tardía. Las tres fracciones acetónicas produjeron daños citotóxicos y citológicos importantes en los embriones de erizo de mar. Los efectos sobre los embriones fueron retrasar su desarrollo y producir anomalías morfológicas como lisis de blástulas y exogastrulación. Los daños citológicos observados fueron núcleos heteropicnóticos, núcleos gigantes y espacios celulares anormales. La fracción II fue la más citotóxica produciendo una mortalidad de 75,52 ± 5,5% en los primeros estadíos con 1,0 µg/mL. La fracción I produjo el mayor porcentaje de anomalías en los embriones supervivientes 64,15 ± 4,2 % con 1,3 µg/mL. La fracción III fue la menos tóxica.
Palabras claves: Anthothoe chilensis, Nematocistos, Anémona de mar, Toxinas, citotoxicidad, erizo de mar, Tetrapigus niger.
Abstract
This paper reports on biochemical characteristics, hemolytic activity, cytolytic and citotóxic of three fractions venom from the sea anemone Anthothoe chilensis. The arms of 78 individuals of A. chilensis, from the Isle Cabinza-San Lorenzo, Lima, were treated to obtain a filtrate (Ft), which is divided by precipitation with three points of saturation with cold acetone: I (20%), II (50%), III (80%). The Ft showed 1,8 mg/mL of protein concentration. Test of total carbohydrate detection showed the presence of 1,401 mg of glucose/ml of solution in Ft. SDS-PAGE showed proteins between 14 to 94 kDa, almost were glycoproteins. Hemolytic activity was assayed on human erythrocytes showing positive result the fractions II and I. The fraction III was highest phospholipasic activity. Evaluating the proteolytic activity on casein was observed that the fraction I has the highest activity. Cytotoxic and cytological effects were evaluated in sea urchin embryos Tetrapigus niger. The morphologic abnormalities were evaluated at 48 hours of developing. Cytological abnormalities were observed at late gastrule stage. All acetonic fractions caused abnormalities in embryonic development. Delay of development, morphologic abnormalities like lysis at the blastula and exogastrulation, cytological abnormalities like heteropycnosis, giant nuclei and cellular spaces were observed. The fraction II was more cytotoxic, producing a 75,52 ± 5,5% mortality on early stages with 1,0 µg/mL. The fraction I had the highest anomalies quantity on survivor embryos, 64,15 ± 4,2% with 1,3 µg /mL. The fraction III was less toxic.
Keywords: Anthothoe chilensis, nematocysts, sea anemone, toxin, citotoxicity, sea urchin, Tetrapigus niger.
Introduccion
Los primeros trabajos con sustancias biológicamente activas provenientes de actiniarios se iniciaron a comienzos del siglo XX, con Charles Richet y Paul Portier. En el veneno de los actiniarios han sido encontradas diferentes propiedades, como por ejemplo la presencia de fosfolipasas con actividad hemolítica y polipéptidos sinérgicos en el veneno de los nematocistos de Aiptasia pallida (Hessinger y Lenhoff, 1973 y 1976; Grotendorst y Hessinger, 2000).
Las citolisinas y hemolisinas son comunes en anémonas de mar. Varias toxinas con actividad hemolítica fueron aisladas de diversas anémonas: variolisina de Pseudactinia varia (Bernheimer et al., 1984), parasitoxina de Parasicyonis actinostoloides (Shiomi et al., 1985), citolisina II de Stichodactyla helianthus (Kem, 1988), entre otras, además diferentes polipéptidos con actividad hemolítica se han empezado secuenciar (Anderluh et al., 1999).
Estudios de las sustancias farmacológicamente activas de Budonosoma caissarum, han demostrado que esta especie posee grandes cantidades de una iminopurina denominada caisarona (Zelnik et al., 1986). Una de las actividades de la caisarona es la producción de una fuerte estimulación de la actividad peristáltica en intestino de mamíferos (Freitas y Sawaya, 1990; Cooper et al., 1995), además su extracto hidroalcohólico produce alteraciones en el desarrollo embrionario de erizo de mar (Freitas y Sawaya, 1986). Estudios de los efectos de estos venenos sobre el desarrollo embrionario de erizo de mar también han permitido detectar actividades citotóxicas, teratogénicas y antineoplásicas (Malpezzi y Freitas, 1990). Los roles biológicos de estas toxinas, basadas en su actividad formadora de poros, también pueden asociarse a captura y muerte de la presa, digestión, rechazo de depredadores y competencia por espacio e intraespecífica (Maček &Lebez, 1982).
Anthothoe chilensis (Lesson, 1830) es una actinia común en el intermareal y submareal rocoso en la costa de Perú, Chile y Argentina (Excoffon et al., 1997; Paredes et al.; 1999). Existen pocos estudios sobre esta especie a pesar de ser peligrosa y toxica ya que puede causar reacciones cutáneas que pueden llegar a ser de cuidado en personas sensibles.
El presente trabajo informa sobre algunas características bioquímicas, de la actividad hemolítica, citotóxica y citolítica de tres fracciones del veneno de la anémona de mar Anthothoe chilensis.
Material y métodos
Material biológico.
El material utilizado en el presente trabajo procedió de 78 individuos de Anthothoe chilensis (Lesson 1830) colectados frente a Lima, en la Isla Cabinza-San Lorenzo (12°07'57"S-77°12'33"W), entre 6 y 8 metros de profundidad, los individuos fueron transportados vivos al laboratorio en agua de mar y el mismo día. Solamente fueron procesados los tentáculos siguiendo la metodología descrita por Maček y Lebez (1982).
Preparación de la muestra.
Los tentáculos separados junto con el fluido viscoso liberado por las anémonas, fue filtrado en frío a través de un tamiz y con agua destilada fría, para descartar los restos de tejidos agregándole. El filtrado obtenido fue congelado toda la noche, luego fue descongelado y centrifugado por 30 minutos a 1800 rpm, se recuperó el sobrenadante (Ft) el cual se sometió a fraccionamiento con acetona fría para la separación de proteínas de bajo peso molecular.
Fraccionamiento con acetona
Al filtrado obtenido (Ft), se le adicionó un volumen adecuado de acetona hasta alcanzar una concentración final de 20%, luego se centrifugó por 30 minutos a 2500 rpm, se separó el precipitado (fracción I) y se continuó el tratamiento con el nuevo sobrenadante para obtener las fracciones de 50% (fracción II) y 80% (fracción III) de saturación. Las tres fracciones obtenidas así como el filtrado total (Ft) se mantuvieron a -10 °C hasta su análisis para lo cual se resuspendieron en ácido acético 1 mM.
Determinación de la cantidad de proteína
La cantidad de proteína presente en el filtrado y en cada fracción fue determinada usando el método de Lowry et al. (1951), usando albúmina sérica bovina como proteína estándar.
Determinación de carbohidratos totales
La presencia de carbohidratos en el filtrado y en las fracciones obtenidas fue evaluada con el reactivo de fenol-ácido sulfúrico (Dubois et al., 1956). El filtrado fue diluido 1,5 veces y los precipitados acetonicos 5 veces y resuspendidos en 2 mL de ácido acético 1 mM, como estándar se utilizó glucosa (Sigma).
Electroforesis en gel de poliacrilamida
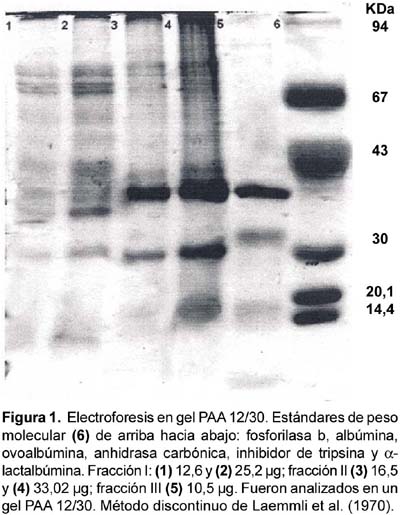
La composición de las fracciones obtenidas fue examinada por electroforesis en gel con gradiente de poliacrilamida PAA 12/30 en presencia de dodecil sulfato de sodio (PAGE-SDS) con el sistema de buffer discontinuo de Laemmli et al. (1970). Las proteínas fosforilasa b 94 kDa, albúmina 67 kDa, ovoalbúmina 43 kDa, anhidrasa carbónica 30 kDa, inhibidor de tripsina 20 kDa y a-lactalbúmina 14 kDa fueron usadas como estándares de peso molecular (Sigma).
Prueba de actividad hemolítica
Se realizó siguiendo el método descrito por Maček et al. (1982). Para obtener eritrocitos lavados se tomó una muestra de sangre humana usando citrato de sodio al 3,8% como anticoagulante, luego de centrifugar por 15 minutos a 1700 rpm se retiró el plasma, los glóbulos rojos fueron lavados y resuspendidos hasta obtener una absorbancia de 0,500 a una longitud de onda de 540 nm, después de la hemólisis total producida con 0,1 mL de Tritón X-100 al 1%. La actividad hemolítica fue probada en 3,5 ml de suspensión de eritrocitos humanos en buffer Tris-HCl 10 mM, NaCl 150 mM, y CaCl2 1 mM pH 7,4; aplicando las proteínas a evaluar en una concentración de 8 µg/ml de suspensión de eritrocitos, se incubó a 37 ºC y luego se midió la absorbancia a 540 nm, cada 5 minutos durante 30 minutos. La actividad específica (A.E.) se expresó como el porcentaje de hemólisis/tiempo de incubación (minutos)/µg de proteína.
Prueba de actividad fosfolipasa.
La actividad fosfolipásica fue evaluada por el método turbidimétrico de Marinetti (1965). La proteína disuelta en NaCl 0,85% pH 7,8 se agregó a una solución de yema de huevo al 2% en buffer Tris-HCl 50 mM, CaCl2 10 mM pH 7,5. Luego de 10 minutos de incubación, se midió la absorbancia a 925 nm. La A.E. se expresa como el cambio de una miliunidad de absorbancia/tiempo de incubación (minutos)/mg de proteína.
Prueba de actividad proteolítica.
La actividad proteolítica se evaluó siguiendo el método de Anson et al. (1938) utilizando caseína como substrato a una concentración de 1,5% (p/v) en buffer fosfato pH 8,7; 0,1 M. La mezcla de reacción se prepara con 0,5 ml de substrato; 0,1 ml de la muestra problema disuelta en NaCl 0,85%. Luego de 30 minutos de incubación a 37 ºC, la reacción se detiene adicionando 1 mL de ácido tricloroacético al 5%. Las proteínas hidrolizadas precipitan y pueden separarse luego de centrifugar a 2250 rpm durante 20 minutos. Los residuos ácido solubles presentes en el sobrenadante son estimados a partir de 0,5 ml de sobrenadante que se hace reaccionar con 1 ml de NaOH 1 M y 0,3 ml del reactivo de Folin-Ciocalteus (1:3) para la formación de un complejo coloreado que puede ser leído en el espectrofotómetro a 650 nm. Los resultados se expresan en microgramos de tirosina liberada para un tiempo de incubación de 30 minutos por miligramo de proteína.
Ensayo de toxicidad en erizo de mar (SET)
La actividad citotóxica y mutagénica fue analizada usando huevos fecundados de erizo de mar, según el método descrito por Hose (1985), el cual evalúa el desarrollo de erizo de mar sobre las 72 horas, incorporando un análisis citológico y citogenético de los embriones. La liberación de gametos fue inducida inyectando 0,5 M de KCl en la cavidad perivisceral. Los huevos fueron lavados dos veces con agua de mar filtrada antes de agregar 0,3 mL de espermatozoides (1:10 en agua de mar filtrada). Los huevos fecundados se incubaron en agua de mar control (2,9 mL de agua de mar filtrada + 0,1 mL de NaCl 0,9%) y dos concentraciones diferentes de proteína en un volumen final de 3,0 mL por triplicado con agitación constante a una temperatura de 16 ºC. El porcentaje de embriones anormales se evaluó a las 48 horas de cultivo y se expresa como el porcentaje de embriones anormales en cada estadio y el porcentaje de embriones anormales con respecto al total de embriones observados. Para la observación de efectos citotóxico y genotóxico se tomaron alícuotas de 0,5 mL de cultivo en el estadio de gástrula tardía y se fijaron en Carnoy (metanol:ácido acético 3:1) las que luego fueron coloreadas con orceína aceto-propiónica y observadas al microscopio óptico. Los daños citológicos y citogenéticos se reportan de modo cualitativo por la presencia del efecto en los embriones dañados que alcanzaron a llegar al estadio de gástrula tardía.
Resultados y discusión
La remoción de los tentáculos de los especímenes colectados ocasionó la producción de una gran cantidad de líquido viscoso, además de la capa mucosa que normalmente segregan, el líquido contenía una gran cantidad de nematocistos descargados.
La proteína contenida en el filtrado fue estimada en 1,8 mg proteína/mL a partir del cual se prepararon diluciones a 1 mg proteína/mL.
Las pruebas para detección de carbohidratos totales mostraron la presencia de 1,041 mg de glucosa/mL de solución en filtrado, 0,26 en la fracción I, 0,195 para la fracción II y 0,312, en la fracción III. Para complementar la prueba se realizó una tinción Schiff-ácido periódico (PAS) para evidenciar glicoproteínas en geles de poliacrilamida-SDS (Fairbanks et al., 1971) resultando que la mayor parte fueron glicoproteínas. Estos resultados coinciden con los hallados en Aiptasia pallida (Grotendorst y Hessinger; 1999) donde utilizando el mismo método detectaron que casi todas las proteínas del veneno, incluido un cofactor lítico de 98 kDa, eran glicoproteínas. Cabe mencionar que los valores hallados pueden verse incrementados por carbohidratos no asociados a proteínas pertenecientes al moco protector característico de estos organismos marinos.
La electroforesis en gel de poliacrilamida, nos indicó que las proteínas del veneno de la anémona A. chilensis se encuentran en el rango de 94 a 14 kDa, la mayoría de bandas por encima de los 40 kDa. La fracción III muestra una banda proteica menor que 14 kDa (Fig.1). Los péptidos y proteínas son los componentes más destacados de varias de las toxinas de anémonas, Béress (1982) menciona que el rango de peso molecular de ellas varía entre 3 y 300 kDa. Se conoce que algunos polipéptidos de bajo peso molecular (2-8 kDa) presentan actividad neurotóxica (Norton, 1991), otros polipéptidos básicos con peso molecular entre 10 y 25 kDa son reconocidos como hemolisinas (Anderluh et al., 1999), mientras que otras proteínas con peso molecular entre 40 y 80 kDa presentan actividad de fosfolipasa (Grotendorst y Hessinger, 1999; Hessinger y Lenhoff, 1974).
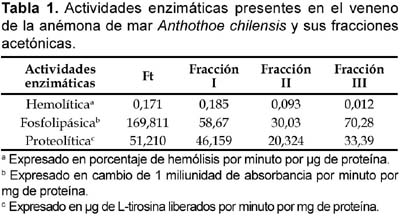
Las actividades enzimáticas del veneno de A. chilensis son mostradas en la tabla 1. La fracción III mostró la mayor actividad de fosfolipasa correspondiente al 41,39% de la actividad del filtrado.
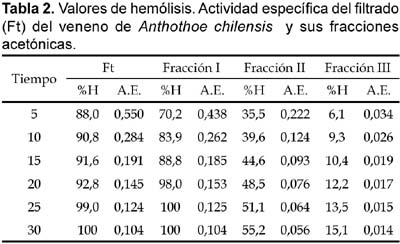
Los resultados de actividad hemolítica sobre eritrocitos humanos se observan en la tabla 2; estos nos indican que el filtrado y las dos primeras fracciones acetónicas fueron fuertemente hemolíticas. La fracción I fue la más tóxica con un t0.5 (tiempo necesario para alcanzar el 50% de hemólisis) menor de 5 minutos, mientras que la fracción III resultó ser la menos tóxica con t0.5 mayor a 30 minutos (Fig. 2).
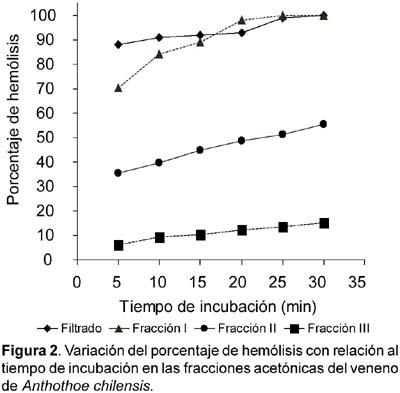
Trabajos previos nos indican que las toxinas hemolíticas/citolíticas encontradas en diversas especies de anémonas, tienen un mecanismo de acción directa y no enzimática, a excepción de Aiptasia pallida (Grotendorst y Hessinger, 2000), Bunodosoma caissarum (Malpezzi, 1995), entre otras, donde la fosfolipasa A2 ha sido encontrada.
En el veneno de Anthothoe chilensis se ha detectado la presencia de actividades hemolítica y fosfolipásica donde los valores de actividad más altos no han coincidido en una misma fracción acetónica. Estos resultados nos hacen suponer que, en el veneno de A. chilensis, más de un componente sería el responsable del efecto hemolítico sobre eritrocitos humanos. Pruebas complementarias serian necesarias para determinar si la propiedad hemolítica observada en el veneno de A. chilensis estaría mediada por un mecanismo sinérgico semejante al de A. pallida o por la presencia únicamente de proteínas formadoras de poro (actinoporinas).
Las tres fracciones evaluadas mostraron una ligera actividad proteolítica. Esta actividad estaría involucrada en los procesos de digestión de la presa, además también influenciarían la rápida pérdida de actividad enzimática observada en las fracciones evaluadas.
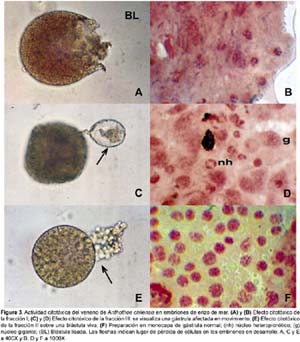
En el ensayo de citotoxicidad en embriones de erizo de mar se ha observado que las toxinas de A. chilensis producen efectos morfológicos como blástulas lisadas y exogastrulación. También se observaron daños citológicos como gástrulas con menos configuraciones mitóticas visibles, núcleos heteropicnóticos (nh) y núcleos gigantes (g).
Se ha determinado el porcentaje de anomalías durante el desarrollo embrionario para todas las fracciones obtenidas (Tabla 3). La determinación de anomalías se realizó por comparación con los estadios normales de desarrollo observados en el control. Fue evidente en todos los casos que las gástrulas tratadas con las toxinas poseían menor número de células y menos configuraciones mitóticas cuando se comparaban con las gástrulas normales (Fig. 3F).
La fracción I a 0,5 µg/mL produce, en los embriones de erizo de mar, una gástrula con un retardo de 24 horas en comparación con el control. Además, aunque su estructura externa fue aparentemente normal, en el análisis citológico estos embriones presentaron anormalidades tales como heteropicnosis y núcleos gigantes, detectados por la coloración con orceína aceto-propiónica. Mientras que, la misma fracción, en concentraciones de 1,3 µg/mL produjo que el 47,86% (±8,49) de los huevos fecundados presenten desprendimientos celulares y detengan su desarrollo, mientras que los embriones sobrevivientes se lisaron en el estadio de blástula (64,15 ± 4,2%) produciéndose una alta tasa de mortalidad en este estadio (Fig. 3A y 3B).
La fracción II con 1,0 µg/mL produjo blástulas y gástrulas anormales (60,53 ± 13,28%), y con 2,5 µg/mL observamos una alta tasa de anormalidades en el estadio de blástula (69,39 ± 8,1%), las cuales finalmente murieron (Fig. 3E).
La fracción III con 0,5 µg/mL produjo gástrulas (42,92 ± 4,46%) con un exogastrulación temprana (Fig. 3C y 3D) mostrando núcleos heteropicnóticos cuando fueron coloreados con orceína aceto propiónica.
Los efectos observados en los embriones fecundados con desprendimiento celulares y la lisis en el estadio de blástula estarían relacionados a las propiedades bioquímicas encontradas en las fracciones acetónicas evaluadas (hemolítica, fosfolipásica y proteolítica).
Los casos de exogastrulación, como los observados en este trabajo, son asociados a la interacción de moléculas ligadas a azúcares y sus respectivos receptores, sistema que seria importante como mediadores de eventos de reconocimiento celular en los embriones de erizo de mar, tal como el desarrollo del arquenterón y la adhesión de células mesénquimales al techo del blastocele (Khurrum et al., 2004).
Las fracciones acetónicas evaluadas mostraron la presencia de glicoproteínas, las que podrían ser las responsables de la alteración del proceso de gastrulación en el desarrollo embrionario de erizo de mar, conduciendo a una exogastrulación.
La heteropicnosis nuclear implica daños irreversibles en la célula, como daños en el ADN que en algunos casos puede provocar que las células pierdan la afinidad por el colorante, observandose espacios celulares, que evidencian la desorganización o desintegración del embrión en desarrollo. El menor número de células observadas, al comparar los embriones tratados con las fracciones acetónicas versus el control, puede explicarse por la inhibición de la división celular en las células dañadas, con la finalidad de reparar los daños y evitar la posibilidad de heredar el daño a la célula hija; también causaría la demora en el desarrollo y la mortalidad en el cultivo.
Estos efectos antimitóticos evidenciados en el veneno de A. chilensis podría significar un potencial efecto antitumoral tal como se ha observado en el extracto hidroalcohólico de Bunodosoma caissarum que mostró efecto antitumoral en células T47D derivadas del carcinoma de mama humano (Malpezzi et al., 1995), luego que fuera probado su efecto antimitótico sobre embriones de erizo de mar (Freitas y Sawaya, 1986).
Literarura citada
Anderluh, G.; I. Krizaj; B. Štrukelj; F. Gubenšek; R. Maček & J.Pungercar. 1999. Equinatoxins, pore-forming proteins from the sea anemone Actinia equina, belong to a multigene family. Toxicon, 37: 1391-1401.
Anson, M.L. 1938. The estimation of pepsin,trypsin, papain, and cathepsin with hemoglobin. J.Gen. Physiol. Sep. 22: 79-89.
Béress, L. 1982. Biologically active compounds from coelenterates. Pure & Appl Chem 54: 1981-1994.
Bernheimer, A.W.; L.S. Avigad, G. Branch, E. Dowle & C.Y. Lai. 1984. Purification and properties of a toxin from the South African sea anemone, Pseudactinia varia. Toxicon, 22: 183-191.
Cooper, R.A.; J.C. Freitas; F. Porreca; C.M. Eisenhour; R. Lukas & R.J. Huxtable. 1995. The sea anemone purine, caissarone: adenosine receptor antagonism. Toxicon, 33 (8): 1025-1031.
Dubois, M.; K. Gilles; J. Hamilton; P. Rebers & F.Smith. 1956. Colorimetric method for determination of sugars and related substances. Analyt. Chem. 28, 350.
Excoffon, A.C., M.J.C. Belém; M.O. Zamponi & E. Schlenz. 1997. The validity of Anthothoe chilensis (Actiniaria, Sagartiidae) and its distribution in southern hemisphere. Iheringia; Sér Zool, Porto Alegre (82): 107-118, 11 abr.
Fairbanks, G.; T.L. Steck & D.F.H. Wallach. 1971. Electrophoretic analysis of the major polypeptides of the human erytrocyte membrane. Biochemistry 10, 2606-2617.
Freitas, J.C. & M.I. Sawaya. 1986. Anomalies in sea-urchin egg development induced by a novel purine isolated from the sea-anemone Bunodosoma caissarum. Toxicon, 24(8): 751-755.
Freitas, J.C. & M.I. Sawaya. 1990. Increase of mammalian intestinal motility by marine natural product caissarone. Toxicon, 28: 1029-1037
Grotendorst, G. & D. Hessinger. 1999. Purification and partial characterization of the phospholipase A2 and co-lytic factor from sea anemone (Aiptasia pallida) nematocyst venom. Toxicon, 37: 1779-1796.
Grotendorst, G. & Hessinger, D. 2000. Enzymatic characterization of the major phospolipase A2 component of sea anemone (Aiptasia pallida) nematocyst venom. Toxicon, Jul; 38 (7): 931-43.
Hessinger, D. & H. Lenhoff. 1973. Assay and properties of the hemolysis activity of pure venom from the nematocysts of acontia of the sea anemone Aiptasia pallida. Archs. Biochem. Biophysic. 159, 629.
Hessinger, D. & H. Lenhoff. 1974. Degradation of red cell membrane phospholipids by sea anemone nematocyst venom. Toxicon 12: 379-383.
Hessinger, D. & Lenhoff, H. 1976. Membrane structure and function. Mechanism of hemolysis induced by nematocyst venom: role of phospholipase A and direct lytic factor. Archs. Biochem. Biophys. 173: 603.
Hose, J. 1985. Potencial uses of sea urchin embryos for identifying toxic chemicals: description of a bioassay incorporating cytologic, cytogenetic and embryologic endpoints. J. Appl. Toxicol., 5 (4): 245-254.
Kem, W.R. 1988. Separation and caracterization of four different amino acid sequence variants of sea anemone (Stichodactyla helianthus) protein cytolysin. Toxicon 26: 997-1008.
Khurrum, M.; A. Hernández; M. Eskalaei; O. Badali; C. Coyle-Thompson & S.B. Oppenheimer. 2004. Carbohydrate involvement in cellular interactions in sea urchin gastrulation. Acta Histochemica, 106 (2): 97-106.
Laemmli, U.K. 1970. Cleaveage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685.
Lowry, O.; Rosebrough, N.; Farr, A. & Randal, R. 1951. Protein measurement with the folin phenol reagent. J. Biol. Chem. 193: 262-275.
Maček, P.; L. Senèic & D. Lebez. 1982. Isolation and partial characterisation of three lethal and hemolytic toxins from the sea anemone Actinica cari. Toxicon 20(1): 181-185.
Maček, P. & D. Lebez. 1982. Isolation and characterization of three lethal and hemolytic toxins from the sea anemone Actinia equina L. Toxicon, 26, 441-455.
Malpezzi, E.L.A. & J.C. Freitas, 1990. Antimitotic effect of an extract of the sea anemone Bunodosoma caissarum on sea urchin egg development. Brazilian J. Med. Biol. Res., 23: 811-814.
Malpezzi, E.L.A.; D.H. Matsui; S.C.T.S. Groote; J.C. Freitas; G.M. Santelli & J.B. Fernandes. 1995. Antitumoral activity in an organic extract of the sea anemone Bunodosoma caissarum. Toxicon, 33 (3): 291-291.
Marinetti, G. 1965. The action of phospholipase A on lipoproteins. Biochimica et Biophysics Acta. 98: 554-565.
Norton, R. 1991. Structure and structure-function relationships of sea anemone proteins that interact with the sodium channel. Toxicon, 29: 1051-1084.
Paredes, C.; F. Cardoso & J. Tarazona. 1999. Invertebrados del intermareal rocoso del departamento de Lima, Perú: una lista comentada de especies. Rev peru biol. 6(1): 143-151.
Shiomi, K.; E. Tanaka, H. Yamanaka & T. Kikuchi. 1985. Isolation and characterization of a lethal hemolysin in the sea anemone Parasicyonis actinostoloides. Toxicon, 23:865-874.
Zelnik, R.; M. Haraguchi; A.K. Matida; D. Lavie; F. Frolow & A.L. Weis. 1986. X-Ray molecular structure of caissarone, a novel purine derivative from the sea anemone Budonosoma caissarum Correa, 1964. J. Ch. Soc. Perkin Trans. 1: 2051-2053.
Correspondencia
Email Fernando Retuerto: fretuertop@unmsm.edu.pe
Presentado: 28/04/2007
Aceptado: 16/12/2007