Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.15 n.2 Lima 2008
TRABAJOS ORIGINALES
Análisis de la composición florística de los bosques de Jenaro Herrera, Loreto, Perú
Analysis of the floristic composition of the forests of Jenaro Herrera, Loreto, Peru
Eurídice N. Honorio1, Toby R. Pennington2, Luis A. Freitas1, Gustav Nebel3 y Timothy R. Baker4
1 Instituto de Investigaciones de la Amazonía Peruana, Av. Abelardo Quiñónez km 2,5, Iquitos, Perú. Email Eurídice Honorio:eurihc@yahoo.com
2 Royal Botanic Garden Edinburgh, 20a Inverleith Row, Edinburgh EH3 5LR, UK.
3 The Royal Veterinary and Agricultural University, Danish Centre for Forest, Landscape and Planning, Rolighedsvej 23, 1958 Frederiksberg C, Denmark.
4 Earth and Biosphere Institute, School of Geography, University of Leeds, Leeds LS2 9JT, UK.
Resumen
La composición florística de 17 parcelas (0,5 - 2 ha) de Jenaro Herrera, Loreto, Perú fue analizada utilizando el método multivariado de agrupamiento por promedio aritmético de grupos de pares no ponderados (UPGMA). Nueve grupos florísticos fueron reportados y correspondieron a los siguientes tipos de bosque descritos anteriormente en la zona: 1) bosque ribereño, un grupo; 2) bosque latifoliado de aguas negras, dos grupos; 3) bosque de arena blanca, dos grupos(más un grupo con parcela que incluye parte de otro tipo de bosque); 4) bosque de terraza, un grupo; 5) bosque de palmeras de aguas negras, un grupo; y 6) bosque de palmeras de terraza baja, un grupo. Problemas taxonómicos en el nivel de especies fueron minimizados con la remoción de las especies raras.
Palabras claves: composición florística, Jenaro Herrera, tipos de bosque, UPGMA.
Abstract
The floristic composition of 17 plots (0,5 - 2 ha) of Jenaro Herrera, Loreto, Peru were analyzed using the unweighted pair group method with arithmetic mean (UPGMA). Nine floristic groups were reported corresponding to the following types of forests described in the study area before: 1) riverine forest -one group, 2) black water broad leaf forest -two groups, 3) white sand forest -two groups (plus one group with a plot including part of another type of forest), 4) terrace forest -one group, 5) black water palm forest -one group, and 6) low terrace palm forest -one group. Taxonomic problems were detected in species level; however, these were minimized when rare species were removed.
Keywords: floristic composition, Jenaro Herrera, types of forest, UPGMA.
Introducción
Los bosque tropicales de la Amazonía del noreste Peruano, departamento de Loreto, son conocidos por la alta riqueza florística local (Gentry, 1988a; Phillips & Miller, 2002; Ter Steege et al., 2003) y la gran variedad de paisajes (Gentry, 1988b; Encarnación, 1985). El paisaje de la región está influenciado por la fisiografía del terreno, la presencia de grandes ríos y quebradas y la variación en la composición y drenaje del suelo (Encarnación, 1985). Por lo tanto, encontrar áreas vecinas con características fisiográficas y de vegetación muy diferentes es común.
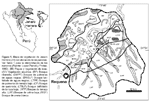
En el distrito de Jenaro Herrera, 200 km al sur de Iquitos en el río Ucayali, en un área aproximada de 2200 km2 fueron descritos once tipos de vegetación (Lopez-Parodi & Freitas, 1990), de los cuales nueve con categoría de bosques son el enfoque de este estudio (Fig. 1). Dos zonas han sido descritas según la fisiográfia del lugar: una influenciada por el río Ucayali y sus tributarios, denominada planicie fluvial y otra denominada planicie interfluvial. Los tributarios del río Ucayali contienenaguas negras con presencia de sustancias fenólicas, pobres en nutrientes, mientras que el río principal contiene aguas blancas con grandes cantidades de sedimentos suspendidos y más ricos en nutrientes (Kvist & Nebel, 2001).
En la planicie fluvial, Lopez-Parodi y Freitas (1990) describieron cinco tipos de bosques tales como: (1) el bosque ribereño que corresponde a la vegetación aledaña al río Ucayali; (2) el bosque latifoliado de aguas negras con vegetación influenciada por tributarios de aguas negras (Nebel et al., 2001); (3) el bosque de palmeras de aguas negras con vegetación adaptada a inundaciones casi permanentes como la palmera Mauritia flexuosa (Encarnación, 1985; Freitas, 1996a); (4) el bosque de palmeras de terraza baja con vegetación ubicada sobre suelos arcillo-arenosos de pobre drenaje (Encarnación, 1985) y gran diversidad de palmeras arbóreas como Mauritia flexuosa, Oenocarpus bataua, Euterpe precatoria y Socratea exorrhiza; y (5) el bosque de quebrada ubicado a cada lado de las quebradas de las terrazas altas, con vegetación adaptada a inundaciones esporádicas durante la época de lluvias como Carapa guianensis.
En la planicie interfluvial, fueron descritos cuatro tipos de bosques tales como: (1) el bosque latifoliado de terraza baja ubicado sobre terrazas formadas durante el Pleistoceno tardío (mas de un millón de años); (2) el bosque de terraza alta ubicado sobre las formaciones Pebas e Ipururo desarrolladas en el Terciario tardío (27 millones de años; Dumont et al., 1991); el bosque de colinas bajas ubicado sobre colinas de más de 20 m de altura; y el bosque de arena blanca presente en pequeños parches con vegetación densa de porte bajo y denominados localmente como varillales y chamizales (Encarnación, 1985).
Los estudios florísticos en Jenaro Herrera y especialmente de la flora arbórea (Spichiger et al., 1989; Spichiger et al., 1990; Freitas, 1996a; Freitas, 1996b; Spichiger et al., 1996; Nebel et al., 2001) fueron desarrollados en los diversos tipos de bosque siguiendo la clasificación descrita por Lopez-Parodi y Freitas (1990). Los inventarios más recientes fueron realizados en el año 2005 por la Red Amazónica de Inventarios Forestales (Peacock et al., 2007) y en el 2007 por el Royal Botanic Garden Edinburgh. Más de 600 especies arbóreas fueron inventariadas y muchas de éstas están depositadas en el herbario de sitio (Herbario Herrerense). Aunque la identificación de las plantas en estos estudios fue realizada por diferentes taxónomos; al menos el 80% de los especímenes colectados fue comparado con aquellos del herbario de sitio; por lo tanto, las determinaciones deberían ser en gran parte concordantes.
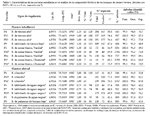
En este estudio, la composición florística de 17 parcelas (Tabla 1) correspondientes a siete tipos de vegetación boscosa (Fig. 1) fue analizada utilizando el método multivariado de agrupamiento UPGMA para responder dos preguntas:
- ¿Cuan similar es la clasificación de la vegetación definida por la composición florística con la clasificación de la vegetación previamente realizada en Jenaro Herrera utilizando la interpretación de imágenes y la experiencia en campo?
- ¿Los datos colectados en diferentes tiempos y por diferentes taxónomos son comparables?
Materiales y métodos
Área de estudio
El distrito de Jenaro Herrera está ubicado a 200 km al sur de Iquitos en la provincia de Requena, departamento de Loreto, Perú (Fig.1). La capital de distrito tiene el mismo nombre, y está ubicada en la margen derecha del río Ucayali a 125 m de altitud (04º54S73º40W). El área presenta un clima tropical. Según los registros del Servicio Nacional de Meteorología e Hidrología del Perú (1987-2001), la temperatura media anual es de 26,0 ºC, con variación estacional entre 25,1 ºC en julio y 26,5 ºC en diciembre. La precipitación promedio anual es de 2724 ± 171 mm, con una estación lluviosa de diciembre a marzo y una estación seca de julio a septiembre. La humedad relativa promedio es de 85,9%, con valores menores de julio a octubre (84,085,2%) y valores máximos en los meses de febrero y abril (87,2%). Durante los periodos marzo-mayo y agosto-octubre ocurren los valores máximos y mínimos del nivel del río Ucayali respectivamente (Nebel et al., 2001).
Recopilación de datos florísticos
Fueron recopilados datos florísticos de 17 parcelas (0,52 ha), ubicados en siete tipos de vegetación de la planicie interfluvial (9 parcelas) y de la planicie fluvial (8 parcelas) de Jenaro Herrera (Tabla 1). Las parcelas fueron establecidas en áreas no perturbadas por el hombre, más o menos siguiendo la clasificación de la vegetación propuesta por Lopez-Parodi y Freitas (1990), durante dos periodos (Tabla 1), antes de 1991 (P1-P11) y desde aquel entonces (P12-P15), hasta los inventarios más recientes del 2005 (P85-P86). Los datos fueron en su mayoría publicados por Freitas (1996a, 1996b), Spichiger et al. (1996); Nebel et al. (2001), otra informacion forma parte del RAINFOR database, un estudio a largo plazo de la dinámica de los bosques amazónicos (Malhi et al., 2002; Peacock et al., 2007).
Procesamiento de datos
Los datos fueron organizados por especies y número de individuos para cada parcela. Consideramos el uso de la abundancia relativa para minimizar el efecto del tamaño de las parcelas (0,52 ha). Los nombres científicos fueron revisados con claves, listados y en las páginas Web del IPNI y TROPICOS (http://www.ipni.org/; http://www.tropicos.org/). Los géneros y familias fueron basados en la clasificación filogenética de las Angiospermas, APG II (Stevens, 2001), y para esto, fue utilizada la base de datos Angiosperm Phylogeny Family Database (2006). Los géneros que no estuvieron en la AGPII fueron asignados a la familia reconocida en la literatura más reciente. Utilizando estos criterios, 71 familias, 289 géneros y 596 especies fueron copilados en la matriz resultante.
Análisis multivariado
El análisis de agrupamiento por promedio aritmético de grupos de pares no ponderados (UPGMA) fue aplicado usando la abundancia relativa de la matriz resultante en el programa PC-ORD versión 4 (McCune & Mefford, 1999). Fue utilizado el índice Sørensen como medida de disimilaridad o distancia entre dos parcelas: D = 1-2W/(A+B), donde W es la suma de abundancias compartidas y A y B son las sumas de abundancias en unidades de muestreo individuales.
Los resultados fueron mostrados en cinco dendrogramas, los cuales fueron preparados utilizando familias, géneros y especies. Tres análisis fueron conducidos a nivel de especie, uno incluyendo todas las especies, otro excluyendo las especies que ocurren en sólo una parcela, y otro excluyendo las especies que ocurren en sólo una o dos parcelas. Los grupos detectados en cada dendrograma fueron escogidos cortando el dendrograma al 25% de la disimilaridad, los cuales fueron comparados con la clasificación propuesta por Lopez-Parodi y Freitas (1990). Las familias, géneros y especies más abundantes fueron identificados en cada grupo o comunidad florística.
Efectos potenciales en el uso de datos florísticos
Como efecto potencial en la utilización de los datos fue tomado en cuenta el tiempo o periodo en el que fueron realizados los estudios florísticos (factor tiempo), el cual incluye las diferentes personas y lugares donde fueron realizadas las identificaciones de las muestras botánicas (factor humano). Con respecto al factor tiempo, fueron identificados dos periodos principales de estudio, uno antes de 1991 (11 parcelas, P1P11) y otro desde aquel entonces (6 parcelas, P12P15 y P85P86). El nivel de identificación por parcela fue cuantificado según el número de individuos identificados a familia, género y especie, tomando en cuenta también el número de especies identificadas a un binomio con género y especie conocidos. La prueba t fue utilizada para mostrar si existen diferencias significativas entre el porcentaje de árboles o especies identificadas entre ambos periodos de estudio. Por otro lado, fueron observadas las especies de parcelas que mostraron una posición inestable en el análisis UPGMA a nivel de especies, especialmente aquellas morfológicamente similares y que podrían ser confundidas; estas fueron citadas como ejemplos de posibles errores en la identificación (factor humano).
Resultados
Número de árboles y especies
En las 17 parcelas (0,52 ha) fueron encontrados un total de 19612 árboles, de los cuales 11558 árboles con DAP ≥ 10 cm correspondieron a 14 parcelas y los 8054 árboles adicionales con diámetro ≥ 5 cm a 3 parcelas (bosques de arena blanca). Del total de árboles, el 99,8% fueron identificados a nivel de familia, 94,9% a género y 75,9% a especie (binomio de género y especie conocidos). En total, fueron contadas 71 familias, 289 géneros y 596 especies, de las cuales 242 especies (41%) fueron reportadas en una sola parcela, 137 especies (23%) en sólo dos parcelas y 217 especies (36%) en tres o más parcelas. En promedio por parcela, el total de especies utilizadas en el análisis corresponde al 61% de las especies reportadas por los autores e identificadas con un binomio de género y especie conocidos. Las especies remanentes (39%) fueron reportadas como especies desconocidas (p.ej. Inga sp. 2 y Lauraceae sp. 1) y eliminadas de la matriz principal antes de realizar los análisis a nivel de especies (Tabla 1).
Análisis multivariado (UPGMA)
El análisis de agrupamiento UPGMA conducido utilizando familias, géneros y especies dieron resultados muy similares.
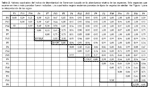
Nueve grupos florísticos aparecen constantemente en los dendrogramas (Fig.2), uno de estos corresponde a una parcela que incluye dos tipos de bosque (parcela transicional). Los grupos mostrados a continuación corresponden al dendograma en el cual fueron incluidas las especies que ocurren en tres o más parcelas (Fig. 2, C3) y cuyos valores de similaridad florística son mostrados en la Tabla 2.
Grupo a: Este grupo consiste de tres parcelas (P1, P13, P14) separadas por 200 a 350 m de distancia y ubicadas en bosques ribereños, con un total de 45 familias, 138 géneros y 171 especies, de las cuales 72 especies (42%) ocurren en sólo una de las parcelas y 37 (22%) en todas las parcelas. Cuatro familias dominan estas parcelas, Fabaceae (15% de los árboles), Annonaceae (10%), Urticaceae (8%) y Putranjivaceae (6%). Los géneros más abundantes de estas parcelas son Inga (9%) y Drypetes (6%) y la especie más abundante, Drypetes amazonica (6%).
Grupo b: Este grupo consta de dos parcelas (P6, P7) separadas por 200 m de distancia y ubicadas en bosques latifoliados de aguas negras (Quebrada Iricahua), con un total de 36 familias, 102 géneros y 58 especies, de las cuales 30 especies (52%) ocurren en sólo una de las parcelas y 28 (48%) en ambas. Tres familias son abundantes en este grupo, Fabaceae (15%), Arecaceae (13%) y Annonaceae (12%). Mientras Inga (4%) es abundante en ambas parcelas, Attalea y Eschweilera son más abundantes en P6 (78%) que en P7 (13%) y Unonopsis es más abundante en P7 (7%) que en P6 (3%). Mouriri grandiflora es muy abundante en P6 (4%) y Qualea paraensis (5%), Theobroma cacao (5%), Socratea exorrhiza (4%), Oenocarpus mapora (4%) y Guarea macrophylla (4%) son abundantes en P7.
Grupo c: Este grupo consiste de sólo una parcela (P15) ubicada en el bosque latifoliado de aguas negras (Quebrada Lobillo) y ubicada a 19 km de las parcelas del grupo b, con un total de 46 familias, 107 géneros y 121 especies, de las cuales 13 especies (11%) son compartidas con el grupo anterior. Lecythidaceae (27%), Fabaceae (11%) y Sapotaceae (9%) son las familias más abundantes. Eschweilera (27%), Pouteria (8%) y Cecropia (6%) son los géneros más abundantes, así como las especies Eschweilera albiflora (17%) y E. parviflora (10%).
Grupo d: Este grupo consiste de tres parcelas establecidas en bosques de arena blanca, dos en varillal (P2, P10) separadas por 4,5 km de distancia y una en chamizal (P3) a 160 m de P2. Fueron registradas un total de 33 familias, 65 géneros y 52 especies, de las cuales 21 especies (40%) ocurren en sólo una de las parcelas, 29 especies (56%) ocurren en P2 y P10 y siete especies (13%) en todas las parcelas. Tres familias Malvaceae (37%), Clusiaceae (20%) y Fabaceae (13%) son particularmente abundantes. Tres géneros, Pachira (37%), Haploclathra (6%) y Macrolobium (5%) y dos especies, Pachira brevipes (37%) y Haploclathra paniculata (6%) son comunes y compartidas entre estas parcelas.
Grupo e: Este consiste de sólo una parcela (P11) establecida en bosque de arena blanca, chamizal, a 190 m de P10. Fueron registradas un total de 22 familias, 32 géneros y 22 especies, de las cuales ocho especies (36%) ocurren también en P3. Clusiaceae (60%), Malvaceae (12%) y Fabaceae (6%) son las familias más abundantes. Caraipa (49%), Pachira (12%) y Macrolobium (6%) son los géneros más abundantes, así como las especies Caraipa utilis (39%) y C. punctulata (10%).
Grupo f: Este grupo consiste de cuatro parcelas de las cuales tres pertenecen al bosque de terraza alta (P4, P12, P85) y una al bosque latifoliado de terraza baja (P9); separadas por 26 km de distancia. Fueron reportadas 60 familias, 192 géneros y 365 especies, de las cuales 193 especies (53%) ocurren en sólo una de las parcelas y 34 (9%) en todas las parcelas. Lecythidaceae (12%), Sapotaceae (8%), Fabaceae (8%) y Lauraceae (6%) son las familias más abundantes. Eschweilera (12%) es el género más abundante, así como la especie Eschweilera coriacea (5%). Mientras Eschweilera coriacea es menos abundante en P9 (1%) que en P4, P12, P85 (46%), E. bracteosa es más abundante en P9 (8%) que en las otras parcelas (04%).
Grupo g: Este consiste de una parcela (P5) establecida en bosque de palmeras de aguas negras, ubicada a 2 km de distancia de P6 y P7. Fueron reportadas 26 familias, 48 géneros y 24 especies, de las cuales la familia Arecaceae (64%) y específicamente las especies Mauritia flexuosa (53%), Euterpe precatoria (8%) y Hura crepitans (7%) dominan el área. Otras familias como Euphorbiaceae (7%) y Fabaceae (6%) son también importantes.
Grupo h: Este consiste de una parcela (P8) establecida en bosque de palmeras de terraza baja, a 21 km de P5 y 2,5 km de P9. Fueron reportadas 35 familias, 82 géneros y 72 especies, de las cuales siete especies (10%) estuvieron también presentes en P5. Las familias Arecaceae (31%), Clusiaceae (12%), Fabaceae (8%) y Lecythidaceae (8%) dominaron P8, así como las especies Mauritia flexuosa (9%), Oenocarpus bataua (9%), Caraipa valioi (8%) y Euterpe precatoria (8%).
Parcela transicional: Este grupo consiste de una parcela (P86) establecida en un bosque de arena blanca (varillal) con inclusiones de bosque de terraza alta, ubicada a 150 m de P2 y 4,5 km de P10. Fueron registradas 33 familias, 76 géneros y 84 especies, de las cuales 22 (26%) estuvieron también presentes en P2 y 20 (24%) en P10. Fabaceae (28%) y Clusiaceae (17%) son las familias más abundantes, así como los géneros Macrolobium (9%) y Tachigali (7%). Las especies más abundantes son Tovomita calophyllophylla, Dicymbe uaiparuensis, Haploclathra cordata y Oenocarpus bataua (6% cada una), siendo las tres primeras especies indicadoras de varillales. Oenocarpus bataua es una especie de bosques de terraza, así como varias otras (28 ssp.) reportadas en P86 y también presentes en P4, una parcela de terraza ubicada a 200 m de distancia.
Factor humano y factor tiempo en el uso de datos florísticos
Los resultados del análisis de disimilaridad florística fueron influenciados por la precisión y compatibilidad de la identificación de las especies. En nuestro caso, las identificaciones fueron realizadas por diferentes personas en diferentes tiempos y con diferente soporte de información o consulta, factores que son citados a continuación.
a) Factor tiempo
El porcentaje de individuos identificados a nivel de familia fue similar para los dos grupos de parcelas, aquellas establecidas después de 1991 y antes de 1991 (t11,6 = 0,3, p > 0,5). El porcentaje de individuos identificados a nivel de género y especie fue mayor en las parcelas establecidas después de 1991 que antes de 1991 (género: t11,6 = 4,5, p < 0,001, especies: t11,6 = 3,5, p < 0,005). De la misma manera, el número de especies identificadas con un binomio de género y especie conocidos fue mayor después de 1991 (74,1%) que antes de 1991 (53,1%; t11,6 = 4,9; p < 0,0005). Por lo tanto, es posible que las mismas especies fueran identificadas con diferente precisión en diferentes tiempos (Tabla 1).
b) Factor humano
Al nivel de especies, existe la posibilidad que algunas especies que son morfológicamente similares hayan sido confundidas y determinadas con nombres diferentes por personas diferentes. Por ejemplo, Andira multistipula reportada en las parcelas P1, P6 y P7 por Freitas (1996a) podría ser lo mismo que A. inermis en las parcelas P13 y P14 de Nebel et al. (2001). Ambas especies crecen en áreas temporalmente inundadas y presentan flores y frutos muy similares, pero Andira multistipula es distintiva por sus largas y persistentes estípulas ausentes en la otra especie (Pennington, 2003). Esto también confirma el uso de distintas fuentes que estuvieron disponibles en el herbario o los herbarios donde fueron tratados los especímenes.
Otros ejemplos de posibles errores en la determinación son Alchornea latifolia, Capparis osmantha, Cordia collococca, Endlicheria krukovii, Nectandra pulverulenta e Iryanthera tessmannii (P1, P6 y P7), las cuales podrían ser equivalentes a A. schomburgkii, Capparis sola, Cordia lutea, E. formosa, N. cuneatocordata e I. juruensis (P13 y P14), respectivamente. Ejemplos similares fueron observados en las parcelas de bosques de arena blanca, donde Haploclathra cordata, Caraipa tereticaulis y Emmotum floribundum de la parcela P86 (Peacock et al., 2007) podrían ser las mismas especies que H. paniculata, C. punctulata y E. affine de las parcelas P2, P3, P10 y P11 (Freitas, 1996b).
Discusión
Los grupos de parcelas obtenidos a través del análisis UPGMA contienen casi siempre parcelas de un mismo tipo de vegetación siguiendo la clasificación propuesta por Lopez-Parodi y Freitas (1990). Por lo tanto, dicha clasificación basada en la interpretación de imágenes, fotografías aéreas y una gran experiencia en el campo fue también ratificada por datos cuantitativos de la composición de la flora arbórea. A nivel de especies, algunos problemas taxonómicos fueron detectados, sin embargo los grupos fueron consistentes a los tres niveles de análisis (familia, género y especies).
Tipos de vegetación
El bosque ribereño (RF) estuvo representado por parcelas ubicadas geográficamente muy cerca (grupo a); este grupo estuvo claramente separado a nivel de familia y género. Al nivel de especie, en cambio, especies presentes en sólo uno o dos parcelas afectaron los resultados, las cuales causaron la mezcla de las parcelas con aquellas del bosque latifoliado de aguas negras. Pensamos que dichas especies son probablemente errores en la determinación y por lo tanto podría requerirse que los especímenes sean nuevamente comparados para asegurar la consistencia de los datos. Esto se discute más adelante con ejemplos de especies de parcelas establecidas en este tipo de bosque.
El bosque latifoliado de aguas negras (BWBLF) estuvo representado por dos grupos (b y c) localizados a 19 km de distancia, cada uno de ellos con diferente composición florística. El grupo c estuvo representado por sólo una parcela (P15) establecida en un parche aislado de este tipo de bosque. Esta zona está dominada por las familias Lecythidaceae, Fabaceae y Sapotaceae y los géneros Eschweilera y Pouteria, taxones que también dominan el bosque de terraza. Por esta razón, P15 aparece más semejante a parcelas de terraza al nivel de familia y género; sin embargo, al nivel de especies, esta parcela está más relacionada a las parcelas del mismo tipo de bosque (grupo b) a pesar de no formar un solo grupo.
El bosque de arena blanca (WSF) está representado por parcelas de los grupos d, e y transicional, que incluyen varillales y chamizales, donde los varillales tienden a tener árboles más altos, más diversidad de especies y mayor número de árboles que los chamizales (Encarnación, 1985). En Jenaro Herrera, estos bosques ocurren en pequeños parches rodeados por bosques de terraza, característica que dificulta el muestreo de áreas homogéneas. Los varillales de esta zona según García et al. (2003) son clasificados como varillales bajos de no más de 15 m de altura, tanto húmedos como secos.
El bosque de terraza alta (HT) y el bosque latifoliado de terraza baja (LTBLF) están representados en el grupo f. Estos dos tipos de bosques no fueron separados por la composición florística a pesar de tener geologías diferentes, con formaciones de suelos en diferentes épocas (HT: 27 Ma, LTBLF: < 1 Ma; Dumont et al., 1991). De otro lado, estudios más recientes sobre la estructura de estos bosques indican que los bosques de terraza alta tienen mayor número de individuos con DAP ≥ 30 cm y por lo tanto, mayor área basal que los bosques latifoliados de terraza baja (Yepes y Honorio, pers. comm.). También, Honorio (2006) demuestra que son bosques inusuales dentro de la Amazonía del noroeste porque presentan suelos muy pobres en nutrientes representando un extremo de la gradiente en la fertilidad del suelo en esta parte de la Amazonía.
El bosque de palmeras de aguas negras (BWPF) y El bosque de palmeras de terraza baja (LTPF) fueron bien definidos debido a la gran abundancia de palmeras. La especie Mauritia flexuosa domina principalmente estos bosques, formando formaciones monoespecíficas de baja diversidad florística (58 especies/ha) en el primer caso (Kahn & Mejía, 1990) y formaciones más diversas (158 especies/ha) en el segundo (Kahn, 1990; Kahn et al., 1988).
Factor tiempo y factor humano en el uso de datos florísticos
El factor tiempo y factor humano son discutidos a continuación debido a que es de esperar que las determinaciones llevadas a cabo por diferentes botánicos, en diferentes periodos y herbarios alteren los resultados de análisis florísticos. Por lo tanto, estos factores son fuentes de error en cualquier base de datos de especies de gran tamaño y diversidad.
A pesar que un botánico puede tener mucha experiencia de campo, la identificación de especies no es fácil e implica un amplio conocimiento del grupo taxonómico. Los taxa comunes y mejor distribuidos (familias, algunos géneros) son más fácilmente identificados y las especies raras o especies de géneros muy diversos son frecuentemente mal identificados. Durante el proceso de identificación, el botánico compara los especímenes colectados en el campo con aquellos del herbario previamente identificados. Este proceso está basado en la decisión de la persona y en la calidad de las determinaciones de los especímenes del herbario. Los especímenes de herbario que son identificados por especialistas, sin embargo las determinaciones dependen de la disponibilidad de las revisiones de los taxa. Lastimosamente, en el Neotrópico, algunos grupos de plantas no cuentan con estudios recientes.
La fecha de la determinación es también crucial para los botánicos, quienes deben lidiar con una taxonomía dinámica, donde nuevos taxones y revisiones taxonómicas son publicadas cada año. Por ejemplo, en el 2004, el International Plant Name Index registró cerca de 300 nuevos géneros y 4000 nuevas especies en el mundo. En la Amazonía, varios nuevos taxones son descritos anualmente, pero muchos más nombres son convertidos en sinónimos durante las revisiones taxonómicas. Por ejemplo, cerca del 20% de los nombres aceptados de Andira fueron convertidos en sinónimos en la última revisión del género (Pennington, 2003).
A pesar de estos problemas, los análisis florísticos idealmente deberían ser realizados a nivel de especies porque frecuentemente, es más a nivel de especies que géneros o familias que se muestran distribuciones restringidas y por ende una mejor definición de patrones florísticos. Una conclusión similar fue alcanzada durante el análisis de patrones fitogeográficos de los bosques de savana del Brazil (Ratter et al., 2003) y bosques estacionalmente secos del Pacífico Ecuatorial (Linares-Palomino et al., 2003), donde los patrones fueron claros usando la composición de las especies. Más recientemente, gradientes en la composición florística de parcelas de la planicie inundable de la Amazonía fueron resueltos a través de un análisis a nivel de especies (Wittmann et al., 2006).
Dado que el análisis florístico a nivel de especies es más ventajoso, debemos cuestionarnos por qué los análisis cuantitativos a gran escala de los bosques Amazónicos más diversos de tierra firme hayan sido realizados sólo a nivel de género y familia (p.ej. Terborgh & Andresen, 1998; ter Steege et al., 2000; ter Steege et al., 2006; De Oliveira y Nelson, 2001). Estos estudios mencionan los mismos problemas descritos anteriormente acerca de la uniformidad en la identificación de las especies y los vacíos en la revisión taxonómica de varios grupos. La única solución a estos problemas de taxonomía e identificación podría ser el asegurar que todos los inventarios sean bien referenciados (especimenes) y que los especímenes sean directamente comparados en los herbarios. Por lo tanto, las colecciones botánicas de los inventarios necesitan ser depositadas en herbarios accesibles y seguros, donde puedan ser revisadas y comparadas con otros especímenes tanto en el presente como en el futuro, cuando nuevas revisiones taxonómicas sean publicadas.
Agradecimientos
Los autores desean expresar su reconocimiento a Francis E. Putz y Filomeno Encarnación por sus comentarios durante la elaboración del documento. Este estudio es parte de la tesis de E. Honorio de M.Sc. en Biodiversidad y Taxonomía de Plantas de la Universidad de Edimburgo, Reino Unido, realizada con el apoyo del Royal Botanic Garden Edinburgh y del Programa Alban, programa de becas de alto nivel de la Unión Europea para América Latina, beca Nº E05M050715PE.
Literatura citada
Angiosperm Phylogeny Family Database. 2006. Published on the Internet http://ctfs.si.edu/apgnames/index.html [accessed June 2006].
De Oliveira A. & B. Nelson 2001. Floristic relationships of terra firme forests in the Brazilian Amazon. Forest Ecology and Management 146: 169-179.
Dumont, J., E. Deza & F. García. 1991. Morphostructural province and neotectonics in the Amazonian lowlands of Peru. Journal of South American Earth Sciencies 4: 373-381.
Encarnación, F. 1985. Introducción a la flora y vegetación de la Amazonía peruana: estado actual de los estudios, medio natural y ensayo de una clave de determinación de las formaciones vegetales en la llanura amazónica. Candollea 40: 237-252.
Freitas, L. 1996a. Caracterización florística y estructural de cuatro comunidades boscosas de la llanura aluvial inundable en la zona de Jenaro Herrera, Amazonía Peruana. Documento Técnico Nº 21. Instituto de Investigaciones de la Amazonía Peruana. 73 p.
Freitas, L. 1996b. Caracterización florística y estructural de cuatro comunidades boscosas de terraza baja en la zona de Jenaro Herrera, Amazonía Peruana. Documento Técnico Nº 26. Instituto de Investigaciones de la Amazonía Peruana. 77 p.
García, R., M. Ahuite, & M. Olórtegui. 2003. Clasificación de bosques sobre arena blanca de la Zona Reservada Allpahuayo-Mishana. Folia Amazónica 14: 17-33.
Gentry, A. 1988a. Tree species richness of upper Amazonian forests. Proc. Natl. Acad. Sci. USA. 85: 156-159
Gentry, A. 1988b. Changes in plant community diversity and floristic composition on environmental and geographical gradients. Annals of the Missouri Botanical Garden 75: 1-34.
Honorio, E. 2006. Floristic relationships of the tree flora of Jenaro Herrera, an unusual area of the Peruvian Amazon. M.Sc. thesis. University of Edinburgh, Royal Botanic Garden Edinburgh, UK. 104 p.
Kahn, F. 1990. Las palmeras del Arboretum Jenaro Herrera (Provincia de Requena, Departamento de Loreto, Perú). Contribución a la Flora de la Amazonía Peruana. XVII. Candollea 45: 341-362.
Kahn, F., K. Mejía, & A. De Castro. 1988. Species richness and density of palms in terra firme forests of Amazonia. Biotropica 20: 266-269.
Kahn, F. & K. Mejía. 1990. Palm communities in wetland forest ecosystems of Peruvian Amazonia. Forest Ecology and Management 33/34: 169-179.
Kvist, L. & G. Nebel. 2001. A review of Peruvian flood plain forests: ecosystems, inhabitants and resource use. Forest Ecology and Management 150: 3-26.
Linares-Palomino, R., T. Pennington, & S. Bridgewater. 2003. The phytogeography of the seasonally dry tropical forests in Equatorial Pacific South America. Candollea 58: 473-499.
Lopez Parodi, J. & D. Freitas. 1990. Geographical aspects of forested wetlands in the lower Ucayali, Peruvian Amazonia. Forest Ecology and Management 33/34: 157-168.
Malhi, Y., O. Phillips, J. Lloyd, T. Baker, et al. 2002. An international network to monitor the structure, composition and dynamics of Amazonian forests (RAINFOR). Journal of Vegetation Science 13: 439–450
McCune, B. & M. Mefford. 1999. PC-ORD. Multivariate Analysis of Ecological Data, Version 4. MjM Software Design, Gleneden Beach, Oregon, USA.
Nebel, G., L. Kvist, J. Vanclay, H. Christensen, et al. 2001. Structure and floristic composition of flood plain forests in the Peruvian Amazon I. Overstorey. Forest Ecology and Management 150: 27-57.
Peacock, J., T. Baker, S.Lewis, G. Lopez-Gonzalez & O. Phillips. 2007. The RAINFOR database: monitoring forest biomass and dynamics. Journal of Vegetation Science 18: 535-542.
Pennington, R.T. 2003. Monograph of Andira (Leguminosae-Papilionoideae). Systematic Botany Monographs. Volume 34. 143 p.
Phillips, O. & J. Miller. 2002. Global patterns of forest diversity: the dataset of Alwyn H. Gentry. Monographs in Systematic Botany. Volume 89. Missouri Botanical Garden, St. Louis, Missouri. 319 p.
Ratter, J., S. Bridgewater, & J. Ribeiro. 2003. Analysis of the floristic composition of the Brazilian cerrado vegetation III: Comparison of the woody vegetation of 376 areas. Edinburgh Journal of Botany 60: 57–109.
Spichiger, R., J. Méroz, P.-A. Loizeau & L. Stutz de Ortega. 1989. Contribución a la Flora de la Amazonía Peruana: Los árboles del Arboretum Jenaro Herrera. Volumen I. Moraceae a Leguminosae. Boissiera 43: 1-359.
Spichiger, R., J. Méroz, P.-A.Loizeau & L. Stutz de Ortega, 1990. Contribución a la Flora de la Amazonía Peruana: Los árboles del Arboretum Jenaro Herrera. Volumen II. Linaceae a Palmae. Boissiera 44: 1-565.
Spichiger, R., P.-A. Loizeau, C. Latour & G. Barriera. 1996. Tree species richness of a south-western Amazonian forest (Jenaro Herrera, Peru, 73º40W/4º54S). Candollea 51: 559-577.
Stevens, P. (2001 onwards) Angiosperm Phylogeny Website. Version 7, May 2006 [and more or less continuously updated since]. http://www.mobot.org/MOBOT/research/APweb/ [accessed May-July 2006].
ter Steege, H., D. Sabatier, H.Castellanos, T. Van Andel, et al. 2000. An analysis of the floristic composition and diversity of Amazonian forests including those of the Guiana Shield. Journal of Tropical Ecology 16: 801-828.
ter Steege, H., N. Pitman, D. Sabatier, H.Castellanos, et al. 2003. A spatial model of tree α-diversity and tree density for the Amazon. Biodiversity and Conservation 12: 2255-2277.
ter Steege, H., N. Pitman, O. Phillips, J. Chave, et al. 2006. Continental-scale patterns of canopy tree composition and function across Amazonia. Nature 443: 444-447.
Terborgh, J. & E. Andresen.1998. The composition of Amazonian forests: patterns at local and regional scales. Journal of Tropical Ecology 14: 645-664. IPNI. 2008. The International Plant Names Index. Published on the Internet http://www.ipni.org [accessed May-July 2006].
TROPICOS. 2008. Tropicos.org. Missouri Botanical Garden. 11 Jul 2008 <http://www.tropicos.org>. [accessed May-July 2006].
Wittmann, F., J. Schöngart, J. Montero, T. Motzer, et al. 2006 Tree species composition and diversity gradients in white-water forests across the Amazon Basin. Journal of Biogeography 33: 1334-1347.
___________________
Presentado: 25/10/2007
Aceptado: 18/04/2008