Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.15 n.2 Lima 2008
Péptidos antibacterianos de los venenos de Hadruroides mauryi y Centruroides margaritatus
Antibacterial peptides from Hadruroides mauryi and Centruroides margaritatus
Enrique Escobar1, Lidia Flores2 y Carlos Rivera1
(1) Laboratorio de Bioquímica y Genética Molecular, Email Enrique Escobar: eescobarg@unmsm.edu.pe
(2) Laboratorio de Microbiología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Apdo. 11-0058, Lima 11, Perú.
Resumen
En este trabajo se describen algunos péptidos antibacterianos de los venenos de los escorpiones Hadruroides mauryi (Francke y Soleglad, 1980) y Centruroides margaritatus (Gervais, 1841), aislados mediante cromatografía de intercambio iónico en CM Sephadex C-25 con buffer acetato de amonio 0,05M a pH 7. El veneno de H. mauryi (44,4 mg) fue separado en 7 fracciones proteicas. La fracción IV inhibió el crecimiento de Escherichia coli, Pseudomona aeuginosa y Bacillus cereus; la fracción V afectó a P. aeruginosa y B. cereus; y fracción VI mostró actividad sobre B. cereus. El veneno de C. margaritatus (50,6 mg) también fue fraccionado en 7 fracciones proteicas. La fracción II inhibió el crecimiento de Staphylococcus aureus; Las fracciones III, IV, V y VI afectaron a S. aureus, P. aeruginosa y B. cereus; y finalmente la fracción VII afectó a P. aeruginosa. En todos los casos los péptidos aislados fueron de naturaleza básica, con excepción del correspondiente a la fracción II de C. margaritatus. Adicionalmente determinamos que todos los péptidos carecen de acción hemolítica.
Palabras claves: veneno, escorpión, antibacteriano, Hadruroides charcasus, Hadruroides mauryi.
Abstract
In this work, we describe antibacterial peptides from Hadruroides mauuryi and Centruroides margaritatus scorpion venom, isolated by ionic exchange chromatography with 0,05M ammonium acetate buffer pH 7. H. mauryi venom (44,4 mg) was separated in 7 protein peaks. IV peak inhibited growth of Escherichia coli, Pseudomona aeuginosa and Bacillus cereus: V peak affect to P. aeruginosa and B. cereus, and VI peak have activity on B. cereus. C. margaritatus venom (50,6 mg) was also separated en 7 protein peaks. II peak inhibited growth of Staphylococcus aureus; III, IV, V and VI peaks affect to S. aureus , P. aeruginosa and B. cerus; and finally VII peak affect to P. aeruginosa. All isolated peptides were of basic pH, with exception of II peak from C. margaritatus. In addition, all peptides have not hemolitic activity.
Keywords: venom, scorpion, antibacterial, Hadruroides charcasus, Hadruroides mauryi.
Desde su descubrimiento, los antibióticos han sido ampliamente utilizados para el tratamiento de diferentes infecciones microbianas; sin embargo, su efectividad se ha visto limitada por la resistencia que han desarrollado diferentes cepas bacterianas, lo cual ha conducido a la necesidad de buscar nuevas fuentes biológicas de principios antibacterianos.
En 1969 se descubrieron en Bombina variegata, dos péptidos con actividad antimicrobiana (Csordas & Michl, 1969), y a partir de esa fecha numerosos péptidos con la misma propiedad fueron identificados en abejas, avispas, hormigas, arañas y escorpiones (Steiner et al., 1981; Bulet et al., 1999), así como en plantas (Broekaert et al., 1995) y mamíferos (Nicolas and Mor, 1995; Ganz and Lehrer, 1998; Hoffmann et al., 1999).
Los péptidos antimicrobianos tienen un amplio espectro de actividad contra una diversidad de microorganismos como bacterias, virus, protozoarios, levaduras y hongos, y están implicados
en la respuesta inmune innata (Larrick and Wright, 1996; Hancocka and Lehrerb, 1998); todos ellos parecen formar poros en la membrana celular aumentando la permeabilidad celular y alterando su fisiología (Sitaram and Nagaraj, 2002); además, muchos de ellos presentan actividad hemolítica. Estos péptidos son de bajo peso molecular (2 a 5 kDa), y en su gran mayoría son de naturaleza básica y anfipática (Torres-Larios et al., 2000).
Mas de 400 péptidos de naturaleza básica han sido descritos y considerando la secuencia de aminoácidos, así como la presencia o no de cisteina para formar puentes disulfuro y ciertos hechos estructurales, éstos se han subdividido en tres clases (Corzo et al., 2001):
- Péptidos lineales que forman alfa hélices y sin cisteína.
- Péptidos lineales que forman alfa hélice, sin cisteína y ricos en prolina o arginina.
- Péptidos con estructura de hoja beta y con enlaces disulfuros.
Los venenos de escorpiones han sido investigados ampliamente por sus neurotoxinas y la acción que ellas tienen sobre diferentes canales iónicos de mamíferos e insectos. Sin embargo, mas recientemente en estos venenos se han descubierto péptidos α-helicoidales capaces de formar poros en las membranas de algunos microorganismos produciendo de esta manera un efecto antimicrobiano. Entre estos péptidos tenemos a la parabutoporina de Parabuthus schlechteri (Verdonck et al., 2000), la hadrurina de Hadrurus aztecus (Torres-Larios et al., 2000), la IsCTs de Opisthacanthus madagascariensis (Dai et al., 2001 y 2002) y las pandininas 1 y 2 de Pandinus imperator (Corzo et al., 2001).
En el Perú existen por lo menos 41 especies de escorpiones, sin embargo recién a partir del año 2002 nuestro grupo de investigación ha comenzado a caracterizar los venenos de algunas especies, habiendo identificado y aislado ciertas toxinas con acción sobre insectos y roedores (Escobar et al., 2002; Escobar et al., 2003; Velásquez y Escobar, 2004).
En el presente trabajo, en los venenos de H. mauryi y C. margaritatus hemos identificado diversos péptidos que han mostrado inhibir el crecimiento de bacterias gram positivas y gram negativas, como E. coli, S. aureus, P. aeruginosa y B. cereus, lo cual constituye el primer reporte sobre péptidos antibacterianos en dos venenos de escorpiones peruanos.
La importancia de estos estudios radica en la necesidad de disponer de principios activos contra diversas infecciones bacterianas que han mostrado ser resistentes al tratamiento convencional con antibióticos.
Veneno de escorpión.- Escorpiones adultos de ambos sexos de las especies H. mauryi y C. margaritatus, fueron colectados en la provincia de Morropón (Lambayeque) y en la provincia de Zarumilla (Tumbes), respectivamente. El veneno, obtenido por estimulación eléctrica (22 voltios), fue colectado con microcapilares y depositado en una placa petri para luego ser desecado al vacío y conservado en refrigeración hasta su uso.
Cepas bacterianas.- Gram negativas: Escherichia coli ATCC 25922, Pseudomona aeruginosa ATCC 15442, Salmonella choleraesuis ATCC 14028 y Klebsiella pneumoniae. Gram positivas: Bacillus cereus ATCC 14579, Enterococcus faecalis y Staphylococcus aureus ATCC 25923.
Cuantificación de proteína.- Fue estimada por la absorción de luz ultravioleta a 280 nm (Warburg & Christian, 1941).
Fraccionamiento del veneno.- 44,4 mg del veneno de H. mauryi fueron disueltos en 1,2 mL de buffer acetato de amonio 0,05M a pH 7, y los restos insolubles fueron eliminados por centrifugación a 10000 rpm durante 15 minutos. Con el veneno de C. margaritatus, se procedió de manera similar, pero en este caso se disolvió 50,6 mg de veneno en 2 ml de buffer.
En cada caso el sobrenadante se aplicó a una columna de CM-Sephadex C-25 (1,1 x 17 cm) equilibrada con el mismo buffer y las proteínas retenidas fueron eluidas con el buffer conteniendo NaCl 0,25M y 0,6M.
Electroforesis en gel de poliacrilamida.- Los patrones electroforéticos de las proteínas aisladas, fueron analizados en geles de poliacrilamida en condiciones denaturantes con dodecil sulfato de sodio (PAGE-SDS), utilizando lisozima (14,3 kDa) y aprotinina (6 kDa) como proteínas estándares (Shäger & Von Jagow, 1987).
Actividad antibacteriana.- La actividad antibacteriana de los venenos y las diferentes fracciones se ensayaron en microplacas de 96 pocillos, en los que se colocó 90 μL del cultivo bacteriano en medio mínimo (con una absorbancia inicial a 600 nm de 0,02) y 10 μL de la fracción respectiva. Luego de 24 horas a 37 ºC se determinó si hubo crecimiento bacteriano por la turbidez desarrollada en cada pocillo.
Actividad hemolítica.- Se ensayó sobre glóbulos rojos humanos, para lo cual 9 mL de sangre se mezclaron con 1 mL de citrato de sodio 3,8 % y se centrifugó a 3000 rpm durante 15 minutos. Se eliminó el sobrenadante y el paquete de glóbulos rojos se lavó 3 veces con buffer fosfato 0,05 M con NaCl 0,9 % a pH 7,4. Finalmente de una suspensión al 0,5 %, se tomó 0,9 mL y se incubó con 0,1 mL de la fracción respectiva durante 1 hora a 37 °C, luego de lo cual se evaluó la hemólisis producida
Al pasar el veneno crudo de H. mauryi por la columna de CM Sephadex C-25, se obtuvieron 7 fracciones de proteína, de las cuales 3 mostraron acción antibacteriana. La fraccion IV (4,3 μg) inhibió el crecimiento de E. coli, P. aeuginosa y B. cereus, la fracción V (2,8 μg) afectó a P. aeruginosa y B. cereus, y finalmente la fracción VI (3,3 μg) mostró actividad sólo sobre B. cereus (Fig. 1).
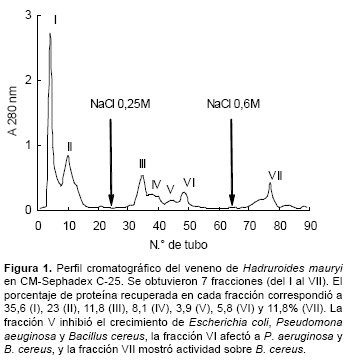
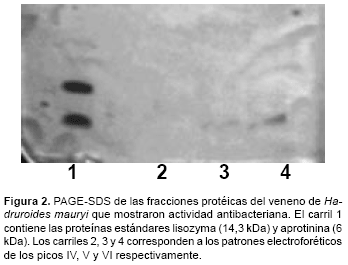
Las 3 fracciones antibacterianas identificadas en este veneno interactuaron con el gel de CM-Sephadex C-25 y solo fueron eluidas luego de emplear NaCl 0,25M, evidenciando que su carga a pH 7 es negativa y que por lo tanto son de naturaleza básica, como la mayoría de péptidos antibacterianos de venenos de escorpiones. La PAGE-SDS de estas fracciones del veneno de H. mauryi, mostró de una a dos bandas proteicas, tal como lo indica la figura 2.
En relación al veneno de C. margaritatus, cuando éste se pasó por la columna de CM Sephadex C-25, también se resolvió en 7 fracciones de proteína. La fracción II (7,5 μg) inhibió el crecimiento de S. aureus, las fracciones III (7,6 μg), IV (3,1 μg), V (4 μg) y VI (2,7 μg) inhibieron el crecimiento de S. aureus, P. aeruginosa y B. cereus y finalmente la fracción VII (4,7 μg) mostró actividad sobre P. aeruginosa (Fig. 3).
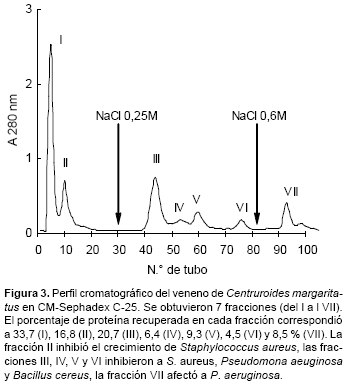
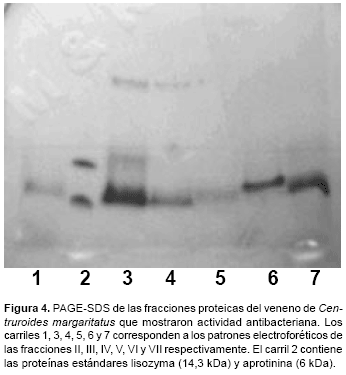
En este caso solo la fracción II eluyó directamente de la columna con el buffer inicial de corrida, lo que indicaría que el péptido antibacteriano contenido en esta fracción es de naturaleza neutra o ácida. Las demás fracciones si fueron de naturaleza básica, pues interactuaron con el gel y solo eluyeron luego del uso del buffer conteniendo NaCl 0,25M (fracciones III, IV, V y VI) o NaCl 0,6M (fracción VII). Igualmente la PAGE-SDS de cada una de estas fracciones mostró una o dos bandas proteicas (Fig. 4).
En la figura 5 se muestra el resultado de un ensayo típico de actividad antibacteriana en microplacas con pocillos.
En general, los péptidos antibacterianos identificados en este estudio son todos de naturaleza básica, con excepción solo de uno que está presente en el veneno de C. margaritatus. Por otro lado ellos difieren en su especificidad de acción y potencia, aunque esto último será mejor determinado cuando puedan ser purificados y se determine su concentración mínima inhibitoria.

Asimismo, es notable el hecho que seis de las siete fracciones cromatográficas obtenidas al separar el veneno de C. margaritatus, presentaron actividad antimicrobiana. Cabe resaltar que en un estudio previo en este mismo veneno, en algunos de esas fracciones se identificaron toxinas con acción sobre crustáceos, insectos y roedores, lo cual podría significar que en estas fracciones se hallan mezcladas estas toxinas con los péptidos antibacterianos, aunque otra posibilidad es que un mismo péptido posea tanto actividad tóxica como antibacteriana, tal como fue hallado recientemente en el veneno de Heterometrus laoticus donde se ha reportado un péptido con actividad antibacteriana y también con acción tóxica sobre grillos (Uawonggul et al., 2007).
De hecho, debido a la larga existencia de los escorpiones por más de 400 millones de años, se podría suponer que estos péptidos han participado en mecanismos de defensas muy antiguos y altamente eficientes contra los microorganismos patógenos presentes en sus presas. Asimismo un comportamiento que se ha verificado en varias especies de escorpiones, consiste en esparcir ocasionalmente su veneno sobre su cuerpo, lo cual permitiría especular que sea una forma de prevenir infecciones por microorganismos del ambiente, mediante los péptidos antibacterianos presentes en el veneno.
Literatura citada
Broekaert, W. F., Terras, F. R., Cammue, B. P. and Osborn, R. W. 1995. Plant defensins: novel antimicrobial peptides as components of the host defense system. Plant Physiol. 108, 1353-1358.
Bulet, P.; Hetru, C.; Dimarcq, J. L. and Hoffmann, D. 1999. Antimicrobial peptides in insects: structure and function. Dev. Comp. Immunol. 23, 329-344
Corzo, G., Escoubas, P., Villegas, E., Barnham, K .J., He, W., Norton, R. S. and Nakajima, T. 2001. Characterization of unique amphipathic antimicrobial peptides from venom of the scorpion Pandinus imperator. Biochem. J. 359, 35–45.
Csordas, A. and Michl, H. 1969. Primary structure of two oligopeptides of the toxin of Bombina variegata. Toxicon 7 (2) : 103-108.
Dai, L.; Corzo, G.; Naoki, H.; Andriantsiferana, M. and Nakajima, T. 2002. Purification, structure-function analysis, and molecular characterization of novel linear peptides from scorpion Opisthacanthus madagascariensis. Biochem. Biophys. Res. Commun. 293, 1514–1522.
Dai, L.; Yasuda, A.; Naoki, H.; Corzo, G.; Andriantsiferana, M. and Nakajima, T. 2001. IsCT a novel cytotoxic linear peptide from scorpion Opisthacanthus madagascariensis. Biochem. Biophys. Res. Commun. 286, 820– 825.
Escobar, E.; Rivera, C.; Tincopa, L. y Rivera, D. (2002). Purificación parcial de las toxinas Hl1, Hl2 y Hl3 del veneno del escorpión
Hadruroides lunatus Koch, 1867. Revista peruana de biología. 9 (1) : 310.
Escobar, E.; Velásquez, L. y Rivera, C. (2003). Separación e identificación de algunas toxinas del veneno de Centruroides margaritatus (Gervais, 1841). Revista peruana de biología. 10 (2) : 217-220.
Ganz, T. and Lehrer, R.I. 1998. Antimicrobial peptides of vertebrates. Curr. Opin. Immunol. 10 : 41-44.
Hancocka, R. and Lehrerb, R. 1998. Cationic peptides: a new source of antibiotics. Trends in Biotechnology. 16 (2) : 86-88.
Hoffmann, J. A., Kafatos, F. C., Janeway, C. A. and Ezekowitz, R. A. 1999. Phylogenetic perspectives in innate immunity. Science (Washington, D.C.) 284: 1313-1318.
Larrick, J. W. and Wright, S. C. 1996. Cationic antimicrobial peptides. Drugs Future. 21: 41-48.
Nicolas, P. and Mor, A. 1995. Peptides as weapons against microorganisms in the chemical defense system of vertebrates. Annu. Rev. Microbiol. 49: 277-304.
Sitaram, N. and Nagaraj, R. 2002. Antimicrobial Peptides as Novel Therapeutic Agents to Combat Drug-Resistant Microbial Infections. Current Medicinal Chemistry - Anti-Infective Agents.1 (4): 413-430.
Steiner, H., Hultmark, D., Engstrom, A., Bennich, H. and Boman, H. G. 1981. Sequence and specificity of two antibacterial proteins involved in insect immunity. Nature 292 (5820): 246-248. Natue (London) 292, 246-248.
Torres-Larios, A., Gurrola, G. B., Zamudio, F. Z. and Possani, L. D. 2000. Hadrurin, a new antimicrobial peptide from the venom of the scorpion Hadrurus aztecus. Eur. J. Biochem. 267, 5023–5031.
Uawonggul, N., Thammasiriraka, S., Chaveerachb, A., Arkaravichienc, T., Bunyatratchatad, W., Ruangjirachuporne, W., Jearranaiprepameb, P., Nakamuraf, T., Matsudaf, M., Kobayashig, M., Hattorig, S. and Daduanga, S. 2007. Purification and characterization of Heteroscorpine-1 (HS-1) toxin from Heterometrus laoticus scorpion venom. Toxicon 49, 19–29.
Velásquez, L. y Escobar, E. 2004. Purificación y caracterización parcial de una toxina (Hm3) del veneno de Hadruroides mauryi (Francke y Soleglad, 1980) (Scorpiones, Iuridae). Revista peruana de biología. 11 (2): 153-160.
Verdonck, F., Bosteels, S., Desmet, J., Moerman, L., Noppe, W., Willems, J., Tytgat, J. and van der Walt, J. 2000. A novel class of pore-forming peptides in the venom of Parabuthus schlechteri Purcell (Scorpions: Buthidae). Cimbebasia 16 (24) : 7–260.
Warburg, O. and Christian, W. 1941. Isolierung and Kristalisation der Garungs ferments enolase. Biochem. Z. Vol. 310 : 384-421.
____________________
Presentado: 15/11/2007
Aceptado: 11/02/2008













