Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.17 n.1 Lima abr. 2010
TRABAJOS ORIGINALES
Caracterización biológica y acción de inhibidores de una fosfolipasa A2 del veneno de Lachesis muta
Biological characterization and inhibitors action of Phospholipase A2 from Lachesis muta venom
Rosalina Inga ; Dan Vivas ; Pedro Palermo ; Julio Mendoza ; Fanny Lazo y Armando Yarlequé
Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Apartado 11-0058, Lima 11, Perú.
Email Rosalina Inga: rosalin_47@hotmail.com
Resumen
El presente trabajo informa de la purificación y caracterización bioquímica y biológica de la fosfolipasa A2 (PLA2) de Lachesis muta (Linnaeus, 1766). La purificación se realizó por cromatografía liquida (CL) usando CM-Sephadex C-50 y Sephadex G-50, obteniéndola al estado homogéneo con un peso molecular de 18749 Da. Los ensayos con PLA2 realizados sobre fosfolípidos de yema de huevo y lecitina comercial, mostraron que los agentes EDTA, PMSF, glutatión y cisteína, inhibieron la actividad con valores mayores al 50%. La PLA2 de L. muta produjo un notable efecto anticoagulante, observándose un retardo de 2'30" en el tiempo de coagulación con 9,6 µg de la enzima. La hemólisis indirecta sobre eritrocitos humanos dio un equivalente de 4,35 µg como dosis hemolítica media (HD50). Los valores de dosis edemática media y dosis miotóxica mínima fueron de 91,5 µg y 125,89 µg/mL respectivamente; valores por debajo de PLA2 de otros venenos. No se registró actividad hemorrágica directa. Las pruebas de inmunodifusión e inmunoelectroforésis revelaron que PLA2 de L. muta tuvo reactividad inmunogénica contra el antiveneno lachésico monovalente (INS-Perú). Sin embargo, la neutralización por el antiveneno fue parcial.
Palabras claves: Fosfolipasa A2, enzima, ofidio, toxicidad, inhibición.
Abstract
In the present study, phospholipase A2 (PLA2) from Lachesis muta (Linnaeus, 1766), is isolated, purified and characterized biochemically and biologically. Purification was performed by liquid chromatography (LC) using CM-Sephadex C-50 and Sephadex G-50, homogenized enzyme had a molecular weight of 18749 Da. Trials with egg yolk phospholipids, and commercial lecithin showed that EDTA, PMSF, glutathione and cysteine inhibited the activity with values greater than 50%. The PLA2 had a significant anticoagulant effect, showing a delay of 2'30" on the coagulation time with 9.6 µg of the enzyme. The indirect impact on human erythrocyte hemolysis gave an equivalent of 4.35 µg as HD50. Mean edematic dose and minimum myotoxic dose were 91.5 mg and 125.89 mg / mL respectively, these values were below enzymes phospholipase A2 from others poisons. There was no hemorrhagic activity. Immunodiffusion tests and immunoelectrophoresis revealed that the PLA2 of L. muta was immunogenic reactivity against lachesic monovalent antivenom (INS-Peru). However, the neutralization by the antivenom was partial.
Keywords: Phospholipase A2 , enzyme, snake, toxicity, inhibition.
Introducción
Muchos de los envenenamientos ofídicos que ocurren en la selva alta y baja del Perú son causados por especies de la familia Viperidae, siendo Lachesis muta "Shushupe" la serpiente Crotalinae que ocasiona un cuadro clínico severo, con daños locales y sistémicos como: cólico abdominal, diarrea, edema, dolor local intenso, nauseas, anormalidades hemostáticas, hipotensión, sangrado, necrosis, signos neurotóxicos, coagulopatias, choque cardiovascular e insuficiencia renal aguda; todo ello atribuido al complejo enzimático del veneno.
Dentro de este complejo enzimático se encuentran las fosfolipasas (EC 3.1.1.4), enzimas hidrolazas de los fosfolípidos que la enzima con cada inhibidor por 10 min a 37 ºC.
Propiedades biológicas de la enzima
Determinación de la actividad hemolítica
a) Actividad Hemolítica en Tubo
Se evaluó la hemólisis directa al mezclar 0,8 mL de buffer isotónico, 0,1 mL de glóbulos rojos lavados (GRL) y 0,1 mL de la enzima a diferentes concentraciones, fue incubado a 37 ºC por 2 horas, se detuvo la reacción con 5 mL de NaCl al 0,9% pH 7,3 con EDTA 1 mM fría; luego fue centrifugada a 1000 rpm por 5 min y la hemoglobina liberada fue leída a 540 nm. El grado de hemólisis total se expresó como porcentaje de hemoglobina liberada de 0,1 mL de GRL hemolizados con 5,9 mL de agua destilada (Condrea et al. 1964). Se determino la Dosis Hemolítica Media (DH50), la cual se define como la concentración de veneno en µg/mL que es capaz de lisar el 50% de los glóbulos rojos, (Castañon et al., 1993). Para la hemolisis indirecta se adiciono además 0,1 mL de fosfolípidos de yema de huevo al 6,4% (Condrea et al., 1964).
b) Actividad hemolítica Indirecta en placa
Se prepararon placas de agar sangre (agar 1,5% en PBS a pH 7,4, GRL al 3%, yema de huevo al 5% y CaCl2 10 mM) donde se fabricaron pocillos colocándose las muestras de veneno y enzima purificada, usándose como control solución salina. Se midieron los halos hemolíticos formados a las 0, 12 y 24 horas (Gutiérrez et al. 1988).
Actividad miotóxica. Se determino por la prueba de cuantificación de Creatina Kinasa (CK) sérica. Inyectandose 0,1 mL de la fosfolipasa A2 a diferentes concentraciones a ratones albinos (18 - 22 g) en el músculo gastrocnemius; se uso como control negativo solución salina. Después de 2 horas se obtuvo el plasma. La actividad de creatina kinasa fue medida con 25 µL del plasma sobre 1 mL del kit para creatina kinasa (Pointe Scientific, USA), midiendo los incrementos en la absorbancia a 340 nm por minuto. La actividad se expresó en UI/L. (Gutiérrez et al. 1980). Se determinó la Dosis Miotóxica Mínima (DMM) que corresponde a la cantidad de enzima que produce un valor de CK 4 veces mayor al control negativo, (WHO 1981).
Actividad edemática. Fue determinado por el método de Yamakawa et al., (1976), inyectándose 0,05 mL de fosfolipasa A2 a distintas concentraciones en el cojinete de la pata posterior derecha de ratones albinos (18 - 22 g), y en la pata posterior izquierda solución salina (control negativo). Después de 3 horas se sacrificaron los animales y las patas inyectadas fueron pesadas comparándolas con su propio control negativo y evaluando la diferencia de pesos entre ellos. La dosis edemática media (DEM) se expresa en microgramos de proteína capaz de producir una diferencia de peso entre el miembro tratado y no tratado, equivalente al 30%., (WHO 1981).
Determinación de la actividad hemorrágica. Se realizó según el Método de Kondo et al. (1960); ratones (18 - 22 g) fueron inyectados intraperitonealmente con 0,1 mL de la muestra, luego de 2 horas se sacrificaron. Retirándose la piel y evaluando el área hemorrágica formada. La actividad hemorrágica se expresó como la dosis hemorrágica mínima (DHM), definida como la cantidad de veneno o enzima que induce un área hemorrágica de 10 mm de diámetro.
Actividad anticoagulante. Se determinó por el método descrito por Yarlequé et al. (1989). La mezcla de reacción contenía 0,2 mL de plasma humano y 0,1 mL de la enzima, se incubaron a 37 ºC por 5 min para luego agregarles 0,1 mL de CaCl2 25 mM midiéndose el tiempo de recalcificación. La actividad anticoagulante se determinó por el retardo en la coagulación o la incoagulabilidad del plasma con respecto al tiempo de coagulación del blanco.
Pruebas inmunológicas y de neutralización
Inmunodifusión directa (IDD) e inmunoelectroforesis
La inmunogenicidad de la enzima purificada fue determinada siguiendo la metodología de Ouchterlony y Nilsson (1967), sobre geles de agarosa al 1% en PBS.
Ensayo de neutralización para la actividad enzimática
Se utilizaron mezclas que contenían 4,35 µg de la enzima en estudio con diferentes concentraciones del suero antilachésico monovalente equivalentes a 0,5; 1 y 2 dosis las cuales fueron preincubadas a 37 ºC por 30 min para luego medir la actividad de fosfolipasa. Una dosis neutralizante equivale a 10 mL de suero que neutraliza 24 mg de veneno lachésico.
Ensayo de neutralización para la actividad hemolítica
Se preparó una solución de agar al 1,5% en PBS a pH 7,4, GRL al 3%, yema de huevo al 5% y CaCl2 10 mM. Luego de su gelificación se realizaron pocillos y se colocaron las muestras del antiveneno y la enzima preincubadas a 37 ºC por 30 min a concentraciones equivalentes a 0,5; 1 y 2 dosis, se evaluó a las 12 y 24 horas observándose el grado de neutralización por la reducción del halo de hemólisis.
Resultados
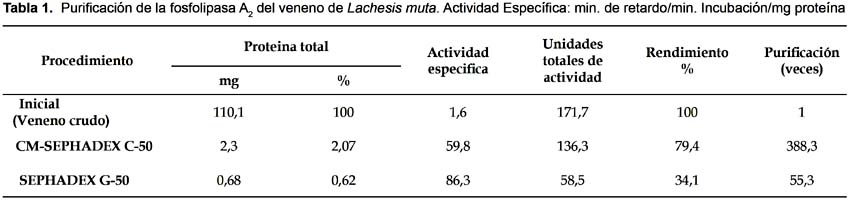
Purificación de la enzima
El veneno crudo de Lachesis muta fue fraccionado en 4 picos al ser pasado por una resina de CM-Sephadex C-50, en condiciones isocráticas, representando el 42,4% del total de la proteína colocada. Eluyeron adicionalmente 3 picos con NaCl 0,3 M y 2 picos con NaCl 0,6 M representando 42,6% y 15% respectivamente. La actividad de fosfolipasa A2 estuvo presente en la caída del tercer pico del volumen isocrático que representó el 2,1% del total de proteína. En el segundo pasó cromatográfico en Sephadex G-50, se resolvieron 2 picos, encontrándose la fosfolipasa en el primero. Como se muestra en la Tabla 1, la metodología empleada nos permitió la purificación de la PLA2 con un rendimiento del 34,1% y una purificación de 55,3 veces representando el 0,62% del total de proteína. Al evaluar la fosfolipasa A2 por PAGE-SDS, bajo condiciones reductoras y no reductoras, se observo en ambos casos que la enzima mostró una sola banda homogénea indicándonos que la proteína es monomérica con un peso molecular de 18749 Da.
Efecto de inhibidores enzimáticos
El EDTA y el PMSF tuvieron un efecto inhibitorio mayor, aunque no total; para que los otros agentes inhibitorios logren un efecto similar es necesario el incremento de su concentración. Por otro lado, las pruebas con los aminoácidos y el glutatión dieron como resultado que este ultimo inhibe en mayor grado la actividad de la enzima seguido por la cisteína sin diferir mucho de los otros aminoácidos que presentan inhibición parcial al emplearse concentraciones altas.
Propiedades biológicas de la enzima
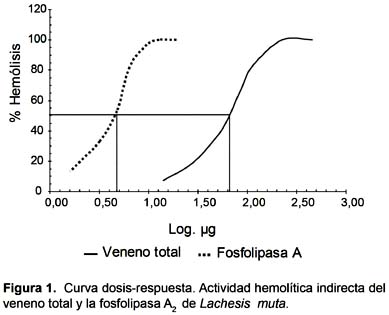
En cuanto a las actividades biológicas la enzima mostró una elevada actividad hemolítica indirecta con una Dosis Hemolítica media (DH50) de 4,35 µg para la enzima purificada y de 67,6 µg para el veneno total (Fig. 1). Los valores de Dosis Miotóxica Mínima (DMM) y Dosis Edemática Mínima fueron de 125,89 µg/mL y de 91,5 µg respectivamente. La enzima purificada retardo el tiempo de recalcificación del plasma humano como se muestra en la Figura 2. Produciendo un retraso de 158 segundos con 9,60 µg de enzima. La enzima no presentó actividad hemolítica directa sobre los eritrocitos humanos así como actividad hemorrágica a las concentraciones de 5, 15 y 30 µg, al inocularse en piel de ratones albinos.
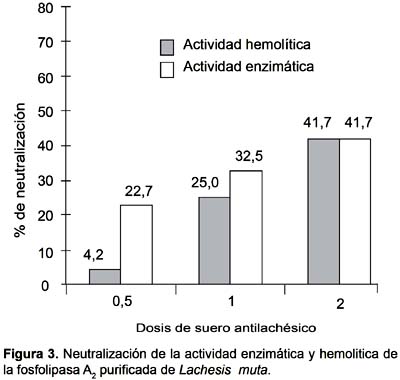
Pruebas inmunológicas y ensayos de neutralización
Las pruebas de inmunodifusión e inmunoelectroforesis demostraron la inmunogenicidad de la fosfolipasa A2 purificada y del veneno de L. muta, al ser reconocidas por el suero antilachésico monovalente comercial, observándose un solo arco de precipitación para la PLA2 purificada y varios arcos para el veneno total.
El suero antilachésico no neutralizó completamente la acción enzimática de la fosfolipasa A2 purificada reduciéndola hasta un 41,7% cuando se emplea la mayor dosis del antiveneno (Fig. 3). De la misma manera la actividad hemolítica indirecta de la enzima solo fue neutralizada parcialmente con la dosis mayor de antiveneno, hasta un 60% de acción hemolítica.

Discusión
Purificación de la enzima y determinación del peso molecular
Una isoforma de fosfolipasa A2, aislada del veneno de la serpiente peruana Lachesis muta, fue purificada por medio de dos pasos cromatográficos que involucraron secuencialmente el empleo de una resina intercambio catiónico CM sephadex C-50 y una resina de exclusión molecular Sephadex G -50. La enzima es de carácter ácido al ser eluída en el volumen isocrático del primer paso cromatográfico. En trabajos previos realizados en veneno de L. muta de Brasil han caracterizado cuatro isoformas de PLA2, siendo dos ácidas y dos básicas (Fuly et al. 2002, Damico et al. 2005), con características bioquímicas y biológicas distintas a las encontradas en la enzima purificada en este trabajo.
Los análisis por PAGE SDS así como las pruebas de inmunodifusión confirmaron la pureza de la proteína. El peso molecular de la enzima purificada tanto en condiciones reductoras como no reductoras fue de 18749 Da, peso similar fue encontrado para la PLA2 de L. muta de Brasil (Fuly et al. 2002), encontrándose dentro del rango de fosfolipasas en venenos de serpientes (Kini 2003). La presencia de una sola banda en condiciones reductoras indica que la proteína es de naturaleza unicatenaria.
Efecto de inhibidores enzimáticos
Como se muestra en la Tabla 2, el EDTA es el mayor inhibidor de la actividad enzimática porque es un agente quelante que atrapa todos los cationes divalentes presentes en el medio, dejando a la enzima sin su activador. Esto permite afirmar que la enzima requiere de iones como calcio para potenciar su actividad (Hseu et al. 1999). Así mismo, debemos resaltar el hecho que los ácidos aspártico y glutámico logran inhibir a la PLA2 a altas concentraciones, por lo que se sospecha que el mecanismo de acción comprendería la atracción del ion ligado a la enzima por tales aminoácidos ácidos, causando con ello un descenso en la afinidad PLA2-fosfolipidos.
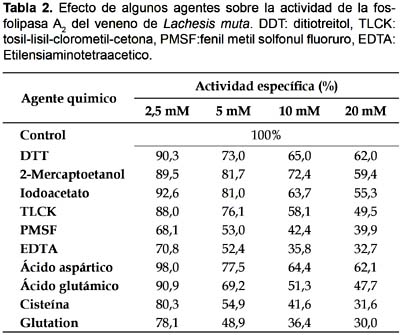
Los efectos del PMSF y TLCK evidenciarían la presencia de los aminoácidos serina e histidina y/o cisteína como residuos fundamentales en la estructura catalítica. Por otro lado, los resultados de inhibición con mercaptoetanol y el DDT indican que los puentes disulfuros no parecen estar involucrados en la conformación del sitio activo de la enzima pero si son necesarios en la estructura conformacional de la misma (Yang & King 1980). Un efecto similar tiene el aminoácido cisteína el cual logra inhibir a la enzima en 68,4% de su actividad; ambos, glutation y cisteína, modificarían la estructura conformacional de la enzima ya sea por ruptura de puentes disulfuros como es el caso del glutation o por la formación de nuevos puentes por encontrarse cisteína libre en el medio. Sin embargo son necesarios estudios cinéticos más profundos para determinar el modo probable de acción de los agentes mencionados
Caracterización biológica
Las PLA2 pueden actuar directamente sobre los eritrocitos para causar hemolisis (Kemparaju et al. 1994). Trabajos previos han sugerido la presencia de componentes que permiten esta actividad como el factor lítico directo, FLD (Martin et al. 1975) o el desoxicolato (Hendon & Fraenkel-Conrat 1971). Sin embargo, el mecanismo responsable para esta actividad no está del todo entendido. La enzima aislada no presenta una actividad hemolítica directa, la hemolisis producida es el resultado de la actividad de la lisolecitina liberada por la enzima al actuar sobre los fosfolipidos libres, atribuyendo de esta manera una actividad hemolítica indirecta que es superior al del veneno crudo y al reportado por Castañon et al. (1993).
No se ha encontrado una actividad miotóxica significante por parte de la enzima aislada lo que sugiere que pertenecería al grupo de las PLA2 que presentan el residuo D-49 y no al grupo que presenta el residuo K-49 (Ownby et al. 1999). Tampoco fue identificada una actividad edematizante significativa, la cual si es producida por las PLA2 de Lachesis muta stenophrys y Crotalus durissus durissus (Lomonte 1985) y B. asper (Lomonte y Gutierrez 1989), sin embargo esta actividad si está presente en el veneno crudo de L. muta lo que sugiere la existencia de otro componente en el veneno responsable para tal actividad.
Una de las diferencias resaltantes de la isoforma aislada en este trabajo con la reportada por Mejia et al. (2006) es la presencia del notable efecto anticoagulante, la cual alarga el tiempo de recalcificación del plasma, probablemente por hidrólisis de fosfolípidos, indispensable para que funcione la cascada de coagulación por la vía intrínseca (Bofa et al. 1982) esta actividad también esta presente en varias PLA2 aisladas (Kemparaju et al. 1994, Boffa & Boffa 1976, Condrea et al. 1981, Teng et al. 1984 y Prado-Franceschi et al. 1998).
Inmunogenicidad y neutralización
La reactividad inmunológica de la PLA2 indica que esta proteína, a pesar de su menor tamaño, puede inducir la producción anticuerpos. Investigaciones previas dan a conocer que las PLA2 pueden llegar a alcanzar hasta el 68% del veneno crudo (la crotoxina de C. durissus terrificus) por lo que al neutralizar al mayor componente del veneno, se estaría neutralizando la letalidad del mismo (Da Silva & Guilherme 1982). Los resultados de neutralización muestran que, independientemente de su inmunogenicidad, los anticuerpos anti-PLA2 presentes en el antiveneno comercial no son neutralizantes de su actividad enzimática. Por otro lado, los ensayos in vitro para probar la potencia del antiveneno sobre la actividad de PLA2, existen como alternativa con el objetivo de aminorar el uso de animales para experimentación (Habermann & Hardt 1972, Gutiérrez et al. 1988).
En conclusión se ha aislado una nueva isoforma de PLA2 del veneno de la serpiente peruana Lachesis muta, que presenta una notable actividad anticoagulante y acción hemolítica indirecta, los principales inhibidores son agentes quelantes y reductores de aminoácidos específicos de sitio activo.
Literatura citada
Boffa M., J. Dachary, H. Verheij, et al. 1982. Do we know: why some phospholipase A2 are anticoagulant? Toxicon 20, 305.
Boffa M. & M. Boffa. 1976. A PLA2 whit anticoagulant activity. Inhibition of the fosfolipid activity in coagulation. Biochem. Biophys. Acta 4, 29.
Castañón Y., A. Zavaleta, M. Salas, et al. 1993. Efectos letal, hemorrágico, coagulante, fosfolipásico y hemolítico de los venenos de las serpientes peruana Lachesis muta muta y Bothrops barnetti. Boletín de la Sociedad Química del Perú Lima 59 pp. 38-48
Condrea E., M. Barzilay & A. De Vries, 1964. Hemolysis and spliting of human erotrocyte phospholipids by snake venom. Biochem. Biophys. Acta 84, 60.
Condrea E., C. Ynga, & P. Rosemberg. 1981. Lack of correlation between anticoagulant activity and phospholipids hydrolysis by snake venom phospholipases A. Thromb. Haemost. 45, 82.
Damico D., S. Lilla, G. De Nuca, et al. 2005. Biochemical and enzymatic characterization of two basic Asp 49 phsopholipase A2 isoforms from Lachesis muta muta (Surucucu) venom. Biochim. Biophys. Acta 1726: 75-86.
Da Silva M. & O.Guilherme. 1982. Titration of antiserum to South American rattlesnake (Crotalus durissus terrificus) venom by measuring inhibition of phospholipase A2 activity. Toxicon. 20, 563-569.
De Oliveira M.R. & M.S. Palma. 1998. Polybitoxins: A group pf phospholipase A2 from the venom of the neotropical social wasp paulistina (Polybia paulista).Toxicon 36. 189-199.}
Escobar E. 1992. Purificación y caracterización bioquímica de una enzima fibrionogenolítica del veneno de la serpiente Lacheis muta. Tesis para optar al grado de Magíster en Bioquímica. UNMSM. Lima-Perú.
Fuly A.L., A.L. De Miranda, R.B. Zingali, et al. 2002. Purification and characterization of a phospholipase A2 isoenzyme isolated from Lachesis muta snake venom. Biochem. Pharmacol. 63, 1589-1597.
Gutierrez J.M., O. Arroyo, & R. Bolaños. 1980. Mionecrosis, hemorragia y edema inducidos por el veneno de Bothrops asper en ratón blanco. Toxicon 18, 603-610.
Gutierrez J.M., C. Avila, R. Rojas, et al. 1988. An alternative in vitro method for testing the potency of the poylivalent antivenom produced in Costa Rica. Toxicon. 26, 411-413.
Haberman E. & K. Hardt. 1972. A sensitive and specific plate test for the quantitation of phopholipases. Analyt. Biochem. 50, 163.
Hseu M.J., C.H. Yen, & M.C. Tzeng. 1999. Crocalbin: a new calcium-binding protein that is also a binding protein for crotoxin, a neurotoxic phospholipase A2. FEBS Lett. 445, 440-444.
Hendon R. & H. Fraenkel-Conrat. 1971. Biological roles of the components of crotoxin. Proc. Wat. Ac. SCI. USA. 68, 1560-1563
Kemparaju K., B. Nijaguna & V. Gowda. 1994. Purification of a basic phospholipase A2 from indian saw scaled viper Echis carinatus venos: caracterization of antigenic, catalytic and pharmacological properties. Toxicon. 32, 1178-1196.
Kini R.M. & H. Evan. 1989. A model to explain the Excitament ahed: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon 42: 827-840.
Kini R.M. 2003. Excitament ahed: structure, function and mechanism of snake venom phospholipase A2 enzymes. Toxicon 42, 827-840.
Kondo H., S.I. Kondo, R. Ikezawa, et al. 1960. Studies on the quantitative method for the determination of hemorrhagic activity of Habu snake venom. Japan. J. Med. Sci. Biol. 13: 43-51.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. 227: 680-685.
Lowry O., N. Rosebrough, & A. Farr. 1951. Protein measurement with the Folin phenol reagent. J Biol Chem. 193:265-275.
Lomonte B. 1985. Edema-forming activity of bushmaster (Lachesis muta stenophrys) in Central American rattlesnake (Crotalus durissus terrificus) venoms neutralization by a polyvalent antivenom. Toxicon. 23, 173-176.
Lomonte B. & J.M. Gutierrez. 1989. A new muscle damaging toxin, myotoxin II, from the venom of the snake Bothrops asper (terciopelo). Toxicon. 27, 725-733.
Martin S., M. Luthra, M. Wells, et al. 1975. Phospholipase A2 as a probe of phopholipid distriburion in erytrocite membranes: factors influencing the apparent specifity of the reaction. Biochemistry. 14. 5400.
Mejia J., R. Inga, F. Lazo, et al. 2006 Aislamiento, purificación y caracterización bioquímica de una fosfolipasa A2 de la serpiente peruana Lachesis muta "shushupe". Rev. Soc. Química del Perú. Vol 70 pag 86 -96.
Murakami M. & I. Kudo. 2002. Phospholipase A2. J. Biochem. 185, 263-270.
Ouchterlony O. & L.A Nilsson. 1967. Immunodifussion and immunoelectrophoresis. Handbook of Experimental Immunology. I (34): 655-660
Ownby C., H. Selistre de Araujo, H.S. White, et al. 1999. Lysise 49 phospholipase A2 proteins. Toxicon 37, 411-445.
Prado-Franceschi J., S. Hyslop, J. Cogo, et al. 1998. Characterization of a myotoxin from the Duvenoy's gland secretion of the xenodontine colubrid Philodryas olfersii (green snake): Effects on striated muscle and the neuromuscular junction. Toxicon. 36, 1407-1421.
Rodríguez E. & A.Yarlequé. 1990. Purification and characterization of two proteinases from bushmaster Lachesis muta snake venom. III Simposium on Animal, Plant and Microbial toxins. International society on toxinologia. Pan American Society. Mexico (Oaxtepec, 9th to 12th of January).
Soares A.M. & J.R. Giglio. 2003. Chemical modifications of phospholipases A2 from snake venoms: effects on catalytic and pharmacological properties. Toxicon 42.
Teng C., Y. Chem & C. Ouyang. 1984. Purification and properties of the main procoagulant and anticoagulant principies of Vipera russelli snake venom. Biochem. Biophys. Acta 786, 204.
Touqui L. & M. Alaoui-El-Azher. 2001. Mammalian secreted phospholipases A2 and their pathophysiological significance in inflammatory diseases. Curr. Mol. Med. 1, 739-754.
Vidal J.C. & A.O.M. Stoppani. 1971. Isolation and purification of two phospholipases A from Bothrops venoms archives of Biochemistry and Biophysics. 145: 543-555.
Warburg O. & W. Christian. 1941. Isolierung and Kristallisation des Gärungsferments Enolase. Biochem. 2(130): 384-421
WHO (World Health Organization). 1981. Progress in the characterization of venoms and standardization of antivenom. Geneva: Worl Health Organization.
Yamakawa M., N. Nosake, & Z. Hokama. 1976. Fractionation of sakishima-hyabu (Trimererusus elegants) venom, and letal, hemorrhagic and edemaforming activities of the fractions. In animal, plant, and microbial toxins. Biochemestry, 1.
Yang C.C. & K. King. 1980. Chemical modification of the histidine residue in basic phospholipase A2 from the venom of Naja nigricollis. Biochim. Biophys. Acta 614, 373-388.
Yarlequé A., S. Campos, E. Escobar, et al. 1989. Isolation and characterization of a Fibrinogen-clotting enzyme from venom of the snake Lachesis muta muta (Peruvian bushmaster). Toxicon, 27, 1189-1197.
Trabajo presentado a la XVIII Reunión Científica del Instituto de Investigaciones en Ciencias Biológicas Antonio Raimondi, 200 años del nacimiento de Charles Darwin y el 150 aniversario de la publicación de On the Origin of Species by Means of Natural Selection. Del 19 al 21 de agosto de 2009.
Publicado impreso: 20/10/2010
Publicado online: 29/09/2010













