Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.17 n.2 Lima ago. 2010
Efectos de la salinidad sobre el desarrollo de embriones de Cryphiops caementarius (Crustacea: Palaemonidae) incubados in vitro
Effects of salinity on embryonic development of Cryphiops caementarius (Crustacea: Palaemonidae) incubated in vitro
Adelhi S. Fuentes1 ; Anghela V. Mogollón1 y Walter E. Reyes2
1. Escuela de Biología en Acuicultura. Facultad de Ciencias. Universidad Nacional del Santa. Av. Universitaria s/n Urb. Bellamar. Nuevo Chimbote. Áncash. Perú.
2. Departamento de Biología, Microbiología y Biotecnología. Facultad de Ciencias. Universidad Nacional del Santa.
Email Walter Reyes: wreyes@uns.edu.pe
Resumen
El objetivo fue estudiar los efectos de la salinidad sobre el desarrollo de embriones de Cryphiops caementarius incubados in vitro. Se utilizaron embriones de desarrollo temprano procedentes de una sola hembra. Se emplearon incubadoras de 400 mL, con 4 tratamientos de salinidades de 0, 10, 20 y 30‰, tres replicas, y 200 embriones cada incubadora. El 80% del agua se renovó frecuentemente. Las salinidades entre 0 y 30‰ no afectaron el desarrollo de los embriones hasta el estadio 6. Las salinidades de 10 y 20‰ ocasionaron retraso del desarrollo de los estadios 7 y 8; y la salinidad de 30‰ ocasionó muerte del estadio 7. En agua dulce el 70,3% de los embriones supervivieron y las larvas fueron normales; en cambio en salinidad de 10‰ el 13,5% y en 20‰ solo 7,9% lograron eclosionar larvas pero con deformaciones.
Palabras claves: Incubación in vitro, embriones, camarón, Cryphiops, Áncash, Perú.
Abstract
The aim of this work was to study the effects of salinity on the development of embryos of Cryphiops caementarius incubated in vitro. We used embryos of early development, from a unique female. The incubators were of 400 mL, with 4 salinity treatments of 0, 10, 20 and 30 ‰, three replicates, and 200 embryos each incubator. The 80% of the water was renewed frequently. The salinities between 0‰ and 30‰ did not affect the development of the embryos up to the stage 6. The salinities of 10 and 20 ‰ caused delay of the development of the stages 7 and 8; and the salinity of 30‰ caused death of the stage 7. In freshwater the 70,3% of the embryos survived and larvae were normal; on the other hand in salinity at 10‰ to 13,5% and 20‰ only 7,9% achieved larvae hatch but with deformations.
Keywords: Incubation in vitro, embryos, prawn, Cryphiops, Áncash, Peru.
Introducción
El camarón Cryphiops caementarius (Molina 1872) es reconocida como una especie de importancia comercial, común en los ríos del sur del Perú (Yépez & Bandín 1997). Su límite de distribución norte es el Perú, hasta el río Taymi-Mochumi (6º32'S) (Amaya & Guerra 1976). En el Perú han sido realizados estudios sobre los estados de madurez gonadal (Viacava et al. 1978) y los estadios del desarrollo embrionario (Vegas et al. 1981). Las hembras se encuentran en las partes más bajas del río, muy cerca de su desembocadura (Elías 1960), lo cual coincide con el requerimiento de salinidad de las larvas para su desarrollo(Viacava et al. 1978). En consecuencia, las larvas, las hembras y los embriones de C. caementarius, se encuentran adaptadas a las variaciones de salinidad y mantener este comportamiento reproductivo (Charmantier & Charmantier-Daures 2001).
La salinidad es uno de los factores ambientales que influye en los animales que residen en estuarios por la amplia variación debido a las mareas y a la descarga de los ríos. La membrana embrionaria de crustáceos ofrece protección osmótica durante el desarrollo y disminuye en el momento de la eclosión (Charmantier & Charmantier-Daures 2001); esto se relaciona con el incremento de la enzima Na+/K+-ATPasa, como se observa en embriones de Macrobrachium rosenbergii (Huong & Wilder 2001) y Palaemonetes argentinus (Ituarte et al. 2008), que les permite enfrentar variaciones de salinidad. Los embriones de M. molcolmsonii incubados in vitro mueren en salinidades de 6‰; y si llegan a nacer las larvas son débiles y menos activas (Samuel et al. 1997); de igual manera en P. argentinus en salinidades entre 25 y 32‰ se ha observado interferencia del catabolismo de lipoproteínas causando deformaciones (Ituarte et al. 2005). Esto indica que la tolerancia a la salinidad es propia de cada especies y parece estar relacionado al punto isoosmótico aspecto que no se ha investigado en C. caementarius. El punto isosmotico reportado para M. rosenbergii (Charmantier et al. 2001, Cheng et al. 2003) es 424 mOsm kg-1 (14‰); de manera practica con 12‰ de salinidad se mejora la eclosión de los embriones portados por las hembras (New & Singholka 1982) y mayores salinidades causan estrés osmótico en los embriones al sobrepasar el punto isoosmótico.
El sistema de incubación in vitro ha sido utilizado en embriones de varios crustáceos como el cangrejo de río Astacus sp. (Arrignon 1985), la langosta Jasus frontalis (Dupré 1988), los cangrejos estuarinos Chasmagnathus granulata y Cryptograpsus angulatus (Bas & Spivak 2000) y diversas especie de palaemonidos como M. nobilii, M. idella, M. lamarrei (Balasundaram & Pandian 1981, Mathavan & Murugadass 1988), M. rosenbergii (Damrongphol et al. 1990, Caceci et al. 1996, Porntrai & Damrongphol 2008), M. molcolmsonii (Samuel et al. 1997) y P. argentinus (Ituarte et al. 2005). Esta técnica de incubación in vitro permite estudiar respuestas a condiciones de estrés como salinidad (Ituarte et al. 2005), temperatura (San Feliu et al. 1976), antibióticos (Damrongphol et al. 1990) o puede ser utilizado en manipulación genética (Caceci et al. 1996).
En el presente trabajo se describen los efectos de tres concentraciones de salinidad (10, 20 y 30‰) sobre el desarrollo de embriones de C. caementarius incubados in vitro.
Material y métodos
Hembras ovíferas de C. caementarius fueron capturadas cerca a la desembocadura del río Lacramarca (09°07'70"S y 78°34'20"W) de la provincia del Santa, Áncash, y transportadas en baldes con agua del mismo río hasta el laboratorio. Un ejemplar de 5,2 cm de longitud total con embriones en estadio 3 de desarrollo fue seleccionado; porciones de la masa embrionaria fueron extraídos con pinzas y depositados en placas petri conteniendo agua con aireación y luego fueron separados para obtener racimos de hasta 20 embriones y embriones individuales.
Doscientos embriones fueron transferidos a cada una de las doce incubadoras de plástico cilindro-cónicas conteniendo 400 mL de agua a las salinidades de 0, 10, 20 y 30‰. Los embriones fueron mantenidos en suspensión y en movimiento continuo introduciendo aire (0,5 L.min-1) desde el fondo de las incubadoras a través de un tubo plástico de ø 3 mm. Todas las incubadoras estuvieron dentro de un acuario a 22,5 ± 1,5 ºC, mantenidas con un termostato y uniformizada con un sistema air-water-lift. A cada incubadora se le agregó 500 ppm de azul de metileno.
La salinidad del agua fue preparada por mezcla de agua de mar (35‰) procedente de la playa El Dorado (Prov. Santa, Región Áncash), con agua potable (0‰) declorada por aireación durante 48 h. La salinidad del agua de las incubadoras fue determinada con un refractómetro (±1‰) y la salinidad fue controlada adicionando agua potable declorada. La temperatura fue registrada con termómetro digital (±0,1 ºC) y el oxígeno con oxímetro digital (± 0,01 mg.L-1). El 80% del agua de cada incubadora fue renovada cada cinco días durante los primeros diez días de incubación, luego cada tres días hasta el final de la experiencia. En todos los casos el agua para recambio tuvo la misma temperatura y concentración de azul de metileno que el de las incubadoras.
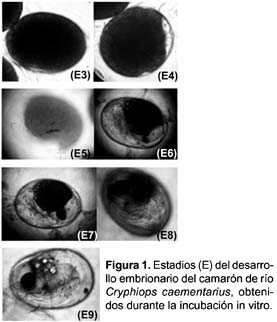
Una submuestra al azar de aproximadamente 10 embriones fueron extraídos diariamente de cada incubadora para determinar los estadios embrionarios según las características siguientes: Estadio 3 con blastoporo y primordio embrionario; estadio 4 metanauplio embrionario reciente; Estadio 5 con cromatóforos y pigmentación ocular sobre el vitelo; Estadio 6 con pigmentación ocular granate al borde del vitelo; Estadio 7 con cromatóforo en tercer segmento abdominal; Estadio 8 metanauplio en premuda y Estadio 9 pre zoea. Así mismo se buscó deformidades del embrión y se contabilizó los embriones muertos.
Debido a la forma elipsoide de los embriones, se midieron los diámetros mayor (D) y menor (d) de cada estadio embrionario utilizando el ocular micrométrico del microscopio, para luego determinar el volumen (mm3) según la fórmula V= ?*D*d2/6; considerando que durante el desarrollo normal hay incremento del volumen que contribuye con la eclosión. El porcentaje de eclosión fue determinado contando las larvas eclosionadas y la longitud total (escotadura postorbital - extremo posterior del telson) fue determinada en 10 larvas.
Se empleo el diseño experimental de estímulo creciente de salinidad. Los datos fueron sometidos a homogeneidad de varianzas, luego análisis de varianza de una vía y a la prueba de Tukey, con un nivel de significancia del 1%, para ello se empleó el software SPSS-15 para Windows.
Resultados
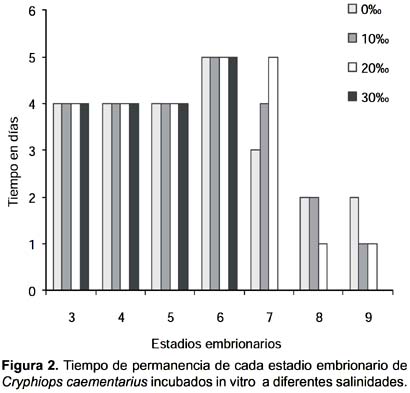
Duración del desarrollo de embriones: El tiempo de permanencia de los estadios 3, 4 y 5 del desarrollo de los embriones de C. caementarius incubados in vitro tanto en agua dulce como en las tres salinidades experimentales fue de 4 días; el estadio 6 fue de 5 días. El estadio 7 demoró 3, 4 y 5 días en 0, 10 y 20‰, respectivamente, y en 30‰ todos los embriones murieron. El estadio 8 demoró 2 días en 0 y 10‰ y un día en 20‰. El estadio 9 demoró 2 días a 0‰ y un día a 10‰ y 20‰ (Figs. 1 y 2). La duración total del desarrollo embrionario fue de 24 días.
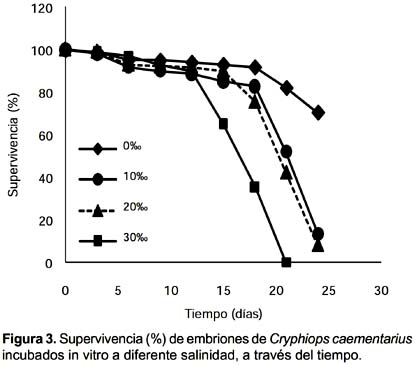
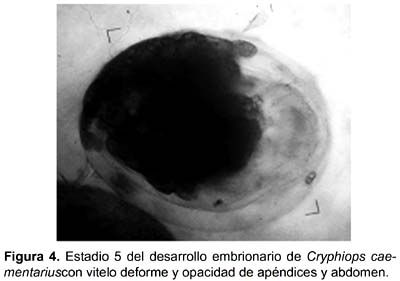
Supervivencia de embriones: La supervivencia de los embriones de C. caementarius incubados in vitro fue estadísticamente similar (p>0,01) hasta los 12 días y en promedio fue de 94%. A los 18 días la supervivencia fue de 35,5% en 30‰ diferente (p<0,01) y más baja que los obtenidos a 0, 10 y 20‰ que fueron 91,8, 82,7 y 75,3%, respectivamente, siendo estos similares pero con tendencia de disminuir a mayor salinidad. A los 21 días, se produjo la muerte de todos los embriones incubados a 30‰. A los 24 días, la supervivencia fue de 70,3 a 0‰ significativamente alta (p<0,01) en relación a 13,5% obtenidos en 10‰ y de 7,9% a 20‰, estos dos últimos no fueron estadísticamente diferentes (Fig. 3). No hubo mortalidad de embriones por infestación con hongos en ninguno de los tratamientos. Los embriones en estadio 5 incubados a 30‰ sufrieron deformación del vitelo y opacidad de los apéndices y del abdomen (Fig. 4).
Volumen de embriones: Los embriones de C. caementarius incubados in vitro a las salinidades de 0 y 10‰ incrementaron de volumen conforme desarrollaron y no hubo diferencia significativa (p>0,01) en cada estadio embrionario; pero desde el estadio 5 si difirieron (p<0,01) con aquellos incubados a 20 y 30‰ cuyos volúmenes fueron inferiores. El volumen del estadio 9 fue mayor en los incubados a 10 y 20‰ (Fig. 5; Tabla 1).
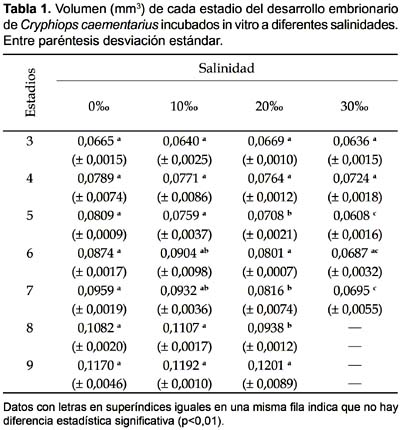
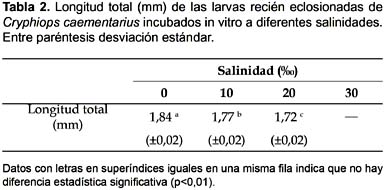
Eclosión: La eclosión de embriones de C. caementarius incubados in vitro se inició a los 22 días a 0‰, a los 23 días a 10‰ y a los 24 días a 10‰. El porcentaje de eclosión de los embriones incubados a 0‰ fue alta (70,3%) y significativa (p<0,01), obteniendo larvas sin alteraciones morfológicas. En cambio fue baja la eclosión de los incubados a 10‰ (13,5%) y 20‰ (7,9%) que no difirieron estadísticamente (Fig. 6); sin embargo, existieron mayor proporción de larvas con deformaciones morfológicas de los apéndices cefalotorácicos y del sexto segmento abdominal, en relación directa con la salinidad. Eclosión prematura ocurrió en 30‰, es decir eclosión de embriones en estadio 8. La longitud total de las larvas recién eclosionadas fue estadísticamente diferente (Tabla 2).
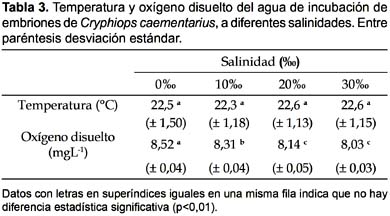
Calidad del agua: La temperatura del agua varió uniformemente en todas las incubadoras; en cambio el oxígeno disuelto del agua varió significativamente en proporción inversa a la salinidad del agua (Tabla 3).
Discusión
No se observó diferencias significativas en el desarrollo de los embriones de C. caementarius incubados in vitro tanto en agua dulce como en las salinidades de 10, 20 y 30‰ desde el inicio hasta el estadio 6; en cambio el estadio 7 retrasó significativamente (p<0,01) el desarrollo a 10‰ y 20‰ pero a 30‰ todos murieron probablemente por deshidratación. Se ha reportado que la habilidad de los embriones de crustáceos para tolerar diferentes concentraciones osmóticas al de su medio interno, está relacionada a su membrana externa (Bas & Spivak 2000) y que la permeabilidad disminuye cuando las membranas embrionarias están en formación y aumenta cuando se completan las membranas (Glas et al. 1997). En embriones de C. caementarius la presencia de una doble membrana aparece en el estadio 4, pero no protege a los embriones porque desde el estadio 5 y en las salinidades de 20 y 30‰ disminuye el volumen pero no alteró la duración de los estadios 5 y 6, lo cual indica que fueron resistentes; en cambio el estadio 7 fue sensible incluso a 10 y 20‰ que ocasionó alteraciones morfológicas reduciendo la supervivencia. Similares resultados fueron obtenidos en embriones de P. argentinus incubados in vitro a 25 y 32‰ (Ituarte et al. 2005). Sin embargo, en embriones de M. molcolmsonii el incremento de salinidad de 0,5 a 6‰ ocasiona alta mortalidad (Samuel et al. 1997), lo que sugiere que la resistencia a la salinidad es propia de cada especie.
El alto porcentaje de eclosión (70,3%) de embriones de C. caementarius incubados in vitro y en agua dulce, es bastante consistente a lo reportado en la misma especie (Vegas et al. 1981), donde alta eclosión en laboratorio es obtenida cuando el desarrollo de los embriones portados por las hembras es llevado a cabo en agua dulce y en condiciones naturales.
Sin embargo, el bajo porcentaje de eclosión obtenido en 10‰ (13,5%) y en 20‰ (7,9%), además de la eclosión prematura de embriones en estadio 8, así como la presencia de larvas con deformidades, sería consecuencia de la salinidad que ocasionó primero deshidratación y después en el último estadio ingreso de excesiva agua y de iones que ocasionó incremento del volumen y ruptura de la membrana embrionaria, lo que sugiere que los embriones a partir del estadio 7 no están capacitados para enfrentar salinidades entre 10 y 30‰. Los embriones de P. argentinus, incubados in vitro a 25‰ y 32‰, sufren deformaciones morfológicas y alteraciones en larvas por interferencia con el catabolismo de lipoproteínas (Ituarte et al. 2005); además, de otras alteraciones metabólicas que pueden haber sido afectadas por el exceso de iones dentro de los embriones.
De acuerdo a los resultados obtenidos, inferimos que las hembras ovíferas de C. caementarius permanecen en lugares con salinidad menor a 10‰; en todo caso, desde mitad del desarrollo de sus embriones ellas deben evitar ambientes con alta salinidad para proteger a la prole.
Literatura citada
Amaya J. & A. Guerra. 1976. Especies de camarones de los ríos norteños del Perú y su distribución. Ministerio de Pesquería. Dirección General de Investigación Científica y Tecnológica Nº 24. Convenio Ministerio de Pesquería - Universidad Nacional de Trujillo. Lima - Perú. 58 pp.
Arrignon J. 1985. Cría del cangrejo de río. Zaragoza, España. Edit. Acribia SA. 201 p.
Balasundaram C. & T.J. Pandian. 1981. In vitro culture of Macrobrachium eggs. Hydrobiologia, 77: 203-208.
Bas C.C. & E.D. Spivak. 2000. Effect of salinity on embryos of two southweatern atlantic estuarine grapsid crab species cultured in vitro. J. Crust. Biol, 20 (4): 647-656.
Caceci T., C.B. Carlson, T.E. Toth & S.A. Smith. 1996. In vitro embryogenesis of Macrobrachium rosenbergii larvae following in vivo fertilization. Aquaculture, 147: 169-175.
Charmantier G. & M. Charmanties-Daures. 2001. Ontogeny of osmoregulation in crustaceans: The embryonic phase. Amer. Zool, 41: 1078-1089.
Charmantier G., C. Haond, J.H. Lignot & M. Charmantier-Daures. 2001. Ecophysiological adaptation to salinity throughout a life cycle: A review in homarid lobster. J. Exp. Biol, 204: 967-977.
Cheng W., C.H. Liu, C.H. Cheng & J.C. Chen. 2003. Osmollality and ion balance in giant river prawn Macrobrachium rosenbergii subjected to changes in salinity: role of sex. Aquaculture Research, 34: 555-560.
Damrongphol P., N. Eangchuan & B. Pool. 1990. Simple in vitro culture of embryos of the giant freshwater prawn (Macrobrachium rosenbergii). J. Sci. Soc. Thailand, 16: 17-24.
Dupré E. 1988. Desarrollo embrionario de la langosta de Juan Fernández Jasus frontalis (Decapoda, Macrura, Palinuridae). Invest. Mar. Valparaíso, 16: 49-62.
Elías J. 1960. Contribución al conocimiento del camarón de río. Pesca y Caza, 10: 84-106.
Glas P.S., L.A. Courtney, J.R. Rayburn & W.S. Fisher. 1997. Embryonic coat of the grass shrimp Palaemonetes pugio. Biol. Bull, 192: 231-242.
Huong D.T.T & M.N. Wilder. 2001. Studies on osmoregulation in the giant freshwater prawn (Macrobrachium rosenbergii). The 2001 Anual Workshop of JIRCAS. Technology Development for Aquaculture Production. 11 p.
Ituarte R.B., E.D. Spivak & K. Anger. 2005. Effects of salinity on embryonic development of Palaemonetes argentines (Crustacea: Decapoda: Palamonidae) culture in vitro. Invertebrate Reproduction and Development, 47 (3): 213-223.
Ituarte R.B., A.A. López, E.D. Spivak & K. Anger. 2008. Activity of Na+, K+-ATPase in a freshwater shrimp Palaemonetes argentinus (Caridea, Palaemonidae): ontogenic and salinity-induced changes. Aquat. Biol, 3: 283-290.
Mathavan S. & S. Murugadass. 1988. An improved design for in vitro hatching of Macrobrachium eggs. Asian Fisheries Science, 1: 197-201.
New M.B. & S. Singholka. 1982. Freshwater prawn farming. A manual for the culture of Macrobrachium rosenbergii. FAO Fish. Tech. Rep, 225: 1-116.
Porntrai S. & P. Damrongphol. 2008. A simple in vitro culture of freshwater prawn embryos for laboratory investigations. J. Biol. Exp, 42 (3): 138-141.
Samuel M.J., T. Kannupandi & P. Soundarapandian. 1997. In vitro embryo culture and effect of salinity on the embryonic development of the cultivable freshwater prawn Macrobrachium malcolmsonii (H. Milne Edwards). Current Science, 73(3):294-297
San Feliu J.M., F. Muñoz, F. Amat, et al. 1976. Cultivo experimental de larvas de crustáceos y peces en tanques. Inf. Tecn. Inst. Inv. Pesq, 36: 3-41.
Viacava M., R. Aitken & J. Llanos. 1978. Estudio del camarón de río en el Perú. 1975-1976. Bol. Inst. Mar Perú, 3 (35): 161-232.
Vegas M., L. Ruiz, A. Vega & S. Sánchez. 1981. El camarón Cryphiops caementarius (Palaemonidae): desarrollo embriológico, contenido estomacal y reproducción controlada. Primeros resultados. Rev. Lat. Acui, 19: 11-23.
Yépez V. & R. Bandín. 1997. Evaluación del recurso camarón de río Cryphiops caementarius en los ríos Ocoña, Majes-Camaná y Tambo, Octubre 1997. Inf. Prog. Inst. Mar Perú, 77: 3-25.
Presentado: 28/11/2009
Aceptado: 23/08/2010
Publicado online: 14/12/2010













