Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.18 no.1 Lima Apr. 2011
TRABAJOS ORIGINALES
Reproducción y dieta de una población de Mabuya dorsivittata (Squamata, Scincidae) en Córdoba, Argentina
Reproduction and diet of a population of Mabuya dorsivittata (Squamata, Scincidae) in Cordoba, Argentina
Liliana Aun
; Damiana Borghi y Ricardo MartoriDepartamento de Ciencias Naturales, Facultad de Ciencias Exactas, Físico- Químicas y Naturales; Universidad Nacional de Río Cuarto. EP. N 9, RN 36 km 601, 5800 Río Cuarto, Córdoba, R. Argentina, 5800 Río Cuarto.
Liliana Aun. Dpto Ciencias Naturales. UNRC. Teléfono 0358- 4676428.
Email Liliana Aun: Laun@exa.unrc.edu.ar
Email Ricardo Martori: rmartori@exa.unrc.edu.ar
Resumen
En el presente trabajo fueron estudiados los aspectos reproductivos y la dieta de Mabuya dorsivittata, una especie de lagarto vivíparo de la localidad de Alto Alegre (Córdoba). La hembra de menor tamaño, con folículos yemados midió de LHC 41 mm. El tamaño de la camada varió entre 5 – 10 embriones por hembra. Los machos de menor tamaño con espermatozoos en los testículos midieron de LHC 31 mm. Hubo una correlación positiva y significativa entre el peso de las gónadas versus el estadio reproductivo (b= 0,524, R= 0,254, P< 0,001). En los machos hubo una correlación positiva y significativa entre el volumen testicular y el estadio reproductivo (R2= 0,851, b= 0,929, P< 0,002). El incremento de cuerpos grasos en hembras y machos se relacionó con el periodo de gestación, especialmente en las hembras, decreciendo en las últimas fases, indicando un costo energético alto en los últimos meses del crecimiento embrionario. En cuanto a la dieta, las hembras se alimentaron principalmente de Araneae (suelo) como ítem fundamental, y de Scarabeidae, Araneae (otras) y Acridiidae como ítem secundario y los machos se alimentaran de Isopoda, Acridiidae y Araneae (otras) como ítem fundamental y de Tettigonidae como ítem secundario. Hubo diferencias significativas en la selección trófica entre sexos.
Palabras claves: Mabuya, reproducción, alimentación, dimorfismo sexual, Argentina.
Abstract
The reproduction and diet were studied in Mabuya dorsivittata a viviparous lizard from Alto Alegre (Córdoba). The smallest female with yolking ovarian follicles measured (svl) 41 mm, and the smallest male with spermatozoa in the testes measures (svl) 31mm. The litter size was from five to ten embryos. A positive and significant correlation existed between the weight of the eggs or embryos and the reproductive state (B = 0,524, R = 0,254, P 0,001). In males there was a positive and significant correlation between the testicular volume and the reproductive state (R2 = 0,851, b= 0,929, P= 0,002). The mass of fat bodies in females and males was related with the reproductive period, especially in the females, diminishing in the final phases of embryo development, indicating a high energetic cost during the last months of embryonic growth. Regarding the diet, females fed mainly on soil Araneae as fundamental prey, Scarabeidae, Araneae (others) and Acridiidae as secondary prey, whereas males fed on Isopoda, Acridiidae and Araneae as fundamental prey and on Tettigonidae as secondary prey. There were significant differences in trophic selection among sexes.
Keywords: Mabuya, reproduction, diet, sexual dimorfism, Argentina.
Introducción
Las especies del género Mabuya en América del Sur son vivíparas. En estos lagartos el mayor suministro de nutrientes para el desarrollo de los embriones se realiza a través de la alta especialización de la placenta corionalantónica que los hace únicos en Squamata (Fitch 1985; Shine 1985; Blackburn & Vitt 1992). En América del Sur, en la zona tropical, se han efectuados estudios sobre reproducción en algunas especies de Mabuya como M. caissara (Vanzolini & Reboucas-Spieker 1976), M. macrorhyncha (Vanzolini & Reboucas-Spieker 1976; Rocha & Vrcibradic 1999), M. nigropunctata (= M. bistriata) (Vitt & Blackburn 1991), M. heathi (Vitt & Blackburn 1983), M. frenata (Vrcibradic & Rocha 1998) y M. agilis (Rocha & Vrcibradic 1999; Rocha et al. 2002), y recientemente una revisión de las Mabuyas de América del Sur (Vrcibradic & Rocha, 2011).
Mabuya dorsivittata Cope, 1862 (Squamata, Scincidae) es una especie categorizada en Argentina como no amenazada (Lavilla et al. 2000), pero este estatus se debe probablemente a la falta de conocimientos sobre su comportamiento y biología. El ambiente natural de esta lagartija es el Espinal, un ecotono entre la ecoregión chaqueña y pampeana. Se caracteriza por ser un bosque poco denso de árboles xerófilos bajos de copas aparasoladas (Bertonati & Concuera 2000), ambiente muy modificado por la tala y el avance de las fronteras agropecuarias, produciendo la fragmentación del paisaje y en consecuencia alteraciones en las relaciones tróficas y declinación de las poblaciones (Carey et al. 2001).
En el presente trabajo se describen variaciones del ciclo reproductivo y se analiza la dieta de una población de Mabuya dorsivittata en Argentina, con la finalidad de aportar conocimientos básicos para establecer pautas de manejo de las poblaciones nativas de esta especie en la región del Espinal de Córdoba, Argentina.
Material y métodos
Área de estudio.- Este trabajo fue realizado en la localidad de Alto Alegre, Dpto. Unión, Provincia de Córdoba, Argentina, (32°22S; 62°53´W) a 250 m de altitud sobre el nivel del mar, situada dentro de la ecoregión el Espinal, en la zona templada de América del sur. La flora está constituida principalmente por tres estratos vegetales, uno bajo representado por gramíneas que varían entre 5 y 15 cm de alto; uno medio por manchones densos de cortaderas (Cortadeiras selloana), con una sucesión vegetal estacional de Senecio pampeanus y Cardus spp., y un tercer estrato con algunas especies arbóreas como Prosopis alba, Geofroea decorticans, Celtis tala, Lyceum cestroides y Schinus fasciculatus. Esta zona en cuanto al clima se caracteriza por tener una marcada estacionalidad en las precipitaciones y temperatura con precipitaciones medias anuales de 800mm. En verano las temperaturas medias alcanzan los 26 °C y en invierno las temperaturas medias alcanzan los 10 °C (Martori et al. 2005).
Análisis de las muestras.- Los ejemplares de Mabuya dorsivittata fueron capturados a mano durante tres años consecutivos de enero de 1998 hasta junio de del año 2000. En el laboratorio cada lagarto fue pesado en una balanza electrónica (0,01 g), y se midieron el largo hocico-cloaca (LHC); alto de la cabeza (ALC); ancho de la cabeza (AC) y largo de la cabeza (LC), con un calibrador vernier (0,1 mm), para determinar la existencia de variaciones morfométricas entre sexos. Los animales fueron anestesiados y prefundidos con formol al 10%. Luego se lavaron y conservaron en alcohol al 80%. Están depositados en la colección de ZVUNRC (44♀, 50♂ y 4 juveniles).
En los lagartos de ambos sexos se removieron las gónadas para el análisis reproductivo y los estómagos para el análisis del contenido estomacal.
En las hembras, se identificaron y pesaron en una balanza electrónica (0,01 g) los folículos yemados, huevos y embriones. La presencia de huevos oviductales o embriones fue considerada para estimar el tamaño de la camada (según Vcibradic & Rocha 1998). Se establecieron los siguientes estados reproductivos para cada hembra, estado 1: ausencia de folículo yemado y de huevo establecido en el oviducto ; estado 2: presencia de folículo yemado y ausencia de huevo establecido en el oviducto; estado 3: huevos o sacos embrionarios en el oviducto (menos de 4 mm de diámetro); estado 4: sacos embrionarios mayores de 4 mm, embriones sin desarrollar; estado 5: embriones ocupando más del 50% del saco embrionario, ojos y patas evidentes y estado 6: embriones a término (según Rocha & Vrcibradic 1999).
A cada macho se le midió el ancho (A) y largo (L) del testículo izquierdo con un calibre digital precisión de 0,1mm y se estimó el volumen testicular, mediante la fórmula del esferoide:
V= 4/3 π (1/2 L) X (1/2 A)2,
Donde L= largo y A= ancho (Dunham & Miles 1985).
Para evaluar la condición reproductiva se escogieron 14 individuos. A los cuales se seleccionó el testículo derecho para realizar cortes histológicos. Los tejidos fueron deshidratados en etanol, aclarados en xileno, incluidos en parafina, cortados en secciones de 4 μm y coloreados con hematoxilina–eosina. Los cortes histológicos fueron analizados para determinar el estado espermatogénico de acuerdo a la clasificación de Ballinger y Nietfeldt (1989). Esta clasificación fue adaptada a M. dorsivittata de la siguiente manera:
-
Estadio 1
Estadio 2:
Estadio 3:
Estadio 4:
También se registraron el diámetro de los túbulos seminíferos (TS) y el alto del epitelio (AE). Para medir la altura del epitelio seminífero se utilizó la imagen del túbulo obtenida en microscopio y registrada en una cámara de video CCD y transferida a un monitor para transformar la imagen real a imagen binaria mediante una placa de adquisición (frame grabber); se diferenció el área tubular total y el área correspondiente a la luz del tubo para medir la altura del epitelio.
Se extrajeron los cuerpos grasos de machos y hembras, luego fueron pesados en una balanza de precisión (0,001 g) para establecer comparaciones entre los cuerpos grasos y la actividad gonadal. Para el análisis de los datos de actividad reproductiva se calcularon los residuales de la regresión de los volúmenes de los órganos de los individuos adultos (gónadas, cuerpos grasos). Esta técnica refleja el ciclo real de las variables tomadas, al eliminar el efecto provocado por el tamaño corporal. El uso de transformaciones a logaritmo de las variables produce regresiones lineares asegurando su distribución normal y reduciendo la dispersión (Sokal & Rohlf 1981). Los residuales de los cuerpos grasos de adultos fueron comparados con los residuales de los testículos de los machos y con los residuales de las gónadas en hembras. Mediante este análisis de regresión se podrá determinar el grado de interacción de las reservas en el ciclo reproductivo.
Se analizó el dimorfismo sexual usando variables morfológicas: largo hocico-cloaca (LHC), con análisis de varianza de una vía (ANOVA). El alto cabeza (ALC), ancho cabeza (AC) y largo cabeza (LC) fueron comparados entre sexos mediante una ANCOVA, considerando LHC como covariante. Este análisis se puede realizar siempre que las muestras cumplan con los supuestos de normalidad y homogeneidad.
La masa del contenido estomacal se determinó pesando los estómagos llenos y luego vacíos y se estimó la diferencia, para correlacionarlos con la masa corporal del predador.
Cada presa del contenido estomacal se identificó utilizando una lupa estereoscópica binocular hasta el nivel de orden o familia según las condiciones que estaba. Cada presa fue medida en el largo y el ancho para calcular luego el volumen de las mismas (en el caso de presas desarticuladas, el tamaño original fue estimado por comparación con muestras de referencia). Para esto se utilizó la fórmula propuesta por Dunham (1983), que es la ecuación para el volumen de un esferoide ensanchado:
V= 4/3 π (a/2) (b/2)2
Donde a= largo y b= ancho. Para el item Araneae se diferenciaron según tela, suelo u otros, porque estos lagartos viven sobre las cortaderas o se desplazan por el suelo según sus actividades.
Se calculó la diversidad trófica acumulada para las muestras con la finalidad de ponderar la muestra mínima siguiendo el criterio de Hurtubia (1973), que consiste en calcular la diversidad trófica (H) para cada individuo utilizando la formula de Brillouin (1965):
H= (l/H) x (log2 N! – Σlog2 Ni!),
Donde N es el número total de organismos hallados en el estomago de cada individuo y Ni es el número total de presas de la especie y en cada estomago. También se analizó la numerosidad, el volumen y la frecuencia de ocurrencia de las presas presentes en la dieta. Para obtener un panorama general de la importancia de cada una de las presas se calculó el índice IRI (Índice de Importancia Relativa).
IRI= 100 * AL/ΣAL
Donde AL= %frecuencia de ocurrencia + %numerosidad por categoría + %volumen por categoría (George & Hadley 1979).
Para establecer la jerarquización de la dieta se aplicó al valor IRI el criterio de categorización, que toma el valor más alto del índice y porcentúa a todos los demás valores a partir de él. Si el porcentaje de la presa queda incluido entre el 100% y el 75% se la considera fundamental, si se ubica entre el 75% y el 50% se categorizó como secundaria, si se ubica entre el 50% y el 25% es accesorio y si se halla en menos del 25% se la considera accidental (Montori 1992).
Para evaluar diferencias de dieta entre sexos, se realizó una prueba de chi-cuadrado agrupándose los ítems para cumplir con los supuestos del test. Simultáneamente se compararon los índices de similitud de dieta entre sexos obtenidos mediante el índice de Morisita-Horn. Para establecer diferencias entre tamaño de los individuos y el tamaño de la presa se realizó un análisis de regresión considerando a la presa de mayor volumen de cada estómago como variable dependiente y el tamaño corporal como variable independiente. Las variables morfológicas se analizaron mediante los estadísticos de dispersión, media, y desvío estándar.
Resultados
Fenología poblacional de M. dorsivittata
En enero–febrero del 1999 y en enero-febrero del año 2000 fueron capturados cuatro ejemplares juveniles de M. dorsivittata (con LHC menor de 30 mm). Tanto machos adultos (LHC) X= 57,42; (31 – 72), n= 50, como hembras adultas (LHC) X= 62,65; (41 – 94), n= 44, fueron capturados en todas las estaciones (Fig. 1).
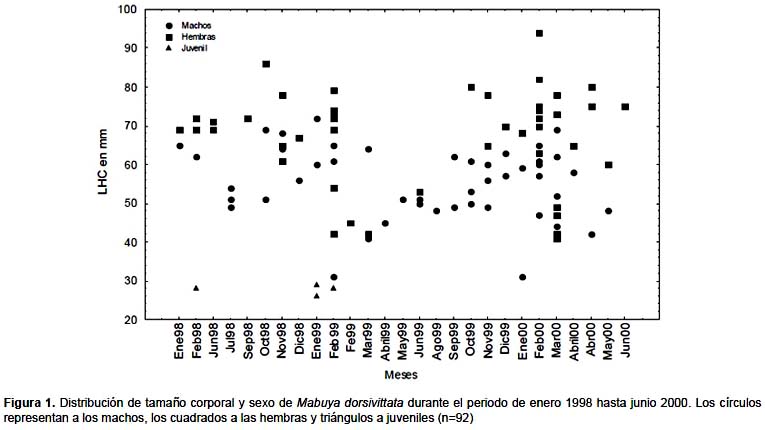
Ciclo Reproductivo
La hembra de menor tamaño con folículos yemados midió 41 mm (LHC). El tamaño medio de la camada (considerando huevos en oviducto y embriones) X= 6,4 (5 – 10) n= 11. La distribución de los estadios reproductivos de las hembras permitió definir las principales fases del ciclo reproductivo de las hembras, tal como se representa en la Tabla 1. Dieciocho hembras colectadas durante los meses de enero, febrero, marzo y abril no presentaban folículos yemados (estadio 1); 8 hembras examinadas en los meses de febrero y marzo tenían los folículos yemados (estadio 2); 8 hembras en abril, mayo, junio y agosto tenían huevos en el oviducto (estadio 3). Las hembras colectadas en septiembre, octubre y noviembre, contenían 5, 7 y 10 sacos embrionarios de un tamaño mayor a 4 mm (estadio 4), en tres hembras colectadas en noviembre los embriones ocupaban más del 50% del saco embrionario; una de estas hembras contenían 6 embriones con un (LHC) X= 8 mm y un peso X= 48 mg y las otras dos hembras con 8 embriones cada una con (LHC) X= 8,9 mm y un peso X= 52 mg, en todos estos embriones eran muy evidentes las patas y los ojos (estadio 5). En dos hembras del mes de diciembre y en una del mes de enero tenían 7 embriones con un (LHC) X= 21 mm y un peso X= 285 mg cada embrión, presentando escamas desarrolladas en todo el cuerpo (estadio 6).
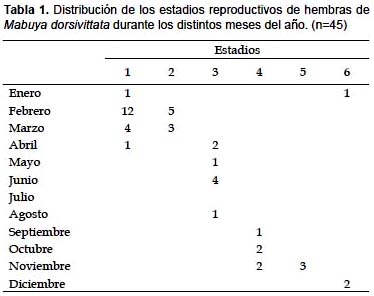
En las hembras el peso de las gónadas versus el estadio reproductivo correlacionó positiva y significativamente: n= 27, b= 0,524, R= 0,254, p< 0,001. Se observa en los últimos estadios reproductivos un mayor incremento del peso gonadal.
La correlación entre los residuales de la masa gonadal con los residuales de los cuerpos grasos (r= -0,01 b= 0,13 P<0,1 n=27) no es significativa. El macho adulto más pequeño midió de LHC 31 mm y se confirmó por la presencia de espermatozoides en el lumen de los túbulos seminíferos; esto determinó el tamaño mínimo de madurez sexual.
En el análisis histológico de los testículos de 14 machos se observó (ver Tabla 2): El estadio uno en julio; con células germinales en el proceso de división, pero sin lumen tubular, y el alto del epitelio de los túbulos seminíferos de 24,31 µm +/- 5,93 µm.
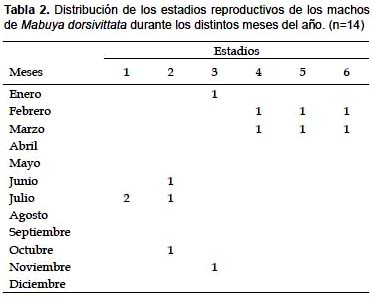
El estadio dos, en los meses de junio, julio y octubre, alto de epitelio de 39,49 µm +/- 14,93 µm, presenta lumen tubular y espermatocitos primarios en el margen de la membrana basal.
El estadio 3, en los meses de enero y noviembre con un alto de epitelio de 41,32 µm +/-6,37 µm, túbulos seminíferos con espermatocitos en el margen luminar. Estadio cuatro, en los meses de febrero y marzo, altura del epitelio de 134,5 µm +/-45,19 µm, con espermátides metamorfoseando en el margen luminar.
El estadio cinco, en los meses de febrero y marzo con un epitelio de 100,97 µm +/- 40,07 µm con espermatozoides en el lumen. Por último el estadio seis, en los meses de febrero y marzo, alto del epitelio de 60,10 µm.
La correlación positiva y significativa entre el volumen testicular y el estadio reproductivo: n= 14, R2= 0,851; b = 0,929; p< 0,002, nos indica que en los últimos estadios reproductivos el volumen testicular es mayor y está en correspondencia con la presencia de espermatozoides en el lumen y con el aumento del grosor del epitelio testicular.
Al analizar en los machos la regresión entre el LHC y el volumen testicular, se destaca una regresión positiva y significativa: n= 44 R2= 0,53; b= 0,735; p< 0,001. Indicando una tendencia que individuos más grandes poseen testículos mayores. En machos la regresión de la masa de los cuerpos grasos y el volumen de los testículos no es significativa, (n= 44), r= 0,002; b= 0,21; p< 0,31. El ciclo reproductivo muestra una estacionalidad marcada siendo junio, julio y agosto pre reproductivos; septiembre, octubre, noviembre y diciembre y enero reproductivos; febrero y marzo post reproductivos. Tanto machos como hembras muestran un ciclo anual, estacional, sincrónico y asociado entre ambos sexos.
Dimorfismo sexual en el tamaño corporal
No se observa dimorfismo sexual con respecto al tamaño corporal entre sexos adultos, el tamaño corporal (LHC) medio en machos fue de X= 57,42; (30 – 72), sd= 9,66 y n=50. En hembras la media de (LHC) X= 62,65; (41 – 94), sd= 16,47 y n= 44. La diferencia de medias entre sexos no resultó significativa: F(1,87)= 1,29; p= 0,257.
Dimorfismo sexual de las proporciones cefálicas
Cuanto al largo de la cabeza, se observó que machos (X= 6,8 mm y sd= 0,77) y hembras (X= 6,77 mm sd= 1,26) son casi iguales con respecto a esta variable (valores absolutos). Según el análisis de Ancova la diferencia entre las medias fue significativa (F(1,87)=8,72 y P= 0,003), lo que muestra que los machos tienen cabezas proporcionalmente más grandes.
Con respecto al ancho de la cabeza no se observan diferencias entre sexos (Machos: X= 6,03 mm y sd= 1,23; Hembras: X= 5,98 mm y sd= 0,75. Según Ancova la diferencia entre las medias no es significativa F(1,90)= 2,51 y p= 0,11. En el análisis del alto de la cabeza se observaron diferencias entre sexos. Los machos con X= 4,87mm y sd= 0,82 poseen cabeza mas alta que las hembras con X= 4,68mm y sd= 1,07. El análisis Ancova indica que la diferencia entre las medias es significativa F(1,80)= 7,88 y p= 0,003.
Alimentación
De los 90 estómagos de lagartos adultos examinados el 40% no contenían alimento. La proporción de estómagos llenos para hembras fue de 51% y para machos de 66%. Se identificaron 14 categorías de ítem presa para machos y hembras. Los ítems pertenecen a 3 clases de artropodos (Aracnida, Crustacea, Insecta). Araneae se agruparon según los hábitos: tela, suelo y otros; en la clase Insecta se consideraron los órdenes (Orthoptera, Coleoptera, Homoptera, Lepidoptera, Diptera, Hymenoptera), llegando en algunos casos al nivel de familia.
Análisis comparativo entre sexos
La diversidad trófica acumulada permite determinar el tamaño de muestra mínima necesaria. Para los machos de M. dorsivittata la muestra mínima necesaria fue de 15 individuos y para las hembras de 19 individuos.
Existen diferencias entre la dieta de los diferentes sexos; en hembras el ítem más numeroso fue Isopoda con 24,07%. El más frecuente también fue Isopoda con 24,39% y el ítem de mayor volumen relativo fue Acrididae con 30,24%. Para el IRI Isopoda representa el 18,50%, Acridiidae 16,43%, y Araneae (otras) 14,97%. Para hembras según el IRI jerarquizado se considera a Isopoda (100%), Acrididae (88,81%), y Araneae (otras) (80,93%) como presa fundamental; Tettigonidae (68,53%) como presas secundarias; Lepidoptera (51,06%) y Araneae (suelo) (43,57%) como presas accesorias y el resto como accidentales (Tabla 3).
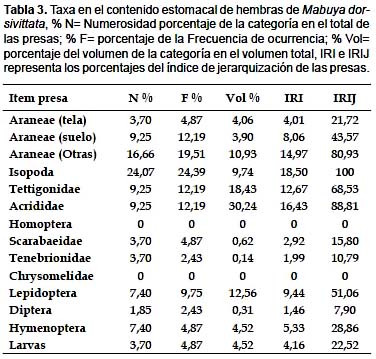
En machos los ítems más numerosos fueron Araneae (suelo) (32%), El ítem consumido más frecuentemente fue Araneae de suelo (39,13 %). Volumétricamente el más importante fue Acrididae (21,84%). Respecto al IRI, Araneae (suelo) con 21,29% fue el ítem más importante en la dieta. En cuanto al IRIJ jerarquizado para los machos se considera a las Araneae (suelo) (100%) como única presa fundamental, Scarabaeidae (65,68%), Araneae (otras) (60,69%), Acrididae (57,33%) como secundarias; Isópoda (40,8%), Tettigonidae (40,6) y Lepidoptera (38,96%) como accesorias y el resto como presa accidental (Tabla 4)
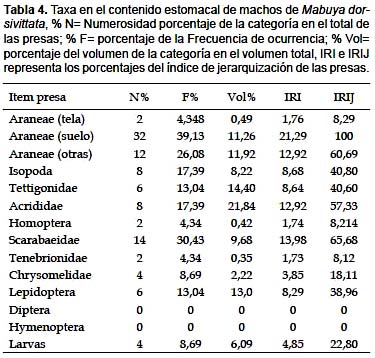
El test de independencia rechaza la hipótesis de que las dietas son iguales para machos y hembras. Con un valor crítico de rechazo de 28,3, con un a= 0,005 y con 12 grados de libertad. Se rechaza la H0 entre sexos, ya que el valor de X2= 61,741 supera al valor crítico. Por lo tanto existen diferencias significativas cuanto a la diversidad trófica entre sexos en Mabuya dorsivittata. El mismo resultado se obtiene aplicando el índice de solapamiento de Morisita–Horn que registra un solapamiento del 60% entre machos y hembras.
Tamaño corporal y el contenido estomacal
La regresión entre el peso del contenido estomacal y el tamaño corporal fue positiva y significativa con b= 0,589 R2= 0,337; p< 0,001, n= 64 denotando que el consumo de alimento es mayor en los individuos más grandes.
Tamaño corporal y el tamaño de la presa
Se analizó la relación entre la masa corporal del lagarto y el volumen de la presa mayor encontrada en cada estómago. Se utilizó la variable masa corporal ya que es una medida cúbica al igual que el volumen del ítem. El resultado es una regresión positiva y significativa con b= 0,39 R2= 0,136, p= 0,004, n= 51 o sea, el tamaño de la presa está relacionado con la dimensión del depredador (lagarto).
Discusión
Estructura de la población.- La población estudiada de Mabuya dorsivittata muestra variación temporal de tamaños corporales, lo mismo ocurre en M. nigropunctata (= M. bistriata) (Vitt & Blackburn 1991) y M. frenata (Rocha & Vrcibradic 1999), de América subtropical y tropical, en las que se observaron patrones estacionales en las distribuciones del tamaño y la edad de los individuos. En general se observa una tendencia de nacimientos en la mayoría de las especies de este género a finales de primavera. En nuestro análisis en M. dorsivittata los nacimientos se producen más tarde, durante el verano; esto puede estar relacionado a fenómenos de termorregulación; en Argentina el clima del centro del país es muy frío con respecto al norte de Brasil y Centro América. En general las especies de Mabuya producen los nacimientos durante la estación cálida y húmeda, con la finalidad de aumentar la probabilidad de supervivencia durante los primeros días de vida. En contraste, estudios realizados en M. mabouya en Colombia (Ramírez-Pinilla et al. 2002) demuestran que aquella especie no posee patrones temporales de distribución de individuos o de tamaños, y animales de diferentes tamaños pudieron ser colectados a través del año.
Madurez sexual.- Según el análisis gonadal realizado en M. dorsivittata, se observa que el tamaño de madurez sexual es de 31 mm en los machos y 41 mm en las hembras, siendo este tamaño de madurez sexual más pequeño en comparación con el de otras especies de Sur América, como M. agilis con un tamaño mínimo (LHC) para hembras de 49 mm y para machos de 46,5 mm (Vrcibradic & Rocha 2002) y M. frenata con 50,8 mm para hembras y 58 mm para machos (Vrcibradic & Rocha 1998).
Actividad Reproductiva.- La actividad reproductiva fue anual, marcadamente estacional, sincrónica y asociada en M. dorsivittata. Tanto machos como hembras poseen un período delimitado de actividad reproductiva que varía en duración y en ubicación temporal según el hábitat. A diferencia de M. macrorhyncha en Brasil (Rocha & Vrcibradic 1999), que algunas veces posee un desarrollo embrionario asincrónico, M. dorsivittata presentó un desarrollo embrionario sincrónico, encontrándose todos los embriones y óvulos en el mismo estadio reproductivo.
En machos y hembras de M. dorsivittata hubo una variación significativa entre la masa gonadal en los diferentes meses del año.
Esto sugiere que la variación en la masa gonadal está relacionada con un ciclo de actividad reproductiva estacional.
La gestación en M. dorsivittata se estima que dura 10 meses. Este rango es el mismo que se ha observado en otras especies de este género como M. heathi (Vitt & Blackburn 1983), M. nigropunctata (Vitt & Blackburn 1991), M. frenata (Vrcibradic y Rocha 1998), y M. mabouya (Ramírez-Pinilla et al. 2002) los cuales duran entre 9 y 12 meses. Teniendo en cuenta el tamaño corporal M. dorsivittata es una especie que está en el grupo de las Mabuyas chicas y de nidada grande (Vrcibradic & Rocha 2011), aunque nosotros medimos un individuo de 94mm de LHC.
Dimorfismo sexual.- En M. dorsivittata aunque existe una leve diferencia entre el tamaño de machos y hembras, estas diferencias no son significativas. Un patrón común en el género Mabuya es que las hembras son más grandes que los machos. Este patrón ha sido observado en especies de Centro América como M. mabouya (Ramírez-Pinilla et al. 2002) y en especies de Sudamérica como M. heathi y M. nigropunctata (Vitt & Blackburn 1991), M. frenata (Vricibradic & Rocha 1998), M. agilis y M. macrorhyncha (Rocha & Vrcibradic 1999). Según Fitch (1985), en especies vivíparas, las hembras poseen cuerpos más largos para soportar el desarrollo de los embriones en el oviducto.
En cuanto al tamaño de la cabeza, en M. dorsivittata se observa que las medidas tomadas como largo y alto de la cabeza son proporcionalmente mayores en machos con respecto a hembras. Este patrón también se da en otras especies congéneres como M. nigropunctata (Vitt & Blackburn 1991) y M. frenata (Rocha & Vrcibradic & 1999). Este tipo de dimorfismo en el cual los machos tienen medidas cefálicas más largas que las hembras está asociado a la selección sexual, aumentando así el éxito reproductivo en machos, ya que tienen mayor fuerza para tomar la presa en la cópula (Vitt & Blackburn 1991). También ocurre que las hembras tengan medidas cefálicas más largas que los machos, como es el caso de M. macrorhyncha (Rocha & Vrcibradic 1999) y M. mabouya (Ramírez-Pinilla et al. 2002). Esto puede deberse a la simple diferencia en el tamaño del cuerpo.
Cuerpos grasos y reproducción.- En los machos hubo una correlación negativa entre los cuerpos grasos y el estadio reproductivo. Aparentemente esto explica que la energía invertida durante el ciclo reproductivo proviene en parte de los cuerpos grasos. Lo mismo ocurre en los machos de M. macrorhyncha y M. agilis (Rocha & Vricibradic 1999) y M. mabouya (Ramírez- Pinilla et al. 2002) donde se observó una correlación negativa entre la actividad reproductiva que coincidió con un decrecimiento de los cuerpos grasos. En contraste en los machos de las especies de M. heathi (Vitt & Blackburn 1983) y M. frenata (Vrcibradic & Rocha 1998), no hubo correlación entre el volumen testicular y la masa de los cuerpos grasos.
En las hembras la masa de los cuerpos grasos varían según los estadios reproductivos; se observó una correlación negativa entre la masa de los cuerpos grasos y la masa de las gónadas, lo que permite inferir que a medida que la masa gonadal aumenta de tamaño, los cuerpos grasos disminuyen, siendo estos los responsables del mantenimiento de la gestación en hembras. En el caso de M. macrorhyncha (Rocha & Vrcibradic 1999), M. mabouya (Ramírez-Pinilla et al. 2002) y M. nigropunctata (Vitt & Blackburn 1991); en las cuales se da el caso de que la masa de los cuerpos grasos decrece en los últimos estadios reproductivos.
Los patrones reproductivos de esta población de M. dorsivittata muestran que esta especie sigue en cierta medida el patrón general del género, como por ejemplo la reproducción estacional y asociada al período de gestación. Aunque difiere en algunos aspectos particulares como la época de parición que ocurre a principios del verano, indicando un ajuste local a los patrones comunes del género.
Dieta.- La dieta de M. dorsivittata está basada principalmente en Araneae, Insecta e Isopoda. Todas estas presas son artrópodos terrestres que habitan en el suelo y la vegetación herbácea. M. dorsivittata consume tanto presas activas como Orthoptera, arácnidos, Coleóptera y Lepidoptera, y gregarias como Isopoda é Hymenoptera todos eran de la familia Formicidae. La variedad de presas consumidas sugiere que M. dorsivattata es un generalista oportunista. Las dietas descriptas para otras especies de Mabuya, se asemejan a los resultados de este trabajo. Vrcibradic y Rocha (1996) describen la dieta de Mabuya macrorhyncha y Mabuya agilis, siendo los principales ítem consumidos Araneae, Orthoptera, Diptera e Isoptera. Vitt & Blackburn (1991) indica que de M. bistriata consume Orthoptera, arácnidos, larvas y termites; M. frenata consume artropodos siendo las termites el ítem más importante (Vrcibrack & Rocha 1998). Vitt & Blackburn (1991) estudiaron la dieta de Mabuya nigropunctata y determinaron que el ítem más consumido fue Araneae y Orthoptera.
La diferencias en la dieta entre el presente trabajo y los antes mencionados con respecto al no consumo de Isóptera, Formicidae y Coleópteros puede deberse a que estas presas no se encuentran bien representadas en el estrato herbáceo que frecuenta M. dorsivittata.
En el presente trabajo aunque existe una diferencia entre machos y hembras en cuanto al ítem fundamental, se considera que los más importantes fueron Araneae, Isopoda, Scarabaeidae, Orthoptera y Lepidoptera.
Consumir presas que son relativamente grandes como Araneae, Orthoptera, larvas, etc. puede ser una ventaja energética. Así los beneficios de la energía ganada son maximizados y el costo del procesamiento de comida es minimizado.
Existe variación temporal en la dieta. La preferencia de ciertos ítems presa en determinada estación del año, depende de la abundancia de este y de su disponibilidad.
La regresión positiva y significativa entre el peso corporal del depredador y el volumen de la presa mayor, se afirma sobre la idea expresada por Huey y Pianka (1977) trabajando con otras especies que el tamaño de la presa está limitado por el tamaño del predador. Se encontró que machos y hembras se alimentan distinto en cuanto a los ítem presa.
Agradecimientos
Agradecemos a la SECYT de la UNRC que subsidio el proyecto. También deseamos expresar su agradecimiento a Fernando y Cristina por su colaboración en el trabajo de campo y a todos los revisores por la lectura crítica del manuscrito.
Literatura citada
Ballinger R. & J. Nietfeldt.
1989. Ontogenetic stages of reproductive maturity in the viviparous lizard. Sceloporus jarrovi (Iguanidae). Journal of Herpetology. 23(3): 282-292.Bertonatti C & J.Corcuera.2000. Situación ambiental 2000.Fundación Vida Silvestre. Argentina. Buenos Aires.
Pp 440.Blackburn D. & L. Vitt. 1992. Reproduction in viviparous South American lizards of the genus Mabuya. In Reproductive Biology of South American Vertebrates. Pp 150-164. Springer -Verlag. New York
Brillouin L. 1965. Science and information theory. Academic Press, New York. 245 p.
Carey C., W.R.Heyer, J Wilkinson, et al. (2001): Amphibian declines and environmental change: Use of remote-sensing data to identify environmental correlates. Conservation Biology 15, 903-913
Dunham A.E. 1983. Realized niche overlap, resource abundance and intensity of interspecific competition. In R.B. Huey, E.R. Pianka and T.W. Schoener (eds.), Lizard Ecology. Harvard University Press, Cambridge, Massachusetts, U.S.A. pp 261-280
Dunham A. & D. Miles. 1985. Patterns of covariation in life history traits of Squamate reptiles: The effects of size and phylogeny reconsidered. The Am. Nat. 126: (2)231-257.
Fitch H. 1985. Clutch and litter size variation in new world reptiles. Univ. kans. Mus.Nat. Misc. Publ. 76:1-76.
George E.L. & W.F. Hadley. 1979. Food and habitat partitioning between rock bass (Amblopites rupestris) and smallmouth bass (Micropterus dolomieui) young of the year. Trans. Am. Fish. Soc. 108: 253-261
Huey R. & E. Pianka. 1977. Patterns of Niche Overlap Among Broadly Sympatric Versus Narrowly Sympatric Kahalari Lizard (Scincide: Mabuya) Ecology 58:119-28
Hurtubia J. 1973. Trophic diversity measurement in sympatric predatory species. Ecology 54(4): 885-890.
Lavilla E.O., E. Richard & G.J. Scrocchi. 2000. Categorización de los Anfibios y Reptiles de la Republica Argentina. Edición especial de la asociación Herpetologica Argentina. 1-97PP
Martori R., L. Aun, F. Gallego & C. Rozzi Giménez. 2005. Temporal variation and size class distribution in a herpetological assemblage from Córdoba, Argentina. Cuad. Herpetol. 19 (1): 35-52.
Montori A. 1992. Alimentación de larvas de triton pirenaico, Euproctus asper, en el prepirineo de la Cerdeña, España. Amphibia-Reptilia 13:157-167.
Ramírez-Pinilla M., V. Serrano & J. Galeano. 2002. Annual Reproductive Activity of Mabuya mabouya (Squamata, Scincidae) Journal of Herpetology 36(4): 667-667.
Rocha C.F.D. & D. Vrcibradic.
1999. Reproductive Traits of Two Sympatric Viviparous Skinks (Mabuya macrohyncha and Mabuya agilis) in a Brazilian Restinga Habitat. Herp. Jour. 9:43-53.Shine R. 1985. The evolution of viviparity in reptiles: an ecological analysis. In C. Gans an F. Billet (eds), Biology of the Reptilia. Vol 15:Pp 605-694 John Willey and Sons , New York.
Sokal R. & F. Rohlf. 1981. Biometry. 2nd. ed. Freeman and co., San Francisco. 859 pp.
Vanzolini, P.E. & R. Rebouças-Spieker. 1976. Distribution and differentiation of animals along the coast and in continental islands of the state of São Paulo, Brazil. 3. Reproductive differences between Mabuya caissara and Mabuya macrorhyncha (Sauria,Scincidae). Pap. Avuls. Zool. São Paulo 29: 95-109.
Vitt L. & D. Blackburn. 1991. Ecology and Life History of the Viviparous Lizard Mabuya bistriata (Scincidae) in the Brazilian Amazon. Copeia 1991: 916-927.
Vitt L. & D. Blackburn. 1983. Reproduction in the lizard Mabuya heathi (Scincidae), a comemntary on viviparity in new world Mabuya. Can.J. Zool 61: 2798-2806.
Vrcibradic D. & C.F.D. Rocha. 1996. Ecological Differences in tropical Sympatric Skinks (Mabuya macrorhyncha and Mabuya agilis) in Southeastern Brazil. Jour. of Herp.30: 60-68.
Vrcibradic D. & C.F.D. Rocha. 1998. Reproductive Cycle and Life_history Traits of the Viviparous Skink Mabuya frenata in southeastern Brazil. Copeia 612-619.
Vrcibradic D. & C.F.D. Rocha. 1998. The ecology of the skink Mabuya frenata in an area of rock outcrops in southeastern Brazil. Journal Herpetol. 32:229-237
Vrcibradic D. & C.F.D. Rocha. 2002. Ecology of Mabuya agilis (Raddi) (Lacertilia, Scincidae) at the restinga of Grumari, Rio de Janeiro, Southeastern Brazil. Revista Bras, Zool. 19: (supl. 2): 19-29.
Vrcibradic, D., & C.F.D.Rocha. 2011. An overview of female reproductive traits in South American Mabuya (Squamata, Scincidae), with emphasis on brood size and its correlates. Journal of Natural History 45(13): 813-825.
Presentado: 05/01/2010
Aceptado: 28/12/2010
Publicado online: 23/06/2011













