Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.18 no.2 Lima Aug. 2011
NOTA CIENTÍFICA
Notas sobre la ecología de Thecadactylus solimoensis (Squamata, Phyllodactylidae) de la Amazonía Peruana
Ecological notes on the ecology of Thecadactylus solimoensis (Squamata, Phyllodactylidae) from Peruvian Amazon
Juan C. Jordán1,2
; Juana Suárez S.1 y Lidia Sánchez31 Departamento de Herpetología, Museo de Historia Natural, Universidad Nacional Mayor de San Marcos. Av. Arenales 1256, Jesús María Apdo. 14-0434, Lima 14, Perú.
2 Laboratorio de Estudios en Biodiversidad (LEB). Departamento de Ciencias Biológicas y Fisiológicas. Facultad de Ciencias y Filosofía. Universidad Peruana Cayetano Heredia (UPCH).
3 Departamento de Protozoología Helmintología e Invertebrados Afines. Museo de Historia Natural, Universidad Nacional Mayor de San Marcos.
Email Juan C. Jordán: juan.jordan@gmail.com
Resumen
Thecadactylus solimoensis es una especie de gecónido nocturno abundante en la Amazonía peruana. Sin embargo, se desconocen aspectos básicos de su ecología. Se presenta información sobre su dieta, morfología, reproducción y parasitismo por nemátodos evaluados en especímenes de museo.
Palabras clave: ecología; Thecadactylus solimoensis; Amazonía Peruana.
Abstract
Thecadactylus solimoensis is an abundant nocturnal gekkonid species in Peruvian Amazonia. However, basic aspects on its ecology remain unknown. Here, we present data on diet, morphology, reproduction and nematode parasitism assessed in museum specimens.
Keywords: ecology; Thecadactylus solimoensis; Peruvian Amazon.
Introducción
En el Perú, diversos estudios sobre la ecología de saurios han sido desarrollados principalmente con especies diurnas en ambientes costeros áridos (Huey 1974, Pefaur & López-Tejeda 1983, Pérez & Jhancke 1998, Catenazzi et al. 2005, Pérez 2005 a,b, Pérez & Balta 2005a,b, Pérez & Balta 2007, Pérez et al. 2008, Quispitúpac & Pérez 2009) mientras que sólo un estudio reporta datos sobre la ecología de saurios (y anfibios) en un ambiente tropical amazónico peruano (Duellman 2005). Sin embargo, las investigaciones relacionadas con la ecología de especies nocturnas, particularmente de la familia Gekkonidae, son escasos (Huey 1979, Pérez 2005a, Jordán 2006, Catenazzi & Donnelly 2007).
En la Amazonía peruana ocurren dos especies de geckos nocturnos: Thecadactylus solimoensis y Hemidactylus mabouia. Thecadactylus solimoensis, una especie recientemente descrita (Bergmann & Russel, 2007) fue considerada por mucho tiempo como Thecadactylus rapicauda, una especie de amplia distribución en Centro y Sur América. Thecadactylus solimoensis presenta un rango geográfico amplio, abarcando ambientes tropicales al este de los Andes de Ecuador, Perú, Bolivia y los estados brasileños de Rondonia y Amazonas (Bergmann & Russel 2007).
El objetivo de esta nota es presentar datos dieta, morfometría, reproducción y parasitismo por nemátodos de Thecadactylus solimoensis Bergmann and Russell, 2007 en el Perú.
Material y métodos
Se analizaron 17 individuos depositados en la colección herpetológica del Departamento de Herpetología del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (material examinado: MUSM 21747, MUSM 24045, MUSM 24623, MUSM 22263, MUSM 17372, MUSM 17519, MUSM 17518, MUSM 14429, MUSM 14460, MUSM 14716). Los individuos fueron medidos, disectados, sexados, extrayéndose
los estómagos (incluyendo esófago e intestinos). El contenido estomacal fue analizado, contabilizándose e identificándose las presas a nivel de Orden. Debido al bajo número de muestras, no se consideraron datos morfológicos de las presas identificadas. La amplitud del nicho trófico fue calculada con la fórmula inversa de Simpson (Pianka 1973, Vitt & Zani 1996):
B = 1/Σ (ρi 2)
Donde ρi es la proporción del ítem i en la dieta. La amplitud del nicho trófico varía desde 1 (uso de una sola presa) hasta n (uso de todas las presas).
Con un calibrador vernier (0,02 mm de precisión), se registraron las siguientes medidas corporales: longitud hocico-cloaca (LHC), largo de la cabeza (LC), ancho de la cabeza (WC), alto de la cabeza (AC), largo de las extremidades inferiores y posteriores (HL y FL, respectivamente). Se analizaron posibles diferencias morfológicas entre machos y hembras mediante un t-test con el sexo como factor.
Para analizar la condición reproductiva de cada individuo, se registró la presencia de folículos vitelogénicos o huevos en el oviducto. Los huevos fueron contados y medidos (ancho y largo). En machos, se examinaron si los testículos eran grandes y turgentes.
Se analizó el tracto digestivo de cada individuo para examinar la presencia de nemátodos parásitos adheridos a las mucosas o presentes en el material digerido. Los nemátodos encontrados fueron depositados en viales con alcohol de 70°. Posteriormente fueron aclarados con lactofenol para su identificación. Se calculó la prevalencia e intensidad de infección por nemátodos en T. solimoensis.
Resultados y discusión
Vitt y Zani (1997) presentaron datos sobre la ecología de Thecadactylus rapicauda, considerando dos poblaciones geográficamente separadas en la Amazonía: una proveniente de Cuyabeno (Ecuador) y otra proveniente de Pará, incluyendo algunos datos colectados en Roraima, Rondonia y el centro de Pará. De acuerdo a la descripción y distribución señalada por Bergmann y Russel (2007), la población "ecuatoriana" de Thecadactylus rapicauda pertenece en realidad a Thecadactylus solimoensis, mientras que la población "brasileña" pertenece a Thecadactylus rapicauda.
Thecadactylus solimoensis (Fig. 1) presenta un LHC promedio de de 91,66 ± 11,05, variando entre 73-111,1 mm. Las hembras presentaron un LHC promedio de 93,02 ± 11,61, con un rango entre 73-111,1 m, mientras que los machos presentaron un LHC promedio de 88,40 ± 10,21 mm, con un rango entre 79,1-103,1 mm. Las hembras son ligeramente más grandes que los machos aunque no significativamente (t=0,776 p= 0,449, df=15). Removiendo el efecto de LHC no se presentan diferencias morfométricas significativas entre ambos sexos (p> 0,005, df = 15).

Thecadactylus solimoensis consume seis tipos de presas, principalmente insectos de los órdenes Orthoptera, Lepidoptera y Blatoptera, y en menores proporciones, Coleoptera. Se registró un caracol (Gasteropoda) en un individuo de Thecadactylus solimoensis. La amplitud de nicho calculada para esta especie es de 4,74.
Este gecko es parasitado por tres especies de nemátodos: Parapharyngodon scleratus, Physaloptera retusa y Physalopteroides venancioi, presentando una prevalencia general de 47,05% y una intensidad de entre 1 – 4 nemátodos por individuo.
Se registraron 9 hembras maduras que presentaron huevos en sus tractos reproductivos. Estas hembras fueron colectadas entre los meses de noviembre a febrero en diferentes años. Las hembras presentaron una LHC promedio de 97,16 ± 8,68, con un rango entre 83,1 y 111,1 mm. Los huevos presentaron una longitud promedio de 14,36 ± 6,87 (6 – 28 mm) y un ancho promedio de 9,95 ± 3,70 (4,9 – 14,4 mm).
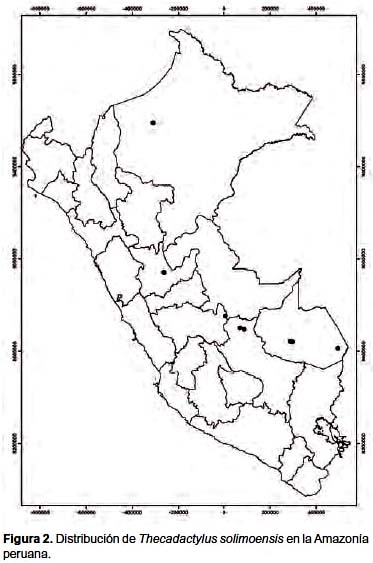
En el Perú, Thecadactylus solimoensis ha sido registrado en los departamentos de Cusco, Huánuco, Junín, Loreto, Madre de Dios y Ucayali, habitando en bosques tropicales amazónicos (Fig. 2).
Thecadactylus solimoensis presentó un LHC promedio menor a lo reportado para esta misma especie en Ecuador, aunque dentro de los rangos descritos (Vitt & Zani, 1997). Tal resultado puede ser atribuido a diferencias en el tamaño de muestra considerada y la presencia de juveniles. No se presentaron diferencias morfométricas significativas entre machos y hembras, sin embargo, las hembras son ligeramente más grandes que los machos, reportándose similares resultados para esta especie en Ecuador y para Thecadactylus rapicauda en Brasil (Vitt & Zani, 1997).
En este estudio, se reporta una menor talla en hembras adultas (sexualmente maduras) de Thecadactylus solimoensis, a diferencia de los resultados presentados por Vitt y Zani (1997) (LHC= 95 mm). Así mismo, los huevos presentaron menores dimensiones lo cual podría estar relacionado con el tamaño de la hembra o a diferentes etapas durante el desarrollo de los mismos al ser examinados. Sin embargo, Vitt y Zani (1997) no reportan una relación significativa entre el tamaño de las hembras y la masa de los huevos contenidos. A diferencia de otras especies de gecónidos que producen dos huevos por puesta (uno por oviducto), Thecadactylus solimoensis presentan una puesta de un solo huevo similar a Thecadactylus rapicauda (Vitt & Zani 1997). Tal patrón podría estar asociado al tipo de locomoción que presenta esta especie, particularmente sobre superficies verticales, por lo que una modificación de la forma corporal y aumento de peso, podría influir negativamente en su capacidad locomotora. Restricciones similares en locomoción, visibilidad ante predadores entre otras han sido sugeridas para diferentes especies de saurios (Vitt & Congdon 1978, Cooper et al. 1990, Galdino et al. 2003).
Es posible que T. solimoensis realice puestas simultáneas alternando el desarrollo de los huevos en su oviducto, lo que ha sido señalado para T. rapicauda (Vitt & Zani 1997) y Gonatodes spp. (Vitt et al. 2000). Nuestros datos muestran que la etapa reproductiva se produce entre noviembre y febrero, sin embargo, debido al bajo número de muestra, no se ha identificado si variaciones climáticas asociadas a diferencias geográficas influencian el período reproductivo de esta especie a lo largo de su rango de distribución, como ha sido reportado en otras especies de saurios tropicales (Colli 1991) incluyendo geckos (Colli et al. 2003).
Thecadactylus solimoensis consume principalmente grillos, cucarachas y polillas. Cabe mencionar que en un individuo se encontró un gasterópodo como única presa consumida, siendo este el primer registro de tal presa. En Perú, esta especie presenta un valor de B mayor que el reportado en Ecuador, aunque bastante bajo comparado con la amplitud de nicho de Thecadactylus rapicauda en la Amazonía brasileña (Vitt & Zani 1997). Sin embargo, tanto en Ecuador como en Perú, Thecadactylus solimoensis consume una considerable proporción de cucarachas, lo cual podría estar relacionado con la ocupación de construcciones humanas o con la abundancia de estos insectos en los bosques (Vitt & Zani 1997). En el caso de los individuos de T. solimoensis analizados en este estudio, al menos dos de ellos fueron colectados en construcciones humanas. Resultados similares fueron reportados por Jordán (2006) para Phyllodactylus reissi, una especie de gecónido nocturno en el Parque Nacional Cerros de Amotape.
Los endoparásitos, como nemátodos, tremátodos y céstodes, usan el tracto gastrointestinal de diversos vertebrados como microhábitat, debido a que representa un ambiente homeostático para ellos (Ribas et al. 1998). Thecadactylus solimoensis es parasitado por tres especies de nemátodos: Parapharyngodon scleratus, Physaloptera retusa y Physalopteroides venancioi, reportándose para la primera especie un nuevo registro de hospedero. Las otras dos especies de nemátodos han sido registrados previamente por Bursey et al. (2005) en individuos identificados como Thecadactylus rapicauda en Cuzco Amazónico. De acuerdo a Bergmann y Russell (2007), los hospederos registrados corresponderían a Thecadactylus solimoensis. Se reportó una alta prevalencia de parásitos, debido probablemente al pequeño tamaño muestral. Sin embargo, la intensidad es baja comparada con otras lagartijas (p.e. Ameiva edracantha y Microlophus occipitalis, datos no publicados), asociado posiblemente con sus hábitos de forrajeo (Huey & Pianka 1981).
Thecadactylus solimoensis es la especie de gecónido nocturno más grande en la Amazonía Peruana. Se sugiere la continuación de estudios sobre la ecología de esta especie, particularmente en su ambiente natural.
Agradecimientos
Agradecimientos: A Jesús Córdova, Jefe del Departamento de Herpetología del Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, y César Aguilar, por permitirnos el acceso y uso de los especímenes de Thecadactylus solimoensis depositados en la colección herpetológica. A Juan Carlos Cusi, por la elaboración del mapa de distribución de los especímenes estudiados.
Literatura citada
Bergmann P. & A. Russel. 2007. Systematics and biogeography of the widespread Neotropical gekkonid genus Thecadactylus (Squamata), with the description of a new cryptic species. Zoological Journal of the Linnean Society 149: 339-370.
Bursey C.R., S.R. Goldberg and J.R. Parmelee.2005. Gastrointestinal helminths from 13 species of lizards from Reserva Cuzco Amazónico, Peru. Comparative Parasitology 72, (1): 50-68. Carrillo, N. y J. Icochea.1995. Lista taxonómica preliminar de los reptiles vivientes del Perú. Publicaciones del Museo de Historia Natural, UNMSM (A) 4: 1-27.
Catenazzi, A. & M.A. Donnelly. 2007. Distribution of geckos in northern Peru: Long-term effect of strong ENSO events? Journal of Arid Environments 71: 327-332.
Catenazzi A., J. Carrillo and M. Donnelly. 2005. Seasonal and Geographic Eurythermy in a Coastal Peruvian Lizard. Copeia 4: 713-723.
Colli G.R., D. Mesquita, P. Rodrigues and K. Kitayama. 2003. Ecology of the gecko Gymnodactylus geckoides amarali in a Neotropical savanna. Journal of Herpetology, 37(4):694-706.
Colli G.R. 1991. Reproductive ecology of Ameiva ameiva (Sauria: Teiidae) in the cerrado of central Brazil. Copeia: 1002–1012.
Cooper J.R., W. E., L. J. Vitt, R. Hedges and R. B. Huey. 1990. Locomotor impairment and defense in gravid lizards (Eumeces laticeps): behavioral shift in activity may offset costs of reproduction in an active forager. Behavioural Ecology and Sociobiology 27:153–157.
Duellman W.E. 2005. Cusco Amazónico, the lives of amphibian and reptiles in an Amazonian rainforest. Cornell University Press, Ithaca.
Galdino C., V. Assis, M. Kiefer & M. Van Sluys. 2003. Reproduction and fat body cicle of Eurolophosaurus nanuzae (Sauria;Tropiduridae) from a seasonal montane habitat of southeastern Brazil. Journal of Herpetology, 37(4):687-694
Huey, R. & E.R. Pianka. 1981. Ecological consequences of foraging mode. Ecology 62 (4): 991-999.
Huey R. 1974. Winter thermal ecology of the iguanid lizard Tropidurus peruvianus. Copeia 1: 149-155.
Huey R.B. 1979. Parapatry and niche complementarity of. Peruvian desert geckos (Phyllodactylus): the ambiguous role of competition. Oecologia. 38: 249-259.
Jordán, J.C. 2006. Dieta de Phyllodactylus reissi en la Zona Reservada de Tumbes. Revista Peruana de Biología 13 (1):121-123.
Péfaur J. & E. López-Tejeda. 1983. Ecological notes on the lizard Tropidurus peruvianus in southern Peru. Journal of Arid Environments 6: 155-160.
Pérez J., K. Balta, R. Ramírez & D. Susaníbar. 2008. Succinea peruviana (Gastropoda) en la dieta de la lagartija de las Lomas Microlophus tigris (Sauria) en la Reserva Nacional de Lachay, Lima, Perú. Revista Peruana de Biología 15 (1):109-110.
Pérez J. & K. Balta. 2007. Ecología de la comunidad de saurios diurnos de la Reserva Nacional de Paracas. Revista Peruana de Biología 1(3): 169-176.
Pérez J. 2005a. Ecologia de duas espécies de lagartos simpátricos em uma formação vegetal de lomas no deserto costeiro peruano central. Orientador: Carlos Frederico Duarte da Rocha Dissertação apresentada para obtenção do grau de Mestre em Biologia (Ecologia). Universidade do estado do Rio de Janeiro, Río de Janeiro, Brasil.
Pérez J. 2005b. Microlophus peruvianus. Cannibalism. Herpetological Review 36(1): 63.
Pérez J. & K. Balta. 2005a. Microlophus theresiae. Saurophagy. Herpetological Review 36 (1):63.
Pérez J. & K. Balta. 2005b. Microlophus quadrivittatus. Cannibalism. Herpetological Review 36 (2): 180.
Pérez J. & J. Jhancke. 1998. Saurios como consumidores de ectoparásitos de aves guaneras. Boletín del Instituto del Mar de Perú. p: 81-86.
Pianka, E. 1973.
The structure of lizard communities. Annual Review of Ecology and Systematic 4: 53-74.Ribas S.,C.F. Rocha, P. Texeira-Filho and J.J. Vicente. 1998. Nematode infection in two sympatric lizards (Tropidurus torquatus and Ameiva ameiva) with different foraging strategies. Amphibia-Reptilia 19: 323-330.
Quispitúpac E. & J. Pérez. 2009. Dieta de la lagartija de las playas Microlophus peruvianus (Reptilia: Tropiduridae) en la playa Santo Domingo, Ica, Perú. Revista Peruana de Biología 15 (2): 129-130.
Vitt L.J., R. Souza, S.Sartorius, T. Avila-Pires and M.C. Espósito. 2000. Comparative ecology of simpatryc Gonatodes (Squamata:Gekkonidae) in the Western Amazon of Brazil. Copeia, 1:83-95.
Vitt, L.J. & P. Zani. 1997. Ecology of the nocturnal lizard Thecadactylus rapicauda (Sauria: Gekkonidae) in the Amazon Region. Herpetologica 53 (2): 165-179.
Vitt L.J. & J.D. Congdon. 1978. Body shape, reproductive effort and relative clutch mass in lizards: resolution of a paradox. American Naturalist. 112: 595-608.
Presentado: 19/01/2011
Aceptado: 16/07/2011
Publicado online: 25/08/2011













