Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.18 no.3 Lima Dec. 2011
TRABAJOS ORIGINALES
Análisis de las vocalizaciones del murciélago longirrostro peruano Platalina genovensium Thomas, 1928 (Chiroptera: Phyllostomidae)
Analysis of vocalizations of Long-snouted Bat Platalina genovensium Thomas, 1928 (Chiroptera: Phyllostomidae)
Juan A. Malo de Molina1 ; Sandra Velazco2 ; Víctor Pacheco2,3 y Juan Carlos Robledo4
1 ECONIMA, Consultoría Ambiental. Batalla de Bailén, 24, 28400 Madrid, España. jmalomolina@econima.com
2 Departamento de Mastozoología, Museo de Historia Natural - UNMSM. Aptdo. 14-0434, Lima 14, Perú.
3 Instituto de Ciencias Biológicas "Antonio Raimondi", Facultad de Ciencias Biológicas de la Universidad Nacional Mayor de San Marcos. Lima 1, Perú.
4 DBBASICO. Avda. Toledo 31, 3º P, L22. 45600 Talavera de la Reina (Toledo, España).
Resumen
Se presentan los primeros datos sobre las emisiones acústicas del murciélago longirrostro peruano Platalina genovensium, siendo este el primer estudio que se publica sobre análisis de los ultrasonidos emitidos por murciélagos en el Perú. Las emisiones acústicas analizadas fueron grabadas de individuos volando en condiciones de confinamiento dentro de sus propios refugios, en dos localidades relativamente próximas a la ciudad de Lima. La señal acústica de P. genovensium está compuesta por pulsos de 1,30 ms de duración media, en frecuencia modulada, de niveles sonoros extremadamente bajos (aprox. -10 a -35 dB a 1 m de distancia), en secuencias de 12,90 pulsos/segundo, con ancho de banda promedio de 28,58 kHz, discontinuo, con interpulso promedio de 67,56 ms y con máxima energía en 89,21 kHz. Presentan además un armónico en frecuencias superiores a190 kHz. El uso de la Transformada de Fourier para Señales Discretas y el posterior Análisis de la Distribución de Energía en bandas de frecuencia han permitido establecer una ecuación predictiva sobre el tiempo de duración del pulso en función de las bandas 70-80 kHz, 90-100 kHz y 110-120 kHz. Aumentos de un 4% de la Energía en la banda de 110-120 kHz implican una disminución de hasta 0,2 ms en la duración del pulso, mientras que el mismo aumento en las bandas de 70-80 y 90-100 kHz incrementan 0,1 ms dicha duración. Esta ecuación de predicción podría ser de utilidad para la identificación de la especie, su monitoreo, y servir de base para conocer cómo P. genovensium adapta la emisión energética en sus bandas de frecuencia evitando que pulso y eco se solapen y enmascaren la señal emitida.
Palabras clave: Platalina genovensium, Phyllostomidae, Lonchophyllinae, Emisiones acústicas, Vertiente occidental del Perú, Transformada de Fourier.
Abstract
This paper presents the first data on vocalizations of the Long-snouted Bat Platalina genovensium. It is also the first published study on ultrasound analysis of any bat from Peru. The recordings of vocalizations were obtained from flying bats while in their roosts. These roosts were found in two locations near the city of Lima. Each echolocation call was composed of FM fast pulses of 1.30 ms of extremely low intensity (-10 to -35 dB one m away from the recording device), in sequences of 12.90 pulses per second, with 28.58 kHz bandwidth in average, discontinuous, average interpulse of 67.56 ms, and an energy peak in 89.21 kHz. The pulses present a harmonic above 190 kHz. Both, Discrete Fourier Transform and Analysis of the Energy Distribution in frequency bands were used to obtain a predictive equation. This equation is able to predict duration call for 70-80 kHz, 90-100 kHz, and 110-120 kHz energy frequency bands. So, if 110-120 kHz frequency band increases 4%, then duration call decreases 0.2 ms, whereas if 70-80 y 90-100 kHz frequency band increases, then duration call also does it in 0.1 ms. This equation can be used to identify and monitor this species. It also allows us to determine how P. genovensium adapts its energy frequency bands in order to avoid overlap between pulse and echoes.
Keywords: Platalina genovensium, Phyllostomidae, Lonchophyllinae, Acoustic signals, Western slope of Peru, Fourier transform.
Introducción
El murciélago longirrostro peruano Platalina genovensium es una especie nectarívora de la subfamilia Lonchophyllinae (Griffith 1982) catalogada en peligro crítico por la legislación peruana (Ministerio de Agricultura 2004) y como casi amenazada por UICN desde el año 2008 (Pacheco et al. 2008) porque su población global se encuentra declinando significativamente, aunque se estima que a una tasa inferior al 30% en 10 años. UICN reconoce que está próxima a calificar como vulnerable debido a la extensa y rápida pérdida de su hábitat en gran parte de su área de distribución. En su proceso de enrarecimiento se señalan también otros factores como la captura de ejemplares para su uso en la medicina tradicional (Zeballos-Patrón et al. 2001). En cuanto a su tamaño poblacional, se considera una especie rara; en un hábitat favorable del SW del Perú se ha estimado una densidad poblacional de 0,0684 individuos/km2 (Sahley 1995, Sahley & Baraybar 1996). La falta ocasional de alimento por prolongadas sequías u otras razones puede ocasionar mortandades o movimientos dispersivos (Graham 1987, Eisenberg & Redford 1999, Sahley 1995).
Se refugia principalmente en cuevas de dimensión variable. Se han registrado casos en los que descansa durante el día bajo cornisas naturales de grandes rocas (M. Aguirre, com. pers.). Excepcionalmente lo hace también en refugios artificiales como se demuestra en este trabajo. Presentan un sistema complejo de organización dentro de las colonias, donde machos y hembras preñadas se encuentran formando grupos separados (S. Velazco, com. pers.) con un promedio de 10 individuos por refugio, aunque se ha reportado un refugio que albergaba alrededor de 50 ejemplares (Sahley & Baraybar 1996).
Esta especie se encuentra a lo largo de la costa comprendida entre Piura (Perú) (Aragón & Aguirre 2007) y Tarapacá (Chile) (Galaz et al. 1999). Su distribución está vinculada a la presencia de cactáceas como Neoraimondia arequipensis, Corryocactus brevistylus (Aragón & Aguirre 2007), Weberbauerocereus weberbaueri (Sahley 1995 & 1996) y Stenocereus thurberi (Sahley 2001), de las que obtiene su alimento. Para ello, P. genovensium probablemente combina sus capacidades olfativa, visual y ecoacústica para explotar los recursos florales quiropterófilos, al igual que otros murciélagos nectarívoros (von Helversen & von Helversen 1999, von Helversen et al. 2003, Simon et al. 2006).
La subfamilia Lonchophyllinae, a la que pertenece Platalina, fue separada de Glossophaginae por Griffiths (1982) sobre la base de diferencias linguales que inducen a pensar que ambas subfamilias han alcanzado el nectarivorismo por rutas evolutivas diferentes; sin embargo, las afinidades evolutivas y adaptativas con Glossophaginae son notables, aunque se desconoce si ambas subfamilias presentan similares señales de ecolocación (Helversen et al. 2003).
Las vocalizaciones de la familia Phyllostomidae, entre los que se encuentra el género Platalina, se emiten desde las narinas, a diferencia de la mayoría de quirópteros que lo hacen por la boca; rasgo que es compartido con Megadermatidae, de su mismo suborden Yangochiroptera, y con Rhinolophidae, Nycteridae e Hipposideridae del suborden Yinpterochiroptera (Teeling et al. 2002, Vaughan et al. 2010). P. genovensium, al igual que otros quirópteros, tienen estructuras dérmicas en el área naso-bucal, como pliegues y proyecciones, que les permiten modular el ultrasonido (Mergell et al. 1999).
El objetivo de este trabajo es dar a conocer por primera vez las características de las vocalizaciones de P. genovensium. Este estudio es también el primero que presenta un análisis de las emisiones acústicas de una especie de murciélago en Perú. Se pretende contribuir a facilitar la identificación de la especie emisora a partir de la grabación y posterior análisis de sus emisiones de ultrasonidos. Esta técnica, novedosa aún en el Perú, se viene aplicando desde hace décadas en otras regiones aunque presenta algunas limitaciones (Ahlén & BaagØe 1999, Russo & Jones 2002). Este estudio se centra en las emisiones durante el vuelo en condiciones de confinamiento en sus propios refugios.
Área de estudio
El trabajo de campo se realizó durante marzo y octubre de 2010 en las cuencas de los ríos Chillón y Chancay, departamento de Lima, Perú (Fig. 1). Ambas se encuentran dentro de la zona de vida del matorral desértico subtropical (md-ST) el cual se ubica entre los 800 y 2100 m. El clima en ambas zonas es árido y semicálido hasta los 2000 m, con un gradiente de precipitación que aumenta con la altitud (Cabrera et al. 2001, Novoa et al. 2005). La temperatura media en la cuenca del río Chillón es de 18 °C con una precipitación media anual de más de 125 mm, cerca de cuatro veces más de lo que recibe la cuenca del río Chancay a similar altitud (36 mm/año) (Novoa et al. 2005). Al igual que en las demás cuencas de la costa del Pacífico, el relieve se caracteriza por ser una hoya hidrográfica alargada, profunda y de fuertes pendientes, que se ensancha hacia los valles (Cabrera et al. 2001). A continuación se detallan las características de los dos refugios evaluados de P. genovensium.
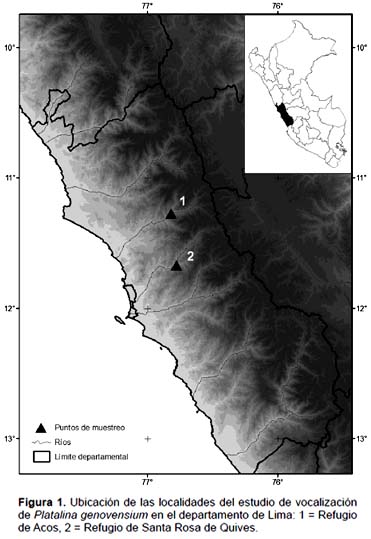
Refugio de Acos
Se localiza en la cuenca del río Chancay, en el segundo piso de una vivienda de dos plantas a medio construir con ladrillos y temporalmente abandonada de la localidad de Acos, distrito de San Miguel de Acos, provincia de Huaral, departamento de Lima, Perú. El refugio se ubica a 1571 m de altitud, en las coordenadas 11°16'25.62"S; 76°49'16.13"W. En las laderas desérticas de los cerros circundantes crecen las cactáceas columnares Neoraimondia arequipensis de las que probablemente se alimenta P. genovensium (Fig. 2). Durante el muestreo del 20 de marzo de 2010 (estación húmeda) se encontraron 3 ejemplares: un macho muy joven, posiblemente recién independizado, y un macho adulto (Fig. 3). El tercero, también adulto, no se capturó y no se pudo verificar su sexo.


Refugio de Santa Rosa de Quives
El segundo refugio se ubica a 1320 m de altitud, con coordenadas 11°40'07.99"S y 76°46'45.39"W, en la localidad de Santa Rosa de Quives, distrito de Santa Rosa de Quives, provincia de Canta, departamento de Lima, Perú. El refugio es una pequeña gruta de unos 5 m de profundidad por 2,5 m de ancho y 4 m de alto, cuya entrada se encuentra reducida por un portón construido de barro y piedra. La entrada está orientada al oeste junto a una pequeña quebrada seca que desemboca sobre el río Chillón. En la evaluación del 9 de octubre de 2010 se encontraron dos ejemplares, ambos machos adultos.
Material y métodos
En este trabajo se describen los anchos de banda, duración de pulso, picos de frecuencia e interpulsos de las señales acústicas. Se demuestra que las bandas de frecuencia consideradas están relacionadas con la duración del pulso. La distribución en frecuencias de la energía puede resultar útil como herramienta a la hora de identificar la especie debido a la relación de estas con las adaptaciones discriminatorias de la señal (Signal Overlap Zone (SOZ) y Distance Of Focus (DOF)) y por lo tanto con la adaptación evolutiva de cada especie a su hábitat.
Grabación de las señales de ultrafrecuencia
Una vez localizados los refugios, estos fueron inspeccionados para verificar que no residan otras especies cuyas emisiones pudiesen confundirse con las de P. genovensium. Se tomaron grabaciones en el interior del refugio durante un período de 20 minutos, evitando prolongar el tiempo para no estresar a los individuos. En el refugio de Acos se obtuvieron unas 30 grabaciones pero en general resultaron deficientes por la baja presión sonora de emisión de las vocalizaciones, de modo que solo se aprovecharon 12 pulsos a efectos de este estudio. En Santa Rosa de Quives se obtuvieron 200 pulsos de suficiente calidad como para ser estudiados.
Las grabaciones se realizaron en horario diurno y crepuscular. En el curso del estudio se comprobó que en horas diurnas P. genovensium es muy reacio a abandonar el refugio incluso aunque se sienta seriamente amenazado en su interior. No obstante, para realizar algunas de las grabaciones se cerraron todas las posibles salidas con redes de neblina asegurando que no se produjeran escapes que habrían sido tan perjudiciales para la obtención de registros sonoros como para la propia supervivencia de los murciélagos.
Para la detección de las emisiones se utilizó un detector Pettersson D240x, el cual permite su uso en función heterodina y de expansión de frecuencia. Para este estudio se utilizó en primer lugar la función heterodina para asegurarse de que no existieran otros quirópteros ocultos en grietas del refugio, cuyas emisiones pudiesen interferir con las de P. genovensium; mientras que se aplicó la expansión de frecuencia para la grabación y el análisis de vocalizaciones. Cada secuencia de ultrasonido registrada en expansión de frecuencia se grabó con una TASCAM DR-08 configurada en PCM wav 44,1 kHz/16 bits/mono, cumpliendo las especificaciones del fabricante del detector. El procedimiento es muy similar al empleado en muchos estudios con equipos de similares condiciones (e.g. Russo & Jones 2002). Para ello, se grabaron 41 secuencias de sonido de 1,7 y de 3,4 segundos, y se expandieron a 17 y 34 segundos respectivamente para examinar y medir con precisión sus características tras reflejarlas gráficamente en un sonograma.
Análisis
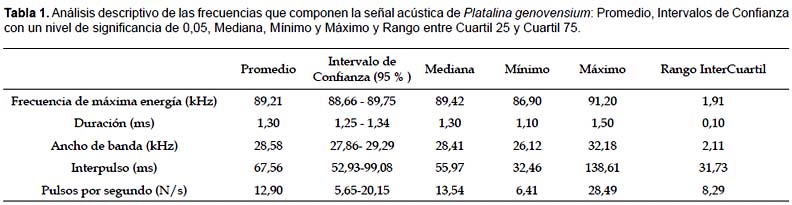
Las grabaciones fueron analizadas con los programas BatSound y Audacity. Se seleccionaron las de mejor calidad y se analizaron los siguientes parámetros: Descripción del pulso, descripción de la secuencia de pulsos, frecuencia de máxima energía, duración del pulso e interpulso (tiempo entre pulsos) (Tablas 1 y 2).
Muchos de los pulsos grabados se utilizaron para verificar ritmos (duración del pulso e interpulso); mientras que se realizó una selección de los de mejor calidad con el fin de medir en cada uno de ellos los parámetros indicados. En la selección se tuvo en cuenta la posibilidad de que modifiquen levemente sus frecuencias cuando coexisten dos o más individuos en un espacio en el que sus emisiones pueden interferir (Airas 2003). De hecho, en este estudio se comprobó que las emisiones simultáneas de dos ejemplares de P. genovensium se pueden diferenciar entre sí levemente tanto en estructura como en frecuencia.
Se analizó la señal de P. genovensium con la aplicación Matlab 7.7., calculándose la Transformada de Fourier mediante el algoritmo:

Las Energías por bandas de Frecuencia de la señal se calcularon mediante la Ecuación de Paserval (Oppenheim & Schafer 1999) para las bandas de frecuencias < 50Khz, entre 50-60 kHz, entre 50-60 kHz, entre 60-70 kHz, entre 70-80 kHz, entre 80-90 kHz, entre 90-100 kHz, entre 100-110 kHz, entre 110-120 kHz, entre 120-130 kHz y > 130 kHz. El Teorema de Paserval relaciona la energía de la señal en el dominio temporal y frecuencial de la forma:
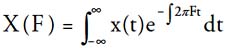
Los intervalos entre pulsos y la duración del pulso fueron determinados usando el oscilograma. Máximos y mínimos de frecuencias en la señal fueron determinados para el cálculo del ancho de banda utilizando el pico de frecuencia de la serie como máximo y el mínimo el valor por debajo de 15 dB con el fin de eliminar el efecto del ruido de fondo y la distancia a P. genovensium (Surlykke & Moss 2000).
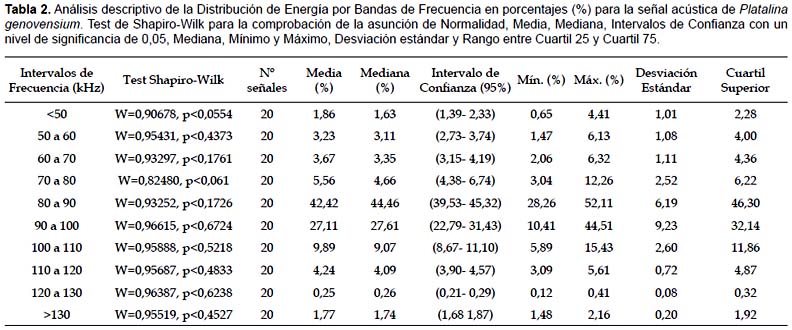
Los datos en porcentajes por bandas de frecuencias se analizaron previamente para identificar el ruido de fondo descartándose aquellos valores definidos como atípicos:
UBV + 1,5*(UBV-LBV)
Siendo UBV el valor de la media más el cuartil 75%, LBV la media menos el cuartil 25% y 1,5 el coeficiente outlier o valor atípico (Tukey 1977).
El análisis estadístico siguió dos objetivos; el primero, la caracterización de una señal típica y representativa de P. genovensium a través de la distribución frecuencial de su energía, anchos de banda, picos de frecuencia, duración del pulso y tiempo de interpulsos. El segundo objetivo fue analizar la distribución en frecuencias de la energía como herramienta causal en el tiempo de duración del pulso. Los murciélagos acortan la duración del pulso cuando se aproximan al objetivo como consecuencia de optimizar la Signal Overlap Zone (SOZ) (Jones & Holderied 2007) por lo que la distribución en frecuencias de la energía podría ser un indicador de dicha adaptación. Las variables asociadas al análisis descriptivo de la señal de murciélagos no cumplen, según diversos autores, el supuesto de normalidad (Ratcliffe & Dawson 2003). Con el objeto de cumplir con dicho supuesto se transformaron los datos de porcentajes con la raíz cuadrada y la duración del pulso mediante la transformación logarítmica (Zar 1999). Posteriormente se valoró la normalidad mediante el Test de Shapiro-Wilk (Shapiro et al. 1968). Finalmente, se utilizó un análisis de regresión por pasos para determinar qué bandas de frecuencia estaban relacionadas con la duración del pulso.
Resultados
La señal emitida por P. genovensium es de tipo modulado, variando las amplitudes de la misma en intervalos de tiempo muy breves con interpulsos de duración variable (Fig. 4). Estas vocalizaciones registradas tienen en común la presencia de armónicos emitidos a partir de 190 kHz hacia frecuencias más elevadas. Cada uno de los pulsos pueden descomponerse en una serie de armónicos distribuidos en el rango de frecuencias comprendidas entre 50 y 120 kHz, teniendo como consecuencia un sonograma característico (Fig. 5).
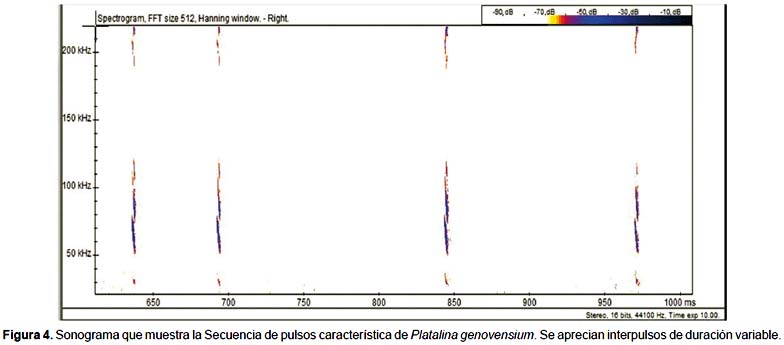
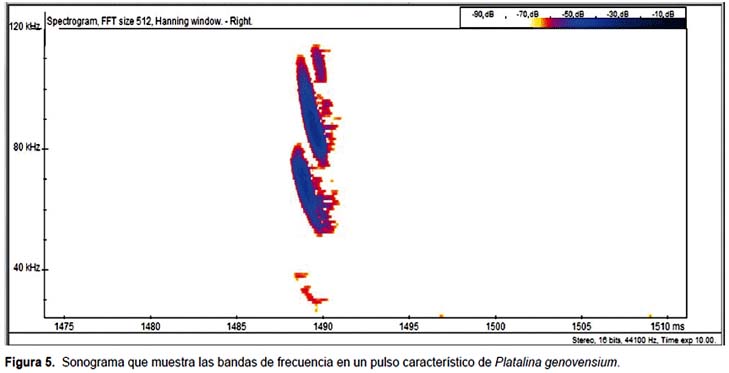
El rango de frecuencias de los pulsos de P. genovensium es una variable de escaso interés porque depende de las condiciones de grabación. En condiciones óptimas puede extenderse en un rango de 25-225 kHz pero con el aumento de la distancia se pierden rápidamente las altas frecuencias y también aquellas frecuencias asociadas a los niveles de presión sonora más bajas.
La señal de Platalina genovensium tiene una duración media de 1,3 segundos (Fig. 6) . Las frecuencias en las cuales los coeficientes de Fourier presentan amplitudes máximas son 60, 90 y 110 kHz como puede observarse en la Figura 7, lo que demuestra la modulación de la señal por parte de Platalina genovensium frente a otras especies que emiten en frecuencias constantes.
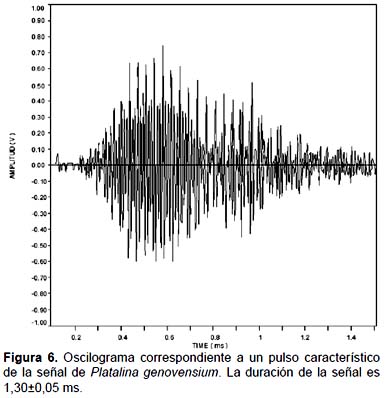
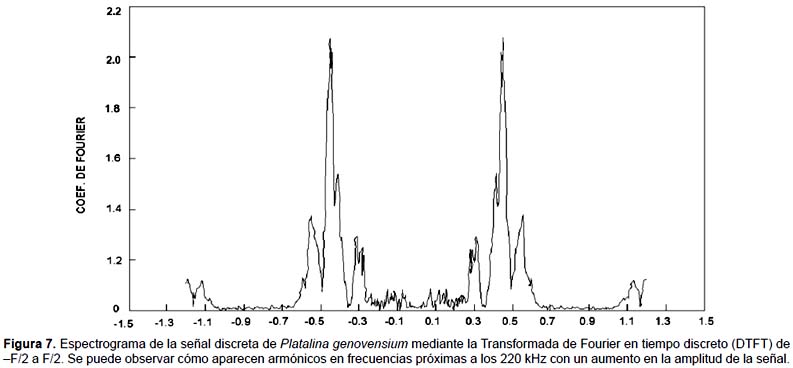
Las Figuras 6 y 7 presentan distintos aspectos de un pulso característico de P. genovensium. Para la caracterización de la señal se ha utilizado la muestra que más se correlaciona con los valores de la mediana (Muestra 1, r=0,999) con el fin de definir la señal más característica. Por otro lado, las Tablas 1 y 2, y la Figura 8 sintetizan los resultados obtenidos en el análisis de los pulsos.
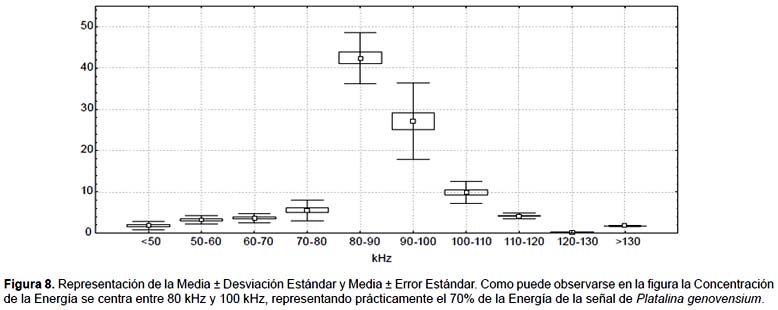
Se han obtenido valores medios de duración de la señal de 1,3 ms, con interpulsos en intervalos de 67,56 ms y valores máximos de energía a 89,21 Hz (Tabla 1). La comprobación de los Test de Normalidad (Shapiro-Wilk) para la distribución de energías en la señal permite utilizar indiscriminadamente la media o la mediana para la interpretación de la distribución de la energía con el fin de poder comparar su señal con la de otras especies en trabajos posteriores (Tabla 2).
Relación energía en bandas de frecuencia con el tiempo de duración de la señal
Al analizar mediante el Análisis de Regresión Forward se comprobó que la dependencia entre los residuos no tenían colinealidad mediante el Test de Durban-Watson (d= 2,44) entre las variables consideradas.
Los resultados del Modelo de Regresión indican que existe una relación significativa entre la concentración de energía en las bandas de frecuencia 80 - 90, 90 - 100 y 110 - 120 kHz (F= 5,451; p<0,00893; R= 0,71; R²= 0,51) y la duración del pulso, resultando la ecuación predictiva observada en la Figura 9.

La mayor contribución a las variaciones en la duración del pulso se debe a la banda de frecuencia 110 - 120 kHz. Un incremento energético en esta banda de frecuencia implicará una disminución en la duración del pulso en P. genovensium.
A medida que aumenta la concentración de energía en la banda de frecuencia 110 - 120 kHz, P. genovensium estaría reduciendo el tiempo de duración del pulso y a su vez la Signal Overlap Zone (SOZ) corrigiendo los posibles errores introducidos por el eco de la señal conforme con la Teoría Distance Of Focus (DOF) (Holderied et al. 2006).
Discusión
Al igual que sucede en otras especies simpátricas de la familia Phyllostomidae grabadas en Lima, como Glossophaga soricina o Artibeus fraterculus (J. A. Malo de Molina, com. pers.), las emisiones sonoras de P. genovensium son de presión sonora extremadamente débil, concordando con lo publicado para otros miembros de la familia Phyllostomidae (Fenton et al. 1992), como los glossofaginos que presentan emisiones sonoras muy breves (0,5-3 ms) y débiles, así como multiarmónicas, de banda ancha y frecuencia modulada (von Helversen et al. 2003). En consecuencia, P. genovensium no es detectable con el equipo utilizado en este trabajo a más de 3 m de distancia, mientras que en el mismo entorno y condiciones, especies insectívoras como Tadarida brasiliensis, por ejemplo, son nítidamente registrables a distancias de 40 m o incluso superiores (J. A. Malo de Molina, com. pers.). No obstante, la posibilidad de discriminar la señal acústica de Platalina genovensium de la de otras especies será especialmente útil en prospecciones con grabaciones no presenciales y en otras situaciones en que no se pueda identificar la especie de visu. Para que esto sea factible serán necesarios ulteriores estudios para caracterizar las vocalizaciones de especies simpátricas estableciendo criterios de discriminación acústica.
Es de esperar que la subfamilia Lonchophyllinae muestre una menor dependencia de la ecolocación que las especies insectívoras, como Bogdanowicz el al. (1997) sugirió para los Glossophaginae, constituida también por especies básicamente nectarívoras. Afirmación basada en el hecho que muchas especies de la familia Phyllostomidae localizan sus recursos alimenticios principalmente con el olfato y la visión en horario crepuscular, reservando la ecolocación para la aproximación final a la flor (Korine & Kalko 2005, von Helversen & von Helversen 2003). Esto, además de la escasa presión sonora de emisión en etapas preliminares de este estudio, podría justificar los escasos y deficientes registros que se obtuvieron para P. genovensium en condiciones de no confinamiento. Estas dificultades se muestran en muchas especies de filostómidos y fueron ya descritas por Griffin (1958), lo que induce a estudiar sus vocalizaciones en laboratorio (Macías et al. 2006). Howell (1974) describe cómo muchos filostómidos, a los que denominaban murciélagos susurrantes, whispering bats, emiten señales con intensidades 50 veces menores que las especies insectívoras.
En contraste con los murciélagos de la familia Molossidae, el conocimiento acústico de los murciélagos de la familia Phyllostomidae aún es limitado, por la dificultad de registrar las bajas intensidades y las altas frecuencias de sus señales de ecolocación emitidas en frecuencia modulada (Kalko 2004). No obstante, se tiene información de algunas especies, por ejemplo Desmodus rotundus (Schmidt et al. 1991), Carollia perspicillata (Koay et al. 2003, Sterbing 2002), los géneros Lophostoma, Micronycteris, Chiroderma, Artibeus (Kalko 2004, Jennings et al. 2004) y Glossophaga, Anoura y Leptonycteris (Howell 1974, von Helversen et al. 2003). A ellos se añade Platalina en el presente estudio.
Agradecimientos
Nuestro agradecimiento a Catherine Sahley por la mejora en la preparación del abstract. Un especial reconocimiento a Kathrin Barboza por sus comentarios y sugerencias, y a un réferi anónimo por revisar el manuscrito del presente trabajo.
Literatura citada
Ahln I. & H.J. Baagøe. 1999. Use of ultrasound detectors for bat studies in Europe: experiences from field identification, surveys, and monitoring. Acta Chiropterologica 1 (2): 137-150.
Airas M. 2003. Echolocation in bats. In: Proceedings of spatial sound perception and reproduction. The postgrad seminar course of HUT Acoustics Laboratory. Pp 1-25.
Aragón G. & M. Aguirre. 2007. Conservación, distribución y densidad poblacional de Platalina genovensium (Thomas, 1928) en las Lomas del Morro Sama, distrito de Sama, Provincia de Tacna. Zonas Áridas 11 (1): 219-232.
Bogdanowicz W., R. D. Csada & M. B. fenton. 1997. Structure of noseleaf, echolocation, and foraging behavior in the Phyllostomidae (Chiroptera). Journal of Mammalogy 78(3): 942-953.
Cabrera C., R. Villanueva, M. Espino et al. 2001. Análisis integrado de trabajo de Campo, aplicado a la cuenca media y baja del río Chillón, Lima. Revista del Instituto de Investigación de la Facultad de Ingeniería Geológica, Minera, Metalúrgica y Geográfica 4(7): 7-12.
Eisenberg J.F. & K.H. Redford. 1999. Mammals of the Neotropics: The Central Neotropics. The University of Chicago Press, Chicago, USA.
Fenton M.B., D. Acharya, M.B.C. Audet, et al. 1992. Phyllostomid bats (Chiroptera: Phyllostomidae) as indicators of habitat disruption in the Neotropics. Biotropica 24(3): 440-446.
Galaz J.L., J.C. Torres Mura & J. Yáñez. 1999. Platalina genovensium (Thomas, 1928), un quiróptero nuevo para la fauna de Chile (Phyllostomatidae: Glossophaginae). Noticiario Mensual del Museo Nacional de Historia Natural (Chile) 337: 6-12.
Graham G. L. 1987. Seasonality of reproduction in Peruvian bats. In: B. D. Patterson and R. M. Timm. (eds.), Studies in Neotropical mammalogy. Essays in honor of Philip Hershkovitz. Fieldiana: Zoology New Series 39: 173-186.
Griffin D. R. 1958. Listening in the dark. New Haven, Yale University Press.
Griffiths T. A. 1982. Systematics of the New World nectar-feeding bats (Mammalia, Phyllostomidae) based on the morphology of the hyoid and lingual regions. American Museum Novitates 2742:1-45.
Holderied M. W., G. Jones & O. Von Helversen. 2006. Flight and echolocation behaviour of whiskered bats commuting along a hedgerow: range-dependent sonar signal design, doppler tolerance and evidence for acoustic focussing. The Journal of Experimental Biology 209: 1816-1826.
Howell D.J. 1974. Acoustic behavior and feeding in Glossophagine bats. Journal of Mammalogy 55 (2): 293-308.
Jennings N. V., V. S. Parsons, K. E. Barlow & M.R.Gannon. 2004. Echolocation calls and wing morphology of bats from the West Indies. Acta Chiropterologica 6: 75-90.
Jones G. & M.W. Holderied. 2007. Bat echolocation calls: adaptation and convergent evolution. Proceedings of the Royal Society B 274: 905-912.
Kalko E.K.V. 2004. Neotropical leaf-nosed bats (Phyllostomidae): "Whispering" bats as candidates for acoustic surveys?. In: Brigham M, Jones G, Kalko EKV (eds) Proceedings of a workshop on identification and acoustic monitoring of bats. Bat Conservation International, Austin, Texas, pp 63-69.
Koay G., R.S. Heffner, K.S. Bitter & H.E. Heffner. 2003. Hearing in American leaf-nosed bats. II : Carollia perspicillata. Hearing Research 178: 27-34.
Korine K. & E. K. V. Kalko. 2005. Fruit detection by small fruit-eating bats (Phyllostomidae): echolocation call design and olfaction. Behavioral Ecology and Sociobiology 59 (1): 12-23.
Macías S., E. Mora, A. García & Y. Macías. 2006. Echolocation behavior in Brachyphylla nana (Chiroptera: Phyllostomidae) under laboratory conditions. Caribbean Journal of Science 42 (1): 114-120.
Mergell P., W. T. Fitch & H. Herzel. 1999. Modeling the role of nonhuman vocal membranes in phonation. Journal of Acoustical Society of America 105(3): 2020-2028.
Ministerio de Agricultura. 2004. Decreto Supremo No. 034-2004-AG. El Peruano. Pp: 276853-276855.
Novoa S., A. Ceroni & C. Arellano. 2005. Contribución al conocimiento de la fenología de Neoraimondia arequipensis ssp. roseiflora (Werdermann y Backeberg) Ostolaza (Cactaceae) en el valle del río Chillón, Lima-Perú. Ecología Aplicada: 4(1-2): 35-40.
Oppenheim A. & R. Schafer. 1999. Discrete-Time Signal Processing. 2nd Edition. Prentice-Hall, New Jersey.
Pacheco V., L. Aguirre & H. Mantilla. 2008. Platalina genovensium. In: IUCN 2010. IUCN Red List of Threatened Species. Versión 2010.4. <www.iucnredlist.org>. [Acceso 29 de Noviembre del 2010].
Ratcliffe J. M. & J.W. Dawson. 2003. Behavioural flexibility: the little brown bat, Myotis lucifugus, and the northern long-eared bat, M. septentrionalis, both glean and hawk prey. Animal Behaviour 66: 847-856.
Russo D. & G. Jones. 2002. Identification of twenty-two bat species (Mammalia: Chiroptera) from Italy by analysis of time-expanded recordings of echolocation calls. Journal of Zoology, London 258 (91-103).
Sahley C.T. 1995. Bat and hummingbird pollination of two species of columnar cacti: effects on fruit production and pollen dispersal. Thesis, Doctor of Philosophy. University of Miami, USA. 126 pp.
Sahley C.T. 1996. Bat and hummingbird pollination of an autotetraploid columnar cactus, Weberbauerocereus weberbaueri (Cactaceae). American Journal of Botany 83(10):1329-1336.
Sahley C.T. 2001. Vertebrate pollination, fruit production and pollen dispersal of Stenocereus thurberi (Cactaceae). The Southwestern Naturalist 46 (3) 261-271.
Sahley C. T. & L. Baraybar. 1996. Natural History of the long-snouted bat, Platalina genovensium (Phyllostomidae: Glossophaginae) in Southwestern Perú. Vida Silvestre Neotropical 5(2): 101-109.
Shapiro S.S., M. B. Wilk & H. J. Chen. 1968. A comparative study of various tests of normality. Journal of the American Statistical Association 63: 1343-1372.
Simon R., M. W. Holderied & O. von Helversen. 2006. Size discrimination of hollow hemispheres by echolocation in a nectar feeding bat. The Journal of Experimental Biology 209: 3599-3609.
Surlykke A. & C.F. Moss. 2000. Echolocation behavior of big brown bats, Eptesicus fuscus, in the field and the laboratory. Journal of the Acoustical Society of America 108: 2419-2429.
Schmidt U. P., Schlegel, H. Schweizer & G. Neuweiler. 1991. Audition in vampire bats, Desmodus rotundus. Journal of Comparative Physiology A 168: 45-51.
Sterbing S. J. 2002. Postnatal development of vocalizations and hearing in the phyllostomid bat, Carollia perspicillata. Journal of Mammalogy 83: 516-525.
Teeling E.C., O. Madsen, R.A. van den Bussche, et. al. 2002. Microbat paraphyly and the convergent evolution of a key innovation in Old World rhinolophoid microbats. Proceedings of the National Academy of Sciences of the USA. 99: 1431-1436.
Tukey J. 1977. Exploratory Data Analysis, Addison-Wesley.
Vaughan T. A., J.M. Ryan, J. Nicholas & N.J. Czaplewski. 2010. Mammalogy. Jones y Bartlett Learning. 750 pp.
Von Helversen D. & O Von Helversen. 1999. Acoustic guide in bat-pollinated flower. Nature 398: 759-760.
Von Helversen D. & O. Von Helversen. 2003. Object recognition by echolocation: a nectar-feeding bat exploiting the flowers of a rain forest wine. Journal of Comparative Physiology A. 189:327-336.
Von Helversen D., M. Holderied & O. Von Helversen. 2003. Echoes of bat-pollinated bell-shaped flowers: conspicuous for nectar-feeding bats?. Journal of Experimental Biology 206: 1025-1034.
Zar J. H. 1999. Biostatistical analysis. 4th edition. Prentice Hall, Englewood Cliffs, New Jersey. 663 pp.
Zeballos-Patrón H., V. Pacheco & L. Baraybar. 2001 (2002). Diversidad y conservación de los mamíferos de Arequipa, Perú. Revista Peruana de Biología 8(2): 94-104.
Presentado: 28/07/2011
Aceptado: 23/09/2011
Publicado online: 08/02/2012













