Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.18 n.3 Lima dic. 2011
TRABAJOS ORIGINALES
Inmunogenicidad del veneno de Bothrops atrox (Ophidia: Viperidae) y su evaluación por métodos inmunoenzimáticos
Immunogenicity of Bothrops atrox (Ophidia: Viperidae) venom and its evaluation by immunoenzymatic methods
Gustavo A. Sandoval1 ; Julio Mendoza1 ; William Roldán2 ; Yrma Espinoza2 ; Hilda Solis2 ; Armando Yarlequé*1
1 Laboratorio de Biología Molecular. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima - Perú.
2 Instituto de Medicina Tropical "Daniel Alcides Carrión". Facultad de Medicina Humana. Universidad Nacional Mayor de San Marcos. Lima - Perú.
Resumen
Se estudió la inmunogenicidad del veneno de la serpiente Bothrops atrox, "jergón", utilizando los métodos inmunoenzimáticos de ELISA y Western Blot, así como los patrones de reactividad cruzada empleando los venenos de las serpientes Bothrops brazili, Lachesis muta y Crotalus durissus. Para este fin se inmunizaron conejos albinos Nueva Zelanda (2 kg aprox) con cuatro dosis de 500 ¼g del veneno de B. atrox en un periodo de 90 días. La producción de anticuerpos fue monitoreada mediante la técnica de ELISA, determinándose el título del suero hiperinmune obtenido al final del protocolo de inmunización. Adicionalmente se analizaron los patrones electroforéticos de los venenos en estudio mediante PAGE-SDS y su reactividad frente al suero obtenido mediante ELISA y Western Blot. El esquema de inmunización utilizado permitió una producción sostenida de anticuerpos a partir del día 20 del protocolo. Finalizado este proceso, el título del suero fue calculado en 256000, lo cual mostró la eficacia y practicidad del procedimiento desarrollado. Por otro lado, los venenos estudiados mostraron una heterogeneidad en su composición proteica a partir del análisis de sus patrones electroforéticos, mientras que a partir de los estudios inmunoenzimáticos, se pudo obtener valores de reactividad cruzada entre el veneno de B. atrox y los venenos de B. brazili, L. muta y C. durissus, de 23,7%, 4,0% y 1,8%, respectivamente. Los resultados obtenidos constituyen el paso inicial para posteriores ensayos dirigidos a la optimización en la producción de inmunosueros para el tratamiento del envenenamiento, así como para el desarrollo de kits de diagnóstico e identificación de especies de serpiente.
Palabras claves: inmunogenicidad, veneno, Bothrops atrox, ELISA, Western Blot, reactividad cruzada.
Abstract
The immunogenicity of Bothrops atrox, "jergón", venom was studied using ELISA and Western Blot methods, as well as cross-reactivity patterns against venoms of Bothrops brazili, Lachesis muta and Crotalus durissus. For this purpose, New Zealand white rabbits (2 kg aprox) were immunized with four 500 µg doses of B. atrox venom in a period of 90 days. Antibody production was followed using ELISA technique, and title of hiper-immune serum was determined at the end of immunization protocol. Additionally, electrophoretic patterns of venoms were analyzed by SDS-PAGE and venom reactivity against obtained serum by ELISA and Western Blot. Immunization schedule allowed a pronounced antibody production since day 20 of protocol. At the end of process, serum title was 256000, which demonstrated both efficacy and usefulness of the developed procedure. On the other hand, studied venoms showed a heterogenic protein composition according to their electrophoretic patterns, whereas cross-reactivity values of 23,7%, 4,0% and 1,8% were obtained between B. atrox venom and B. brazili, L. muta and C. durissus venoms, respectively, using immunoenzymatic methods. According to our results, this procedure constitutes an initial step for further assays directed to optimization in immunoserum production for envenoming treatment and development of kits for diagnosis and species identification of snakes.
Keywords: immunogenicity, venom, Bothrops atrox, ELISA, Western Blot, cross-reactivity.
Introducción
Los venenos de serpientes son mezclas complejas de sustancias, principalmente proteínas, producidas por una glándula sero - mucosa, e inoculados mediante un aparato especializado compuesto por colmillos acanalados los cuales ingresan por presión en los tejidos. Debido a su acción tóxica, estas proteínas han sido clasificadas como miotoxinas, hemorraginas, nefrotoxinas, neurotoxinas y toxinas coagulantes; sin embargo, debido a su variada acción farmacológica y a sus propiedades farmacocinéticas, Chippaux y Goyffon (1998) agruparon estas sustancias en dos categorías: a) toxinas, que son polipéptidos con un peso molecular menor a 30 kDa, abundantes en los venenos de serpientes de la familia Elapidae; y b) enzimas, las cuales poseen un peso molecular mayor a 30 kDa y constituyen el componente principal del veneno de serpientes de la familia Viperidae.
Las ponzoñas procedentes de la familia Viperidae causan principalmente hemorragia, edema, mionecrosis y disturbios en la coagulación, siendo la incidencia mundial anual de mordedura por serpientes de 5 millones de habitantes (Chippaux y Goyffon, 1991) con cálculos de muertes estimados entre 60 a 80 mil (Warrell, 1996). Por ello, el ofidismo constituye un problema de salud pública para los países que cuentan con una fauna ponzoñosa muy variada, tal como ocurre en el Perú (Yarlequé 2000).
En nuestro país, las mordeduras por serpientes se producen en su mayoría en las zonas silvestres de selva alta y baja y en numerosos reportes se consigna a los especímenes de la familia Viperidae como las principales agresoras (Lévano & Fernández 2004). Dentro de éstas, se considera a la especie Bothrops atrox "jergón" como la más común para la zonas selváticas, B. brazili "jergón shushupe" localizada principalmente en la selva norte, Lachesis muta "shushupe", que habita diversas regiones de la selva amazónica y Crotalus durissus "cascabel" restringida al valle de Sandia, provincia de Puno. De estas serpientes, es de especial interés la especie B. atrox por ser la serpiente de mayor peligro y la causante entre el 88 y 92% de accidentes ofídicos registrados en el país (Loja, 2000).
Frente al envenenamiento ofídico, la seroterapia es la única alternativa específica para contrarrestar su acción, por ello se producen antivenenos mediante hiperinmunización de animales seroproductores (por ejemplo, caballos, ovejas, cabras, etc.), usando venenos de especies de serpientes taxonómicamente cercanas (Theakston et al. 2003). A pesar de la efectividad en el tratamiento, se pueden presentar reacciones alérgicas tardías producto de la inoculación del antiveneno. En el caso de los antivenenos producidos en el Perú, el Instituto Nacional de Salud elabora un antiveneno botrópico polivalente mediante la inoculación de caballos con una mezcla de venenos de las serpientes B. atrox, B. brazili, B. pictus, B. barnetti y B. hyoprora, el cual resulta efectivo en la neutralización de los daños locales producidos durante el envenenamiento, pero presenta propiedades limitadas para reducir el edema y la necrosis (Rojas et al. 2005). Así, se requiere de un mejor conocimiento de las propiedades inmunogénicas de los componentes proteicos de los venenos de serpientes, la cual puede lograrse con la aplicación de técnicas inmunoenzimáticas como el análisis por Western Blot y el ELISA (EnzymeLinked Immunosorbent Assay), en las cuales la reactividad de un antígeno es valorada cualitativa y cuantitativamente.
Por este motivo, en el presente trabajo se ha realizado un estudio de la inmunogenicidad del veneno de la serpiente Bothrops atrox (Linnaeus, 1758), y luego se evaluó la reactividad cruzada del suero hiperinmune producido contra los venenos de otras serpientes peruanas de la familia Viperidae, mediante técnicas inmunoenzimáticas. Estos resultados contribuirán al mejoramiento de la calidad de los antivenenos polivalentes comerciales producidos en el Perú.
Materiales y métodos
Material biológico.- Se empleó el veneno de la serpiente Bothrops atrox obtenido a partir de ejemplares procedentes de Pucallpa - Ucayali y mantenidos en el Serpentario "Oswaldo Meneses" - Museo de Historia Natural - UNMSM. El veneno fue extraído por presión manual, después liofilizado y mantenido a 4 °C hasta su uso. Para evaluar la reactividad cruzada se emplearon venenos de las especies: B. brazili, L. muta y C. durissus, procedentes de ejemplares mantenidos en el mismo serpentario.
Para la obtención del suero hiperinmune se emplearon conejos albinos machos Nueva Zelanda (2,5 kg de peso aprox.), los cuales fueron mantenidos en el Instituto de Medicina Tropical Daniel Alcides Carrión de la Universidad Nacional Mayor de San Marcos.
Cuantificación de proteínas.- La cantidad de proteína fue calculada midiendo la absorbancia de luz UV a 280 nm (Warburg & Christian 1944) y por el método de Lowry et al. (1951) modificado en nuestro laboratorio (Loayza et al. 1985) empleando albúmina sérica bovina como proteína estándar.
Protocolo de inmunización.- El veneno crudo de B. atrox (1 mg/mL) preparado en PBS, fue emulsificado con un volumen equivalente de Adyuvante Completo de Freund (CFA) e inyectado por vía intradérmica, en cada uno de los conejos albinos en volúmenes de 0,25 mL seleccionando cuatro lugares del dorso.
Luego de 10 días se aplicaron tres dosis de refuerzo preparadas en Adyuvante Incompleto de Freund (IFA) a intervalos de 30 días. Diez días después de aplicada cada dosis de refuerzo, se extrajo sangre a partir de la vena marginal de la oreja y al finalizar el protocolo de inmunización, la sangre se obtuvo mediante punción cardiaca, a fin de evaluar la presencia de anticuerpos reactivos en el suero contra el veneno en estudio.
Detección de anticuerpos contra el veneno de B. atrox y cálculo del título de anticuerpos.- Se realizó mediante la técnica de ELISA (Engvall & Perlmann 1971), siguiendo el método de titulación a punto final (Alzamora et al. 2002). Para ello se emplearon placas de 96 pocillos (Nunc - ImmunoTM, Dinamarca) cubiertas con 100 µL/pocillo de veneno de B. atrox (0,25 µg/mL) disuelto en buffer de cubierta (carbonato de sodio 0,015 M; bicarbonato de sodio 0,035 M; pH 7,6), durante una noche a 4 °C. Después de tres lavados sucesivos empleando buffer de lavado (NaCl 0,15 M, Tween-20 0,05%), se aplicó en los pocillos buffer de bloqueo (leche descremada al 3%, Tween-20 0,05% en PBS pH 7,4) por 1 h a 37 °C. Luego de tres lavados, se aplicaron 100 µL/pocillo de suero de conejo obtenido a los días 0, 10, 40, 70, así como al final del protocolo de inmunización (día 90), diluido seriadamente con factor 2 a partir de 1/1000 en el buffer de bloqueo, e incubados durante 1 h a 37 °C. Las placas fueron lavadas nuevamente y los anticuerpos unidos fueron detectados empleando anti-IgG de conejo conjugado con fosfatasa alcalina (1/4000 en buffer de bloqueo) seguido de la adición del sustrato respectivo (100 µL/pocillo de p-nitrofenil fosfato disuelto en buffer Tris). Después de 30 min a 20 - 22 °C, la reacción se detuvo mediante la adición de 50 µL/pocillo de NaOH 3 M registrándose la absorbancia a 405 nm en un lector de placas Titertek Multiskan PLUS MKII. El título del suero correspondió a la inversa de la dilución del mismo que produjo un 50% de la máxima absorbancia registrada.
Evaluación de la reactividad cruzada entre el suero anti-B. atrox y otros venenos de serpientes peruanas.- La reactividad cruzada del suero anti-B. atrox contra los venenos de B. brazili, L. muta y C. durissus fue evaluada mediante la técnica de ELISA para lo cual se emplearon placas de 96 pocillos cubiertas con 100 µL/pocillo de los respectivos venenos (0,25 µg/mL). Luego se siguieron los pasos establecidos en el procedimiento anterior, empleando el mismo suero de conejo diluido a partir de 1/1000. La reactividad cruzada fue expresada como porcentaje de las densidades ópticas resultantes de la reacción entre los mencionados venenos y el suero anti-B. atrox considerando como 100% el valor de absorbancia obtenido entre el veneno de B. atrox y su respectivo suero a una dilución equivalente al título obtenido.
Análisis electroforético de los venenos en estudio.- Los venenos en estudio (20 - 25 µg) fueron tratados con buffer de muestra bajo condiciones no reductoras (Tris - HCl 0,05 M, pH 6,8; SDS 2%, azul de bromofenol 0,1%, glicerol 10%) durante 5 min a 100 °C para luego ser sometidos a PAGE - SDS al 12% durante 1 h a 100 voltios constantes (Laemmli 1970). Se utilizaron como proteínas patrones de peso molecular: fosforilasa b (97 kDa), albúmina (66 kDa), ovoalbúmina (45 kDa), anhidrasa carbónica (29 kDa), inhibidor de tripsina (20,1 kDa) y lisozima (14,3 kDa). Después de la corrida, los geles fueron teñidos con azul de Coomassie R-250 0,1% durante 2 h y lavados con solución decolorante conteniendo metanol, ácido acético y agua (4:3:4) hasta evidenciar las bandas proteicas.
Análisis por Western Blot.- Los venenos en estudio (10 - 15 µg) separados previamente mediante PAGE - SDS, fueron transferidos a membranas de polifluoruro de vinilideno (PVDF) en buffer de transferencia (Tris 0,02 M, pH 8,3; glicina 0,192 M, SDS 0,1%, metanol 20%) durante 50 min a 100 voltios (Towbin et al. 1979). Las membranas fueron bloqueadas usando el buffer respectivo (leche descremada al 5% en Tris-HCl 0,02 M, NaCl 0,15 M, pH 7,5, Tween-20 1%) durante una noche a 4 °C. Después se procedió al lavado con buffer de lavado (NaCl 0,15 M, Tween-20 0,05%) y luego las membranas fueron enfrentadas con el suero hiperinmune de conejo (1/1000) diluido en buffer de bloqueo. Luego de 1 h de exposición a 20 - 22 °C, las membranas fueron lavadas nuevamente y esta vez expuestas a anti-IgG de conejo ligada a fosfatasa alcalina (1/4000) durante 1 h a 20 - 22 °C, para luego de lavados sucesivos incubarlas con una solución de revelado (NBT [nitro-azul tetrazolio] y BCIP [bromo-cloro indolil sulfato] en buffer Tris-HCl 0,1 M; NaCl 0,1 M; MgCl2 0,005 M; pH 9,5). Posteriormente, las membranas fueron sumergidas en agua destilada para detener el desarrollo de color y finalmente se procedió al análisis visual de los patrones de reactividad del suero hiperinmune, obtenido experimentalmente contra los diferentes venenos.
Resultados
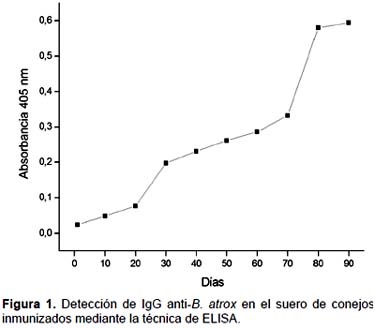
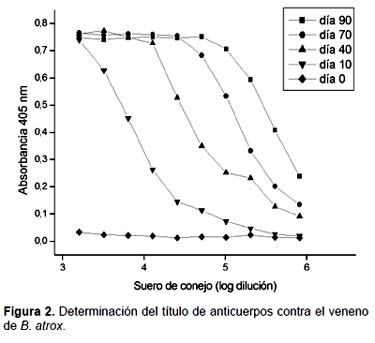
Detección y título de anticuerpos contra el veneno de B. atrox.- Se realizó el seguimiento de la respuesta inmune de los conejos albinos mediante la técnica de ELISA desde el día 0 hasta el día 90 del protocolo de inmunización (Fig. 1). Los resultaron muestran los niveles de producción de anticuerpos IgG específicos contra el veneno de B. atrox, los cuales alcanzan su máximo valor después de la tercera dosis de refuerzo (día 70), y se mantuvieron hasta el final del protocolo de inmunización. Asimismo, el título de anticuerpos anti-B. atrox en el suero obtenido al final del protocolo de inmunización correspondió al valor de 256000 (Fig. 2).
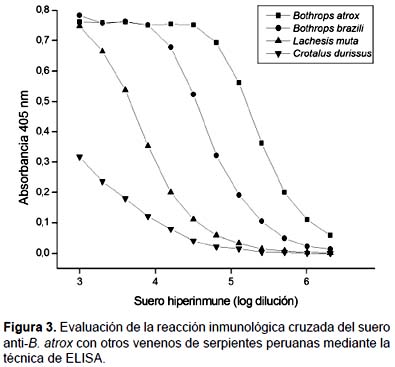
Reactividad cruzada determinada por ELISA.- Al evaluarse la reactividad de los cuatro venenos en estudio contra el suero hiperinmune anti-B. atrox mediante la técnica de ELISA; se alcanzaron diversos valores de densidad óptica a 405 nm, donde el máximo valor correspondió a la reacción entre el veneno de B. atrox y su correspondiente suero (Fig. 3). Además, se observó que el suero reaccionó de forma cruzada con los otros venenos de serpientes, pero con diferente intensidad, siendo los valores de reactividad cruzada para los venenos de B. brazili, L. muta y C. durissus, de 23,7, 4,0 y 1,8%, respectivamente.
Comparación de los perfiles de veneno de serpiente mediante PAGE-SDS.- La Figura 4a muestra los patrones proteicos obtenidos para los venenos de B. atrox, B. brazili, L. muta y C. durissus mediante PAGE - SDS en condiciones no reductoras. En todos los casos, se detectó un mínimo de 10 bandas proteicas, observándose que cada veneno presenta un patrón característico. Además se pudieron detectar varios componentes de pesos moleculares similares en todos los venenos dentro del rango de 14,3 y 66 kDa. Sin embargo también se visualizaron bandas específicas entre los 25 y 60 kDa especialmente en el veneno de B. atrox. En el caso del veneno de B. brazili se distinguieron proteínas en el rango de 30 a 45 kDa y componentes de bajo peso molecular alrededor de los 14,3 kDa. Para el veneno de L. muta se pudieron apreciar bandas proteicas en un rango mucho mayor (14,3 - 97 kDa) donde las más abundantes se concentraron en el rango de los 30 kDa. En cambio, para el caso del veneno de C. durissus se observaron bandas mayormente agrupadas en el rango de los 14,3 a 30 kDa.
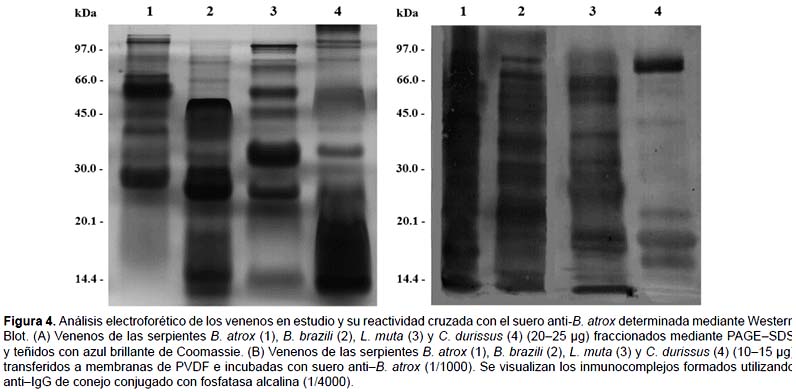
Reactividad cruzada determinada por Western Blot.- La Figura 4b muestra que el suero anti - B. atrox reaccionó con los componentes proteicos de los venenos de B. atrox, B. brazili, L. muta y C. durissus lo cual se evidencia por la formación de bandas coloreadas. Para el caso del veneno de B. atrox se obtuvo una intensa reactividad comprendiendo bandas en el rango de 14,3 a 97 kDa, lo cual indica que la mayoría de sus componentes son inmunogénicos. Por otro lado el suero reaccionó de forma cruzada con los componentes del veneno de B. brazili abarcando un rango de pesos moleculares similar al anterior, pero con menor intensidad y a su vez mostrando un número menor de bandas coloreadas. Los venenos de L. muta y C. durissus reaccionaron con menor intensidad frente al suero anti-B. atrox, donde la reactividad de este último se limitó a componentes alrededor de los 66 kDa y a otros comprendidos en el rango de 14,4 a 20,1 kDa.
Discusión
Los venenos de serpientes peruanas han sido durante muchos años, objeto de estudio mediante el empleo de herramientas bioquímicas dirigidas principalmente al análisis de su actividad enzimática, tanto en sistemas in vitro como su actividad biológica mediante el empleo de animales de experimentación, cuyos efectos semejan a los mostrados por las personas envenenadas (Yarlequé 2000). Como resultado de estos estudios, se ha podido clasificar a estos venenos como proteolíticos, coagulantes, hemorrágicos, nefrotóxicos, neurotóxicos y miotóxicos, lo cual se puede correlacionar con la sintomatología manifestada por las personas accidentadas producto de la mordedura de estos animales (Lévano & Fernández 2004).
La principal herramienta terapéutica contra estos accidentes es el empleo de antivenenos producidos en caballos, ovejas, cabras y conejos, elaborados con sueros obtenidos a partir de la inoculación de estos animales con el veneno de las serpientes de mayor importancia en salud pública de un país, tomando como punto de partida la incidencia de su mordedura en una determinada población (Theakston et al. 2003). En Perú, el Instituto Nacional de Salud, mediante el Centro Nacional de Productos Biológicos, es el encargado de elaborar diferentes tipos de antivenenos como el botrópico polivalente (el cual utiliza los venenos de B. atrox "jergón de la selva", B. brazili "jergón shushupe", B. pictus "jergón de la costa", B. barnetti "macanche" y B. hyoprora "jergón"), el laquésico monovalente (empleando el veneno de L. muta "shushupe") y el crotálido monovalente (obtenido a partir del veneno de C. durissus "cascabel sudamericana"). A pesar de la efectividad mostrada por estas preparaciones biológicas en el tratamiento de mordeduras ofídicas, existe escasa información sobre las características inmunoquímicas de los venenos utilizados para su producción, por lo que resulta crucial estudiar la potencial reactividad inmunológica cruzada presente entre estos venenos a fin de optimizar la producción de tales inmunobiológicos, así como para el desarrollo de sistemas de detección de venenos para la identificación de la especie de serpiente responsable de un envenenamiento a fin de seguir el tratamiento apropiado (Van Dong et al. 2003).
Para la producción de anticuerpos se siguen diversos esquemas o protocolos de inmunización, los cuales consideran diferentes parámetros para su desarrollo (Christensen 1979); entre ellos se considera el tiempo necesario para obtener un título aceptable de anticuerpos, la edad del animal inmunizado y el empleo de adyuvantes. Además se debe tener en cuenta la naturaleza del antígeno y su toxicidad, así como la del antiveneno que se pretende producir (Heneine & Heneine 1998). En el presente estudio se utilizaron conejos albinos de raza Nueva Zelanda como animales de experimentación, los cuales fueron inmunizados con una cantidad de veneno de B. atrox que se encuentra por debajo del valor de toxicidad (DL50) reportado (Laing et al. 2004, Rojas et al. 2005) por lo que no se observaron reacciones secundarias en los animales que pudieran interferir con la producción de anticuerpos. A fin de garantizar la producción de altos títulos de anticuerpos en el suero, el veneno fue emulsificado previamente con adyuvante completo de Freund (CFA) para la inmunización primaria y adyuvante incompleto de Freund (IFA) para las dosis de refuerzo, co-adyuvantes ampliamente utilizados por su capacidad de localizar a los antígenos en la zona de inoculación durante un periodo de tiempo prolongado. La eficacia de este método puede ser monitoreada por diversos métodos inmunoquímicos tales como inmunodifusión, inmunoelectroforesis, inmunofluorescencia, hemaglutinación, radioinmunoensayo (RIA), etc. (Theakston 1983). Sin embargo, se ha encontrado que la técnica de ELISA es el método más usado para la detección específica de venenos de serpientes y sus respectivos anticuerpos (Selvanayagam & Gopalakrishnakone 1999). La respuesta inmune de los conejos inoculados fue monitoreada mediante la técnica de ELISA (Fig. 1) donde el aumento de la absorbancia a 405 nm, indica el aumento en la cantidad de inmunocomplejos formados producto del reconocimiento entre el antígeno y los anticuerpos IgG específicos presentes en el suero de los conejos inmunizados. A partir de estos resultados se considera que el procedimiento empleado resulta práctico, eficiente y de corta duración, convirtiéndolo en un método útil para la obtención de anticuerpos contra el veneno de B. atrox.
Para la obtención del título de los antivenenos estudiados existen diversos métodos, siendo el más útil el de la titulación a punto final (Alzamora et al. 2002). Este método consiste en analizar los sueros problema en diluciones seriadas con factor 2 partiendo de una dilución inicial fija. En nuestro esquema experimental se eligió como título la dilución de suero que produce un 50% de la absorbancia máxima, siendo el título anti-B. atrox correspondiente al valor de 256000 (Fig. 2), el cual muestra que el veneno analizado es altamente inmunogénico. En el caso de los venenos de serpientes y los protocolos de inmunización para la obtención de anticuerpos específicos, se considera que el título de anticuerpos para un antiveneno es alto cuando su valor es mayor a 32000 (Van Dong et al. 2003). Sin embargo también se han observado títulos que alcanzan valores de 2048000 para los venenos de B. atrox y L. muta provenientes de Brazil (Colombini et al. 2001). Si bien estos valores están muy por encima de los hallados en la presente investigación, hay que tener en cuenta el tipo de conjugado empleado en ambos tipos de ensayos, el cual basa la sensibilidad de su detección en la enzima acoplada que realiza la hidrólisis del sustrato respectivo. En el presente trabajo se utilizó un conjugado acoplado a la enzima fosfatasa alcalina el cual reaccionó sobre el sustrato p-nitrofenil fosfato para dar una coloración amarilla cuya absorbancia es registrada a 405 nm.
A fin de realizar un análisis comparativo de los venenos de serpientes en estudio: B. atrox, B. brazili, L. muta y C. durissus, se analizó el patrón electroforético de sus proteínas mediante PAGE - SDS en condiciones no reductoras (Fig. 4a). En el caso del veneno de B. atrox se pueden observar bandas específicas entre los 25 y 60 kDa, las cuales corresponderían a proteínas tales como la miotoxina (27 kDa; Huatuco et al. 2004) y la L-aminoácido oxidasa (60 kDa; Lazo et al. 2007). Así mismo podría notarse la presencia de la atroxina, una metaloproteinasa dependiente de Ca2+, principal responsable del efecto proteolítico y hemorrágico de este veneno (19,9 kDa, Pantigoso et al. 1996). En el perfil electroforético del veneno de B. brazili, se distinguen bandas proteicas dentro del rango de 30 a 45 kDa que corresponderían a la miotoxina (30 kDa, Pantigoso et al. 2001), incluyendo una L-aminoácido oxidasa (59,9 kDa, Solis et al. 1999). Además de las proteínas mencionadas, se pueden distinguir componentes de bajo peso molecular como es el caso para una fibrinogenasa (22 kDa, Azañero et al. 2000) y una fosfolipasa A2 (21,2 kDa, Zeballos et al. 1999) previamente reportadas. Ambos venenos tuvieron un número similar de componentes, si bien la distribución de bandas de sus perfiles electroforéticos es claramente diferente. Con respecto al patrón de bandas para el veneno de L. muta, éste presenta un rango mucho mayor abarcando proteínas desde los 14,4 kDa hasta los 97 kDa como se ha reportado para el caso de la fosfolipasa A2 (19,2 kDa, Mejia et al. 2006), la proteinasa I (25,1 kDa, Rodriguez & Yarlequé 1991), la enzima similar a trombina (40,0 kDa, Yarlequé et al. 1989) y la L-aminoácido oxidasa (60,6 kDa, Cisneros et al. 2006). En el caso del veneno de C. durissus, se observa un menor número de bandas, donde las proteínas se encuentran agrupadas en el rango de 14,4 a 30 kDa, sin embargo sólo se ha reportado la presencia de ciertas actividades enzimáticas como la proteolítica, amidolítica, coagulante, fosfolipasa A2 y L-aminoácido oxidasa (Remuzgo et al. 2000). A partir de este análisis, los componentes de los venenos en estudio pueden dividirse en dos grupos basados en sus pesos moleculares; por un lado los de alto y mediano peso molecular (mayor a 15 kDa) y por otro los de bajo peso molecular (menor a 15 kDa). Esta heterogeneidad en los perfiles obtenidos ha sido reportada para venenos de otras especies sudamericanas, como B. alternatus, B. atrox, B. cotiara, B. erythromelas, B. jararaca, B. jararacussus, B. moojeni, B. neuwiedi y B. pradoi de Brazil (da Silva et al. 1990); centroamericanas, incluyendo a L. muta stenophrys y C. durissus durissus de Costa Rica (Anderson et al.1993); norteamericanas como C. atrox, C. viridis viridis, C. adamanteus y C. horridus horridus (Ownby & Colberg 1990) y asiáticas como Naja naja siamensis, Ophiophagus hannah, Bungarus fasciatus, Vipera russelli, Calloselasma rhodostoma y Trimeresurus albolabris (Chinonavanig et al. 1988).
Para el análisis de la reactividad inmunológica de los venenos de serpientes estudiados contra el suero anti-B. atrox, se empleó en primer lugar el método de ELISA. Mediante esta técnica se pudo determinar que los anticuerpos presentes en el suero hiperinmune reaccionaron con los venenos de serpientes, donde la densidad óptica más fuerte fue la obtenida entre el veneno de B. atrox y su antiveneno homólogo (Fig. 3). En estos experimentos de titulación, se pudo observar también reactividad cruzada con los otros venenos de serpientes, donde el mayor valor correspondió a la reacción del suero hiperinmune con el veneno de B. brazili, seguido por títulos bajos contra los venenos de L. muta y C. durissus. Estos resultados indican que los venenos en estudio contienen proteínas estructuralmente relacionadas con los componentes del veneno de B. atrox, los cuales varían tanto en intensidad como en abundancia. Estos resultados deben ser correlacionados con los de otros métodos inmunoenzimáticos, siendo el más idóneo el de Western Blot (Li & Ownby 1994), ya que si sólo se utiliza un método para este tipo de análisis, se podría llegar a conclusiones e interpretaciones erróneas sobre la reactividad entre los venenos y antivenenos (Siigur et al. 2000). Por esta razón se evaluó de forma adicional la inmunogenicidad de los componentes de los venenos en estudio utilizando el ensayo de Western Blot, el cual consiste en primer lugar en la separación de los componentes proteicos del veneno mediante PAGE - SDS, para luego ser transferidos a membranas de nitrocelulosa y puedan así ser detectadas por los anticuerpos presentes en el suero hiperinmune obtenido. De este modo, la formación de inmunocomplejos es detectada de forma similar que en un ELISA indirecto. La Fig. 4b muestra el patrón característico de coloración de bandas correspondiente a los componentes inmunorreactivos de los venenos en estudio analizados previamente por PAGE - SDS (Fig. 4a). Esta metodología permite la visualización directa y la comparación de la reacción de un mismo suero con los componentes del veneno homólogo y los venenos heterólogos bajo las mismas condiciones. De esta manera se pudo observar que las proteínas de los venenos reaccionaron con el suero hiperinmune producido contra el veneno de B. atrox lo cual indica que la mayor parte de los componentes proteicos son potencialmente inmunogénicos. Estos resultados pueden correlacionarse con los de Chinonavanig et al. (1988), quien trabajando con el veneno de serpientes de Tailandia, encontró que los componentes de alto peso molecular fueron inmunogénicos, donde además otros componentes de menor peso molecular también lo fueron. En los demás carriles se pudo observar una reactividad inmunológica cruzada entre los anticuerpos del suero hiperinmune con las proteínas de los venenos de B. brazili (carril 2), L. muta (carril 3) y C. durissus (carril 4). La mayoría de estas bandas de reacción corresponden a proteínas de alto y mediano peso molecular y con una elevada inmunorreactividad. Tales reacciones cruzadas entre los venenos de vipéridos han sido descritas antes para el caso de un antiveneno anti-C. atrox y los venenos de C. adamenteus, C. h. horridus y C. v. viridis de norteamerica (Minton 1979). En nuestro estudio, se obtuvieron resultados mediante ELISA, pero con esta técnica no se pudieron determinar los componentes específicos que contribuyen a la reactividad cruzada. En el caso del veneno de B. brazili (Fig. 6b, carril 2), las reacciones cruzadas ocurren con una intensidad casi similar a la del veneno homólogo, lo que indicaría un alto grado de conservación en la estructura de sus proteínas con las del veneno de B. atrox lo cual se correlaciona con los datos obtenidos por ELISA. Para el veneno de L. muta (Fig. 6b, carril 3), la mayor reactividad se concentró en componentes de alto y mediano peso molecular (20 - 60 kDa), donde se encuentran agrupados componentes como proteasas y otras toxinas hemorrágicas. Finalmente, el veneno de C. durissus (Fig. 6b, carril 4), reaccionó pobremente con el antiveneno, donde la mayor reactividad se concentró en un componente de alto peso molecular (>66 kDa) que podría corresponder a su L-aminoácido oxidasa.
En el desarrollo de pruebas de inmunodiagnóstico para identificación rápida de la especie responsable de un envenenamiento, los componentes del veneno que reaccionan cruzadamente podrían dar lugar a ambigüedad o inclusive error en el diagnóstico (Marshall & Herrmann 1984, McCarthy 1984, Ho et al. 1986). Los anticuerpos producidos contra el veneno de B. atrox mostraron una reactividad cruzada con los tres venenos heterólogos, por lo que sería necesaria la preparación de anticuerpos específicos de especie como paso preliminar en el desarrollo del kit de diagnóstico. Una aproximación para la obtención de tales anticuerpos ha sido reportada en el trabajo de Sandoval et al. (2006), donde utilizando columnas de afinidad con el veneno inmovilizado de B. atrox se pudieron capturar los anticuerpos IgG específicos a partir del suero hiperinmune. Queda por analizar si estos anticuerpos reaccionan de forma cruzada o no contra otros venenos de serpientes empleando las técnicas descritas en este trabajo.
Agradecimientos
El presente trabajo fue desarrollado gracias al apoyo recibido en marco del Convenio firmado entre la Universidad Nacional Mayor de San Marcos (Perú) y las Universidad de Liverpool y Oxford (Inglaterra).
Literatura citada
Alzamora L., E. Colona, M. Vizcarra. 2002. Manual de prácticas de inmunoserología. Primera Edición. Universidad Nacional Mayor de San Marcos. Facultad de Ciencias Biológicas.
Anderson S.G., J.M. Gutierrez & C.L. Ownby. 1993. Comparison of the immunogenicity and antigenic composition of ten Central American snake venoms. Toxicon 31(8):1051 - 9.
Azañero A., E. Escobar & A. Yarlequé. 2000. Purificación de una enzima proteolítica del veneno de Bothrops brazili y estudio de su actividad sobre fibrinógeno. Revista Peruana de Biología. 7(1): 55-66.
Chinonavanig L., P.B. Billings, P. Matangkasombut & K. Ratanabanangkoon. 1988. Antigenic relationships and relative immunogenicities of venom proteins from six poisonous snakes of Thailand. Toxicon 26(9):883 - 90.
Chippaux J.P. & Goyffon M. 1998. Venoms, antivenoms and immunotherapy. Toxicon 36(6):823 - 46.
Chippaux J.P., V. Williams & J. White. 1991. Snake venom variability: methods of study, results and interpretation. Toxicon 29(11):1279 - 303.
Christensen P.A. 1979. Production and standardization of antivenin. In: Lee, C.Y. (Ed.). Handbook of Experimental Pharmacology, vol. 52. Springer, Berlin, pp. 825 - 47.
Cisneros Y., F. Lazo, S. Gutierrez, A. Yarlequé. 2006. Características bioquímicas de una proteína antibacteriana aislada del veneno de Lachesis muta "Shushupe". Rev Soc Quim Perú 72(4):187 - 96.
Colombini M., I. Fernandes, D.F. Cardoso & A.M. Moura - da - Silva. 2001. Lachesis muta muta venom: immunological differences compared with Bothrops atrox venom and importance of specific antivenom therapy. Toxicon 39(5):711 - 9.
da Silva A.M., M.R. Lima, A.K. Nishikawa, et al. 1990. Antigenic cross - reactivity of venoms obtained from snakes of genus Bothrops. Toxicon.;28(2):181 - 8.
Engvall E. & P. Perlman. 1971. Enzyme - linked immunosorbent assay (ELISA). Quantitative assay of immunoglobulin G. Immunochemistry 8(9):871 - 4.
Heneine I.F. & L.G. Heneine. 1998. Stepwise iodination. A general procedure for detoxification of proteins suitable for vaccine development and antiserum production. Biologicals 26(1):25 - 32.
Ho M., M.J. Warrell, D.A. Warrell, D. Bidwell, A. Voller. 1986. A critical reappraisal of the use of enzyme - linked immunosorbent assays in the study of snake bite. Toxicon 24(3):211 - 21.
Huatuco S., E. Escobar, A. Yarlequé. 2004. Aislamiento y caracterización parcial de una miotoxina del veneno de la serpiente Bothrops atrox (Ophidia: Viperidae). Rev Peru Biol. 11(1):79 - 86.
Laemmli U.K. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227(5259):680 - 5.
Laing G.D., A. Yarleque, A. Marcelo, et al. 2004. Preclinical testing of three South American antivenoms against the venoms of five medically - important Peruvian snake venoms. Toxicon 44(1):103 - 6.
Lazo F., O. Málaga, A. Yarlequé & R. Severino. 2007. Algunas propiedades bioquímicas de una L - aminoácido oxidasa aislada del veneno de la serpiente Bothrops atrox. Rev Soc Quim Perú 73(3):131 - 41.
Lévano J. & R. Fernández. 2004. Diagnóstico y tratamiento de los accidentes por animales ponzoñosos. Instituto Nacional de Salud, Ministerio de Salud, Lima, Perú. 1era edición. 74 Pp.
Li Q. & C.L. Ownby. 1994. Cross reactivities of monoclonal antibodies against hemorrhagic toxins of Prairie rattlesnake (Crotalus viridis viridis) venom. Comp Biochem Physiol B Biochem Mol Biol. 107(1):51 - 9.
Loayza S., Y. Morante, S. Campos & A. Yarlequé. 1985. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox. Bol Soc Quim Perú. 52(3):151 - 63.
Loja .D, R. Aviles, Y. Necochea, M. Vilca, J. Castro. 2000. Ofidismo por Bothrops atrox: estudio clínico - epidemiológico. Diagnóstico 39(5):261 - 5.
Lowry O.H., N.J. Rosebrough, A.L. Farr & R.J. Randall. 1951. Protein measurement with the Folin phenol reagent. J Biol Chem. 193(1):265 - 75.
Marshall L.R. & R.P. Herrmann. 1984. Cross - reactivity of bardick snake venom with death adder antivenom. Med J Aust. 140(9):541 - 2.
McCarthy N.J. 1984. Snake venom detection kit. Med J Aust. 140(9):518.
Mejia J., R. Inga, F. Lazo, et al. 2006. Purificación y propiedades bioquímicas de una fosfolipasa A del veneno de la serpiente Lachesis muta "Shushupe". Rev. Soc. Quim. Perú. 72(2):86 - 95.
Minton, S.A., Jr. 1979. Common antigens in snake venoms. In: Lee, C.Y. (Ed.). Handbook of Experimental Pharmacology, vol. 52. Springer, Berlin, pp. 847 - 862.
Ownby C.L., T.R. Colberg. 1990. Comparison of the immunogenicity and antigenic composition of several venoms of snakes in the family Crotalidae. Toxicon 28(2):189 - 99.
Pantigoso C., E. Escobar, O. Málaga, A. Yarlequé. 1996. Isolation and some properties of the proteinase atroxin from the venom of the snake Bothrops atrox. Acta Cient Venez. 47(1):67 - 73.
Pantigoso C., E. Escobar & A. Yarlequé. 2001. Aislamiento y caracterización de una miotoxina del veneno de la serpiente Bothrops brazili Hoge ,1953 (Ophidia: Viperidae). Rev Peru Biol. 8(2):136 - 48.
Remuzgo C., M.P. Alvarez, F. Lazo, A. Yarlequé. 2000. Caracterización parcial del veneno de la serpiente cascabel peruana Crotalus durissus terrificus. Rev Peru Biol. 7(1):67 - 73.
Rodríguez E., A. Yarlequé. 1991. Isolation and various properties of proteinase I from the venom of the Peruvian snake Lachesis muta. Acta Cient Venez. 42(4):219 - 25.
Rojas E., L. Quesada, V. Arce, et al. 2005. Neutralization of four Peruvian Bothrops sp. snake venoms by polyvalent antivenoms produced in Perú and Costa Rica: preclinical assessment. Acta Trop. 93(1):85 - 95.
Sandoval G., L. Lerma, E. Rodríguez, et al. 2006. Purificación de anticuerpos policlonales contra el veneno de la serpiente peruana Bothrops atrox ("Jergón"). Rev Soc Quim Perú. 72(3):140 - 9.
Selvanayagam Z.E. & P. Gopalakrishnakone. 1999. Tests for detection of snake venoms, toxins and venom antibodies: review on recent trends (1987 - 1997). Toxicon. 37(4):565 - 86.
Siigur E., M. Samel, K. Tõnismägi, J. Siigur. 2000. Cross - reactivities of polyclonal antibodies against factor V activating enzyme, a serine proteinase from Vipera lebetina (snake) venom. Comp Biochem Physiol B Biochem Mol Biol. 126(3):377 - 82.
Solis C., E. Escobar, A. Yarlequé, S. Gutierrez. 1999. Purificación y caracterización de la Laminoácido oxidasa del veneno de la serpiente Bothrops brazili "Jergón shushupe". Rev Peru Biol. 6(1):75 - 84.
Theakston R.D., D.A. Warrell & E. Griffiths. 2003. Report of a WHO workshop on the standardization and control of antivenoms. Toxicon 41(5):541 - 57.
Theakston R.D. 1983. The application of immunoassay techniques, including enzymelinked immunosorbent assay (ELISA), to snake venom research. Toxicon 21(3):341 - 52.
Towbin H., T. Staehelin, J. Gordon. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci U S A. 76(9):4350 - 4.
Van Dong L., Quyen le K, Eng KH, Gopalakrishnakone P. 2003. Immunogenicity of venoms from four common snakes in the South of Vietnam and development of ELISA kit for venom detection. J Immunol Methods 282(1 - 2):13 - 31.
Warrell D.A. 1996. Clinical features of envenoming. In: Envenoming and their treatments. cd. Bon, C.; Goyffon, M. pp. 63 - 76. Fond. Marcel Mérieux, Lyon.
Yarleque A., S. Campos, E. Escobar, et al. 1989. Butterworth PJ, Price RG. Isolation and characterization of a fibrinogen - clotting enzyme from venom of the snake, Lachesis muta muta (Peruvian bushmaster). Toxicon 27(11):1189 - 97.
Yarlequé A. 2000. Las serpientes peruanas y sus venenos. Lima: Fondo Editorial - UNMSM.
Zeballos J., E. Escobar, A. Yarlequé. 1999. Aislamiento y algunas propiedades de una fosfolipasa del veneno de la serpiente Bothrops brazili. Bol Soc Quim Perú 65(1):10 - 20.
* Correspondencia:
Dr. Armando Yarlequé,
Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos,
apartado postal 110058, Lima 11, Perú.
E-mail: ayarleque48@gmail.com
Presentado: 12/02/2011
Aceptado: 23/07/2011
Publicado online: 08/02/2012













