Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.19 n.1 Lima abr. 2012
TRABAJOS ORIGINALES
Fauna flebotomina (Diptera: Psychodidae) del estado Falcón, Venezuela
Phlebotomine sandfly fauna (Diptera: Psychodidae) of Falcon state, Venezuela
Dalmiro J. Cazorla 1* y Pedro Morales1
1 Laboratorio de Entomología, Parasitología y Medicina Tropical, Centro de Investigaciones Biomédicas, Universidad Nacional Experimental "Francisco de Miranda" (UNEFM), Apdo. 7403, Coro 4101, Estado Falcón, Venezuela.
Resumen
Se estudio la composición, abundancia y dispersión de la fauna flebotomina en focos endémicos de leishmaniasis en el estado Falcón, Venezuela. Se emplearon 5 métodos de captura, en 41 localidades ubicadas entre los 0 y 1584 m. Se colectaron 6273 especímenes, pertenecientes a 17 especies de Lutzomyia y 1 de Brumptomyia. De éstas, 10 especies (55,56%) fueron reconocidas por poseer hábitos antropofílicos. Lutzomyia evansi (52,37%) resultó ser la especie más abundante. Se presenta la diversidad y el rango de dispersión de las especies flebotominas a lo largo de la transecta altitudinal, y se discute su posible significancia en la transmisión de las leishmaniasis en el estado Falcón.
Palabras clave: Flebotominos, Leishmaniasis, diversidad, dispersión, epidemiología.
Abstract
Composition, abundance and dispersion of phlebotomine sandfly fauna were studied in Falcon state, Venezuelan north-western region. The sandflies were collected by five methods in 41 localities between 0 to 1584 m. A total of 6273 specimens were collected, 17 species of Lutzomyia and 1 of Brumptomyia were identified. Of these, 10(55.56%) species are known to be anthropophilic. The predominant species was L. evansi (52.37%). The diversity and dispersion range of sandflies along an altitudinal transect, are presented. The significance of sandfly fauna in the transmission of leishmaniases in the Falcon state region is discussed.
Keywords: Phlebotomine sanflies, Leishmaniasis, diversity, dispersion, epidemiology.
Introducción
Las leishmaniasis son consideradas entidades nosológicas endémicas y focales en prácticamente la totalidad de las entidades federales de Venezuela, registrándose en promedio 2388 casos por año, siendo por lo tanto un problema de salud pública (De Lima et al. 2010).
De acuerdo con De Lima et al. (2010), en el periodo comprendido entre 1988-2007 se han reportado para el estado Falcón, al nor-oeste de Venezuela, 304 casos de leishmaniasis cutánea americana (LCA), con una tasa de incidencia por cada 100000 habitantes de 2,09, por lo que se considera al estado de Falcón como un foco activo de la protozoosis. En relación con la leishmaniasis visceral (LV), el estado Falcón forma parte del denominado foco occidental de la protozoosis, registrándose durante el lapso 1990-2003 al menos 15 casos (Zerpa et al. 2003).
Siendo las leishmaniasis enzootias cuyos límites se encuentran definidos en gran medida por la distribución de sus flebotominos vectores(Scorza 1989), resulta lógico pensar que la implementación de un programa eficaz para su control y vigilancia epidemiológica, sólo será posible en la medida que se conozcan con exactitud las especies flebotominas encargadas de mantener los ciclos enzoóticos y antropozoonóticos, y los factores abióticos y bióticos que condicionan las fluctuaciones y dinámica de sus poblaciones.
Varios autores han hecho señalamientos si se quiere esporádicos sobre los vectores de Leishmania del estado Falcón, al realizar estudios sobre seroprevalencia y/o casos clínicos de leishmaniosis tegumentaria (LT) y LV en algunos focos endémicos de la región. La revisión más completa y exhaustiva sobre los flebotominos de esta entidad federal se debe a Feliciangeli (1988), quien reporta para la misma la presencia de 17 especies de Lutzomyia França, 1924, aunque debe mencionarse que en dicho trabajo no se indican la abundancia relativa, los hábitats, hipsometría, ni la dispersión de los flebotominos.
A la luz de lo expuesto, las LT y LV como problema de salud pública en el estado Falcón demandan un estudio más amplio, detallado, sistemático y cuantitativo sobre sus eco-epidemiologías y dinámicas de transmisión, incluyendo a su flebótomo-fauna. El presente trabajo tiene como finalidad estudiar la diversidad, abundancia, dispersión y hábitats de la fauna flebotomina, en 41 localidades ubicadas a diferentes altitudes y zonas de vida bioclimáticas, donde se han detectado casos activos y/o inaparentes de estas protozoosis. Asimismo, se discute el posible rol que pudieran estar jugando las especies en los ciclos enzoóticos y antropozoonóticos de las LT y LV en la región falconiana.
Material y métodos
Área de estudio.- Durante el periodo comprendido entre marzo de 1998 y septiembre de 1999, y enero-julio de 2005, se muestrearon 41 localidades del estado Falcón, al nor-occidente de Venezuela, ubicadas a diferentes altitudes, entre los 10º1808" y 12º1146"N y los 68º1428" y 71º1821"W. Las localidades estudiadas se dividieron en 3 pisos altitudinales, de manera tal de trazar una transecta, aproximadamente cada 400-600 m, desde los 0 m (llanura costera) hasta los 1584 m (macizo coriano), clasificándose sus zonas de vida bioclimáticas de acuerdo con los trabajos de Ewel et al. (1976). Así se tiene que en el primer piso (0 – 400 m), se escogieron 23 localidades con una gran variedad de zonas de vida, que van desde el Monte Espinoso Tropical (MET), el Bosque Muy Seco Tropical (BMST), el Bosque Seco Tropical (BST) y el Bosque Húmedo Premontano (BHP), y zonas de transición entre las mismas, detectándose una acentuada intervención del bosque primario. El segundo piso comprende 15 localidades ubicadas entre los 462 y 990 m. En las mismas se encuentran zonas bio-climáticas correspondientes a los BST, BMST, BHP, y al Bosque muy Húmedo Premontano (BMHP), detectándose, asimismo, zonas de transición entre éstas, donde el bosque primario se encuentra obstensiblemente talado para la siembra de pastizales empleados en la cría de vacunos, y para la siembra de cafetos, frutales u otros cultivos no perennes. En el piso de mayor altitud (1056 – 1584 m), se estudiaron 3 localidades, con zonas bioclimáticas que corresponden al BHP y BMHP, en las cuales vastas áreas del bosque primario se encuentran fuertemente intervenidas.
Captura de flebotominos.- Se realizaron capturas diurnas y nocturnas de flebotominos adultos en refugios naturales, el domicilio humano y sus alrededores. Se emplearon cinco métodos de captura: trampas lumínicas de Shannon y CDC, papel aceitado, aspiración directa y la de Disney (Añez et al. 1988). Los flebotominos se transportaron al laboratorio en cavas de poliuretano con alta humedad, y se sacrificaron con vapores de cloroformo. Todos los insectos fueron clarificados en solución de Nesbitt a temperatura ambiente durante 24 horas y montados sobre láminas portaobjetos en líquido de Berlese.
Identificación de flebotominos.- La identificación de las especies flebotominas se realizó básicamente mediante morfología externa e interna comparada (Young & Duncan 1994), y en el caso de las especies isomórficas o con problemas para su identificación morfológica, se complementó con análisis multivariante de la variación morfométrica. La ubicación de las diversas especies flebotominas en sus respectivos géneros, subgéneros y grupos, se basó primordialmente en criterios dados por Young y Duncan (1994).
Resultados
Composición y abundancia relativa de especies flebotominas.- Se capturaron 17 especies flebotominas del género Lutzomyia (99,97%) y 1 del género Brumptomyia França & Parrot, 1921 (0,03%) (Tabla 1). De éstas, 10 son reconocidas por poseer hábitos antropofílicos (Tabla 1). L. evansi (Nuñez-Tovar, 1924) es la especie más abundante, con un 52,37% del total de los individuos colectados, seguida por L. trinidadensis (Newstead, 1922) (16,69%) y L. gomezi (Nitzulescu, 1931) (11,59%) (Tabla 1).
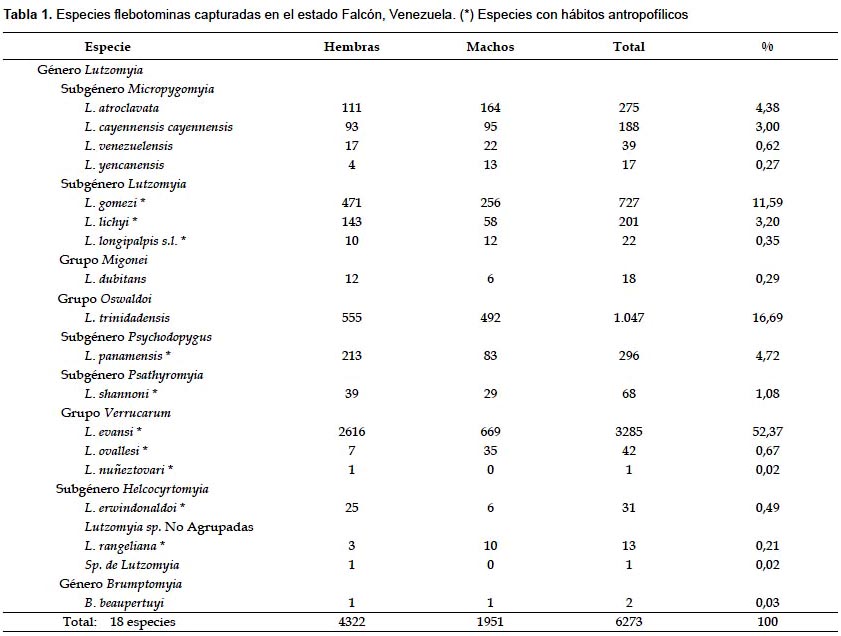
Diversidad y dispersión altitudinal de especies flebotominas.- Tal como se aprecia en la Tabla 2, en el intervalo altitudinal entre los 0 y 400 m., se capturaron 13 especies de Lutzomyia y 1 de Brumptomyia, siendo L. evansi y L. trinidadensis las especies de mayor abundancia. De los 2016 especímenes que se capturaron en el piso altitudinal medio, L. evansi fue de igual modo la especie predominante de las 12 colectadas, representando el 42,9% del total (Tabla 2). En el piso de mayor altitud, se colectaron 10 especies de Lutzomyia, exhibiendo las mayores abundancias poblacionales L. lichyi (Floch & Abonnenc, 1950) y L. gomezi (Tabla 2).
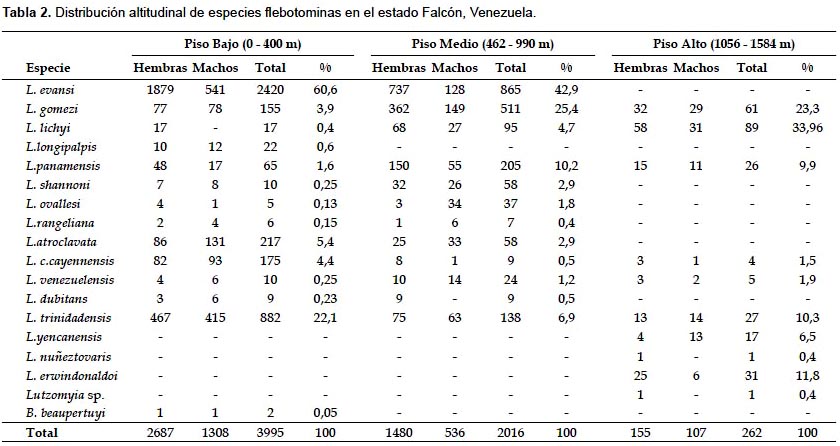
Como se aprecia en la Tabla 2, L. gomezi, L. panamensis (Shannon, 1926), L. venezuelensis (Floch & Abonnenc, 1948), L. lichyi, L. trinidadensis y L. c. cayennensis (Fairchild & Hertig, 1948) exhibieron el rango de dispersión más amplio a lo largo de la transecta altitudinal, al ser colectadas desde los 0 hasta los 1122 m, mientras que L. evansi fue encontrada ininterrumpidamente hasta los 858 m., donde presenta su menor abundancia poblacional. Por contraste, L. longipalpis s.l. (Lutz & Neiva, 1912) y B. beaupertuyi (Ortiz, 1954), y las especies L. nuñeztovari (Ortiz, 1954), L. yencannensis (Ortiz, 1965) y L. erwindonaldoi (Ortiz, 1978), sólo se capturaron en los pisos bajo y alto, respectivamente.
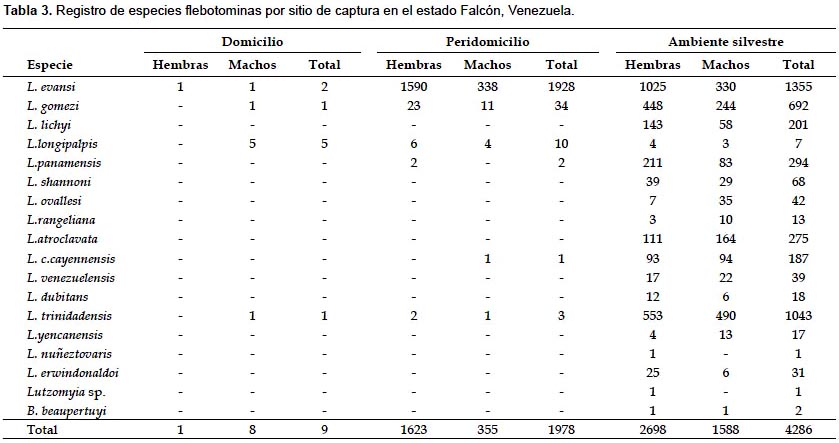
Composición y abundancia relativa de especies flebotominas por hábitat.- El análisis de los resultados exhibidos en la Tabla 3 revela que todas las especies flebotominas se hallaron en sus ambientes silvestres o naturales. Dentro del domicilio humano se detectaron 4 especies de Lutzomyia, y en sus alrededores 6. Es importante indicar que 4 especies, incluyendo L. evansi, L. gomezi, L. longipalpis s.l. y L. trinidadensis, se observaron en los 3 hábitats de captura (Tabla 3).
Discusión
Llama la atención que 10 de las especies capturadas, poseen hábitos antropofílicos, representando las mismas el 74,7% de los especímenes recolectados. Además, se debe agregar a esta lista las especies antropofílicas L. davisi (Root, 1934), L. olmeca bicolor (Fairchild & Theodor, 1971), L. migonei (França,1920) y L. punctigeniculata (Floch & Abonnenc, 1944), que aunque no fueron capturadas durante la ejecución del presente trabajo, también forman parte de la fauna flebotomina de la entidad federal (Feliciangeli 1988). Estas cifras, aunado al hecho de que varias de estas especies son incriminadas o comprobadas vectores de LT y/o LV, hablan a favor de considerar a la región falconiana como un área con una alta potencialidad para la transmisión de las leishmaniasis.
Feliciangeli (1987a) resalta el hecho de poder predecir la composición de la fauna flebotomina en una determinada región, al considerar que similares condiciones metereológicas, geográficas, florísticas y del tipo de suelo darían como resultado, igualmente, una composición faunística muy similar. Esta apreciación pareciera verse apoyada al detectarse similitudes cuando se comparan la composición de la fauna flebotomina y las zonas bioclimáticas del estado Sucre, ubicado en la región nor-oriental de Venezuela, hechas por Ramírez-Pérez et al. (1982), con las del estado Falcón, dadas por Feliciangeli (1988) y por los resultados del presente trabajo. En efecto, las zonas bioclimáticas de la entidad oriental abarcan básicamente las mismas ubicadas en el estado Falcón, inclusive al MET, teniendo en su geografía 16 de las 20 especies flebotominas que se han capturado hasta el presente en la región falconiana.
Cuando se realiza el análisis de la distribución altitudinal, se observa que hasta los 600 m, donde predominan las zonas bioclimáticas de los MET y BMST, la especie flebotomina antropofílica más frecuentemente capturada y en mayor abundancia resultó ser L. evansi, aunque también se le halló hasta casi los 800 m en porcentajes relativamente bajos, lo que sugiere que la abundancia relativa y la ocurrencia de L. evansi se correlacionan inversamente con la altitud. Similares resultados a los nuestros encontraron Mogollón et al. (1977), quienes detectaron la presencia de esta especie preferentemente en localidades del estado Trujillo, región andino-venezolana, ubicadas entre los 15 y 600 m, a pesar de que se logró su captura aun a los 1900 m en porcentajes muy bajos. De acuerdo a esta distribución altitudinal, L. evansi puede considerarse una especie flebotomina de tierras bajas o calientes (especie macrotérmica), tal como lo sugieren Mogollón et al. (1977). En la experiencia del presente estudio llama la atención el hecho de que a L. evansi sólo se le halló simpátricamente con L. longipalpis s.l., en tres localidades ubicadas entre los 0-400 m, encontrándose L. longipalpis s.l en porcentajes muy bajos, aunque faltarían muestreos aún más sistemáticos, lo cual habla a favor de una alternancia estacional de ambas especies. Este hecho pareciera encontrar apoyo en los trabajos de Pifano & Romero (1973), y más recientemente en los de Feliciangeli et al. (1999), quienes detectan la referida alternancia en focos endémicos de LV de los estados venezolanos de Nueva Esparta y Aragua, presentando L. longipalpis s.l su mayor abundancia en este último estado durante la estación seca, y L. evansi para el final de la estación lluviosa; similar comportamiento ecológico presentan estas especies en América Central (Valle & Espinoza 2006). Por otra parte, no debe sorprender el haberse capturado a L. evansi en varias localidades sin la presencia de L. longipalpis s.l., aunque faltarían igualmente más muestreos para confirmarlo, ya que en la región del caribe colombiano, donde no se ha capturado a L. longipalpis s.l. después de un estudio intenso y sistemático, la transmisión de la LV se debe a L. evansi (Bejarano et al. 2001).
En Colombia, L. evansi posee una distribución predominante hacia zonas ecológicas del BST, aunque también se le captura en otras zonas bioclimáticas como el BMST, BHT y MET (González et al. 2006). Por lo tanto, tomando en consideración que en la región falconiana esta especie flebotomina similarmente alcanza una amplia variedad de ecotopos, se sugiere que L. evansi es una especie flebotomina con un comportamiento oportunista, con una plasticidad en su genoma y conducta que le permite colonizar nuevos ambientes, incluyendo los intervenidos por la mano del humano.
Debido a su gran abundancia poblacional registrada, a su alto grado de antropofilia y su comprobada conducta intradomiciliar, además de haberse demostrado su infección con promastigotes de Le. (Le.) chagasi/infantum en focos de LV de Venezuela (Feliciangeli et al. 1999), L. evansi debería estar jugando un papel importante, junto con L. longipalpis s.l., en la transmisión de la LV en las localidades del estado Falcón por debajo de los 600 m, dejándose la posibilidad de considerarse, así mismo, como un vector secundario de LT, tal como se ha sugerido en un foco de LT debido a Le. (Le.) chagasi/infantum en Altagracia de Orituco, estado Guárico, Venezuela, donde predominan L. evansi y L. longipalpis s.l. (De Lima et al. 2009).
A diferencia de L. evansi, L. gomezi y L. lichyi exhibieron una mayor abundancia relativa hacia los pisos más altos, sugiriendo este hecho la existencia de una correlación positiva entre ambos parámetros. Esta afirmación pareciera verse apoyada por previas observaciones de Mogollón et al. (1977), quienes en el estado Trujillo, Venezuela, encuentran a L. gomezi y L. lichyi prevalentes en un 4,8% y 6,7%, respectivamente, de las localidades muestreadas ubicadas a los 200 m, mientras que detectan a las mismas en un 23,8% y 16,7%, respectivamente, en aquellas ubicadas a 1000 m. Asimismo, Feliciangeli (1987a) captura a L. gomezi en poca abundancia en el estado Carabobo, en la región central de Venezuela, atribuyéndole a la baja altitud de la zona como una de las posibles explicaciones a este fenómeno. Por su parte, Perruolo (1984), trabajando en un foco endémico de LT del estado Táchira, en los Andes de Venezuela, ubicado a 1000 m, encuentra a L. gomezi como la especie de mayor abundancia. La misma es considerada como un vector alterno de LT en la región septentrional del centro y otras regiones de Venezuela (Feliciangeli et al. 1994). A la luz de lo discutido anteriormente, y teniendo en mente su amplio rango de distribución altitudinal, L. gomezi debe ser considerada potencialmente como un posible vector de LT, especialmente hacia las zonas de mayor altitud del estado Falcón, donde presenta su mayor abundancia poblacional. Similar rol pudiera estar representando L. lichyi, que ha sido incriminada en Colombia como vector de Le. (Viannia) braziliensis (Alexander et al. 2001).
Por otra parte, L. panamensis, vector comprobado de LT en Venezuela (Scorza 1989), presentó su mayor abundancia en el piso altitudinal medio. Estos resultados sugieren que, contrariamente a los hallazgos de otros investigadores (Feliciangeli 1987a; Mogollón et al. 1977), la abundancia de L. panamensis en el estado Falcón no pareciera correlacionarse inversamente con la altitud. No obstante estas divergencias, L. panamensis puede considerarse como un flebotomino que predomina en el piedemonte, a altitudes entre 100 y 700 m, con temperatura del tipo mega-mesotérmico (Scorza 1989). Tomando en cuenta su comprobada efectividad como vector de Le. (V.) braziliensis, su alta antropofilia, fotofilia y hematofagismo intradomiciliar (Feliciangeli 1987b) se sugiere, con una alta probabilidad, que L. panamensis debería estar jugando un papel muy importante como vector de LT en el estado Falcón.
En relación con L. ovallesi, a la misma se le detectó tanto en pisos de baja altitud como en localidades ubicadas a mayores elevaciones, siendo mayor su abundancia en estas últimas, sugiriendo este hallazgo una relación positiva entre su abundancia y la altitud. Cuando se comparan estos resultados con los obtenidos por otros investigadores, se encuentran posiciones contrastantes. Por una parte, Mogollón et al. (1977) la capturan en un 2% de las localidades muestreadas a los 200 m, detectándola en un 24% en aquellas ubicadas a los 1000 m, aunque también logran su captura hasta los 1900 m en una baja abundancia. Similares resultados a estos investigadores encuentran Añez et al. (1994), quienes colectan a L. ovallesi en mayor abundancia en localidades del estado Mérida, en la región andina de Venezuela, ubicadas entre los 800 y 1000 m. Por el contrario, para Feliciangeli (1987a) la abundancia de L. ovallesi en San Esteban, estado Carabobo, pareciera estar principalmente relacionada con factores climáticos. L. ovallesi se encuentra considerada un importante vector de Le. (V.) braziliensis, Le. (Le.) mexicana y Le. (V.) guyanensis en Venezuela (Feliciangeli et al. 1994). Por todos estos antecedentes, se sugiere que L. ovallesi podría estar transmitiendo Leishmania al humano hacia las zonas endémicas ubicadas en la parte oriental del estado Falcón, donde se le captura preferentemente.
Mientras que la transmisión de la LV en las Américas se encuentra asociada principalmente con las especies L. longipalpis s.l. y L. evansi, la LT lo está con una amplia variedad de especies flebotominas (Scorza 1989). Debido a ésto, consideramos que la importancia epidemiológica de las restantes especies con hábitos antropofílicos capturadas en el presente trabajo, o por otros autores, debe ser establecida en futuros estudios bionómicos más detenidos.
Se debe enfatizar la presencia de L. rangeliana como componente de la fauna flebotómica del estado Falcón. La misma es una especie distribuida hasta los 460 m, en por lo menos 16 estados de Venezuela (Feliciangeli 1988), siendo capturada en el presente trabajo por primera vez en el intervalo altitudinal de hasta los 990 m. Comúnmente, se le consideró de poseer hábitos zoofílicos, especialmente hacia quirópteros y armadillos (Young & Duncan 1994). Sin embargo, Bonfante-Garrido et al. (1999) la refieren como una especie con hábitos moderadamente antropofílicos y con una conducta intradomiciliar y fotofílica, en un estudio llevado a cabo en una casa situada en la periferia de Barquisimeto, estado Lara, en la región occidental de Venezuela. Así mismo, estos investigadores encontraron infectados a 23 especímenes de esta especie con promastigotes que exhibieron características morfológicas y biológicas similares a las de Le. (Le.) venezuelensis. A la luz de estos hallazgos, no debería ignorarse el papel de L. rangeliana como posible vector de LT al humano en las regiones bajas y medias del estado Falcón, a pesar de no habérsele capturado en una abundancia relativa significativa.
En relación con L. nuñeztovari, a pesar de que apenas se capturó un único ejemplar en el piso más elevado, su papel como posible vector de LT en la región falconiana debe dilucidarse con mayores muestreos y estudios eco-epidemiológicos, toda vez que es considerada en Bolivia como vector de Le. (Le.) amazonensis y Le. (V.) braziliensis (Martínez et al. 1999). En este mismo orden de ideas, se deberá establecer en la mayor elevación de la región falconiana (1500 m), el status epidemiológico de L. erwindonaldoi, debido a que es la especie flebotomina más abundante y con una acentuada antropofilia, pero su biología ha sido poco estudiada.
Cuando se analiza la composición de la fauna flebotomina en relación con el hábitat, se tiene que todas las especies se capturaron en los ambientes naturales. Estos resultados sugieren, por una parte, que los flebotominos neotropicales tienen un origen selvático (Feliciangeli 1987b), y, por la otra, que el riesgo de adquirir la leishmaniasis es mayor en los ambientes silvestres, al interrumpir accidentalmente el humano en los focos naturales de la biocenosis. Esta aseveración encuentra apoyo en Añez et al. (1988), quienes llegan a una conclusión similar a la del presente trabajo, al detectar casi el 90% de los flebotominos en sus ambientes silvestres, en un estudio eco-epidemiológico sobre la LT en Mérida, Venezuela. El hecho de haberse capturado dentro de la vivienda humana y sus alrededores el 0,14% y el 31,53%, respectivamente, del total de los flebotominos recolectados apoya la tesis de considerar la transmisión intradomiciliar de las leishmaniasis. Esto se hace más patente en lo relacionado con la LV, donde los infantes resulta el grupo etáreo de mayor riesgo, precisamente por ser el grupo que mayormente permanece dentro de la habitación humana, y que muchas veces el humano puede considerarse un reservorio de los parásitos del género Leishmania.
Agradecimientos
Fundacite-Falcón (Proyecto S197-012), y Decanato de Investigación, UNEFM, Coro, estado Falcón, Venezuela.
Literatura citada
Añez N.,D.Cazorla,E.Nieves, et al. 1988. Epidemiología de la leishmaniasis tegumentaria en Mérida, Venezuela. I.- Diversidad y dispersión de especies flebotominas en tres pisos altitudinales y su posible role en la transmisión de la enfermedad. Mem. Inst. Oswaldo Cruz. 83: 455 – 463.
Añez N.,E.Nieves,D.Cazorla, et al. 1994. Epidemiology of cutaneous leishmaniasis in Merida, Venezuela.
III. Altitudinal distribution, age structure, natural infection and feeding behaviour of sandflies and their relation to the risk of transmission. Ann. Trop. Med. Parasit. 88: 279 – 287.Alexander B., L. Agudelo, F. Navarro, et al. 2001.
Phlebotomine sandflies and leishmaniasis risks in Colombian coffee plantations under two systems of cultivation. Med. Vet. Entomol. 15: 364-373.Bejarano E., S.Uribe, W.Rojas, et al 2001.
Presence of Lutzomyia evansi, a vector of American visceral leishmaniasis, in an urban area of the Colombian Caribbean coast. Trans. R. Soc. Trop. Med. Hyg. 95: 27-28.Bonfante-Garrido R., R.Urdaneta, I.Urdaneta, et al. 1999. Natural infection of Lutzomyia rangeliana (Ortiz, 1952) (Diptera: Psychodidae) with Leishmania in Barquisimeto, Lara State, Venezuela. Mem. Inst. Oswaldo Cruz. 94: 11.
De Lima H., N.Rodríguez, M.Feliciangeli, et al. 2009. Cutaneous leishmaniasis due to Leishmania chagasi/Le. infantum in an endemic area of Guarico State, Venezuela. Trans. R. Soc. Trop. Med. Hyg. 103: 721-726.
De Lima H., R.Borges, J.Escobar, et al. 2010. Leishmaniasis cutánea americana en Venezuela: un análisis clínico epidemiológico a nivel nacional y por entidad federal, 1988-2007. Bol. Mal. Salud Amb. 50: 283-300.
Ewel J., A.Madriz & Jr J.Tosi 1976. Zonas de Vida de Venezuela. Memoria explicativa sobre el mapa ecológico. 4a Ed. Caracas, Venezuela: Editorial Sucre.
Feliciangeli M. 1987a. Ecology of sandflies (Diptera: Psychodidae) in a restricted focus of cutaneous leishmaniasis in nothern Venezuela. I.- Description of the study area, catching methods and species composition. Mem. Inst. Oswaldo Cruz. 82: 119 – 124.
Feliciangeli M. 1987b. Ecology of sandflies (Diptera: Psychodidae) in a restricted focus of cutaneous leishmaniasis in northern Venezuela. II. Species composition in relation to habitat, catching method and hour of catching. Mem. Inst. Oswaldo Cruz. 82: 125 – 131.
Feliciangeli M. 1988. La fauna flebotómica (Diptera: Psychodidae) en Venezuela. I.- Taxonomía y distribución geográfica. Bol. Dir. Malariol. San. Amb. 28: 99 – 113.
Feliciangeli M., N.Rodríguez, A.Bravo, et al. 1994. Vectors of cutaneous leishmaniasis in north-central Venezuela. Med. Vet. Entomol. 8: 317 – 324.
Feliciangeli M., N.Rodríguez, Z.De Guglielmo, et al. 1999. The re-emergence of american visceral leishmaniasis in an old focus of Venezuela. II. Vectors and parasites. Parasite. 6: 113 – 120.
González C., O. Cabrera, L.Munstermann, et al. 2006. Distribution of Leishmania infantum vector species in Colombia. Biomédica. 26 (Suppl 1): 64- 72.
Martínez E., F. Le Pont, M. Torrez, et al. 1999. Lutzomyia nuneztovari anglesi (Le pont & Desjeux, 1984) as a vector of Leishmania amazonensis in a sub-Andean leishmaniasis focus of Bolivia. Am. J. Trop. Med. Hyg. 61: 846-849.
Mogollón J., P.Manzanilla & J.Scorza 1977. Distribución altitudinal de nueve especies de Lutzomyia (Diptera: Psychodidae) en el estado Trujillo, Venezuela. Bol. Dir. Malariol. San. Amb. 17: 206 – 229.
Perruolo G. 1984. Ecología de los flebotomos (Diptera: Psychodidae) y su influencia sobre la leishmaniasis tegumentaria en zonas endémicas del estado Táchira. Kasmera. 12: 74 – 95.
Pifano F. & J.Romero 1973. Comprobación de un foco autóctono de leishmaniasis visceral (kala-azar) en la isla de Margarita, Estado Nueva Esparta, Venezuela. Med. Trop. & Parasitol. Méd. 5: 134 – 143.
Ramírez-Pérez J., G.Rodríguez & A.Ramírez. 1982. Estudio de la fauna flebotómica del estado Sucre (Venezuela). Bol. Dir. Malariol. San. Amb. 22: 11 – 22.
Scorza J. 1989. Información ecológica sobre Phlebotominae de Venezuela. Bol. Dir. Malariol. San. Amb. 29: 1 – 10.
Valle S. & P.Espinoza. 2006. Fluctuación poblacional e impacto de la aplicación de dos piretroides contra vectores de leishmaniasis cutánea atípica en la localidad de Apompúa, Departamento de Chontales (1998-1999). Rev. Nic. Entomol. 66: 1-8.
Young D. & M.Duncan. 1994. Guide to the identification and geographic distribution of Lutzomyia sand flies in Mexico, the West Indies, Central and South America (Diptera: Psychodidae). Memories of the American Entomological Institute, Number 54. Associated Publishers, Gainesville, Florida, Estados Unidos de América.
Zerpa O., M.Ulrich, R.Borges, et al. 2003. Aspectos epidemiológicos de la leishmaniasis visceral humana y canina en Venezuela. Rev. Panam. Salud. 13: 239 – 245.
*Autor para correspondencia:
Email: lutzomyia@hotmail.com
Presentado: 03/01/2012
Aceptado: 15/08/2012
Publicado online: 01/10/2012













