Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.19 no.3 Lima dic. 2012
NOTA CIENTÍFICA
Introducción y multiplicación in vitro del cultivo de ajo variedad Morado Barranquino
Introduction and multiplication in vitro of garlic culture var. Morado Barranquino
Karina Carhuaricra E. 1*, Julio Olivera S. 2, Javier Gonzales A. 1 y Juan Rodríguez L. 1
1 Universidad Nacional Daniel Alcides Carrión - Facultad de Ciencias Agropecuarias. Ciudad Universitaria km 3 Carretera Central Miraflores – Oxapampa.
2 Estación Experimental Agraria DONOSO -Instituto Nacional de Innovación Agraria. Altura km 5,4 de la Carretera Chancay – Huaral.
*Email: karinavicares@hotmail.com
Resumen
En este trabajo determinamos el efecto de medios de cultivo modificados usando diferentes concentraciones de reguladores de crecimiento (auxinas/citoquininas) para la regeneración y multiplicación in vitro del ajo (Allium sativum L.) variedad Morado Barranquino. En la fase de introducción se cultivó meristemos apicales en tubos de prueba hasta su regeneración y se determinó que el medio MSM + AIB 0,6 mg/L es el más adecuado para la diferenciación y desarrollo del meristemo. Para la multiplicación se utilizaron las microplantas (13 semanas) de la fase de introducción, obteniéndose formación de macollos en cada subcultivo; se logró mejor tasa de multiplicación en el medio MMA + AIA 2,5 mg/L + KIN 5 mg/L y el medio MSM + 2ip 1,5 mg/L con 4,71 y 4.79 respectivamente.Palabras claves: Allium sativum; explante; in vitro; meristemo caulinar; subcultivo.
Abstract We determine the effect of modified culture medium using different growth regulators concentrations (auxins / cytokinins) for regeneration and propagation of in vitro garlic plants (Allium sativum L.) var. ‘Morado Barrranquino’. In the introduction stage meristem tips were cultured in test tubes up to regeneration. It was determined that medium MSM + IBA 0.6 mg/L was most suitable for the meristem tip differentiation and development. 13 weeks old microplants obtained on introduction stage were used for multiplication, obtaining the formation of a cluster after each subcultive. The best multiplication ratio was obtained in MMA medium + IAA 2.5 mg/L + KIN 5.0 mg/L and MSM medium + 2iP 1.5 mg/L with 4.71 and 4.79 respectively.
Keywords: Allium sativum; explants; in vitro; meristem caulinar; subcultive.
Introducción
El ajo Allium sativum L., en el Perú es considerado una hortaliza importante por las excelentes cualidades para la salud y gastronomía, por este motivo dentro de la Comunidad Andina se ha incrementado la superficie para su producción (MINAG 2008). La variedad Morado Barranquino presenta un periodo vegetativo de 5,5 a 6 meses, nativo de la localidad de Barranca (norte de Lima), presenta las mejores características comerciales de bulbo, (circular perfecto), con bajo número de dientes, compactos, homogéneos (máximo 13 – 14), las túnicas tienen una coloración morada a rosada (Nicho et al. 2005).El ajo, aunque es una planta anual, presenta la limitante de que sólo se reproduce de forma asexual (Conci & Vilmas 1991); esto lleva a que, en ciclos sucesivos de cultivo, se produzca una acumulación del inóculo de muchos patógenos como, hongos, bacterias y principalmente virus; ocasionando la reducción de los rendimientos y la calidad, en consecuencia pérdidas económicas. Una alternativa para evitar estos problemas de sanidad, es el uso de la técnica del cultivo de tejidos que permite obtener plántulas libres de patógenos.
Mujica y Mogollón (2004) estimularon la bulbificación in vitro de ajo morado con la adición de citoquininas y sacarosa. Así mismo, Mujica et al. (2008) indujeron la bubificación in vitro del ajo morado, posteriormente realizaron estudios histológicos con el propósito de conocer el origen de los órganos regenerados y cambios anatómicos. Izquierdo y Gómez (2010) seleccionaron genotipos de ajo de más alto rendimiento, del cual el genotipo criollo-3 fue saneado de los virus que afectan al cultivo en la Habana y propagado in vitro. El clon mostró un buen comportamiento agronómico a las plagas, un elevado rendimiento y buena calidad de la semilla.
Pardo et al. (2011) establecieron un protocolo para la regeneración de plantas a partir de segmentos de hojas y raíces. Determinaron el efecto de la combinación de auxinas y citoquininas, así como la influencia del tipo de explante y su posición en la microplanta sobre la inducción de callos y su posterior regeneración a brotes. Los explantes extraídos de la sección apical de las raíces favorecieron la regeneración de callos, en comparación con segmentos basales de las hojas
Aunque existen medios de cultivo establecidos para diferentes variedades de ajo, para la obtención de plantas in vitro del ajo Morado Barranquino aún no existe trabajos publicados al respecto. Por lo tanto, se hace necesario establecer los medios adecuados para cada etapa del proceso, probando diferentes medios, variando los componentes, como los reguladores de crecimiento (auxinas/citoquininas) para la micropropagación in vitro para este cultivar con cualidades de exportación. Además, el material libre de patógenos podría ser llevado a las regiones del Perú productoras de ajo como Arequipa, Cajamarca, La Libertad, Lima, Ayacucho y Junín; y conllevaría a lograr la producción potencial del cultivo de ajo (24 t/ha) utilizando semillas certificadas provenientes del cultivo in vitro (Olivera, 2009). Por estos motivos, el presente trabajo tuvo como objetivo determinar los efectos de medios básicos modificados con diferentes concentraciones de reguladores de crecimiento (auxinas/citoquininas) en el desarrollo y crecimiento in vitro del ajo (Allium sativum L.) variedad Morado Barranquino.
Material y métodos
El trabajo fue realizado en el Laboratorio de Biotecnología del Instituto Nacional de Innovación Agraria – INIA, Estación Experimental Donoso - Centro de Investigación y Capacitación Hortícola Kiyotada Miyagawa, mediante el diseño completamente aleatorizado (DCA), con cuatro y siete repeticiones en la fase de introducción y multiplicación respectivamente; los tratamientos se muestran en la Talab 1 y Tabla 2.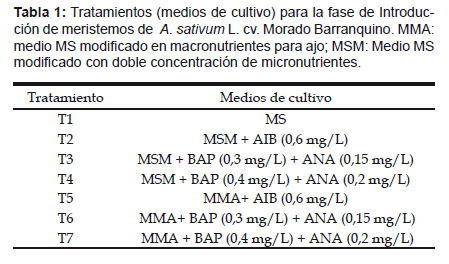
En las dos fases se realizaron modificaciones de los medios básicos, para obtener el medio MSM (MS con doble concentración en micronutrientes), y el medio MMA (MS con NaH
2PO4 255 mg/L; KNO3 5700 mg/L; CaCl2.2H2O 440 mg/L; MgSO4.7H2O 370 mg/L y NH4H2PO4 150 mg/L), a éstos se agregaron 3% de sacarosa, 0,8% de agar, ajustándose el pH a 5,6±0,1 en la fase de introducción, y 5,7±0,1 para la fase de multiplicación. Los reguladores de crecimiento fueron agregados en las cantidades que se muestran en las Tabla 1 y Tabla 2, luego se esterilizaron en autoclave a 121 °C y 1,2 kg/cm2 durante 20 minutos.Las condiciones del cultivo in vitro fueron: temperatura de 23 – 24 °C, humedad relativa 80%, luminosidad de 45 µmol.m2.seg-1 y fotoperiodo de 16 horas luz.
Los meristemos caulinares (explante) fueron extraídos de bulbos grandes y con madurez fisiológica con 2/3 de brotación; previamente se desgranaron los dientes de ajo para la remoción de cutícula, luego se cortaron en forma rectangular, los que se lavaron superficialmente con agua y jabón y fueron llevados a la cámara de flujo laminar previamente desinfectada con alcohol al 86%, para la desinfección en magentas estériles con etanol al 70% durante 30 segundos, seguidamente con NaOCl (Hipoclorito de sodio) al 20% más 3 gotas de la solución Tween 20, por un período de 12 minutos; en ambos casos la soluciones cubrieron los explantes, finalmente fueron lavados con agua destilada estéril por tres veces.
Fase de introducción de meristemos.- El meristemo (explante) utilizado en esta fase estuvo constituido por el domo meristemático y un primordio foliar; utilizando un microscopio estereo, fueron extraídos y se sembraron cada uno en 10 mL de medio de cultivo (tratamientos) contenido en tubos de ensayo (25 x 150 mm), luego se colocaron en gradillas y llevadas a la sala de crecimiento, por cuatro semanas y posteriormente se realizaron tres subcultivos cada tres semanas. Las variables evaluadas prendimiento de meristemo, presencia de raíces y longitud de raíces y altura de microplanta; las lecturas han sido tomadas en la cuarta, octava y decimotercera semana respectivamente.
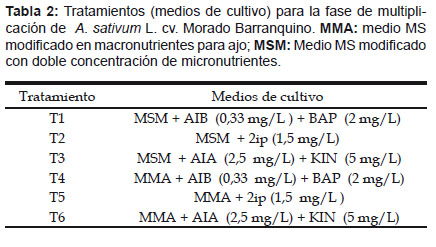
Fase de multiplicación.- Los explantes utilizados en esta fase fueron de las microplantas de la fase de introducción, sembrados en frascos de vidrios con tapa de aluminio conteniendo los diferentes medios, Tabla 2; cada quince días después de la siembra, se separaron brotes de las microplantas con el fin de obtener mayor cantidad de explantes. Las variables evaluadas fueron número de días de formación de brotes, número de brotes por explante por ciclo y altura de macollo, y longitud de raíces; los datos se registraron a los diez días, quince días y sesenta días respectivamente.
Resultados y discusiónFase de introducción.-
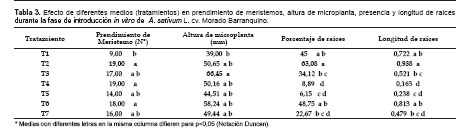
Los resultados obtenidos del efecto de diferentes medios (tratamientos) en el cultivo in vitro de ajo A. satiuvm L. var. Morado Barranquino, sobre prendimiento de meristemos, altura de microplanta, porcentaje y longitud de raíces en la fase de introducción, se muestran en la Tabla 3. El mayor prendimiento se ha presentado en el T2, T4, y T6 he igual a T7, T5, T3 y el menor a correspondido al T1, la mayor regeneración en estos tratamientos concuerda con lo señalado por Conci et al. (1986) que, las respuestas del desarrollo de meristemos en el medio de cultivo Murashige y Skoog (MS), varían dependiendo del cultivar. En cuanto al T4 y T6 el prendimiento de mayor numero de explantes se debería a la presencia de ANA; al respecto, Bovo y Mroginske (1985), señalan que la adición de 100 mL/L de mio-inositol en MS suplementado con 0,1 ó 0,01 mL/L de ANA duplican el porcentaje del desarrollo de meristemos de ajo que originan plantas enteras. El mayor prendimiento el T2, respecto al T1 a la presencia de auxina AIB; Jiménez (1998) indicó que los ápices y meristemos que son empleados como material inicial para el cultivo in vitro, son áreas de síntesis de auxinas por lo que la concentración endógena es alta y que normalmente cuando se emplean ápices no se adicionan auxinas al medio de cultivo aunque estos pueden estimular el crecimiento, pero cuando se emplean meristemos es frecuente que no exista suficiente auxina endógena siendo necesaria la adición exógena.Las alturas de microplantas han variado desde 39 mm en T1 hasta 66,45 mm en el T3, Tabla 3, la mayor altura de microplanta se ha presentado en el T3 estadísticamente igual a T7, T5, T3, T2, T4, T6 y el menor ha correspondido al T1.
En cuanto a los tratamientos T3 (MSM + BAP 0,3 mL/L +ANA 0,15 mL/L)que presenta mayor altura de microplanta con respecto al testigo; resultado similar reporta Olivera (2009), usando diversos cultivares de ajo empleando meristemos como explantes, en el medio de cultivo MS, sin embargo con mayor concentración de reguladores de crecimiento (BAP 0,5 mL/L y ANA 0,1 mL/L), obtuvo microplantas en el rango de 50 a 60 mm de longitud en un lapso de ocho a diez semanas dependiendo del cultivar; resultado que indicaría el efecto favorable de los micronutrientes en el crecimiento de las microplantas, en comparación a los reguladores de crecimiento. Esto concuerda con Margara (1988), quien menciona que los microelementos resultan ser indispensables para el crecimiento, intervienen como activadores (eventualmente como constituyentes) de diversos sistemas enzimáticos; a veces los microelementos se utilizan a concentraciones más elevadas con el objetivo de provocar una activación de crecimiento.
El porcentaje de raíces concuerda con la longitud, Tabla 3, este resultado se debería a que existiría una correlación entre el tiempo de aparición y el crecimiento. El tratamiento T2 es superior a T3, T5, T7 pero estadísticamente igual a T6 y T1.
La regeneración y longitud de raíces en el T2 se debió a la doble concentración de micronutrientes y a la auxina (AIB), lo que favorecería la presencia de raíces, en menor tiempo y mayor proporción, en contraste con los otros tratamientos ensayados. Por lo que se acepta la teoría de George, (1996) que indica que a mayor concentración de auxina que citoquininas o la ausencia de esta última, dará origen a la formación de raíz en la microplanta. Margara (1988) menciona, cuando se trata de una organogénesis (neoformación de raíces), no resulta evidente que medios como MS sean favorables para este equilibrio. Es posible que algunos macro-microelementos (N, K, Zn, Mn, etc.) aportados a concentraciones relativamente elevadas actúen activando preferentemente algunos sistemas enzimáticos.
Así mismo el tratamiento T6, que constaba de Murashige y Skoog modificado en sus compuestos de macronutrientes, suplementado con BAP (0,3 mg/L) y ANA (0,15 mg/L), logro una longitud de raíz con promedio de 5,93 mm ocupando el tercer lugar en longitud de raíz, lo que se podría decir que el crecimiento se debería a la interacción que existe en las concentraciones de auxina/citoquinina, además de la función del fosfato de amonio y nitrato de potasio sobre el crecimiento de la raíz, coincidiendo con Margara (1988), que el empleo de medios ricos en nitrógeno (N nítrico y amoniacal) y potasio K estimulan sobre la organogénesis (neoformación de raíces).
Por otro lado, el tratamiento T4 que ha mostrado menores valores en presencia y longitud de raíces, al resto de los tratamientos, se debería a la alta concentración de la citoquinina frente a la auxina, lo que inhibe la regeneración y elongación de la raíz, al respecto Ayerbe y Sagasta (1990) señalan que, en concentraciones elevadas de citoquininas entre 1 y 10 mL/L, generalmente inhiben la formación de raíces. El medio que ha resultado más prometedor para la fase de introducción en el cultivo de ajo ha sido el tratamiento T2, Figura 1a.
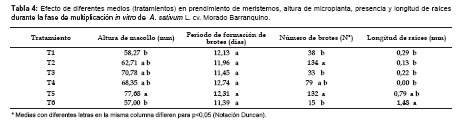
Fase de multiplicación.- Los resultados de altura de macollo, periodo de formación de brotes, numero de brotes y longitud de raíces, se muestra en la Tabla 4; el tratamiento T5 ha sido igual estadísticamente a T3, T4 y T2 y superior a T6 y T1, esto demuestra que las microplantas de ajo Morado Barranquino tiene diferentes respuestas en el desarrollo y crecimiento de macollo, que se debería a la baja concentración y ausencia de auxinas, frente a la citoquinina, debido a que la morfología del tallo del ajo (masa cónica), solamente es suficiente el aporte de citoquininas para el desarrollo de las hojas; al respecto Hurtado y Merino (1992) indican que las citoquininas inhiben la elongación del tallo, pero estimulan el alargamiento de las hojas, así mismo Margara (1988), menciona que las altas concentraciones de macronutrientes como fosfato de amonio, nitrato de potasio influyen en el desarrollo del macollo presente en el T5.
En cuanto al periodo de formación de brotes no existe efecto diferencial entre los medios, lo que indicaría que el agregado de los macroelementos-microelementos mas los reguladores de crecimiento (auxina/citoquinina), no tiene efecto alguno sobre esta variable; ésta es importante en la fase de multiplicación, porque de ella dependerá obtener en el menor tiempo, mayor número de microplantas.
El número de brotes por ciclo los tratamientos T2, T5 fueron superiores al T1, T3, T6 e iguales estadísticamente al T4, esto se debería a que los medios de cultivo T5 y T2 contenían el regulador de crecimiento 2ip (1,5 mL/L) que coincide con Ravnikar et al. (1993) y Moriconi et al. (1990) quienes indican que en la etapa de multiplicación obtuvieron mejores resultados utilizando como regulador 2ip. Así mismo, Olivera (2009) en las variedades de ajo “Arequipeño” y “Napuri” ha determinado que el 2ip en concentraciones de 6 mL/L a 10 mL/L logró la mejor respuesta de macollamiento de las microplantas. Por tanto, los resultados de los tratamientos T2 y T5 se debieron al efecto de la citoquinina (2ip) en la regeneración de brotes; al respecto Hurtado y Merino, (1992) señalan el efecto de la citoquinina en el retraso de la dominancia apical y teniendo un papel fundamental en la organogénesis, ya que pueden inducir la formación de yemas en tejidos in vitro de callo, hojas, raíces, cotiledones o piezas de tallo. El coeficiente de multiplicación durante los siete ciclos, los tratamientos T2 (4,79) y T5 (4,71) lograron un alto coeficiente de multiplicación frente al resto de los tratamientos (Figura 1b y c). El número de brotes es fundamental durante la fase de multiplicación ya que a mayor número de brotes se tendrá una mayor tasa de multiplicación.
La longitud de raíces, el T6 ha sido superior a T1, T2, T3, T4 pero igual estadísticamente a T5. Respecto al tratamiento T6, coincide con los resultados de Bustamante y Muñoz (1993) usando MS conteniendo KIN o BA en 0,5; 1,0 y 2,0 mg/L + 0,1 mg/L de ANA en el cultivo in vitro de ajo, encontraron que el porcentaje de explantes con raíces y el número de raíces por explante fueron superiores con KIN, que con BA, sin embargo morfológicamente las microplantas fueron superiores con KIN, especialmente en la más bajas concentraciones.
Literatura citada
Ayerbe M.L. & J. Sagasta. 1990. Cultivo in vitro de las plantas superiores, Editorial Mundi - Prensa. Madrid – España.Bovo O.S. & L.A. Mroginski. 1985. Obtención de plantas de ajo (Allium sativum L.) por cultivo in vitro de meristemos En Fyton. Berkeley, Estados Unidos. 159-163 p. Phyton 45(2):159-163
[ Links ]Bustamante M. A. & A. Muñoz. 1993. In vitro culture of garlic in response to Cytokinins and auxin. In vitro cellular y Animal. Vol. 29/A N°3, Part III Journal of the tissue culture Association. [ Links ]
Conci V.C. & A. Vilmas.1991. Virus free garlic (Allium sativum L.) plants obtained by thermotherapy and meristem tip culture. J. Phytopathology 70-76 p. [ Links ]
Conci V.C., D.N. Moriconi & S.F. Nome. 1986. Cultivo de meristemos apicales de seis tipos de clonales de ajo Allium sativum L. Phytun 46 (2):187-194
[ Links ]George E.F. 1996. Plant Propagationby tissue culture, Segunda parte in practica, segunda edición. Madrid – España 653-667 p.
Hurtado M.D. & M.V. Merino. 1992. Cultivo de tejidos vegetales. Editorial Trillas. México. 30-47 p. [ Links ]
Izquierdo H. & O. Gómez. 2010. informe de nuevas variedades crollo-3, un genotipo de ajo de elevada productividad. Cultivos tropicales, vol. 31. N°3, p.58 http://www.inca.edu.cu/otras_web/revista/pdf/2010/3/(3)2010_58.pdf. Acceso 22/12/2011
[ Links ]Jiménez E. 1998. Cultivo de ápices y meristemos. En J. Pérez (Ed.), Propagación y mejora genética de plantas por biotecnología (pp. 45-56). Cuba. Ediciones GEO. [ Links ]
Margara J.M. 1988. Multiplicación vegetativa y cultivo in vitro Los Meristemos y la Organogénesis. Editorial Mundi - Prensa. Madrid – España. 99-110 p.
MINAG (Ministerio de Agricultura). 2008. Situación Actual de la producción de ajo. http://www.minag.gob.pe/download/pdf/herramientas/boletines/ajo.pdf. Acceso 10/09/2011
[ Links ]Moriconi D.N., V.C. Conci & S.F. Nome. 1990. Rapid Multiplication of Garlic (Allium sativum L.) in vitro. En: Phyton. Berkeley, Estados Unidos. 145-151 p. [ Links ]
Mujica H. & N. Mogollón. 2004. bulbificación in vitro del ajo (Allium sativum L.) con adición de citoquininas y sacarosa en el medio de cultivo. Bioagro 16(1):55-60. [ Links ]
Mujica H., M.E. Sanabria, N. Mogollón & Y. Perozo. 2008. formación in vitro del bulbo del ajo morado (Alium sativum L.). Rev. Fac. Agron. (LUZ). 2008, 25: 197-210. [ Links ]
Nicho S.P., V.J. Loayza, J. B. Cahuas, & C. R. Cosme. 2005. Descripción agronómica de cultivares de ajo (Allium sativum L. ssp. vulgare) bajo condiciones del valle de Huaral, Serie Boletín técnico N° 01-05, Lima – Perú. 12-13 p.
Pardo A., F. Luna & N. Hernández. 2011. Regeneración in vitro de Allium sativum L. a partir de segmentos de hojas y raíces. Bioagro 23(3):207-214
[ Links ]Olivera S.J. 2009. Técnica de producción de semilla genética y básica de ajo (Allium sativum L.) libre de virus, Serie Folleto Nº 6-09, Lima – Perú. 2-10 p.
Ravnikar M., J. Zel, I. Plaper, et al. 1993. Jasmonic Acid Stimulates Shoot and Bulb Formation of Garlic In Vitro. En: Journal of Plant Growth Regulation. 12: 73-77 p. [ Links ]