Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.20 no.1 Lima set. 2013
Ecología del jurel (Trachurus murphyi) en el Perú
Ecología trófica del jurel Trachurus murphyi en el Perú entre 1977 – 2011
Trophic ecology of Jack mackerel Trachurus murphyi in Peru, 1977 – 2011
Ana Alegre, Pepe Espinoza y Marco Espino
Instituto del Mar del Perú, esquina Gamarra y General Valle S/N Chucuito, Callao, Perú.
Email Ana Alegre: palegre@imarpe.gob.pe
Resumen
Se analizó la variabilidad espacio-temporal de la dieta de jurel Trachurus murphyi frente a Perú de 1977 a 2011. Un total de 21058 estómagos fueron analizados utilizando métodos bivariados y el Modelo de Árbol de Regresión Multivariado (ARM). Se utilizó como variable respuesta la composición gravimétrica de la dieta, con respecto a diferentes variables pre dictivas como años, profundidad de la isoterma de 15 °C, Índice de Oscilación del Sur (IOS), Índice de Oscilación Decadal del Pacífico (PDO), anomalía de la temperatura superficial del mar, zona (norte, centro y sur) y distancia de la costa. Nuestros resultados nos permitieron identificar dos escenarios diferentes, uno desde el año 1977 al 2000, donde la dieta del jurel T. murphyi estuvo fuertemente dominada por Euphausiidae, y otro escenario después del 2000, donde el jurel T. murphyi consumió mayor diversidad de presas, principalmente Euphausiidae, camaroncito rojo Pleuroncodes monodon y Zoeas. Se destaca que el primer escenario corresponde a condiciones cálidas y el segundo a condiciones frías, ambas coincidentes con los periodos multidecadales. A diferencia de estudios anteriores que muestran que la anchoveta Engraulis ringens es una presa abundante, en este estudio no fue significativamente importante. Espacialmente, los Euphausiidae dominaron la dieta en el norte-centro de Perú, mientras que al sur, la composición de las presas fue más diversa. La dieta también varió significativamente según la distancia a la costa, con mayor proporción de P. monodon cerca a la costa y con respecto a su etapas de desarrollo ontogenético.Palabras clave: Jurel, alimentación, Perú.
Abstract We analyzed the spatiotemporal variability of Jack mackerel Trachurus murphyi diet off Peru from 1977 to 2011. A total of 21058 stomachs were analyzed using bivariate methods and the Multivariate Regression Tree Model (MRT). The gravimetric composition of the diet was used as response variable with respect to different predictor variables such as years, depth of the 15°C isotherm, Southern Oscillation Index (SOI), Index of the Pacific Decadal Oscillation (PDO), sea surface temperature anomaly, zone (north, center and south) and distance to the coast. Our results allowed us to identify two different scenarios. From 1977 to 2000 the Jack mackerel T. murphy diet was strongly dominated by Euphausiidae, and since 2000 when T. murphyi consumed a greater diversity of prey, mainly Euphausiidae, squat lobster Pleuroncodes monodon and Zoea. It is noted that the first scenario corresponds to warm conditions and the second to cold conditions, both coincident with observed multidecadal periods. In contrast to previous studies showing that the anchovy Engraulis ringens is an abundant prey, in this study anchovy was not significantly important. Spatially, the Euphausiidae dominated the diet in central-northern Peru, while further south the prey composition was more diverse. The diet also varied significantly according to the distance from the coast (higher proportion of P. monodon closer to the coast) and the ontogenic stages.
Keywords: Jack mackerel, food, Peru.
Introducción
El jurel Trachurus murphyi Nichols 1920 es uno de los componentes de la red trófica marina peruana que se asocia principalmente con el subsistema pelágico oceánico, y junto a la anchoveta Engraulis ringens, sardina Sardinops sagax sagax y caballa Scomber japonicus han posibilitado el desarrollo de una de las principales actividades pesqueras del ámbito mundial, localizada frente al Perú.Cada vez con mayor frecuencia se recomienda que los administradores pesqueros deban tener en cuenta las más amplias consideraciones ecológicas en el manejo de los stocks de peces explotados (Botsford et al. 1997). Dentro de las consideraciones ecológicas, se menciona que las relaciones tróficas de las especies de importancia comercial representan uno de los principales aspectos a estudiar.
Un método común para estudiar las relaciones tróficas es el que se basa en los análisis de los contenidos estomacales (Caddy & Sharp 1988). Mediante este método, se puede conseguir información de utilidad que nos aproxime a cuantificar el flujo de energía en la red trófica marina, identificándose las especies de mayor relevancia en dicha estructura, sea como predadores o presas.
Trachurus murphyi ha sido definido como un depredador del zooplancton y de peces pelágicos tales como la anchoveta E. ringens (Sánchez de Benites et al. 1985). También, se le ha definido como un predador facultativo en el ecosistema pelágico de Perú (Konchina 1980 y 1983) debido a su naturaleza migratoria, que lo lleva a acceder a ambientes neríticos y oceánicos epipelágicos para alimentarse (Medina & Arancibia 2002). En los últimos años se han observado cambios notables en las capturas, así como en la abundancia, distribución y disponibilidad espacial del jurel, lo que ha llevado a interrogarnos sobre las posibles consecuencias en su rol trófico. En el presente estudio se postula que el jurel T. murphyi es una especie altamente plástica en su dinámica de alimentación y para entender su rol trófico se analiza la información colectada para el mar peruano desde 1977 a 2011.
Material y métodos
Muestreo.- La muestra está conformada por datos de 21058 estómagos de jurel T. murphyi de los cuales en 8693 (41,3%) se encontró contenido. Las muestras de estómagos fueron colectadas de los cruceros de investigación de IMARPE, operaciones Eureka y la flota industrial, cuyas capturas se realizaron a lo largo de todo el litoral peruano (zonas de Paita, San José, Chimbote, Huacho, Callao, Pisco e Ilo), desde 1,5 a 205 mn de distancia a la costa, desde 1977 a 2011 (Fig. 1).
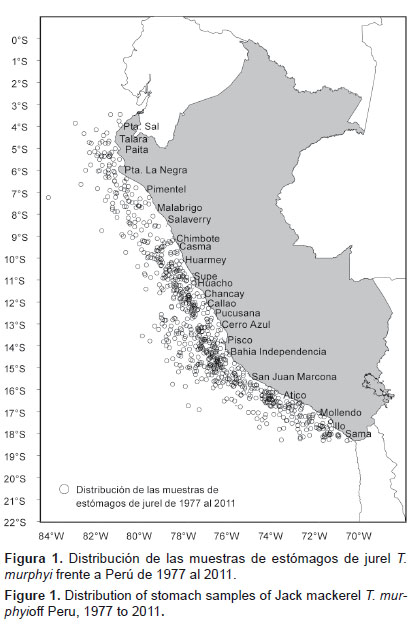
La colecta de estómagos se efectuó de manera estratificada, para lo cual se consideraron todos los rangos de talla registrados en el momento de la captura, en las principales zonas de pesca. Las muestras colectadas entre 1977 y 1992 provienen de operaciones Eureka y cruceros de investigación de recursos pelágicos y las muestras colectadas de 1994 al 2011 son procedentes de la flota industrial.
Los estómagos colectados en la zona del Callao fueron fijados en alcohol al 96% y los estómagos procedentes de los laboratorios costeros (San José, Chimbote, Huacho, Callao, Pisco e Ilo), cruceros de investigación y operaciones Eureka fueron fijadas en formol al 10%.
Análisis de las muestras.- Los contenidos estomacales fueron pesados con precisión al 0.01 g y las presas fueron diferenciadas con microscopio estereoscópico al 10X de aumento, llegando al mínimo taxón posible mediante el empleo de listas y claves taxonómicas especializadas para teleósteos (Fitch & Brownell 1968, García-Godos 2001, Chirichigno 1998), cefalópodos (Wolf 1984), crustáceos (Newel 1963, Méndez 1981), zooplancton (Trégouboff & Rosse 1957) y moluscos (Álamo & Valdivieso 1987).
Tratamiento de los datos
Composición de la dieta.- El índice gravimétrico fue calculado como el porcentaje en peso de las presas (Berg 1979, Hyslop 1980) y agrupadas según años (de 1977 al 2011) por intervalos de talla (cada 10 cm), estadios de madurez (8 estadios), latitud (por estratos de 1°S) y distancia a la costa (desde la línea de costa, por estratos de cada 10 mn):
–1*100%P = pp * pt
Donde:
%P = índice gravimétrico (%)
pp = peso de la presa (g)
pt = peso total del depredador (g)
Índice de llenura estomacal.- Con respecto al peso eviscerado para cada individuo, el índice de llenura estomacal se calculó mediante la fracción del peso de contenido estomacal, de acuerdo a la relación de Hureau (1970), modificado por Rasero et al. (1996):
F= (pce * 100) / (pt – pce)
Donde:
F = índice de llenura estomacal (%)
pce = peso de contenido estomacal (g)
pt = peso total del individuo (g)
En función a este índice se agrupó la información disponible calculando la media aritmética (sin considerar los estómagos vacíos), según latitud, distancia a la costa y talla. Con esta información se realizaron comparaciones múltiples entre el índice de llenura estomacal en función a talla (cada 10 cm), estadios de madurez, latitud (por estratos de 1°S) y distancia a la costa (desde la línea de costa por estratos de 10 mn), para validar los resultados de estas comparaciones se utilizó la prueba estadística no paramétrica de Kruskal-Wallis (Iman et al. 1975).
Árbol de Regresión Multivariado.- Este método forma grupos homogéneos respecto al comportamiento de variables predictivas con respecto a la variable respuesta (De’ath & Fabricius 2000). La ventaja de usar este método es que no es necesario que las variables tengan una distribución normal (Zuur et al. 2009) lo que se ajusta muy bien a los datos de contenido estomacal. El proceso de determinar el mejor tamaño de árbol es llamado “poda” (Breiman et al., 1984). La poda del árbol se puede llevar a cabo mediante varios criterios. Un criterio primario es utilizar el parámetro de complejidad (cp). El cp es un parámetro de aviso y está especificado de acuerdo a la fórmula:
RSScp=RSS+CP * size of tree
RSS es la suma de los cuadrados de los residuos y size of tree es el tamaño del árbol (número de divisiones más 1). Un valor de cp=1 resultará en un árbol sin divisiones. El valor de cp=0.01 es un valor razonable para una poda inicial del árbol, pero algunas veces se sobreestima la poda sobre todo para conjuntos grandes de datos. Sin embargo, se puede obtener podas más confiables optimizando el valor de cp mediante validación cruzada (CV). Para el presente trabajo, se usó como variable respuesta la composición de grupos dietarios en proporción gravimétrica denominada “Grupo” y como variables predictivas el año, profundidad de la isoterma de 15 °C, Índice de Oscilación Decadal del Pacífico (PDO), zonas (norte, centro y sur) y distancia a la costa en millas náuticas(mn). Donde:
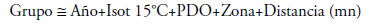
Resultados
Cambios en la dieta
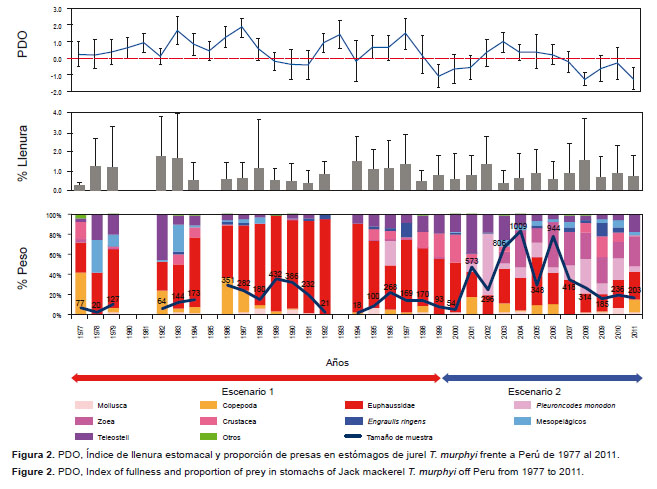
1. Temporales.- En términos de porcentaje en peso húmedo, la composición de la dieta varió con respecto al tiempo. En la Figura 2 se observan dos escenarios en la composición de la dieta en términos de porcentaje en peso húmedo: el primero que comenzó en 1977 hasta el año 2000, siendo la especie dominante los Euphausiidae (%W≤ 96.0), después del periodo interdecadal cálido y el ENSO 1997-98 (Chávez et al. 2008). A partir del 2000 aumentó la proporción de zoeas (%W≤ 45.1) y P. monodon (%W≤ 61.8), indicador de Aguas Costeras Frías (ACF), mientras que la presencia de Euphausiidae disminuyó (%W≤ 55.8) sin dejar de ser representativa. El índice de llenura fue variable en todo el periodo de estudio (p-valor < 0.0001; H15= 408.79) (Fig. 2).
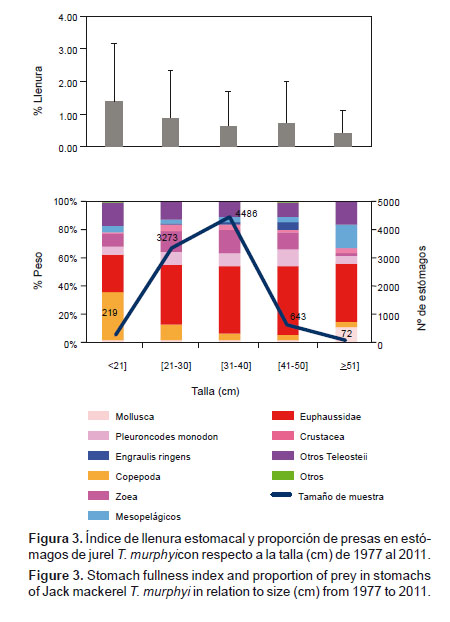
2. Según la talla.- Respecto de la talla, en los individuos menores de 21 cm de LT, la dieta estuvo compuesta mayormente por Copepoda (%W= 34.0), la proporción de Euphausiidae fue aumentando con la talla hasta los 50 cm de LT (%W= 27.0 – 49.5). A partir de 51 cm de LT, aumentó la ingesta de peces mesopelágicos (%W= 15.8), otros Teleosteii (%W= 16.9) y Mollusca (%W= 10.8). El índice de llenura estomacal disminuyó en relación al incremento del tamaño (p-valor < 0.0001; H4= 217.14) (Fig. 3).
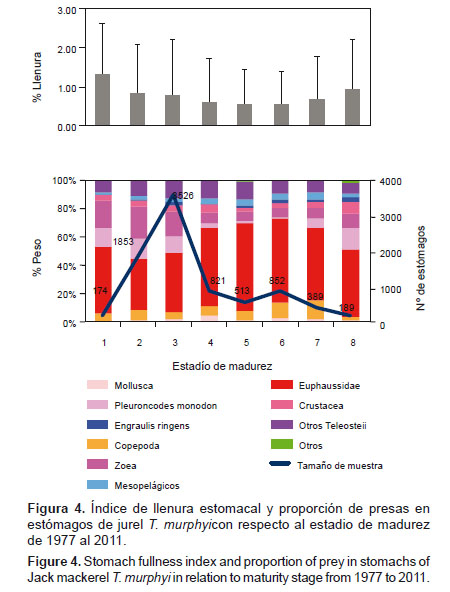
3. Según el sexo y madurez gonadal.- No se presentan diferencias según el sexo en la composición de la dieta. Sin embargo, se observan ligeros cambios respecto al índice de llenura estomacal, que fue mayor en los machos (p-valor< 0.0001; H1= 34.37). La dieta respecto a la madurez tuvo un comportamiento similar a lo observado con la talla, pero se puede apreciar que en los estadios del 1 al 3, la proporción de zoeas (%W= 18.1 – 22.2) y P. monodon (%W=11.4 – 14.2) son más altas que en los siguientes estadios de madurez. La proporción de Euphausiidae fue alta en los estadios del 4 al 6 (%W= 55.0 – 59.9). El índice de llenura disminuyó desde el estadio 1 al estadio 6, a partir del cual se aprecia un ligero aumento (p-valor < 0.0001; H7= 131.46), lo que corresponde al periodo de desove y recuperación (Fig. 4).
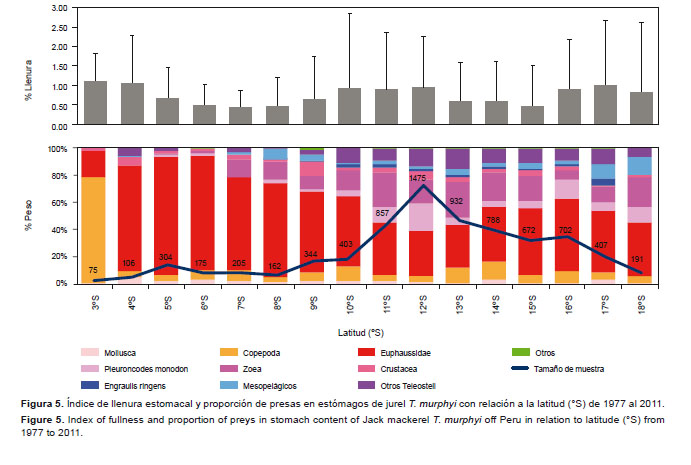
4. Según la distribución espacial.- En la Figura 5, con relación a la latitud, se observó que los Copepoda fueron las presas más destacadas (%W= 77.9) en los 03°S. Esta zona está fuertemente influenciada por las Aguas Ecuatoriales Superficiales (AES) y las Aguas Superficiales Tropicales (AST) (Morón et al. 2001). A partir de la ampliación de la plataforma continental (de 04 a 09°S), los Euphausiidae constituyeron las presas dominantes (%W= 59.1 – 86.8). En la zona centro-sur, la dieta se tornó más variada, las zoeas (%W= 7.5 – 25.7) y P. monodon (%W= 4.6 – 20.0) fueron muy importantes. En el sur, entre los 17 y 18°S, se observó un ligero aumento de peces mesopelágicos (%W= 10.7 – 12.8); asimismo, el índice de llenura estomacal a lo largo del litoral fue variable (p-valor < 0.0001; H15= 408.79).
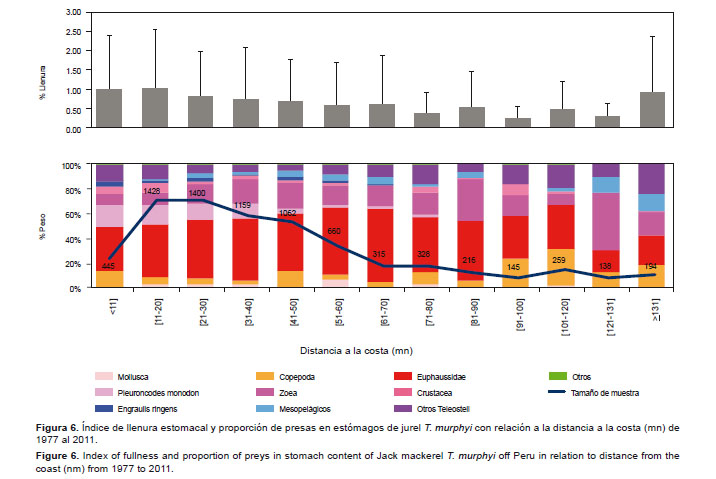
Hasta las 120 mn, los Euphausiidae (%W= 35,1 – 60.1) fueron las presas más representativas en la dieta de T. murphyi; sin embargo, P. monodon fue importante en términos de proporción en peso hasta 40 mn (%W= 17 9 – 11.7). A partir de 91 mn, la proporción de las presas fue más variada y destacaron los Copepoda (%W= 12.1 – 22.8), las zoeas (%W= 9.0 – 46.5) y los Teleosteii en la dieta (%W= 10.3 – 24.7). Asimismo, se observó después de las 130 mn un ligero incremento en la proporción de mesopelágicos en la dieta (%W= 12.9 – 13.4) (Fig. 6). El índice de llenura estomacal disminuyó respecto a la distancia a la costa, excepto a partir de las 131 mn (p-valor < 0.0001; H12= 352.31). Cabe destacar que en estómagos del jurel, P. monodon estuvo presente hasta las 80 mn entre el 2004 y 2008.
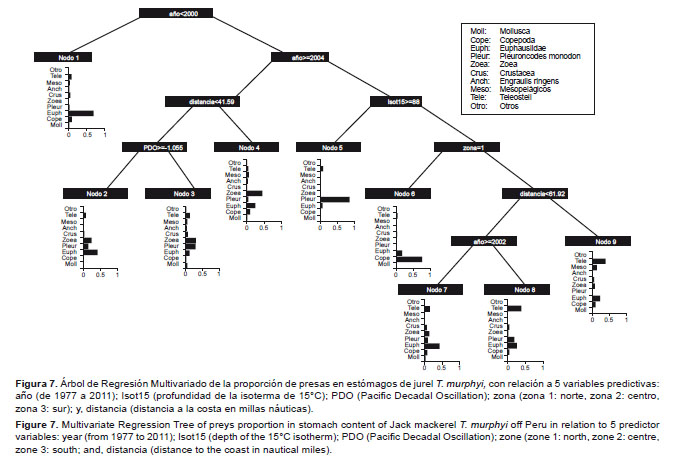
Relación recurso-ambiente En el Árbol de Regresión Multivariado (Fig. 7), los resultados del árbol de regresión podado (cp= 0.012) muestran que la variable predictiva más importante fue el tiempo, con un nivel de importancia de 39.59%. Esta variable discrimina 2 periodos en el comportamiento trófico de T. murphyi: el primero, desde 1977 al 2000, en el que se tiene a Euphausiidae como la presa más representativa; y, el segundo, del 2000 hacia adelante, caracterizado principalmente por tener a Euphausiidae, P. monodon y zoea, como presas muy importantes. En este segundo periodo, surge nuevamente el tiempo como variable discriminante y clasifica el comportamiento alimentario de T. murphyi para un corto periodo entre 2000 y 2004, en el que la profundidad de la isoterma de 15 °C es la variable predictora de importancia (16.61%). Por esta variable, se distinguen dos agrupaciones: una cuando la isoterma de 15°C se encuentra a más de 88 m de profundidad y es caracterizada por la dominancia de P. monodon en la dieta, y la otra agrupación caracterizada por la ingesta de Copepoda, Euphausiidae y Teleosteii.En el caso de los individuos agrupados después del 2004, la otra variable predictora que discrimina las muestras es la distancia a la costa (15.12%), que permite clasificar las muestras en aquellas que están a más de 53.3 mn y que se alimentaron mayormente de zoea, mientras que aquellos individuos colectados a menor distancia de 41.59 mn, estuvieron influenciados por el PDO (16.55% de importancia). De este modo, a valores ≥ -1.06, la dieta estuvo dominada por Euphausiidae, y a valores menores < -1.06, la dieta estuvo compuesta mayormente de zoea, Euphausiidae y P. monodon.
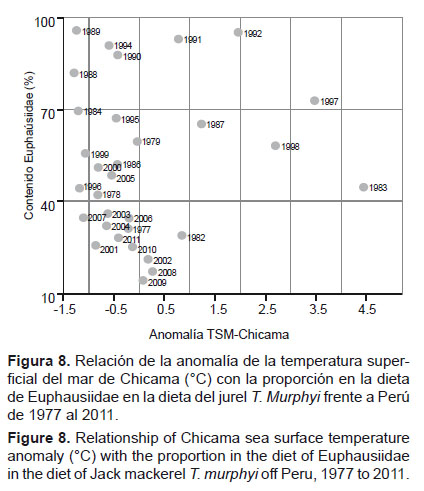
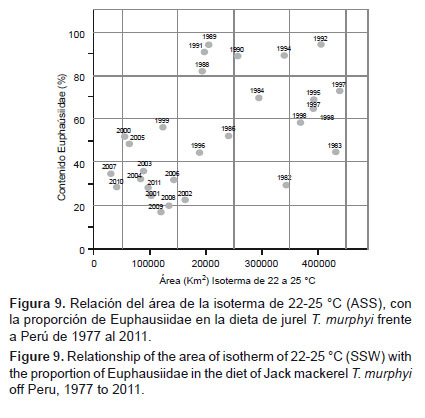
Debido a que el árbol de regresión no incluye las variaciones térmicas como una variable predictora, hemos realizado una comparación entre las anomalías de la temperatura superficial del mar en Chicama, que son consideradas como un buen indicador de condiciones El Niño (Espino 2013) y la proporción de Euphausiidae en la dieta del jurel T. murphyi (Fig. 8). Como se puede apreciar, no se aprecia una relación clara entre la proporción dietaria de Euphausiidae con la anomalía térmica de la estación de Chicama, lo que estaría indicando que los cambios en la proporción de esta presa en la dieta de T. murphyi no son influenciados por la ocurrencia o no de eventos El Niño. También, comparamos la extensión del área de la isoterma de 22 – 25 °C, la cual corresponde a las masas de Aguas Subtropicales Superficiales (ASS) frente al Perú (Wyrtki 1967, Morón & Sarmiento 2001) con la proporción dietaria de Euphausiidae y nuevamente no encontramos una relación clara entre estas variables. Trachurus murphyi se alimenta de Euphausiidae en las mismas proporciones durante eventos El Niño y eventos que no tienen relación con El Niño (Fig. 9).
En cuanto al efecto de la talla en la alimentación de T. murphyi, se observa que, a medida que crece y madura, el peso relativo del contenido estomacal disminuye. Al respecto, Konchina et al. (1996) señalan que el jurel T. murphyi juvenil está relacionado con la zona epipelágica marina y que en etapas adultas se traslada a la zona nerítica; siendo los nichos ecológicos en ambas zonas diferentes, la alimentación más activa la observó en los individuos juveniles de T. murphyi en las aguas epipelágicas oceánicas fuera de los límites de la plataforma. Sin embargo, nuestros resultados muestran que la proporción peso del cuerpo y peso del estómago disminuye con la edad, lo cual podría sostenerse en lo que afirma Pauly (1984), de que los peces requieren tanto de una adecuada provisión de alimento como de oxígeno para crecer, cumpliendo con la regla general de que los individuos juveniles tienen mayor consumo por sus altos requerimientos metabólicos.
Según nuestros resultados, T. murphyi se alimenta de zooplancton en una proporción semejante al 80% en términos de peso, desde tallas menores a mayores, con una mayor contribución de mesozooplancton en los individuos menores de 21 cm y de macrozooplancton en los de tallas mayores de 21 cm. Estos resultados entran en clara controversia con la afirmación de que T. murphyi cambia de estrategia zooplanctófaga a ictiófaga en la talla de 30 cm (Muck & Sánchez 1987). Según nuestros resultados, T. murphyi, desde tallas menores ingiere peces en una proporción semejante a 20% en peso, con algunas particularidades, como es el incremento en la proporción de E. ringens en la dieta de los individuos con tallas entre 31 y 50 cm y que fluctúan entre 2.2 y 5.7%. Nuevamente, esta última apreciación contradice la afirmación de que E. ringens es la presa principal de T. murphyi (Paredes 1972, Sánchez de Benites & Muck 1987, Muck & Sánchez 1987, Dioses 1995).
En cuanto a los estadios de madurez gonadal, no hemos encontrado un patrón definido que diferencie la dieta de los individuos de estadios de madurez inicial con los de estadio tardío. Los individuos de estadios iniciales pueden comer la misma proporción de E. ringens que los individuos de estadios de madurez gonadal avanzados, sólo observamos cambios referidos a la composición del zooplancton ingerido por T. murphyi. Al respecto, según Konchina (1979) y Konchina et al. (1996), T. murphyi cuando es juvenil se asocia más con la zona epipelágica marina y cuando es sexualmente maduro se concentra en la zona nerítica. La mayor ingesta de Euphausiidae por parte de individuos con estadio de madurez avanzados parece ser suficiente para proveerles de energía y continuar con su proceso reproductivo.
Según nuestros resultados, el patrón latitudinal de la dieta de T. murphyi rechaza la afirmación de que T. murphyi es ictiófago de norte a sur, en condiciones normales, y que ante un evento El Niño se torna mayormente zooplanctófago y puede depredar sobre mictófidos y juveniles de E. ringens (Sánchez de Benites et al. 1985, Sánchez de Benites & Muck 1987, Dioses 1995). Estos mismos autores indican que hay cambios en la ictiofagia, con predominio de Anchoa sp. en la zona norte, E. ringens en la zona centro y peces mesopelágicos en el sur. Nuestros resultados muestran que la ictiofagia es de menor importancia de norte a sur y que se incrementa de 5 a 30%, sin mostrar predominio de E. ringens ni de peces mesopelágicos como se ha mencionado en la literatura mencionada.
Según la distancia a la costa, la tendencia del índice de llenura estomacal es decreciente. Esta tendencia es contradictoria con la hipótesis de segregación por tallas postulada por Konchina (1979) y Konchina et al. (1996). Sin embargo, a partir de las 130 mn, fuera del límite de la plataforma continental, se observó un incremento del índice de llenura estomacal y según lo observado, estaría asociándose con la mayor ingesta de peces a esa distancia, en especial los peces mesopelágicos. En toda el área estudiada, el predominio de Euphausiidae guarda relación con su amplia distribución en el mar peruano (Aronés et al. 2009, Ballón et al. 2011). Pleuroncodes monodon, que está principalmente asociado con las Aguas Costeras Frías (Gutiérrez et al. 2008), fue ingerido con singular importancia por T. murphyi hasta 40 mn de distancia a la costa.
En cuanto a la relación recurso-ambiente, el Árbol de Regresión Multivariado muestra la gran importancia que tienen en la dieta las variables explicativas tiempo (definiendo dos periodos, antes y después de 2000), la distancia a la costa (fuertemente ligada con el PDO), y la profundidad de la isoterma de 15°C (ligada fuertemente a la ingesta del camaroncito rojo P. monodon.
Conclusiones Se observan dos escenarios en la dieta del jurel T. murphyi frente al Perú: el primero dentro de un periodo cálido desde 1977 hasta el 2000, que se caracterizó por la presencia de Euphausiidae, y el último dentro de un periodo frío a partir del 2001, en el que la dieta fue más diversa y las presas dominantes fueron el camaroncito rojo P. monodon y los Euphausiidae. Los escenarios descritos en el tiempo estarían obedeciendo a cambios ambientales observados en los últimos 30 años.Este trabajo rebate el paradigma de la dominancia de la anchoveta E. ringens en la dieta del jurel T. murphyi y queda comprobado que los Euphausiidae son el componente que sustenta su dieta a lo largo del tiempo.
Se confirma la gran plasticidad del comportamiento alimentario del jurel T. murphyi. Esta especie puede adaptar su régimen de alimentación para hacer frente a los cambios ambientales espacio-temporales que impactan la disponibilidad y composición de las presas, siendo capaz de modificar la amplitud de su hábitat.
Literatura citada Álamo V.& V. Valdivieso. 1987. Lista sistemática de moluscos marinos del Perú. Boletín Instituto del Mar del Perú. Vol.extraordinario: 205 pp. [ Links ]
Aronés K., P. Ayón, H.J. Hirche et al. 2009. Hydrographic structure and zooplankton abundance and diversity off Paita, northern Peru (1994 to 2004) – ENSO effects, trends and changes. Journal of Marine Systems 78:582-598. DOI:10.1016/j.jmarsys.2009.01.002. [ Links ]
Ballón M., A. Bertrand, A. Lebourges-Dhaussy et al. 2011. Is there enough zooplankton to feed forage fish population off Peru? An acoustic (positive) answer. Progress in Oceanography 91: 360-381. DOI: 10.1016/j.pocean.2011.03.001. [ Links ]
Berg J. 1979. Discussion of methods of investigating the food of fishes, with reference to a preliminary study of the prey of Gobiusculus flavescens (Gobiidae). Mar. Biol. 50: 263-273. DOI: 10.1007/BF00394208
[ Links ]Botsford L., J. Castilla & C. Peterson. 1997. The management of fisheries and marine ecosystems. Science 277: 509-515. DOI: 10.1126/science.277.5325.509
[ Links ]Breiman L., J. Friedman, R. Olshen &C. Stone. 1984. Classification and RegressionTrees. Wadsworth & Brooks/Cole Advanced Books & Software, Pacific Grove, CA. [ Links ]
Caddy J. & G. Sharp. 1988. Un marco ecológico para la investigación pesquera. FAO Doc. Tec. Pesca 283:155 pp. [ Links ]
Chávez F., J.Ryan,S. Lluch-Cota & M. Ñiquen. 2003. From anchovies to sardines and back: multidecadal change in the Pacifc Ocean. Science 299: 217-221. DOI: 10.1126/science.1075880
[ Links ]Chávez F., A. Bertrand, R. Guevara-Carrasco, P. Soler & J. Csirke. 2008. The northern Humboldt Current System: Brief history, present status and a view towards the future. Progress in Oceanography 79: 95-1051. DOI: 10.1016/j.pocean.2008.10.012. [ Links ]
Chirichigno N. 1998. Clave para identificar los peces marinos del Perú, 2ª ed. Instituto del Mar de Perú. Publicación Especial. Callao: 496 pp. [ Links ]
De’ath G. & K. Fabricius. 2000. Classification and regression trees: a powerful yet simple technique for ecological data analysis. Ecology 81(11): 3178-3192. DOI: 10.1890/0012-9658(2000)081[3178:CARTAP]2.0.CO;2
[ Links ]Dioses T. 1995. Análisis de la distribución y abundancia de los recursos jurel y caballa frente a la costa peruana. Inf. Prog. Inst. Mar Perú. 03:55 pp. [ Links ]
Espino M. 2003. Estrategia de gestión oriental para el Pacífico Oriental con especial mención a la pesquería peruana. Tesis para optar el grado de Magíster en Geografía con mención en Ordenamiento y Gestión Ambiental. Unidad de Post Grado, Facultad de Ingeniería Geológica, Minera, Metalúrgica y Geográfica, Universidad Nacional Mayor de San Marcos, Lima. 102 pp. [ Links ]
Espino M. 2013. El jurel Trachurus murphyi y las variables ambientales de macroescala. En: Csirke J., R. Guevara-Carrasco & M. Espino (Eds.). Ecología, pesquería y conservación del jurel (Trachurus murphyi) en el Perú. Rev. peru. biol. número especial 20(1): 009- 020
[ Links ]Fitch J. & R. Brownell. 1968. Fish Otoliths in Cetacean Stomachs and Their Importance in Interpreting Feeding Habits. Journal of Fisheries Research Board of Canada 25(12):2561-2574. DOI: 10.1139/f68-227
[ Links ]García-Godos I. 2001. Patrones morfológicos del otolito sagitta de algunos peces óseos del mar peruano. Boletín Instituto del Mar del Perú 20 (1-2): 83 pp. [ Links ]
Gutiérrez M., A. Ramírez, S. Bertrand et al. 2008. Ecological niches and areas of overlap of the squat lobster ‘munida’ (Pleuroncodes monodon) and anchoveta (Engraulis ringens) off Peru. Progress in Oceanography 79:256-263. DOI : 10.1016/j.pocean.2008.10.019
[ Links ]Hureau J. 1970. Biologie compare de quelques poissons antarctiques (Nototheniidae). Bulletin de l’Institut Oceanographique Monaco 68(1391): 244 pp. [ Links ]
Hyslop E. 1980. Stomach contents analysis-a review of methods and their applications. Journal of Fish Biology 17 (4): 411-429. DOI: 10.1111/j.1095-8649.1980.tb02775.x
[ Links ]Iman R., D. Quade & Alexander D. 1975. Exact Probability Levels for Kruskal-Wallis Test. In:H. Harter and D. Owen (Eds.). Select Tables in Mathematical Statistics (Vol 3). American Mathematical Society, Providence, Rhode Island. [ Links ]
Konchina Y. 1979. The feeding of the Peruvian Jack mackerel, Trachurus symmetricus murphyi. Journal of Ichthyology 19: 52-61. [ Links ]
Konchina Y. 1980. The Peruvian Jack mackerel, Trachurus symmetricus murphyi, a facultative predator in the coastal upwelling ecosystem. Journal of Ichthyology 20(5): 46-59. [ Links ]
Konchina Y. 1983. The feeding niche of the hake Merluccius gayi(Merlucciidae), and the Jack mackerel, Trachurus symmetricus(Carangidae) in the trophic system of the Peruvian coastal upwelling. Journal of Ichthyology 23(2): 87-98. [ Links ]
Konchina Y., A.V. Nesin, N.A. Onishchik et al. 1996. On the migration and feeding of the Jack mackerel Trachurus symmetricus murphyi in the Eastern Pacific. Journal of Ichthyology 36(9):753-766. [ Links ]
Medina M. & H. Arancibia. 2002. Dinámica trófica del jurel (Trachurus symmetricus murphyi) en el norte de Chile. Invest. Mar., Valparaíso, 30(1): 45-55. [ Links ]
Méndez M. 1981. Claves de identificación y distribución de los langostinos y camarones (Crustacea: Decapoda) del mar y ríos de la costa del Perú. Boletín Instituto del Mar del Perú 5:170 pp. [ Links ]
Morón O. & M. Sarmiento. 2001. Aspectos oceanográficos de El Niño 1997-98 y su relación con los recursos pelágicos. En:J. Tarazona, W.E. Arntz y E. Castillo de Maruenda(Eds.). El Niño en América Latina: Impactos Biológicos y Sociales. Consejo Nacional de Ciencia y Tecnología. Lima: 5-27. [ Links ]
Muck P. & G. Sánchez . 1987. The importance of mackerel and horse mackerel predation for the Peruvian anchoveta stock (a population and feeding model). In: D. Pauly and I. Tsukayama (Eds.). The Peruvian Anchoveta and Its Upwelling Ecosystem: Three Decades of Change. ICLARM Studies and Reviews 15: 351 pp. [ Links ]
Newell G. 1963. Marine plankton a practical guide. Hutchison Biological Monographs. 207 pp. [ Links ]
Paredes V. 1972. Estudio sobre contenido estomacal de jurel Trachurus murphyi Nichols del área de pesca del Callao. Tesis para optar el grado de Bachiller en Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima, Perú. [ Links ]
Pauly D. 1984. A mechanism for the juvenile-to-adult transition in fishes. Journal Du Conseil 41 (3):280-284. DOI:10.1093/icesjms/41.3.280. [ Links ]
Rasero M., A. González, B. Castro et al. 1996. Predatory relationships of two sympatric squid, Todaropsis eblanae and Illex coindetii (Cephalopoda: Ommastrephidae) in Galician waters. Journal of the Marine Biological Association of the United Kingdom 76: 73-87. DOI: 10.1017/S0025315400029027
[ Links ]Sánchez de Benites G., A. Álamo & H. Fuentes. 1985. Alteraciones en la dieta alimentaria de algunos peces comerciales por efecto del fenómeno “El Niño”. En W. Arntz, A. Landa y J. Tarazona (Eds.). El Niño: Su impacto en la fauna marina. Boletín Instituto Mar Perú. Vol. Extraordinario: 135-142. [ Links ]
Sánchez de Benites G. & P. Muck. 1987. Situación alimentaria del jurel Trachurus murphyi Nichols en un año normal (1979) y en El Niño 1982-1983. Boletín Instituto Mar Perú 11(4):152-171. [ Links ]
Trégouboff G. & M. Rosse. 1957. Manuel de plactonologie mediterraneénne. Centre National de la Recherche Scientifique. Paris. Tome I, 587 pp; Tome II, 207 planches. [ Links ]
Wolff G.1984. Identification and estimation of size from the beaks of 18 species of cephalopods from the Pacific Ocean. NOAA Technical Report NMFS, 17: 1-50. [ Links ]
Wyrtki K. 1967. Circulation and water masses in the eastern Equatorial Pacific Ocean. Int. Jour Oceanol and Limnol 1(2):117-147. [ Links ]
Zuur F., E. Ieno, N. Walker et al. 2009. Mixed effects models and extensions, in Ecology with R. Springer. 530pp. [ Links ]
Publicado online: 11/10/2013
Publicado impreso: 15/10/2013