Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.21 no.1 Lima 2014
http://dx.doi.org/http://doi.org/10.15381/rpb.v21i1.8248
http://doi.org/10.15381/rpb.v21i1.8248
TRABAJOS ORIGINALES
Dieta de Leopardus colocolo (Carnivora: Felidae) en la Reserva Nacional de Junín, Junín, Perú
Diet of Leopardus colocolo (Carnivora: Felidae) in the Reserva Nacional de Junín, Junín, Peru
Ursula Fajardo1,2, Daniel Cossíos3 y Víctor Pacheco1,4
1 Departamento de Mastozoología, Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Av. Arenales 1256, Jesús María, Lima. Aptdo. 14-0434, Lima-14, Perú.
2 Laboratorio de Estudios en Biodiversidad (LEB). Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Department of Genetics and Evolution, University of Geneva. 1211, Genève 4, Switzerland.
4 Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima, Perú.
Email Ursula Fajardo: ursula_fajardo@yahoo.com
Email Daniel Cossíos: dcossios@yahoo.com
Email Víctor Pacheco: vpachecot@unmsm.edu.pe
Resumen
Este estudio caracteriza la dieta de Leopardus colocolo en los alrededores del lago Junín, en el centro del Perú, a partir de los restos de las presas presentes en 43 heces. El origen de las heces del predador se determinó a partir del ADN mitocondrial de las células epiteliales intestinales adheridas a la superficie de las heces, utilizando como marcador la región de control. Los restos de las presas fueron identificados utilizando literatura especializada y la comparación con especímenes de colección, identificando un total of 14 ítems alimenticios pertenecientes a mamíferos de las familias Cricetidae (6), Chinchillidae (1) y Caviidae (1) y aves de las familias Anatidae (3) y Rallidae (2), y un grupo de aves no identificadas (1). Los roedores fueron el principal componente de la dieta de L. colocolo, en frecuencia y biomasa, seguido por las aves. Entre los ítems alimenticios consumidos, el roedor cricétido pequeño Calomys sp. fue el más frecuente; sin embargo, el mayor aporte de biomasa relativa fue proporcionado por el roedor mediano Cavia tschudii. La amplitud de nicho obtenida fue baja (Bsta= 0.17), indicando una dieta especializada. Nuestros resultados confirman que, como ocurre con la mayoría de felinos pequeños neotropicales, L. colocolo es un predador especializado en la captura de vertebrados, principalmente mamíferos pequeños. No se registró variación estacional en la dieta y el análisis de las clases de edad de los roedores cricétidos mostró que los adultos fueron los más consumidos. Se infiere que L. colocolo tiene un patrón de actividad diurno y nocturno.
Palabras clave: Leopardus colocolo; heces; dieta; Reserva Nacional de Junín; Perú.
Abstract
This study characterized the diet of Leopardus colocolo from the surroundings of Junín lake, in the center of Peru, from prey remnants found within 43 scats. Origin of predator scats was determined from mitochondrial DNA from intestinal epithelial cells existing on the surface of the scats, using as a marker the control region. The prey remnants were identified using specialized literature and comparison with a voucher collection, identifying a total of 14 food items belong to mammals of Cricetidae (6), Chinchillidae (1) and Caviidae (1) families, birds of Anatidae (3) and Rallidae (2) families and one group of unidentified birds. The rodents were the main component of the diet of L. colocolo, in frequency and biomass, followed by birds. Among the food items consumed, the small cricetine rodent Calomys sp. was the most frequent; however, the greatest relative biomass contribution was provided by the medium rodent Cavia tschudii. The niche breadth obtained was low (Bsta= 0.17), indicating a specialized diet. Our results confirm that, as with most neotropical small felids, L. colocolo is a predator specialized in capturing vertebrates, mainly small mammals. No seasonal variation was recorded in the diet and the analysis of the age class of the cricetine rodents showed that the adults were the most consumed. It is inferred that L. colocolo have diurnal and nocturnal activity patterns.
Keywords: Leopardus colocolo; scats; diet; Reserva Nacional de Junín; Peru.
Introducción
El gato del pajonal Leopardus colocolo (Molina 1782) es un felino pequeño ampliamente distribuido en Sudamérica, cuyo rango de distribución se extiende desde Ecuador hasta la Patagonia en Argentina, incluyendo parte de Perú, Bolivia, Brasil, Chile, Paraguay y Uruguay (Wozencraft 1993, Sunquist & Sunquist 2002). En el Perú, se distribuye a lo largo de la Cordillera de los Andes y en la vertiente del Pacífico, desde el departamento de Tumbes (en el norte) hasta el departamento de Tacna (en el sur), ocupando una gran variedad de hábitats que incluyen la ceja de selva, páramo, pajonal de puna, humedales altoandinos, valles interandinos, bosques secos, colinas costeras y algunos humedales costeros, en un rango de elevación comprendido entre el nivel del mar y los 4982 m (Cossíos et al. 2007a, García-Olaechea et al. 2013, Grimwood 1969).
A pesar de ser considerada una especie relativamente común (Nowell & Jackson 1996), el estudio de sus hábitos alimenticios ha recibido poca atención, existiendo pocos trabajos publicados a lo largo de su distribución. Estudios cuantitativos realizados en Argentina (Walker et al. 2007, Palacios 2006), Chile (Napolitano et al. 2008) y Bolivia (Viscarra 2008) documentan la importancia de los roedores de pequeño y mediano tamaño como principal componente de su dieta, seguido por las aves en la mayoría de los casos. En el centro de Brasil, Silveira et al. (2005) reportan de forma cualitativa el consumo de roedores y aves terrestres, mientras que Bagno et al. (2004), adicionalmente al consumo de estos ítems, reportan la presencia de reptiles en la dieta de este felino pequeño. Los libros de consulta de Sunquist y Sunquist (2002) e Iriarte y Jaksic (2012) documentan que la dieta de esta especie se encuentra constituida principalmente por vertebrados pequeños como roedores, lagomorfos, marsupiales y aves.
En el Perú, el conocimiento sobre la dieta de L. colocolo proviene de los estudios de investigación realizados por Romo (1995) en el páramo del Parque Nacional Río Abiseo, en el norte del país, y por Cossíos et al. (2013) en los pastizales de altura de Ayacucho y Huancavelica, siendo este último un estudio de los felinos simpátricos L. colocolo y L. jacobita, sin distinción de la especie. Ambos estudios determinaron, a partir del análisis de heces, que los roedores pequeños constituyen el principal componente de la dieta de los pequeños felinos altoandinos. Además, es importante destacar el registro de frutos de Vaccinium sp. y restos del "majaz de montaña" Cuniculus taczanowskii en la dieta de L. colocolo, reportado únicamente por Romo (1995). Otra información sobre su dieta proviene de la observación casual de un individuo cuando se encontraba cazando vizcachas, en el altiplano del sur del país (Pearson 1951).
Los estudios sobre la dieta de los carnívoros son importantes para comprender su rol como reguladores de las poblaciones de sus presas (Estes 1996, Roemer et al. 2009, Farias 2012) y obtener información sobre su comportamiento de forrajeo, relaciones interespecíficas con otros carnívoros y, además tienen implicancias en conservación (Manfredi et al. 2004, Novack et al. 2005, Walker et al. 2007, Napolitano et al. 2008). El uso de técnicas no invasivas como el análisis de heces es una alternativa viable y efectiva que permite obtener información sobre hábitos alimenticios de especies esquivas, de hábitos nocturnos o crepusculares y con poblaciones generalmente poco abundantes como los carnívoros (Korschegen 1987, Klare et al. 2011, Lagos & Villalobos 2012). Sin embargo, en casos de simpatría de especies congéneres es recomendable que el uso de características morfológicas para la identificación de las heces (forma, diámetro, etc.) vaya acompañado de un método de identificación más consistente, como los análisis genéticos moleculares que permiten identificar especies a partir de ADN de baja calidad procedente de heces, pieles de museo o pelos (Cossíos & Angers 2006, Napolitano et al. 2008).
En cuanto a su conservación, L. colocolo se encuentra categorizada como especie Casi Amenazada (NT) por la Unión Internacional para la Conservación de la Naturaleza y Recursos Naturales (IUCN 2014) y se encuentra listada en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (CITES 2013). En el Perú, recientemente ha sido incluida en la categoría Datos Insuficientes (DD) mediante DS Nº. 004-2004-MINAGRI (2014). Entre las amenazas que afectan negativamente a las poblaciones distribuidas en el Perú se han identificado la caza y la fragmentación y alteración/pérdida de hábitat (Cossíos et al. 2007a, Villalba et al. 2004). Un estudio reciente realizado por Cossíos et al. (2013), en los Andes de Ayacucho y Huancavelica, identificó como factores que pueden afectar negativamente a los gatos silvestres la presencia de animales domésticos y ganado, la quema de pastos y el uso de cuevas de gatos por parte de los pobladores locales.
El objetivo del presente estudio fue determinar la dieta de L. colocolo en los alrededores del lago Junín, en la ecorregión Puna del centro del Perú, a partir del análisis de los restos de las presas contenidos en sus heces. El conocimiento generado sobre el nicho trófico de esta especie ayudará a comprender la importancia de los carnívoros en este ecosistema, a la vez que podrá ser empleado como información básica en la elaboración de planes de manejo para su conservación.
Área de estudio
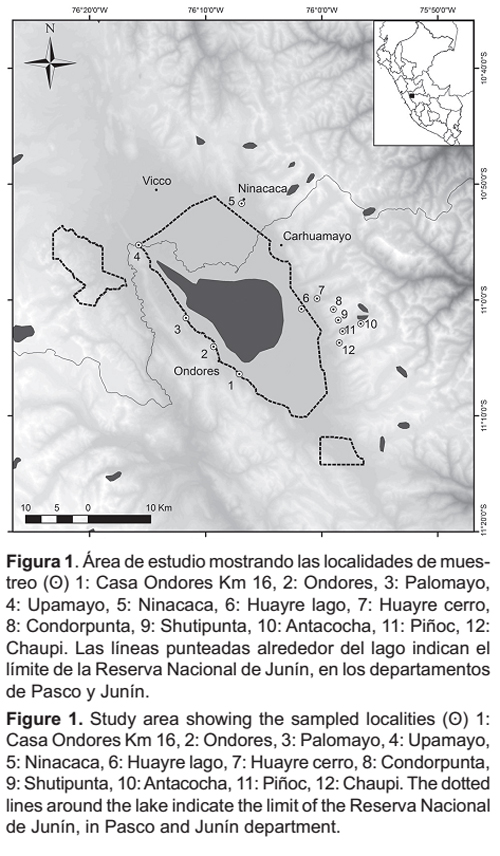
El presente estudio se realizó en los alrededores del lago Junín, dentro de los límites de la Reserva Nacional de Junín (RNJ) (11º0'54"S y 76º06'27"W) y su zona de amortiguamiento (ZA), ubicadas en los distritos de Carhuamayo, Ondores y Junín (provincia y departamento de Junín) y los distritos de Ninacaca y Vicco (provincia y departamento de Pasco), sobre los 4100 msnm (Fig. 1). El área de estudio se encuentra ubicada en la ecorregión Puna (Brack 1986), destacando como principales formaciones vegetales los humedales alto andinos, el césped de puna y el pajonal (INRENA 2008). La temperatura media mensual oscila entre 4.6° y 6.7°C durante el día (estación Upamayo), disminuyendo por debajo de los 0ºC durante la noche; las precipitaciones anuales alcanzan los 940 mm en promedio; y su relieve comprende zonas planas en la parte central y colinas con afloramientos rocosos hacia los alrededores del lago (INRENA 2008).
Materiales y métodos
Se realizaron evaluaciones mensuales de 3 a 4 días de duración entre agosto del 2005 y julio del 2006, efectuando una búsqueda intensiva de letrinas de felinos pequeños en roquedales, afloramientos rocosos, peñas, casas abandonadas y pequeños islotes en el borde del lago, donde se recolectó un total de 50 heces. Las letrinas son acumulaciones de heces depositadas en lugares protegidos como pequeñas cuevas rocosas, debajo de rocas grandes, casas abandonadas y capillas (Cossíos et al. 2007b).
En el campo, las heces de L. colocolo fueron discriminadas de las de otros carnívoros utilizando las características descritas por Palacios (2007) para heces de felinos pequeños, según las cuales las heces asemejan la forma de "un rosario" por la cercanía y profundidad de sus constricciones (Fig. 2A), presentan un diámetro promedio de 18 mm, contienen restos de origen animal y generalmente se ubican en lugares protegidos (Fig. 2B). Posteriormente, las heces colectadas fueron secadas al sol, preservadas en bolsas de papel rotuladas, y dispuestas dentro de contenedores herméticos provistos de desecantes para evitar el ataque de hongos.
La identificación de la especie de felino que produjo las heces colectadas fue realizada a partir del ADN de las células epiteliales intestinales adheridas a la superficie de las heces, utilizando como marcador la región de control del ADN mitocondrial, mediante la técnica PCR-RFLP (Polymerase Chain Reaction _ Restriction Fragment Length Polymorphisms) que proporciona un patrón de bandas único para cada especie, visualizado en geles de poliacrilamida (Cossíos et al. 2009). Los análisis genéticos fueron realizados en el Departamento de Ciencias Biológicas de la Universidad de Montréal, Canadá.
Para la caracterización de la dieta de L. colocolo se siguió la metodología de Korschgen (1987): las heces fueron sometidas a un proceso de ablandamiento con agua durante 2 horas, posteriormente los restos no digeridos de las presas fueron separados con ayuda de un microscopio estereoscópico realizando una disección longitudinal de las heces para rescatar porciones diferenciables de las presas (cintura pélvica, cintura escapular, etc.), mientras que los demás restos fueron lavados con agua corriente, utilizando coladores de 1 y 0.5 mm de apertura de malla. Las plumas encontradas en las heces fueron lavadas con champú, secadas y montadas en láminas para su posterior identificación.
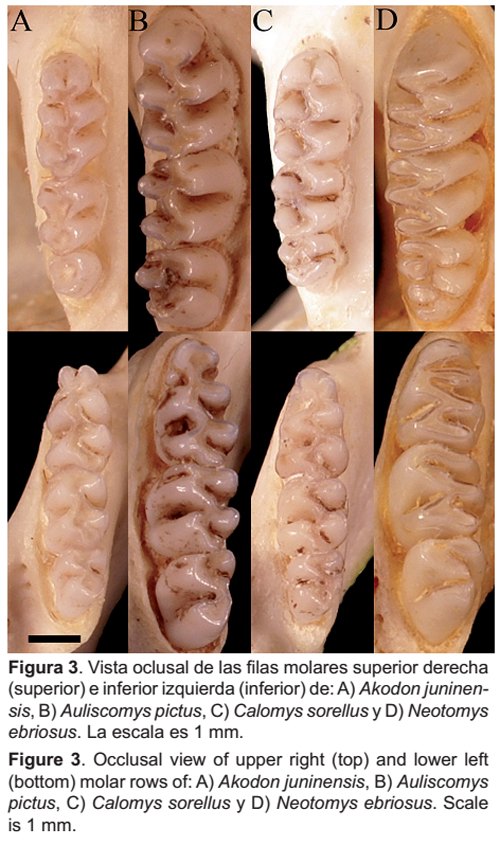
Los restos de las presas fueron identificados hasta el nivel taxonómico más bajo posible, partiendo de una lista de especies potenciales de roedores y aves, elaborada a partir de la base de datos de la colección científica de mamíferos del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (MUSM), estudios realizados en el área de evaluación o localidades cercanas y otra literatura especializada (Hershkovitz 1962, Dourojeanni et al. 1968, Myers et al. 1990, Musser & Carleton 2005, Schulenberg et al. 2007). Para la identificación de los roedores cricétidos, se utilizó como primer criterio discriminante el patrón de pentalofodoncia y tetralofodoncia de los molares (Hershkovitz 1962). Se utilizó la descripción de Reig (1987) para identificar individuos de la tribu Akodontini (Akodon) y la diagnosis de Olds y Anderson (1989) para identificar individuos de las tribus Phyllotini (Auliscomys y Calomys) y Reithrodontini (Neotomys), todas ellas con un patrón de tetralofodoncia en los molares. Para la identificación específica de las presas mamíferas se utilizaron las descripciones de Hershkovitz (1962) y Myers et al. (1990) sobre la morfología de los dientes de roedores cricétidos, la clave dicotómica de Reise (1973) y la comparación con especímenes de la colección científica de mamíferos del MUSM (Fig. 3 y 4).
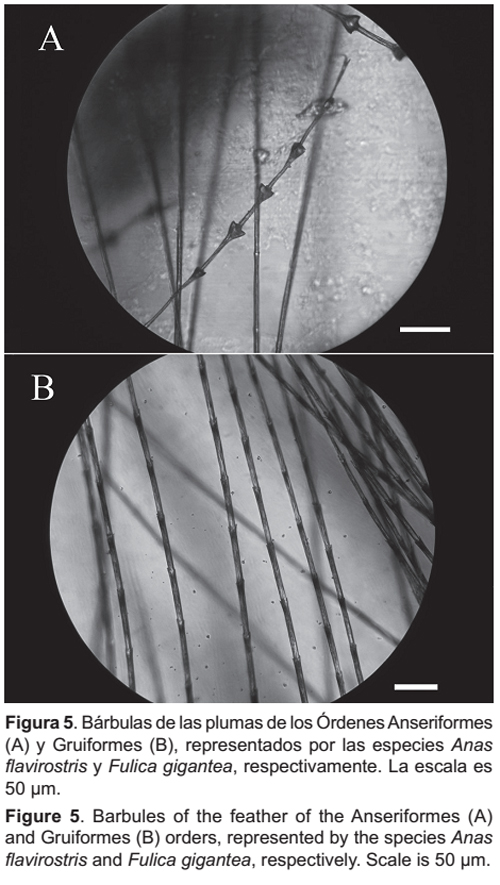
En el caso de las aves, se realizó una primera identificación a nivel de Orden, utilizando las descripciones de Day (1965) y Rau y Martínez (2004), basadas en la microestructura (forma, distribución y pigmentación) de los nodos de las bárbulas de las plumas, con ayuda de un microscopio con ocular micrométrico. Se prepararon láminas de las plumas de especies de aves distribuidas en el Perú, representantes de los órdenes más comunes presentes en el área de estudio (Fig. 5). Para la identificación específica de las aves se utilizó la comparación con especímenes de la colección ornitológica del MUSM, considerando el tamaño, forma, textura y color de las plumas.
Según Klare et al. (2011), la frecuencia de ocurrencia es el método usualmente empleado para la determinación de la importancia de los ítems alimenticios de la dieta en estudios de carnívoros; sin embargo, no recomiendan su uso como único estimador debido a que tiende a sobrestimar la importancia de presas pequeñas y subestimar la de las presas de mayor tamaño. Estos autores sugieren el cálculo de la biomasa basada en factores de corrección (ecuaciones de conversión especie-específica) como el método que proporciona la mejor aproximación de la dieta; sin embargo, las ecuaciones de conversión se encuentran disponibles principalmente para carnívoros grandes o medianos como el puma (Ackerman et al. 1984), zorros (Lockie 1959) y coyotes (Weaver & Hoffman 1979, Monroy-Vilchis & Frieven 2006), siendo una limitante para los estudios dietarios de pequeños felinos neotropicales. En forma alternativa, algunos estudios dietarios emplean el cálculo de la biomasa relativa para especies presa pequeñas (<2kg), cuyos restos tienden a estar incluidos en una sola feca (Napolitano et al. 2008).
En este estudio, la importancia de cada ítem alimenticio de la dieta fue estimada calculando su porcentaje de ocurrencia (%n) y el porcentaje de biomasa relativa que aporta (%B). El porcentaje de ocurrencia se calculó dividiendo el número de individuos de un determinado ítem alimenticio (n) entre el número total de individuos registrados en las heces examinadas, multiplicado por 100%. Un individuo fue considerado como tal a partir del hallazgo de por lo menos una de las dos hemimandíbulas articulables, un diente, uno de cada par de húmeros, de cada par de fémures, de cada par de ilíacos, de cada par de patas, un sacro, un pico, entre otros. En el caso del hallazgo de dos estructuras similares se comparó la forma, el tamaño, lado (derecho o izquierdo) y la posición (superior e inferior) y grado de desgaste, en el caso de dientes, para determinar si pertenecían a un mismo individuo o a individuos diferentes.
Además, se calculó el porcentaje de heces (%F) dividiendo el número de heces donde se registró un determinado ítem alimenticio (F) entre el número total de heces de la muestra, multiplicado por 100%. Para determinar posibles diferencias significativas entre los ítems consumidos se utilizó las pruebas no paramétricas Kruskall-Wallis y U de Mann Whitney, comparando el número de individuos de cada ítem.
La biomasa relativa fue calculada multiplicando el número de individuos de un determinado ítem alimenticio (n) por el peso promedio de los individuos adultos (Rau 2000 en Napolitano et al. 2008, Iriarte & Jaksic 2012). Los resultados fueron expresados en porcentaje de biomasa relativa (%B), dividiendo la biomasa relativa de cada ítem alimenticio entre la sumatoria de biomasas de todos los ítems, multiplicado por 100%. Los pesos promedio de los ítems alimenticios (presas) consumidos fueron obtenidos a partir de la base de datos de la colección de mamíferos del MUSM y de la literatura (Dourojeanni et al. 1968, Romo 1995, Pearson 1948). En este análisis solo fueron considerados los ítems alimenticios plenamente identificados.
Se calculó la amplitud de nicho trófico estandarizada propuesta por Colwell y Futuyma (1971) (en Jaksic 2001): Bsta = (B_Bmin)/(Bmax_Bmin ), donde B = 1/»pi2 es la amplitud de nicho observada o índice de Levins (1968), pi es la proporción del ítem i en la dieta, Bmin es la diversidad mínima posible (1) y Bmax es la diversidad máxima posible (total de ítems consumidos). Los valores de Bsta varían entre 0 y 1, indicando un uso restringido de los recursos alimenticios (valores cercanos a 0) o una mayor diversidad de los recursos utilizados (valores cercanos a 1).
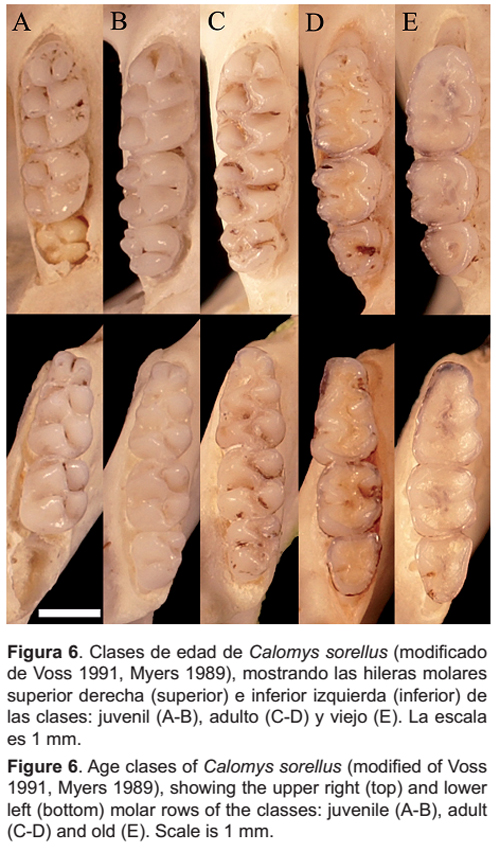
Se evaluó si existen diferencias significativas en el consumo de las clases de edad de cada especie de roedor cricétido, utilizando la prueba no paramétrica Chi cuadrado a un nivel de significancia de 0.05. Se trabajó con los datos de los roedores cricétidos identificados hasta el nivel de especie o género. Se estimaron las edades de los roedores cricétidos utilizando como criterio discriminante el patrón de desgaste de los dientes descrito por Voss (1991) y Myers (1989), con algunas modificaciones, estableciéndose tres clases de edad: a) juveniles, caracterizados por presentar el tercer molar en proceso de erupción (Fig. 6A) o el tercer molar completamente erupcionado, pero sin signos de desgaste en las cúspides de todos los dientes (Fig. 6B); b) adultos, caracterizados por presentar desgaste en las cúspides principales de sus dientes, pero con los lofos menores aún distintivos y el tercer molar con su superficie oclusal aún tubercular (Fig. 6C) o por presentar las cúspides principales del primer y segundo molar aún distintivas, pero con los lofos menores obliterados y el tercer molar con superficie plana o cóncava (Fig. 6D); y c) viejos, caracterizados por presentar la superficie de los dientes plana o cóncava y la mayoría de los detalles de la topología obliterados (Fig. 6E).
En forma adicional, se evaluó si existe una variación estacional en la dieta de L. colocolo, utilizando la prueba no paramétrica Chi cuadrado (nivel de significancia de 0.05), a partir del análisis de las heces procedentes de letrinas monitoreadas, de las cuales se tuvo certeza de la fecha en la que fueron depositadas.
Finalmente, se utilizó la información sobre los patrones de actividad temporal de las presas consumidas para deducir el horario de alimentación aproximado de L. colocolo. Esta información fue obtenida a partir de Pearson (1948, 1951), Pizzimenti y De Salle (1980), Ferro y Barquez (2008), Iriarte (2008) y Eisenberg y Redford (1999). Para esta aproximación solo se incluyeron aquellos ítems plenamente identificados.
Los análisis estadísticos de los datos fueron realizados con el programa Systat versión 11.0.
Resultados
De un total de 50 heces colectadas, solo 41 fueron analizadas genéticamente, resultando que 34 pertenecieron a Leopardus colocolo y 7 dieron un resultado negativo para la especie, siendo éstas últimas excluidas de los análisis. Las 9 heces restantes fueron asignadas a L. colocolo por provenir de letrinas donde en más de una oportunidad las heces fueron identificadas genéticamente como pertenecientes a esta especie, siendo incluidas en el análisis de la dieta.
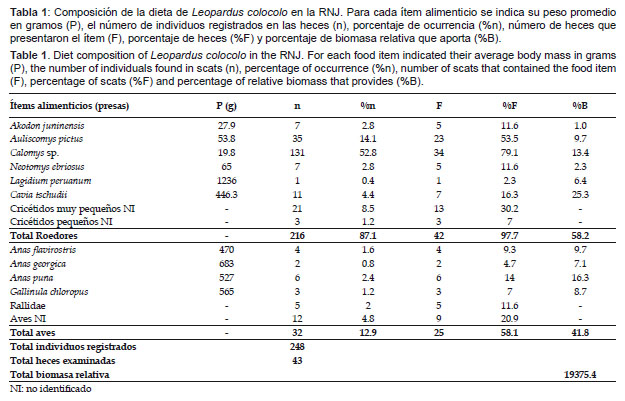
A partir de 43 heces analizadas se obtuvieron restos de 248 individuos vertebrados, identificándose 14 ítems alimenticios pertenecientes a mamíferos de las familias Cricetidae (6), Chinchillidae (1) y Caviidae (1), y aves de las familias Anatidae (3) y Rallidae (2) y un grupo de aves no identificadas (Tabla 1).
Los restos vegetales encontrados (hojas de gramínea) no fueron incluidos en los análisis, debido a que fueron considerados de consumo incidental por su bajo porcentaje de ocurrencia y escasa cantidad hallada en cada una de las heces.
Nuestros resultados muestran que los roedores como grupo constituyen el principal componente de la dieta de L. colocolo, representando el 87.1% del total de presas consumidas y estando presentes en el 97.7% de las heces examinadas. Las aves representaron únicamente el 12.9% del total de presas consumidas, pero fueron registradas en el 58.1% de las heces examinadas (Tabla 1).
Es importante destacar que en este estudio se reporta por primera vez la presencia de aves de las familias Anatidae y Rallidae en la dieta de L. colocolo.
Entre los ítems consumidos, el roedor cricétido Calomys sp. fue el más frecuente, representando el 52.8% del total de presas consumidas y fue registrado en el 79.1% de las heces examinadas (Tabla 1). Estadísticamente, la prueba no paramétrica Kruskall-Wallis detectó diferencias significativas en el consumo de Calomys sp. respecto a los demás ítems alimenticios (Kruskall-Wallis Statistic = 69.163, df=3, p< 0.001). Así mismo, la Prueba U de Mann-Whitney aplicada por pares a los ítems más consumidos también evidenció diferencias significativas en el consumo del roedor Calomys sp. respecto a Akodon juninensis (Prueba U de Mann-Whitney de 249.000, p< 0.001), Calomys sp. respecto a Auliscomys pictus (Prueba U de Mann-Whitney de 471.500, p< 0.001) y Calomys sp. respecto a Neotomys ebriosus (Prueba U de Mann-Whitney de 1600.000, p< 0.001).
Los roedores también constituyen el principal componente de la dieta de L. colocolo en términos de biomasa relativa, aportando el 58.2% de la biomasa total, seguido por las aves con un aporte del 41.8% (Tabla 1). Entre los ítems alimenticios registrados, el roedor de mediano tamaño Cavia tschudii fue el que proporcionó el mayor aporte de biomasa (25.3%), a pesar de encontrarse poco representado en términos de frecuencia (Tabla 1).
La amplitud de nicho trófico de L. colocolo fue estimada en 0.17 (Bsta), indicando una dieta especialista, dominada por el roedor cricétido Calomys sp.
Por otro lado, se determinó que entre los roedores cricétidos los adultos fueron los más consumidos (X2=8.4; df=3; p <0.05) respecto a los juveniles y viejos.
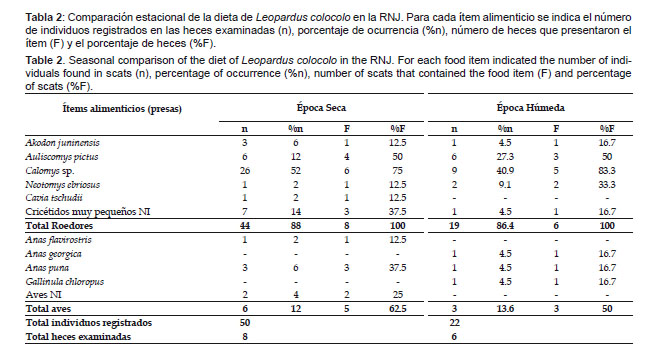
No se observó variación estacional en la dieta de L. colocolo (X2=12.0; df=10; p>0.05); sin embargo, debido al tamaño reducido de la muestra (época seca=8, época húmeda=6), este resultado debe ser considerado de forma referencial. El pequeño tamaño de la muestra se debió a que las letrinas monitoreadas inicialmente fueron quemadas por los pobladores locales, por lo que se tuvo que evaluar nuevas letrinas de las que no se conocía la fecha exacta de deposición de las heces. Los roedores fueron los más consumidos, tanto en la época seca (%n=88, %F=100) como en la húmeda (%n=86.4, %F=100), seguido por las aves con %n=12 y %F=62.5 en la época seca y %n=13.6 y %F=50 en la época húmeda (Tabla 2), siendo importante destacar que el consumo de aves acuáticas fue registrado principalmente entre los meses de agosto y diciembre. El roedor Calomys sp. fue el ítem alimenticio más frecuente, tanto en la época seca (%n= 52, %F= 75) como en la húmeda (%n= 40.9, %F= 83.3) (Tabla 2).
En relación al patrón de actividad temporal de L. colocolo, se infiere que éste utiliza tanto horas del día como de la noche para alimentarse, ya que no se observó diferencias significativas en el consumo de presas con actividad nocturna como Calomys sp. (81%) respecto al consumo de presas con actividad nocturna-diurna como Akodon juninensis, Auliscomys pictus, Neotomys ebriosus y Cavia tschudii) (73.8%), y las presas con actividad diurna como Lagidium peruanum, Anas spp., Gallinula chloropus y Rallidae estuvieron bien representadas (47.6%).
Discusión
Los resultados obtenidos muestran que L. colocolo depreda principalmente sobre roedores pequeños y medianos, concordando con lo documentado en Perú (Romo 1995, Cossíos et al. 2013) y en otros países rango de su distribución (Napolitano et al. 2008, Viscarra 2008, Walker et al. 2007, Palacios 2006). Nuestros resultados son consistentes con lo documentado para la mayoría de pequeños felinos neotropicales, cuya dieta se basa principalmente en el consumo de vertebrados pequeños y, especialmente, en mamíferos pequeños como roedores, lagomorfos y marsupiales (Bisceglia et al. 2008, Silva-Pereira et al. 2011, Iriarte & Jaksic 2012).
De manera similar a este estudio, diversos trabajos han mostrado la importancia de las aves en la dieta de L. colocolo, siendo el segundo componente más consumido (Viscarra 2008, Walker et al. 2007, Napolitano et al. 2008, Cossíos et al. 2013). Este estudio reporta por primera vez el consumo de aves acuáticas de las familias Anatidae y Rallidae en la dieta de L. colocolo, resultado documentado únicamente para el "gato montés argentino" Leopardus geoffroyi en los humedales de los alrededores de la Laguna Mar Chiquita, en la Reserva de Biósfera Mar Chiquita, Argentina, (Manfredi et al. 2004).
La alta representatividad del roedor Calomys sp. en la dieta de L. colocolo podría estar relacionada con una mayor abundancia de éste respecto a otras especies presa presentes en el área de estudio, a la facilidad con la que puede ser capturado o a una mayor sincronicidad entre su patrón de actividad y el del predador. En este trabajo no se evaluó la abundancia de las presas, pero se tiene conocimiento de que las dos especies del género Calomys potencialmente presentes en el área de estudio son comunes en la ecorregión Puna de Perú y en otros países donde se distribuyen. Calomys sorellus es considerada relativamente común en ambientes altoandinos y arbustivos de Perú (Hershkovitz 1962) y Calomys lepidus ha sido reportada común en la región Altoandina de Bolivia (Tarifa & Yensen 2001) y una de las especies dominantes en las estepas altoandinas de las Cumbres Calchaquíes y Nevados del Aconquija, en la provincia de Tucumán, en Argentina (Ferro & Barquez 2008). Ambas especies de roedores presentan una estrecha asociación con zonas abiertas como pastizales y matorrales, en el caso de Calomys sorellus (Hershkovitz 1962) y pastizales y vegas, en el de Calomys lepidus (Tarifa & Yensen 2001, Ferro & Barquez 2008), lo cual podría hacerlas más vulnerables que otras especies presa. Sobre este punto, la teoría de Schoener (1971) señala que muchos carnívoros seleccionan sus presas por la facilidad con la que éstas pueden ser capturadas más que por su abundancia. En general, los roedores cricétidos son más vulnerables a la depredación que las aves acuáticas quienes, además de su mayor tamaño, tienen la capacidad de correr o volar y refugiarse durante el día en el lago (Fjeldså & Krabbe 1990, Schulenberg et al. 2007). Por otro lado, Napolitano et al. (2008) en su estudio realizado en el norte de Chile sugirieron que el patrón de actividad de las presas fue el factor que determinó su depredación por parte de L. colocolo, basados en el mayor consumo de roedores nocturnos del género Phyllotis sobre especies diurnas que presentaron una mayor abundancia. Posteriores estudios son necesarios para identificar el factor o factores que ocasionan que el roedor Calomys sp. sea el ítem más consumido.
El consumo de aves acuáticas de los géneros Anas y Gallinula, sugiere que L. colocolo aprovecha alguna situación particular que las convierte en presas vulnerables. En la Reserva de Biósfera Mar Chiquita, en Argentina, Canepuccia et al. (2007) encontraron que la abundancia de las aves acuáticas, la distancia entre la presa y el predador previo al ataque y el tamaño de la presa determinan el consumo de aves acuáticas por parte de Oncifelis geoffroyi. Estos autores señalan que la vegetación que rodea las áreas de descanso de las aves acuáticas permite al predador aproximarse sin ser visto muy cerca de su presa. En las costas de Virginia (Erwin et al. 2001) y en España (Ruiz-Olmo et al. 2003) se ha reportado la depredación de aves acuáticas por parte del zorro rojo Vulpes vulpes, durante la época de reproducción de éstas. En el presente estudio se obtuvieron indicios que sugieren que L. colocolo aprovecha la vulnerabilidad que muestran las aves acuáticas durante la época reproductiva, ya que éstas fueron registradas en las heces colectadas entre finales de agosto y diciembre, coincidiendo con parte de la época de reproducción de las especies de Anatidae y Rallidae registradas.
La "vizcacha peruana" Lagidium peruanum estuvo muy poco representada, en términos de frecuencia, en la dieta de L. colocolo, a diferencia de lo documentado en el sur de Bolivia (Viscarra 2008) y norte de Chile (Napolitano et al. 2008) donde la "vizcacha chilena" Lagidium viscacia constituye el principal ítem alimenticio de su dieta o es parte importante de ella. Se presume que este resultado podría estar relacionado con las características del área de estudio, que presenta solo algunos afloramientos rocosos dispersos donde habitan pequeñas poblaciones de vizcachas. En el presente estudio, los roedores también constituyen el principal componente de la dieta de L. colocolo en términos de biomasa relativa, siendo el "cuy silvestre" Cavia tschudii el ítem alimenticio que proporciona el mayor aporte de biomasa a la dieta, concordando con lo reportado en Chile por Napolitano et al. (2008), donde la especie Lagidium viscacia representa el principal ítem alimenticio en aporte de biomasa. Estos resultados evidencian la importancia de las presas de mayor tamaño en aporte de biomasa a la dieta de L. colocolo.
A pesar de encontrarse numéricamente poco representadas en la dieta de L. colocolo, las aves mostraron un aporte importante en biomasa relativa (41.8%), mayor al reportado por Napolitano et al. (2008) para flamencos y perdices (21.3%). El alto porcentaje de biomasa relativa que aportan las aves en el presente estudio se debe al consumo de aves acuáticas cuyo tamaño y peso superan ampliamente el de las presas más frecuentes como los roedores cricétidos.
La estrecha amplitud de nicho trófico obtenida para L. colocolo sugiere una dieta especializada, constituida exclusivamente por roedores y aves, particularmente por el roedor cricétido Calomys sp. La especialización en su dieta ha sido documentada en otros países rango de su distribución (Palacios 2006, Walker et al. 2007, Napolitano et al. 2008), siendo las especies presa más consumidas los roedores de los géneros Ctenomys, Phyllotis y Lagidium viscacia. Estos resultados discrepan con lo reportado por Viscarra (2008) en Bolivia, quien la considera una especie generalista. Sin embargo, con la finalidad de interpretar adecuadamente los datos de un estudio dietario y determinar el comportamiento de forrajeo de una especie, se recomienda conocer la abundancia de las presas en el área de estudio (Korschgen 1987, Jaksic 1989).
La mayor proporción de roedores cricétidos adultos en la dieta de L. colocolo podría deberse a que las campañas de muestreo realizadas en el área de estudio no coincidieron con la etapa de reclutamiento, por lo cual no se encontraron individuos juveniles en las heces. También podría estar relacionada a la mayor movilidad que muestran los roedores en la etapa adulta respecto a la etapa juvenil, lo cual los hace fácilmente detectables por el predador, como lo sugieren Castro y Jaksic (1995). Los roedores, durante la etapa juvenil, permanecen protegidos dentro de sus madrigueras. Iriarte (2008) reporta que el roedor Calomys lepidus alcanza su madurez sexual entre los 72 y 82 días, lo cual da una idea de la corta duración de la etapa juvenil. Por otro lado, en una población de roedores los individuos viejos se encuentran naturalmente en baja abundancia debido a la competencia, enfermedades, presión de depredación, etc.
Por otra parte, no se observó variación estacional en la dieta de L. colocolo; sin embargo, se recomienda el uso de una muestra de mayor tamaño para confirmar estos resultados.
Finalmente, se infiere que L. colocolo tiene un patrón de actividad nocturno y diurno, ya que su dieta incluye especies presa con actividad tanto nocturna como diurna. Sin embargo, esta deducción se basa en información procedente de estudios realizados en los Andes del sur de Perú (Pearson 1948, 1951), Chile (Iriarte 2008) y las altas cumbres de la provincia de Tucumán, en Argentina (Ferro & Barquez 2008), siendo necesario obtener información sobre la historia natural de los roedores del área de estudio para confirmar este resultado. Nuestros resultados concuerdan con lo reportado por Bagno et al. (2004), en el Cerrado de Brasil, y por Napolitano et al. (2008), en el norte de Chile. Reportes de actividad diurna han sido documentados por Silveira et al. (2005), en el Cerrado de Brasil; García-Olaechea et al. (2013), en la costa norte del Perú y Pacheco (com. pers. 2014) en los departamentos de Lima, Ancash y La Libertad. Actividad nocturna ha sido reportada por Lucherini et al. (2009) en el norte de Argentina, a partir de fototrampeos, y por Pearson (1951) en el Altiplano del sur de Perú, a partir de un avistamiento casual. Al parecer, el patrón de actividad de L. colocolo varía de acuerdo a la localidad; al respecto, Lucherini et al. (2009) sugieren que esta variación puede estar relacionada con las diferencias existentes entre cada zona o ser el resultado de un comportamiento para evadir otros carnívoros que viven en simpatría. Posteriores estudios utilizando cámaras trampa son necesarios para obtener una mejor aproximación sobre el patrón de actividad de L. colocolo en el área de estudio.
Agradecimientos
Esta investigación fue parte del proyecto "Ecología y conservación de pequeños félidos andinos en la Reserva Nacional de Junín, el Santuario Nacional de Huayllay y alrededores", liderado por Daniel Cossíos y desarrollado gracias al financiamiento de Wildlife Conservation Network y el apoyo de la Alianza Gato Andino. Agradecemos al ex Director de la Reserva Nacional de Junín Ing. Marco Arenas, por el apoyo logístico brindado y al Sr. Melecio Arias por su apoyo como guía en el trabajo de campo. Agradecemos a las Directoras del Departamento de Ornitología del Museo de Historia Natural-UNMSM, Dra. Irma Franke y Blga. Letty Salinas por permitirnos el uso de la colección científica de aves, y a las biólogas Sonia Salazar y Yisela Quispe por su orientación en la identificación de las muestras de aves. Igualmente, agradecemos a Cecilia Barriga por su ayuda en la elaboración del mapa del área de estudio, y a Jessica Amanzo, Marina Villalobos y José Pérez por la revisión del manuscrito y comentarios que ayudaron a su mejora.
Contribución de los autores
Ursula Fajardo diseñó el estudio, obtuvo los datos de campo, realizó los análisis y la interpretación de datos y se encargó de la redacción del artículo. Daniel Cossíos lideró el proyecto del cual se tomó parte de la información para este estudio, realizó los análisis de genético para la identificación de las heces, contribuyó en la interpretación de datos y realizó una revisión crítica del contenido intelectual del trabajo. Víctor Pacheco contribuyó en el diseño del estudio, la interpretación de los datos y realizó una revisión crítica de su contenido intelectual. Todos los autores aprobaron el manuscrito final.
Literatura citada
Ackerman B.B., F.G. Lindzey & T.P. Hemker. 1984. Cougar food habits in southern Utah. Journal Wildlife Management 48(1): 147-155.
Bagno M.A., F.G.H. Rodrigues, M.P. Villalobos, et al. 2004. Notes on the Natural History and Conservation Status of Pampas Cat, Oncifelis colocolo, in the Brazilian Cerrado. Mammalia 68: 75-79.
Brack-Egg E. 1986. Las Ecorregiones del Perú. Boletín de Lima 44: 57-70.
Canepuccia A., M. Martinez & A. Vassallo. 2007. Selection of waterbirds by geoffroy's cat effects of prey abundance, size and distance. Mammalian Biology 72(3): 163-173.
CITES 2013. (en línea). Apéndices I, II y III. <www.cites.org/esp/app/appendices.html>. Acceso 20/06/2013.
Cossíos D.E. & B. Angers. 2006. Identification of Andean felid feces using PCR-RFLP. Mastozoología Neotropical 13(2): 239-244.
Cossíos D.E., M. Lucherini, M. Ruiz-García & B. Angers. 2009. Influence of ancient glacial periods on the Andean fauna: the case of the pampas cat (Leopardus colocolo). BMC Evolutionary Biology 9: 68. doi:10.1186/1471-2148-9-68.
Cossíos E.D., A. Madrid, J.L. Condori & U. Fajardo. 2007a. An update on the distribution of Andean cat Oreailurus jacobita and pampas cat Lynchailurus colocolo in Peru. Endangered Species Research 3: 313-320. doi: 10.3354/esr00059.
Cossíos D.E., F. Beltrán, M. Bennet, et al. 2007b. Manual de metodologías para relevamientos de carnívoros alto andinos. Alianza Gato Andino. Buenos Aires, Argentina. 72pp.
Cossíos D.E., L. Maffei & U. Fajardo. 2013. Ecología de pequeños félidos en los Andes de Ayacucho y Huancavelica, Perú. En: A. Alonso, F. Dallmeier and G. Servat, eds. Monitoreo de biodiversidad: lecciones de un megaproyecto transandino. Smithsonian Institution Scholarly Press, Washington, D.C. Pp. 341-350.
Colwell R.R. & D.J. Futuyma. 1971. On the measurement ofniche breadth and overlap. Ecology 52: 567_572.
Day M.G. 1966. Identification of hair and feather remains in the gut and faeces of stoat and weasels. Journal of Zoology (London) 148: 201-217. doi: 10.1111/j.1469-7998.1966.tb02948.x
Dourojeanni M.R., R. Hofmann, R. Garcia, et al. 1968. Observaciones preliminares para el manejo de las aves acuáticas del Lago de Junín, Perú. Revista Forestal del Perú 2(2): 3-52.
DS Nº. 004-2004-MINAGRI. 2014. Decreto Supremo que aprueba la actualización de la lista de clasificación y categorización de las especies amenazadas de fauna silvestre legalmente protegidas. El Peruano, Normas Legales, 08.04.2014:520497-520504.
Eisenberg J.F. & K.H. Redford. 1999. Mammals of the Neotropics. Volume 3. The Central Neotropics: Ecuador, Peru, Bolivia, Brazil. University of Chicago Press, Chicago. 609 pp. ISBN. 0-226-19541-4 (cloth), ISBN. 0-226-19542-2 (paper).
Erwin R.M., B.R. Truitt & J.E. Jiménez. 2001. Ground-nesting waterbirds and mammalian carnivores in the Virginia Barrier Island Region: Running out of options. Journal of Coastal Research 17(2): 292-296.
Estes J.A. 1996. Predators and ecosystem management. Wildlife Society Bulletin 24: 390-396.
Farias A.A. 2012. Los Carnívoros y su papel en el Ecosistema. En: A. Iriarte and F. Jaksic, eds. Los Carnívoros de Chile. Ediciones Flora y Fauna Chile y CASEB, P.U. Católica de Chile. Pp. 30-36.
Ferro L. & R. Barquez. 2008. Comentarios sobre la distribución de Abrothrix andinus y Calomys lepidus (Rodentia: Cricetidae) en la provincia de Tucumán, Argentina. Mastozoología Neotropical 15(2): 197-201.
Fjeldså J. & N. Krabbe. 1990. Birds of the high Andes. Zoological Museum, University of Copenhagen and Apollo Books, Copenhagen.
Grimwood I.R. 1969. Notes on the distribution and status of some Peruvian mammals. American Commitee for International Wild Life Protection and New York Zoological Society, Special Publication 21: 1-86.
Hershkovitz P. 1962. Evolution of Neotropical Cricetine rodents (Muridae) with special reference to the Phyllotine group. Fieldiana: Zoology 46: 1-524.
INRENA. 2008. Reserva Nacional de Junín. Plan Maestro 2008-2012. Lima. 273pp.
Iriarte A. 2008. Mamíferos de Chile. Lynx Edicions. Barcelona, España. 420pp.
Iriarte A. & F. Jaksic. 2012. Los Carnívoros de Chile. Ediciones Flora y Fauna Chile y CASEB, P.U. Católica de Chile. 260pp.
IUCN 2014. (en línea). IUCN Red list of threatened species. Version 2014 <www.iucnredlist.org>. Acceso 20/04/2014.
Jaksic F. 1989. What do carnivorous predators cue in on: size or abundance of mamalian prey? A crucial test in California, Chile and Spain. Revista Chilena de Historia Natural 62: 237-249.
Jaksic F. 2001. Ecología de comunidades. Ediciones Universidad Católica de Chile. Santiago, Chile. 233 p.
Klare U., J.F. Kamler & D.W. Macdonald. 2011. A comparison and critique of different scat-analysis methods for determining carnivore diet. Mammal Review 41(4): 294-312. doi: 10.1111/j.1365-2907.2011.00183.x
Koepcke H.W. & M. Koepcke. 1963. Las aves silvestres de importancia económica del Perú. Servicio Forestal y de Caza y Servicio de Pesquería, Lima.
Korschegen L.J. 1987. Procedimientos para el análisis de los hábitos alimentarios. In: R. Rodríguez (Ed). Manual de técnicas de gestión de vida silvestre. The Wildlife Society. Inc. Bethesda. Pp.119-134.
Levins R. 1968. Evolution in changing environments: some theoretical explorations. Princeton University Press, Princeton, New Jersey.
Lockie J.D. 1959: The estimation of the food of the foxes. Journal of Wildlife Management 23: 224-227.
Lucherini M., J.I. Reppucci, R.S. Walker, et al. 2009. Activity Pattern Segregation of Carnivores in the High Andes. Journal of Mammalogy 90(6): 1404-1409. doi: 10.1644/09-MAMM-A-002R.1
Manfredi C., M. Lucherini, A. Canepuccia & E. Casanave. 2004. Geographical variation in the diet of Geoffroy's cat (Oncifelis geoffroyi) in pampas grassland of Argentina. Journal of Mammalogy 85(6): 1111-1115.
Monroy-Vilchis O. & C. Frieven. 2006. Dejection and expulsion rates of coyotes (Canis latrans) in Captivity. The Southwestern Naturalist 51(2): 272-276. dx.doi.org/10.1894/0038-4909(2006)51[272:DAEROC]2.0.CO;2
Musser G.G. & M.D. Carleton. 2005. Superfamily Muroidea, In: D.E. Wilson and D.A.M. Reeder, eds. Mammal species of the World: A taxonomic and geographic reference. 3rd edn. Johns Hopkins University Press, Baltimore. Pp. 894_1531.
Myers P. 1989. A preliminary revision of the varius group of Akodon (A. dayi, dolores, molinae, neocenus, simulator, toba and varius). In: K.H. Redford and J.F. Eisenberg, eds. Advances in Neotropical Mammalogy. Sandhill Crane Press, Inc., Gainesville, Florida. Pp. 5_54.
Myers P., J.L. Patton & M.F. Smith. 1990. A review of the boliviensis group of Akodon (Muridae: Sigmodontinae), with emphasis on Peru and Bolivia. Miscellaneous Publication of the Museum of Zoology, University of Michigan 177: 1-104.
Napolitano C., M. Bennett, W.E. Johnson, et al. 2008. Ecological and biogeographical inferences on two sympatric and enigmatic Andean cat species using genetic identification of faecal samples. Molecular Ecology 17: 678-690. doi: 10.1111/j.1365-294X.2007.03606.x
Novack A., M. Main, M. Sunquist & R. Labisky. 2005. Foraging ecology of jaguar (Panthera onca) and puma (Puma concolor) in hunted and non-hunted sites within the Maya Biosphere Reserve, Guatemala. J. Zool., Lond. 267: 167_178.
Nowell K. & P. Jackson. 1996. Status Survey and Conservation Action Plan: Wild Cats. IUCN/SSC Cat Specialist Group, Gland, Switzerland. 421 pp.
Olds, N. & S. Anderson. 1989. A diagnosis of the Tribe Phyllotini (Rodentia, Muridae). In: K.H. Redford and J.F. Eisenberg, eds. Advances in the Neotropical Mammalogy. Sandhill Crane Press, Gainesville, Florida. Pp. 55-75.
Palacios R. 2006. Análisis de dieta y superposición de nicho trófico de un ensamble de carnívoros en la Patagonia Argentina. Tesina de licenciatura en Biología. Facultad de Ciencias Exactas Físicas y Naturales, Ciencias biológicas Universidad Nacional de Córdoba, Argentina.
Palacios R., 2007. Manual para identificación de carnívoros andinos. Alianza Gato Andino, Córdoba, Argentina. 40 pp.
Pearson O. 1948. Life history of mountain vizcachas in Peru. Journal of Mammalogy 29: 345-374.
Pearson O. 1951. Mammals in the highlands of southern Peru. Bulletin of the Museum of comparative Zoölogy 106(3).
Pizzimenti J.J. & R. De Salle. 1980. Dietary and morphometric variation in some Peruvian rodent communities: the effect of feeding strategy on evolution. Biological Journal of the Linnean Society 13(4): 263-285.
Rau J. & D. Martínez. 2004. Identificación de los órdenes de aves chilenas a través de la microestructura de sus plumas. En: A. Muñoz, J. Rau y J. Yañes, eds. Aves rapaces de Chile. CEA Ediciones, Santiago, Chile. Pp. 229-234.
Reig O.A. 1987. An assessment of the systematic and evolution of the Akodontini, with the description of new fossil species of Akodon (Cricetidae: Sigmodontinae). In: B.D. Patterson and R.M. Timm, eds. Studies in Neotropical mammalogy. Essays in honor of Philips Hershkovitz Fieldiana, Zoology, new series 39. Pp. 347-399.
Reise D. 1973. Clave para determinación de los cráneos de marsupiales y roedores chilenos. Gayana Zoología (Chile) 27: 1-20.
Roemer G.W., M.E. Gompper & B.V. Valkenburgh. 2009. The Ecological Role of the Mammalian Mesocarnivore. BioScience 59: 165_173. doi.10.1525/bio.2009.59.2.9
Romo M.C. 1995. Food habits of the Andean fox (Pseudalopex culpaeus) and notes on the mountain cat (Felis colocolo) and puma (Felis concolor) in the Río Abiseo National Park, Perú. Mammalia 59(3): 335-343.
Ruiz-Olmo J., F. Blanch & F. Vidal. 2003. Relationships between the red fox and waterbirds in the Ebro Delta Natural Park, N.E. Spain. Waterbirds 26(2): 217-225.
Schoener T.W. 1971. Theory of Feeding Strategies. Annual Review of Ecology and Systematics 2: 369-404.
Schulenberg T.S., D.F. Stotz, D.F. Lane, et al. 2007. Aves de Perú. Field Museum of Natural History. 660pp.
Silva-Pereira J.E., R.F. Moro-Ríos, D.R. Bilski & F.C. Passos. 2011. Diets of three sympatric Neotropical small cats: Food niche overlap and interspecies differences in prey consumption. Mammalian Biology 76: 308-312. doi:10.1016/j.mambio.2010.09.001
Silveira L., A.T.A. Jácomo & M. Malzoni Furtado. 2005. Pampas cat ecology and conservation in the Brazilian grasslands. Project of the Month, Cat Specialist Group Web site. http://www.catsg.org/catsgportal/project-o-month/02_webarchive/grafics/sept2005.pdf Accessed 11/06/2013.
Sunquist M. & F. Sunquist. 2002. Wild cats of the world. University of Chicago Press, Chicago, Illinois.
Taifa T. & E. Yensen. 2001. Mamíferos de los bosques de Polylepis de Bolivia. Rev. Bol. Ecol. 9: 29- 44.
Villalba L, M. Lucherini, S. Waker, et al. 2004. El Gato Andino: Plan de Acción para su Conservación. La Paz: Alianza Gato Andino. 83pp.
Viscarra M.E. 2008. Evaluación de la distribución, densidad y dieta de carnívoros en cuatro tipos de hábitats en un área de la provincia Sud Lípez (Potosí-Bolivia). Tesis, título de Licenciatura en Ciencias Biológicas. Facultad De Ciencias Puras y Naturales, Carrera De Biología. Universidad Mayor De San Andrés.
Voss R.S. 1991. An introduction to the Neotropical muroid rodent genus Zygodontomys. Bulletin of the American Museum of Natural History 210: 1_113.
Walker R.S., A.J. Novaro, P. Perovic, et al. 2007. Diets of three species of Andean carnivores in high-altitude deserts of Argentina. Journal of Mammalogy 88: 519-525.
Weaver J.L. & S.W. Hoffman. 1979. Differential detectability of rodents in coyote scats. The Journal of Wildlife Management 43: 783-786.
Wozencraft W.C. 1993. Carnivores. In: D.E. Wilson and D.M. Reeder, eds. Mammal Species of the World. 2nd ed. Smithsonian Institution Press, Washington, D.C. Pp. 279-348.
Presentado: 04/11/2013
Aceptado: 15/12/2013
Publicado online: 26/05/2014
Journal home page: http://revistasinvestigacion.unmsm.edu.pe/index.php/rpb/index