Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.21 no.1 Lima 2014
http://dx.doi.org/http://doi.org/10.15381/rpb.v21i1.8249
http://doi.org/10.15381/rpb.v21i1.8249
TRABAJOS ORIGINALES
Estado del zorro gris Lycalopex griseus (Gray, 1837) (Mammalia: Canidae) en el Perú
Status of gray fox Lycalopex griseus (Gray, 1837) (Mammalia: Canidae) from Peru
Elena Vivar y Víctor Pacheco
Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Apartado 14-0434, Lima 14, Perú.
Email Elena Vivar: elenavivarp@gmail.com
Email Víctor Pacheco: vpachecot@unmsm.edu.pe
Resumen
Se sustenta la presencia del zorro gris Lycalopex griseus (Gray, 1837) en la costa sur del Perú en base a información morfológica externa y craneal. Esta especie es de similar tamaño a L. sechurae (Thomas, 1900) pero diferenciable en una mayor longitud del hocico y menor amplitud del cráneo; esta diferencia es respaldada en un Análisis de Componentes Principales. Se sugiere que la población del zorro gris en el Perú podría constituir una subespecie nueva de L. griseus por encontrarse más al norte de su distribución tradicionalmente conocida y separada de otras subespecies por el Desierto de Atacama en el norte de Chile, notable barrera biogeográfica.
Palabras claves: Canidae; Lycalopex; morfología; morfometría; poblaciones.
Abstract
The presence of the gray fox Lycalopex griseus (Gray, 1837) in the southern coast of Peru is supported based on external and cranial morphological information. This species is compared with L. sechurae (Thomas, 1900), a fox of similar size, but distinguished from it by a snout greater length and a smaller breadth of the skull. A Principal Component Analysis supports this difference. It is suggested that the gray fox populations in Peru could be a new subspecies of L. griseus because its disjunt distribution with respect to other subspecies from which are separated by the Atacama Desert, a remarkable biogeographical barrier in northern Chile.
Key words: Canidae; Lycalopex; morphology; morphometrics; populations.
Introducción
Los cánidos silvestres en el Perú, están representados por seis especies: Atelocynus microtis (Sclater, 1882), Chrysocyon brachyurus (Illiger, 1815), Lycalopex culpaeus (Molina, 1782), L. griseus (Gray, 1837), L. sechurae (Thomas, 1900) y Speothos venaticus (Lund, 1842) según Pacheco et al. (2009). La mayoría de ellos con caracteres morfológicos externos muy distintivos que permiten discriminar una especie de otra; sin embargo, la presencia de Lycalopex griseus en el Perú es aun un tema controversial. Si bien la especie fue reconocida en nuestro medio (Grimwood 1969, Pearson y Pearson 1978, Zeballos et al. 2000, Quintana et al. 2000, Zeballos et al. 2001, Pacheco et al. 2009), otros autores dudan de que este zorro esté distribuido en el Perú o lo han omitido sin mayor comentario (Know 2003, González del Solar y Rau 2004, Wozencraft 2005, Jiménez et al. 2008). Pacheco et al.(2009) documentó la existencia de varios especímenes procedentes del Perú que sustentan inequívocamente la presencia de esta especie desde Lima central hasta Tacna, a lo largo de la Costa y Vertiente Occidental. El objetivo principal de este trabajo es contribuir con información adicional para sustentar la presencia del zorro gris en el Perú, diferenciándola de las otras dos especies peruanas (i.e., L. culpaeus y L. sechurae) en base a un análisis morfológico y morfométrico craneal y dental.
Especies de Lycalopex
El zorro andino Lycalopex culpaeus es una especie mediana, que pesa de 7 _ 12 kilos. Tiene una amplia distribución en América del sur, desde el sur de Argentina hasta Colombia (Knop 2003, Wozencraft 2005), aunque prefiere las elevaciones altas también se le suele encontrar en las bajas como en Lomas de Atiquipa y Mejía (Zeballos 2000), San Juan de Marcona (Tantaleán et al. 2007), Lomas de San Fernando (Vivar 2008) y Lomas de Lachay (INRENA 2002).
El zorro gris Lycalopex griseus es pequeño, pesa de 3 _ 4 kg; en Argentina se distribuye desde los 23° sur hasta Tierra de Fuego; mientras que en Chile se distribuye desde Atacama hasta el Estrecho de Magallanes (González del Solar y Rau 2004). De acuerdo a Osgood (1943) y Cabrera (1958) existen cuatro subespecies de L. griseus: L. g. griseus, distribuido en las Pampas del oeste de Argentina desde el Estrecho de Magallanes hasta Chubut; L. g. gracilis, desde Santiago de Estero y Catamarca hasta oeste del Río Negro, Argentina; L. g. domeykoanus, en Chile central desde Concepción hasta la parte sur de la Provincia de Atacama; y L. g. maullinicus, en la parte centro sur de Chile, en la Región del Bosque de Valdivia. En el Perú, la especie se distribuye desde San Bartolo, Lima hasta Tacna (Pacheco et al. 2009, MINAM 2011).
El zorro costeño Lycalopex sechurae, de tamaño pequeño (2 - 6 kg) se distribuye mayormente en la región costera y vertiente occidental de los Andes, desde el extremo suroeste de Ecuador hasta el centro de Lima (Asa y Cossíos 2004; Cossíos 2004, 2008; INRENA, 2002), desde el nivel de mar (Cossíos 2010), hasta los 2250 m en Mital, Bosque de Zárate, Prov. Huarochirí, Lima. (E. Díaz, comm. pers.).
En la costa del Perú Lycalopex griseus y L. sechurae presentan distribuciones contiguas y al parecer parapátricas; sin embargo en las costas de Chile L. griseus se encuentra en simpatría con Lycalopex fulvipes (Martin, 1837), especie restringida a la Isla de Chiloé y la parte costera del Parque Nacional Nahuelbuta (Jiménez et al. 20 04, Wozencraft 2005).
Material y métodos
Se examinaron pieles, cráneos y registros fotográficos de Lycalopex griseus procedentes del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos Lima, MUSM; del Museo de la Universidad de San Agustín Arequipa, MUSA; y del Museum of Vertebrate Zoology Berkeley, MVZ (Anexo 1). Se midieron once ejemplares de L. griseus, cinco de L. sechurae y cuatro de L. culpaeus. Todos fueron considerados adultos, en base a la presencia de suturas fusionadas entre el basiesfenoide y occipital.
Se utilizaron las siguientes medidas craneométricas de Zunino et al.(1995): Longitud condilobasal (LCB), Longitud palatal (LP), Longitud mínima del rostro(LMR), Longitud del rostro (LR), Longitud de la bula (LB), Longitud de la fila de dientes del maxilar (LFDMx), Longitud entre el P4-M2 (LP4-M2), Altura mínima del rostro (AlMR), Altura de la caja craneana (AlCC), Constricción interorbital (CI), Constricción postorbital (CP), Ancho del rostro en caninos (ARC), Ancho del rostro en primeros molares superiores (ARPM), Ancho cigomático (AC), Ancho del mastoide (AM), Ancho de la caja craneana (ACC), Ancho a través de los cóndilos occipitales (ACO), Ancho entre procesos postglenoideos (APG), Longitud P4 (LP4),ancho P4 (AP4), Longitud m1 (Lm1), Ancho m1 (Am1), Altura del rostro en P2-P3 (AlRP2-P3), Longitud mandibular (LM), Longitud de la fila de dientes mandibulares (LFDMa), Longitud m1-m3 (Lm1-m3), Longitud alveolar de caninos superiores (LACS), Longitud de fosas nasales (LFN), Ancho a través de los procesos postorbitales (APPO), Longitud entre procesos postorbitales y constricción postorbital (LPPCP) y Ancho de fosa mesopterigoidea (AFM).
Para cada variable se obtuvo los estadísticos descriptivos de promedio, desviación estándar, máximos, mínimos y número de muestra. Se presenta también un Análisis de Componentes Principales (ACP) con las medidas craneométricas tomadas en L. griseus y L. sechurae, usándose 21 de las 31 mediciones craneales arriba mencionadas. Ambos análisis, estadísticos y multivariados fueron ejecutados con el programa PAST: Paleontological Statistics Software Package for Education and Data Análisis (Hammer et al. 2001). El ACP fue desarrollado con siete especímenes de L. griseus, en tres de ellos los valores de una o dos variables fueron obtenidos por promedio por tener datos perdidos.
Para la comparación a nivel subespecífico, se utilizó material fotográfico de especímenes de L. griseus domeykoanus y L. griseus gracilis pertenecientes al Field Museum of Natural History de Chicago (FMNH) y al Natural History Museum de Londres respectivamente (Anexo 1), por estar éstas más cercanas a la distribución de los ejemplares estudiados del Perú.
Resultados
Externamente, Lycalopex griseus (Fig. 1) es un zorro pequeño (LT: 79 cm, LC: 26, LP: 12.5, LO: 9) con orejas grandes y cola frondosa; la longitud de esta última sobrepasa la distancia que hay entre su origen y la base de sus dedos traseros, además esta cola ostenta una conspicua mancha negra en el extremo terminal. La coloración general del manto, cabeza, patas y cola es beige grisáceo con una banda longitudinal oscura en el dorso. La parte superior del hocico presenta tonalidades ligeramente más oscuras alcanzando las mistaciales. También es evidente una mancha negra en la barbilla y una banda longitudinal delgada a manera de collar a la altura del pecho de menor tonalidad. Las patas delanteras y traseras presentan tonalidades más oscuras tanto en la parte anterior del brazo como en la base posterior del muslo, siendo ésta última una mancha bastante oscura en forma triangular. La coloración de la parte ventral es crema, que se extiende al interior de las patas, cuerpo, cuello y base del hocico, incluyendo comisuras y base de la nariz. Esta coloración ventral es evidente aún cuando el animal este de costado.
El tamaño de un pelo de guardia de la espalda es aproximadamente de 59 mm, y la disposición de sus bandas de color es la siguiente: base crema (32%), beige oscuro (20%), crema (27%) y beige oscuro (20%) en el extremo. Los pelos de borda son más cortos y en conjunto muy densos, llegando a un tamaño de 56 mm.
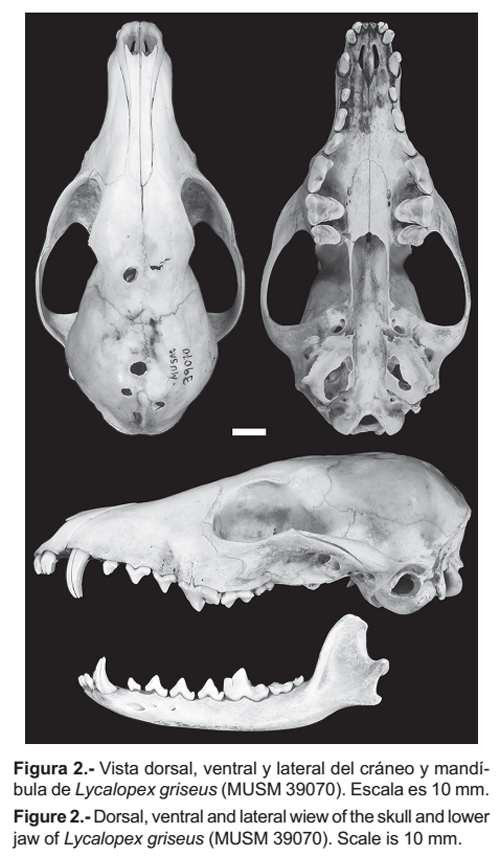
Lycalopex griseus (Fig. 2) tiene el rostro angosto y la porción anterior del arco cigomático presenta bordes afilados. El hueso lacrimal es estrecho y moderadamente alto. Los bordes exteriores del agujero infraorbitario tienden a formar un ángulo agudo. El agujero auditivo es amplio, siendo la distancia entre el borde del agujero y perfil del borde de la bula menor. El borde anterior del palatino es en forma de herradura pasando entre los agujeros palatinos superiores e inferiores, continuando en bordes laterales rectos. Los dientes P4, M1 y M2 son grandes. El P4 (carnasial) presenta un protocono que sobresale medianamente del resto del diente. El hipocono de M1 es pronunciado y junto con el cíngulum lingual le dan una forma curvada casi aguda al diente. El borde posterior de M2 termina después del borde anterior de la fosa mesopterigoidea, la cual es angosta y no presenta espina. La porción anterior de la bula timpánica es menos prominente que la parte posterior. La altura del proceso coronoide de la mandíbula es casi el doble del grosor de la mandíbula. El borde anterior de la cresta coronoide tiende a ser curva. El perfil de la base del proceso angular es horizontal.
Comparaciones
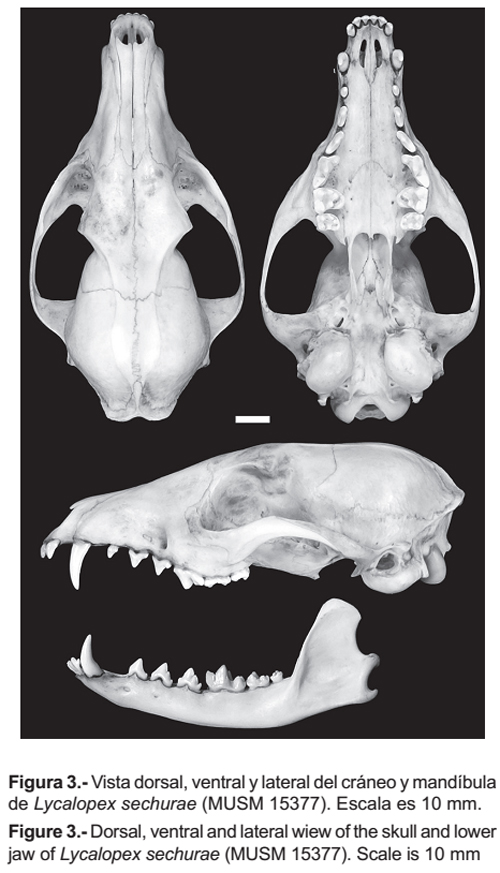
Lycalopex griseus se diferencia de L. sechurae (Fig. 3) por las siguientes características. El rostro es más angosto. La porción anterior del arco cigomático presenta bordes dorsales afilados y no redondeados como en L. sechurae. El hueso lacrimal es estrecho (5.44 mm) con una altura de (11.68 mm), mientras que en L. sechurae es más amplio (8.80 mm) y algo alto (12.61 mm). Los bordes exteriores del agujero infraorbitario tienden a formar un ángulo agudo, mientras que en L. sechurae forman un ángulo recto. El agujero auditivo es algo más amplio (6.78 mm) que en L. sechurae (5.27 mm), siendo la distancia entre el borde del agujero y perfil del borde de la bula menor (4.90 mm) que en L. sechurae (6.83 mm).
El borde anterior de los palatinos es en forma de herradura pasando entre los agujeros palatinos superiores e inferiores, continuando en bordes laterales rectos, a diferencia de L. sechurae donde el borde anterior de los palatinos tiene forma semicircular, pasando por los agujeros palatinos anteriores, pero los bordes laterales se expanden y no tocan los agujeros palatinos inferiores. Los dientes PM4, M1 y M2 son más grandes que en sechurae. El protocono del P4 (carnasial) sobresale medianamente del resto del diente, mientras que en L. sechurae sobresale notoriamente. El hipocono de M1 es pronunciado y junto al cíngulum lingual le dan una forma casi aguda al diente, en cambio en L. sechurae el hipocono es poco desarrollado y con el cingulum lingual le dan una forma curvada al diente. El borde posterior de M2 termina después del borde anterior de la fosa mesopterigoidea, en L. sechurae éste termina antes. El ancho de la fosa mesopterigoidea generalmente es angosta y no presenta espina, en L. sechurae siempre es amplia con bordes anteriores curvados para dar lugar a una espina. La porción anterior de la bula timpánica es menos prominente que la parte posterior, en L. sechurae ambas porciones son prominentes. La altura del proceso coronoide de la mandíbula es casi el doble del grosor de la mandíbula, en L. sechurae es más del doble del grosor de la mandíbula. El borde anterior de la cresta coronoide tiende a ser curva, en L. sechurae es casi recta. El perfil de la base del proceso angular es horizontal, en L. sechurae es oblicuo.
Lycalopex griseus se diferencia de L. culpaeus por las siguientes características. La porción anterior del arco cigomático en L. griseus presenta bordes dorsales afilados mientras que en L. culpaeus los bordes son redondeados.
El hueso lacrimal es estrecho (5.44 mm) con una altura de (11.68 mm), mientras que en L. culpaeus que es más amplio (8.54 mm) y más alto (14.37 mm). Los bordes exteriores del agujero infraorbitario forman un ángulo agudo como en L. culpaeus. El agujero auditivo es casi tan amplio (6.78 mm) como en L. culpaeus (6.58 mm), siendo la distancia entre el borde del agujero y perfil del borde de la bula menor (4.90 mm) que en L. culpaeus (7.85 mm).
El borde anterior del palatino es en forma de herradura pasando entre los agujeros palatinos superiores e inferiores, continuando en bordes laterales rectos, a diferencia de L. culpaeus donde el borde anterior del palatino tiene forma semicircular o angular, pasando por los agujeros palatinos anteriores e inferiores. Los dientes PM4, M1 y M2 son más pequeños que en culpaeus. El P4 (carnasial) como en L. culpaeus presenta el protocono que sobresale medianamente del resto del diente. El hipocono de M1 es pronunciado y conjuntamente con el cingulum lingual le dan una forma casi aguda al diente, en L. culpaeus el hipocono es bastante pronunciado y con el cingulum lingual forman un borde curvado. El borde posterior de M2 termina después del borde anterior de la fosa mesopterigoidea, en L. culpaeus éste termina a la misma altura. El ancho de la fosa mesopterigoidea es más angosta y no presenta espina, en L. culpaeus es amplia con bordes anteriores curvados para dar lugar a una o dos espinas. La porción anterior de la bula timpánica es menos prominente que la parte posterior, en L. culpaeus ambas porciones son prominentes. La altura del proceso coronoide de la mandíbula es casi el doble del grosor de la mandíbula, en L. culpaeus es más del doble. El borde anterior de la cresta coronoide de la mandíbula tiende a ser curva, en L. culpaeus es casi recta.
Lycalopex culpaeus se diferencia de las otras dos especies en casi todas sus dimensiones de largo, ancho y altura. En cambio, las mediciones de L. griseus y L. sechurae son similares entre ellas (Tabla 1). Un cráneo de un L. culpaeus juvenil (con PM4 y M1 en desarrollo) es casi tan largo pero a la vez más amplio (LCB: 105, ACC: 46.39) que un adulto de L. griseus o L. sechurae.
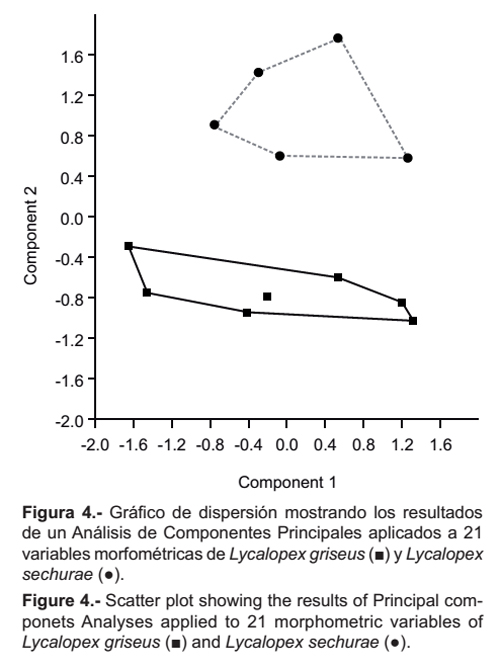
En el análisis de Componentes Principales, donde se confrontan L. griseus y L. sechurae, los porcentajes de los autovalores resultantes para los dos primeros componentes principales fueron 56.7% y 31.87% (Tabla 2). Los coeficientes del primer componente fueron todos positivos y el segundo tuvo una alta carga negativa en: Lm1-m3 (-0.8672), LFDMa (-0.6776), LFDMx (-0.6590), Am1 (-0.6428) y LMR (-0.4041), esto indica que hacia abajo del plot las proporciones de estas medidas aumentan; al contrario, los coeficientes con alta carga positiva fueron: ALRP2-P3 (0.9070), APPO (0.8874), APG (0.8842), Lm1-m3 (0.8672), LPPCP (0.7690), AFM (0.7070), AC (0.7009), ACO (0.5501), AM (0.5604), ARC (0.5158), ALMR (0.5496) y ACC (0.3617)(Tabla 2).
En el gráfico de dispersión de los componentes 1 y 2 (Figura 4) se observa dos grupos discretos que corresponden a las dos especies. L. sechurae se encuentra sobre el eje de las abscisas y L. griseus debajo de ella. Con estos resultados se corrobora mediante análisis multivariante las observaciones morfológicas indicadas anteriormente, en cuanto a las dimensiones de amplitud de los ejemplares de L. griseus, como: Ancho entre procesos postorbitales, Ancho cigomático, Ancho mastoideo y Ancho entre procesos postglenoideos, a la vez en las dimensiones de longitud como: Longitud mínima del rostro, Fila de dientes maxilares, Fila de dientes mandibulares y Longitud de m1 y m3. Estas nos indican que L. griseus presenta un cráneo más angosto, a la vez que un hocico más largo que L. sechurae.
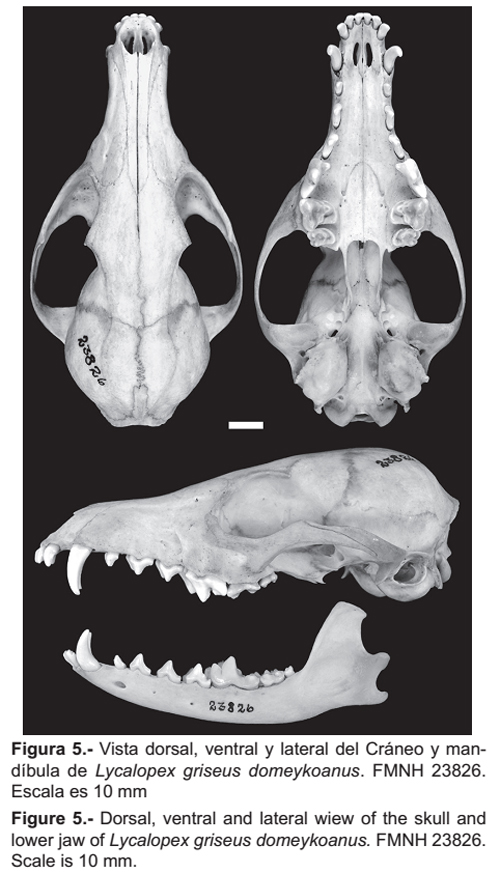
El material fotográfico de L. griseus domeykoanus (FMNH 23826) (Fig. 5) nos muestran que este presenta un cráneo ligeramente más robusto con un hueso lacrimal más amplio, además las bullas auditivas son muy prominentes en su totalidad con reducido conducto auditivo óseo, a diferencia de los especímenes de L. griseus de Perú. Por otro lado L. griseus gracilis (BM [NH] 18-11-11-85) presenta un cráneo más alto con perfil cóncavo notorio, bulas timpánicas más pequeñas y arcos cigomáticos menos amplios, pero al igual que los ejemplares de Perú presenta un hueso lacrimal angosto.
Discusión
Las diferencias en caracteres de las especies examinadas son claras por lo que podemos afirmar que existen dos especies de zorros pequeños en el lado occidental de los Andes peruanos, L. sechurae en el norte y centro y L. griseus en el centro y sur, sustentando así la propuesta de Pacheco et al. (2009). Ambas especies ocupan mayormente ambientes costeros, aunque al parecer L. sechurae sube hasta los 2000 m.
Como en Pacheco et al. (2009), apoyamos el uso del nombre genérico Lycalopex propuesto por Zunino et al. (1995), pero manteniendo a griseus como taxón independiente de gymnocercus (Wozencraft 2005), conservando no obstante sus respectivas subespecies originales.
Quintana et al. (2000) y González del Solar y Rau (2004) presumieron que individuos avistados en Arequipa y Tacna pertenecerían a L. g. domeykoanus, sin presentar mayor sustento. Sin embargo, los caracteres morfológicos descritos aquí para las poblaciones peruanas no coinciden con domeykoanus ni con L. g. gracilis. Por ello, se puede sostener que las poblaciones peruanas podrían corresponder a una subespecie diferente, sin nombre aún. Esta hipótesis estaría acorde también con la distribución disyunta de las poblaciones peruanas y las del norte de Chile separadas ambas por el desierto de Atacama, que si bien en el Pleistoceno este desierto presentaba una diversidad de plantas propias de estepas, en el Holoceno llegó a ser hiperárido convirtiéndose en una efectiva barrera de dispersión (Latorre et al., 2002). Un mayor número de muestras y posiblemente análisis moleculares son necesarios para caracterizar la población peruana, comparándola con las subespecies existentes de L. griseus.
En el Perú L. griseus ha sido muy poco estudiada, por lo que no se sabe apropiadamente sobre su estado de conservación. Los escasos y esporádicos registros visuales (Anexo 2) y la existencia de algunos pocos ejemplares en Museos de Historia Natural nos sugieren que sus poblaciones son bajas y debe ser protegida.
Agradecimientos
Agradecemos especialmente a los Curadores Bruce D. Patterson del Field Museum of Natural History, Chicago; Evaristo López del Museo de Historia Natural de la Universidad San Agustín, Arequipa; James L. Patton del Museum of Vertebrate Zoology, Berkeley; y Paula Jenkins del Natural History Museum of London, por facilitarnos especímenes o información de las colecciones a su cargo. A los investigadores y amigos: Alfonso Orellana, Carlos Jiménez, Delsy Trujillo, Erik Ramirez, Giuseppy Calizaya, Helena Sisniegas, Horacio Zeballos, Hugo Castillo, Jaime Pacheco, Jéssica Amanzo, Joel Córdova, Mario Tenorio, Richard Cadenillas, Richy Tomairo, Rodolfo Salas y Sandra Velazco que nos proporcionaron diversas ayudas como testimonios, especímenes y fotografías. A los Doctores Alfred Gardner del National Museum of Natural History y Gerardo Lamas del Museo de Historia Natural (UNMSM) por apoyarnos con bibliografía y consejo.
Literatura citada
Asa CH. & E.D. Cossíos. 2004. Sechuran fox (Pseudalopex sechurae). In: C. Sillero-Zubiri, M. Hoffmann & D.W. Macdonald, eds. Canids: foxes, wolves, jackals and dogs. Status Survey and Conservation Action Plan. IUCN/SSC Canid Specialist Group. Gland, Suitzerland and Cambridge. Pp. 69-72.
Cabrera A. 1958. Catálogo de los mamíferos de América del Sur. Museo Argentino de Ciencias Naturales Bernardino Rivadavia 4(1): 1-733.
Cossíos D. 2004. Relaciones entre el zorro de Sechura, Pseudalopex sechurae (Thomas), y el hombre en el Perú. 2004. Ecología Aplicada 3(1 y 2): 134-138.
Cossíos D. 2010. Lycalopex sechurae (Carnivora: Canidae). Mammalian Species 42(848): 1_6. doi: http://dx.doi.org/10.1644/848.1
González del Solar R. & J. Rau. 2004. Chilla. Pseudalopex griseus. In: Sillero-Zubiri C, M. Hoffman & D. Macdonald, eds. Canids: Foxes, Wolves, Jackals and Dogs. Status Survey and Conservation Action Plan. IUCN/SSC Canid Specialist Group. Gland, Suitzerland and Cambridge. Pp. 56-63. <http://www.canids.org/species/Chilla.pdf> Acceso 02/06/13.
Grimwood J.R.1969. Notes on the distribution and status of some Peruvian mammals 1968. American Committee for International a Wildlife Protection and New York Zoological Society, Special publication 21: 1-86.
Hammer Ø., D.A.T. Harper & P. D. Ryan, 2001. PAST: Paleontological Statistics Software Package for Education and Data Analysis. Palaeontologia Electronica 4(1): 1-9. <http://palaeo-electronica.org/2001_1/past/issue1_01.htm>. Acceso 02/06/13.
INRENA 2002. Plan Maestro de La Reserva Nacional de Lachay 2003-2007. Lima, 67 pp, 5 mapas.
Jiménez J.E., M. Lucherini & A.J. Novaro. 2008a. (en línea) Pseudalopex culpaeus. In: IUCN 2011. IUCN Red List of Threatened Species. Version 2011.2. <http://www.iucnredlist.org>. Acceso 02/06/2013.
Jiménez J., E. McMahon. 2004. Darwin's fox Pseudalopex fulvipes (Martin, 1837). In: Sillero-Zubiri C., Hoffmann M., Macdonald D.W. (eds). Canids: foxes, wolves, jackals and dogs. Status survey and conservation action plan. IUCN/SSC Canid Specialist Group. Gland, Switzerland and Cambridge, UK, pp. 50-55.
Jiménez J.E., M. Lucherini, & A.J. Novaro, 2008b. (en línea) Pseudalopex griseus. In: IUCN 2011. IUCN Red List of Threatened Species. Version 2011.2. <http:// www.iucnredlist.org>. Acceso 02/06/2013.
Jiménez J.E., M. Lucherini & A.J. Novaro, 2008c. (en línea) Pseudalopex fulvipes. In: IUCN 2011. IUCN Red List of Threatened Species. Version 2011.2. <http://www.iucnredlist.org>. Acceso 02/06/2013.
Knop K. 2003. (en línea) «Lycalopex griseus» Animal Diversity Web. <http://www.animaldiversity.ummz.umich.edu/site/accounts /information/Lycalopex_griseus.html>. Acceso 02/06/2013.
Latorre C., J.L. Betancourt, K.A. Rylander & J. Quade. 2002. Vegetation invasions into absolute desert: A 45 000 yr rodent midden record from the Calama-Salar de Atacama basins, northern Chile (lat 22°-24°S). Geographical Society American Bulletin 114(3): 349-366. doi: 10.1130/0016-7606.
MINAM 2011. Informe Final del Estudio de Especies CITES de Carnivoros Peruanos. <http://sinia.minam.gob.pe/admDocumento.php?accion=bajar&docadjunto=3597>. Acceso 01/05/2014.
Osgood W.H. 1943. Mammals of Chile. Fieldiana Zoology 30: 1-268.
Pacheco V., R. Cadenillas E. Salas, C. Tello & H. Zeballos. 2009. Diversidad y conservación de los mamíferos del Perú. Revista Peruana de Biología 16(1): 5-32.
Pearson O.P. & C. Pearson, 1978. The diversity and abundance of vertebrate along an altitudinal gradient in Peru. Memorias del Museo de Historia Natural "Javier Prado" 18: 1-97.
Quintana V., J. Yáñez & M. Valdebenito. 2000. Orden Carnivora. In: A. Muñoz-Pedreros y J. Yáñez-Valenzuela, eds. Mamíferos de Chile. CEA Ediciones, Valdivia. Pp. 155-188.
Tantaleán M., L. Mendoza & F. Riofrío. 2007. El zorro Andino, Pseudalopes culpaeus, un nuevo huésped para Corynosoma obtuscens (Acanthocephala) en el Perú. Revista Peruana de Biología 14(1): 51-52.
Vivar E. 2008. Evaluación de mamíferos en las Lomas de San Fernando y zonas adyacentes a nivel continental. Boletín de la Sociedad Geográfica del Lima 121: 41-46.
Wozencraft W.C. 2005. Order Carnivora. In: Wilson, D.E. & D.M. Reeder, eds. Mammal Species of the World: A Taxonomic and Geographic Reference. 3rd ed. Johns Hopkins University Press. Pp. 532-628.
Zeballos H., L. Villegas, R. Gutiérrez, K. Caballero & P. Jiménez. 2000. Vertebrados de las Lomas de Atiquipa y Mejía, sur del Perú. Revista de Ecología Latino Americana 7(3): 11-18.
Zeballos H., V. Pacheco & L. Baraybar. 2002 (2001). Diversidad y conservación de los mamíferos de Arequipa, Perú. Revista Peruana de Biología 8(2): 94-104.
Zunino G., O.B. Vaccaro, M. Canevari & A.L. Gardner. 1995. Taxonomy of the genus Lycalopex (Carnivora: Canidae) in Argentina. Proceedings of the Biological Society of Washington 108(4): 729-745.
Presentado: 10/12/2013
Aceptado: 12/04/2014
Publicado online: 26/05/2014
Journal home page: http://revistasinvestigacion.unmsm.edu.pe/index.php/rpb/index