Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.22 no.1 Lima 2015
TRABAJOS ORIGINALES
Biodegradación de hidrocarburos en fondos de tanques de la industria petrolera
Biodegradation of hydrocarbon from bottom oil tanks
Graciela Pucci1; Adrián Acuña2; Oscar Pucci1
1 Centro de Estudios e Investigación en Microbiología Aplicada, Facultad de Ciencias Naturales, Universidad Nacional de la Patagónia San Juan Bosco, Apartado Postal 9000. Ciudad Universitaria, Comodoro Rivadavia, Argentina.
2 Universidad Tecnológica Nacional - Facultad Regional Santa Cruz. Los Inmigrantes 555. Río Gallegos (CP 9400). Santa Cruz, Argentina.
Resumen
Los fondos de tanques provenientes de la industria petrolera son un problema ambiental a resolver en la cuenca del golfo San Jorge. En este trabajo se estudio la biodegradación del hidrocarburo remanente que queda en el sedimento después del lavado con agua y detergente del fondo de tanque. Se realizaron bioreactores a los cuales se los siguió con el sistema OxiTop, consumo de oxígeno, se realizaron recuentos bacterianos y determinación de hidrocarburos por infrarrojo (IR) y por cromatografía gaseosa (GC). El sedimento proveniente del lavado de fondo de tanque contenía cantidad suficiente de bacterias degradadoras y aerobias totales, con un predominio de los géneros Pseudomonas sp y Rhodococcus sp que junto a las condiciones de 20 % humedad, oxigenación y nutrientes en una proporción de 100:3:03 redujeron los hidrocarburos de 2,9 a 0,4 %. La degradación se produjo mayoritariamente entre los hidrocarburos alifáticos de cadena entre 13 a 26 átomos de carbono, la fracción aromáticas presentó baja degradación.
Palabras claves: Fondos de tanques; biorremediación.
Abstract
Oil bottom tank sludge is an environmental problem to be solved in the Gulf San Jorge basin. In this paper we study the biodegradation of hydrocarbon remaining in the sediment after washing with water and detergent of the oil bottom tanks. Bioreactors were made to which the system followed by OxiTop, oxygen consumption, and bacterial counts were carried hydrocarbon determination infrared (IF) and by gas chromatography (GC). The sediment from the background wash tank contained enough degrading and total aerobic bacteria, with a predominance of the genera Pseudomonas sp. and Rhodococcus sp. Microbial population, and the condition of 20% humidity, oxygen and nutrients in a ratio of 100: 3: 03 showed an decreased from 2.9 to 0.4% of hydrocarbon with a strong used of linear alkane (13 to 26C) and less used of aromatic.
Keywords: oil bottom tank; biorremediation.
Introducción
El manejo inadecuado de los materiales y residuos ha generado en todo el mundo un problema de contaminación de los suelos y cuerpos de agua. Entre las más severas contaminaciones se destacan las producidas a causa de la extracción y el manejo del petróleo en todos los países productores de hidrocarburos (Wang et al. 2006). El tratamiento de residuos contaminados con hidrocarburos es esencial para mantener la calidad del medio ambiente y la salud de la población. La industria petrolera genera contaminantes sólidos, semisólidos y líquidos que requieren diferentes formas de tratamiento. Los tratamientos pueden ser físicos, químicos y biológicos dependiendo de la muestra y el estado de contaminación que posea. Los tratamientos biológicos son muy buenos pero necesitan condiciones de pH, humedad, nutrientes y concentraciones de hidrocarburos y metales pesados por debajo de 5% y 2500 ppm respectivamente (EPA 2004).
Uno de los residuos generados por esta actividad en las plantas de tratamiento y almacenamiento son los llamados fondos de tanque, se trata de un producto acumulado en el fondo de los tanques de almacenamiento de petróleo y otras instalaciones, formado por la precipitación de las partículas sólidas y fracciones del petróleo. Los fondos de tanque de petróleo son periódicamente removidos ya que quitan espacio de almacenamiento es estos. Estos suelen contener agua, sedimentos, arenas, grasas, aceites, petróleo, compuestos orgánicos y elementos inorgánicos, como los metales, en algunos casos dependiendo de la cuenca de donde se extraiga el crudo. Existen varios métodos para la decontaminación de los fondos de tanque, en la cuenca del Golfo San Jorge en algunas áreas se realiza un lavado del mismo con detergentes y agua caliente, quedando un residuo que contiene partículas finas de sedimento un porcentaje variable de hidrocarburos, pero este sigue siendo elevado, superior a la que exige la legislación vigente, por lo que se debe seguir tratando.
Existe una gran variedad de tratamientos que pueden aplicarse a este tipo de residuos contaminados con hidrocarburos, que van desde solo disponerlos en lugares considerados seguros, métodos de incineración, tratamientos químicos y tratamientos biológicos. La biorremediación, un tratamiento biológico, es una de las herramientas más adecuadas para el saneamiento de estos residuos. Es una técnica de bajo costo de operación que ha sido aplicada exitosamente en este tipo de contaminaciones en suelos patagónicos (Pucci et al. 2000, Pucci et al. 2013).
Existen diversos parámetros que pueden aumentar la eficiencia de estos tratamientos, como el agregado de nutrientes e inoculación de bacterias seleccionadas obtenidas del mismo sitio (Acuña et al. 2012). Otro aspecto de gran importancia es la composición del residuo a tratar, los tres grupos principales de compuestos presentes en los hidrocarburos del petróleo (alifáticos, aromáticos y polares) tienen diferentes velocidades de biodegradación y algunos de ellos también presentan una marcada toxicidad para ciertos grupos bacterianos e inhiben su crecimiento (Pucci y Pucci 2003). La biodegradación puede complementarse con otras tecnologías que pueden en determinadas situaciones aumentar su eficiencia. La utilización de bacterias es factible, hay autores que han trabajado con mezclas de microorganismo a fin de optimizar la degradación (Ferrari et al. 1996, Gallego et al. 2007, Matsui et al. 2013, Saikia et al. 2013) ya que son muestras complejas con hidrocarburos de cadenas largas.
El objetivo del trabajo fue estudiar la posibilidad de la degradación de los hidrocarburos presentes en los sedimentos que quedaron después del proceso de lavado del fondo de tanque por parte de la comunidad bacteriana presente en la muestra con agregado de nutrientes para favorecer el proceso.
Materiales y métodos
Muestra de fondo de tanque.- Se trabajó con fondos de tanques de la industria petrolera que habían sido tratados previamente con lavado de agua a 70 °C con tensiactivo biodegradable, que redujo el contenido de hidrocarburo.
Análisis físico químico, caracterización inicial.- Se determinó la presencia de los siguientes aniones y cationes: cloruros, por método argentimétrico de Mohr (Standard methods, 1992), carbonatos y bicarbonatos, por titulación con ClH valorado (Standard methods, 1992), sulfatos, por método turbidimétrico (Standard methods, 1992), calcio y magnesio, por titulación complejométrica con solución de EDTA (Standard methods, 1992), hierro, por método colorimétrico, mediante la utilización de tiocianato (Obras Sanitarias de la Nación 1970), amonio por el método colorimétrico basado en la reacción del amoníaco, libre y/o liberado por hidrólisis de la urea, con fenol e hipoclorito en medio alcalino dando como resultado un complejo coloreado, el Azul de Indo fenol que es leído en el espectrofotómetro a 540 nm (método de uremia de laboratorios Wiener), fosfatos, método colorimétrico basado en la reacción entre el fósforo inorgánico y el molibdato en medio ácido para dar fosfomolibdato, que es reducido por el ácido ascórbico a azul de fosfomolibdeno. El exceso de molibdato se eliminó con una solución de arsenito/citrato y el complejo coloreado formado se mide en espectrofotómetro a 620 nm (equipo de determinación de fosfatemia de Laboratorios Wiener). pH (EPA 9040C), densidad aparente, porosidad y capacidad de retención de agua (Garcia Trejo 1981).
Experiencia de biodegradación.- Se armaron bioreactores conteniendo 100 g de sedimento de fondo de tanque, por triplicado, a los cuales se les adicionó agua destilada y nutrientes en una relación 100:3:0,3 de carbono, nitrógeno y fósforo respectivamente (sales utilizadas (NH4)2SO4, NH4 NO3, K2HPO4 y KH2PO4). Se incubó a 28 °C durante 80 días en frascos color caramelo y con el sistema de OxiTop para medición de consumo de oxígeno automático.
Recuento de microorganismos.- El número de microorganismos fue determinado por la técnica de conteo en placa. Se utilizó una suspensión de 10 g de suelo en 90 mL de solución fisiológica estéril que se agitó 30 minutos a 150 r.p.m. Para bacterias totales se utilizó agar nutritivo g/L (5 g peptona de carne, 3 g extracto de levadura, 12 g de agar, 1000 mL de agua destilada, pH 7.2), para bacterias degradadoras de hidrocarburos (BDH) se utilizó un medio mineral 100 mL solución I, 25 ml de la solución II y 14 g de agar-agar completando al litro con agua destilada (solución I (g/L): cloruro de calcio 0.235 g, nitrato de potasio 0.427 g, sulfato de amonio 5 g, cloruro de magnesio hexahidratado 1 g, bicarbonato de potasio 1,2 g. Solución II (g/L): fosfato ácido di sódico dihidratado 0.5 g, fosfato monopotásico 0.5 g. Solución III: EDTA-Na 800 g, cloruro ferroso 300 g, cloruro de calcio hexahidratado 4 g, cloruro de manganeso tetrahidratado 10 g, sulfato cúprico 1g, permanganato de potasio dihidratado 3 g, cloruro de zinc 2 g, cloruro de litio 0.5 g) al cual se le agregó 30 μL de una mezcla de petróleo y gasoil 1:1 por diseminación en superficie que se denominó MBM-PGO (Pucci y Pucci 2003).
Análisis de hidrocarburos.- Determinación por espectrofotometría infrarroja (IR): Sobre dos gramos de muestra mezclados con dos gramos de sulfato de sodio, se procedió a extraer los hidrocarburos presentes con tetracloruro de carbono durante 30 minutos por sonicación. El extracto orgánico obtenido se limpió con sílica gel para posteriormente realizar la lectura en el infrarrojo medio a 2930 cm-1 según lo propuesto por la norma EPA 418.1.
Determinación de hidrocarburos por Cromatografía Gaseosa (GC). Para determinar la composición de los hidrocarburos presentes en la muestra se mezcló 2 g de la muestra, 1 g SO4Na2 y 10 mL de Hexano, la cual se filtró para separar la fase solida y liquida. Seis mililitros del filtrado se evaporo cuidadosamente hasta sequedad, se enfrió y retomó con 50 μL de Hexano. Para la cuantificación se utilizo un cromatógrafo de gases Varian 3800 GC, con detector FID y una columna capilar VF-5ms (30 m, 0.25 mm, 0.2523 μm). La temperatura del inyector fue de 200 °C y la del detector FID 300 °C, se inyecto 1 μL. Los parámetros de corrida de la columna fueron las siguientes: 45 a 100 °C con un aumento de 5 °C/min y una segunda rampa de 100 a 275 °C a 8 °C/min. La temperatura final de 275 ºC se mantuvo por 5 minutos.
Aislamiento e identificación de cepas bacterianas.- A partir de las placas de MBM-PGO utilizadas para conteo de bacterias, se aislaron e identificaron 90 cepas por metil ésteres de ácidos grasos (FAMEs) según el método Sherlock MIDI versión 6.0. La extracción de ácidos grasos de membrana se realizó sobre 40 mg de masa celular comenzando con una saponificación con 2mL de alcohol metílico, hidróxido de sodio y agua (150 mL: 45 g: 150 mL). Posteriormente se realizó una metilación con 1 mL ácido clorhídrico 6 N y alcohol metílico (325 mL: 275 mL), seguido de una extracción con 1.25 mL de n-hexano y metil terbutil éter (1:1). Finalmente se realizó un lavado con 3 mL de hidróxido de sodio y agua (10.8 g en 900 mL) de acuerdo a lo propuesto por el sistema de identificación (MIDI Newark, Del., USA).
Los ácidos grasos obtenidos se determinaron como metil ésteres por cromatografía gaseosa. Para tal fin se utilizó una columna capilar Ultra 2 de 25 m de longitud y 0.2 mm de diámetro. El análisis se llevó a cabo con un cromatógrafo HP 6890 series II GC (inyección splitless, presión inicial 10 psi, programa de temperatura: 170 – 288 °C a 28 °C.min-1, 288 – 310 °C a 60 °C.min-1, 1.5 min de permanencia a 310 °C, detector por ionización de llama). La integración de los pico se efectuó mediante el programa HP 10.01 Chem Station.
Los ácidos grasos fueron identificados utilizando el sistema Sherlock (versión 6.0) con el estándar Agilent "Calibration standards kit for the microbial identification system". La composición en ácidos grasos fue calculada como porcentaje del área de pico (MIDI).
Análisis de resultados.- Los valores de hidrocarburos y recuentos bacterianos se analizaron por análisis de la varianza (ANOVA) mediante el programa BIOM (Applied Biostastics INc 3 Heritage Setauket NY 117II USA).
Resultados y discusión
Las caracteristicas iniciales del fondo de tanque, lo hacen un material para el uso de técnicas biologicas en la eliminación de hidrocarburos. El fondo de tanque contenía un pH 7.5, humedad de 8.9%, residuo orgánico 25%, residuo inorgánico de 75%, densidad aparente 0.8, porosidad 49%, capacidad de retención del agua 64% cloruros 32260 ppm, bicarbonatos 226 ppm, sulfatos 2553 ppm, calcio 5511 ppm, magnesio 1337 ppm, hierro 39 ppm, amonio 18 ppm, fosfato 1.5 ppm y TPH 2.9% compuesto por 48, 35, y 17% de hidrocarburos alifáticos, aromáticos y polares respectivamente.
El valor de pH se encontró dentro de los valores óptimos para el desarrollo bacteriano, entre 6.5 y 7.5 (EPA 510-B-95-002 2004, Pucci et al. 2011). Se observó un alto contenido de cloruros, sodio y potasio, valores frecuentes dado que el petróleo de la zona se extrae en un 40% por recuperación secundaria por lo que esta acompañado de agua de formación que es muy rica en sales y que el petróleo de la cuenca posee una salinidad medida en cloruros de 2000-20000 ppm. Se ha comprobado que estos valores de salinidad pueden resultar tóxicos para algunos grupos de bacterias, desarrollando aquellos discretamente halófilos que presenten tolerancia a niveles de salinidad de 1 a 6% de cloruro de sodio (Meshler & Pucci 2006). Los valores de densidad, tanto aparente como real, se observaron por debajo de los valores normales, de 1 a 1.8 para densidad aparente y 2.6 a 2.7 para densidad real, esto es debido al alto contenido de hidrocarburos en la muestra.
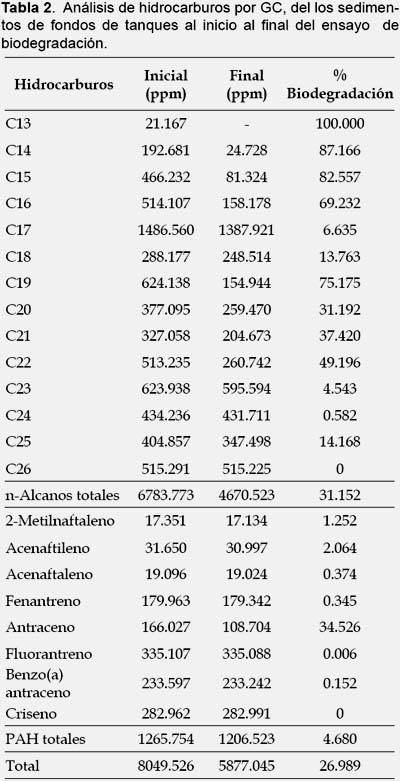
El valor inicial de hidrocarburos totales del petroleo (TPH) fue de 2.9 %, el cual se disminuyó a un 0.4% de TPH (Tabla 1) que se llevo a cabo en la experiencia. Los hidrocarburos que más se degradaron pertenecen al grupo de los n-alcanos con una degradación del 31%, obteniéndose en C13, C14 y C15 los más altos porcentajes de degradación, de 100%, 87% y 82% respectivamente (Tabla 2). Los hidrocarburos poliaromáticos se degradan más lentamente (Acuña et al. 2012), logrando una degradación del 4.5%, la presencia de benzo-antraceno con niveles superiores a las que pide el TIER 1 (ASTM 1739 2010) para suelos industriales seria lo que limita la disposición final de estos, no en todos los fondos de tanque se encuentran valores tan elevados de este compuesto (Bojes & Pope 2007, Pucci et al. 2013).
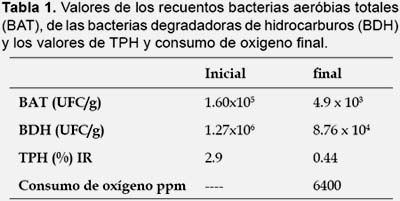
El sedimento resultante del lavado del fondo de tanque presento una cantidad de bacterias compatible para el uso de este en procesos biológicos de degradación (Tabla 1) y valores normales encontrados en suelos patagónicos con procesos de biodegradación aceptables (Acuña et al. 2008, Pucci & Pucci 2003). Esta elevada concentración de bacterias con capacidad de degradar hidrocarburos indica un importante potencial de biodegradación (Atlas 1995, Bartha 1986). La identificación de cepas bacterianas a partir de sus ácidos grasos de membrana permitió observar la presenta bacterias de los géneros Micrococcus sp., Ocrhobactrum sp., Clavibacter sp., Kocuria rosasea, Bacillus sp. y Rhodococcus sp. todos microorganismos que poseen metabolismos con capacidad de degradar hidrocarburos. En los procesos de lavado a 70 C con tensioactivos, previo al análisis de laboratorio se pierden bacterias por la temperatura y los detergentes utilizados aunque existe una población bacteriana capaz de soportar dicho proceso formada principalmente por bacterias Gram positivas y algunas Gram negativas. Predominó el género Pseudomonas sp. (35% de las identificaciones) que son ampliamente conocidas por poseer la habilidad de utilizar diversos sustratos xenobióticos, incluyendo aquellos creados por el petróleo, productoras de biosurfactantes, como los ramnolípidos (Atlas 1981, Foght y Westlake 1988, Kumari et al. 2012, Yan et al. 2012, Zhang et al. 2012,) dado a que muchos poseen plámidos (Bhattacharya et al. 2003, Ghazali et al. 2004).
También se identificó bacterias degradadora de gran cantidad de sustratos como el n-hexadecano, utilización de compuestos alifáticos y degradación de hidrocarburos aromáticos y poliaromáticos. Por su gran capacidad de adaptación, ya que este tipo de bacterias se encuentran normalmente en el suelo y presentan una versatilidad metabólica muy grande que se traduce en su capacidad de utilizar substratos muy variados como fuente de carbono. El género Rhodococcus (24% de las identificaciones) posee una gran variedad de vías metabólicas para la degradación y modificación de compuestos aromáticos, incluyendo las actividades de di-oxigenasas sobre anillos, así como la actividad de ruptura de catecol. Algunas cepas presentan también la vía del 3-oxoadipato. Lo anterior sumado a su capacidad de crecimiento en medios con escasos nutrientes, la carencia de un sistema de represión catabólica y su persistencia ambiental lo hacen un excelente candidato para los tratamientos de biorremediación (Benavides López de Mesa 2006). Estas son bacterias degradadoras de hidrocarburos con alta resistencia a la desecación y adaptadas a sistemas ecológicos con bajo contenido de nutrientes y temperaturas bajas (Díaz-Ramírez et al. 2008). Ambos géneros bacterianos se encuentran comúnmente presentes en suelos patagónicos (Perezutti et al. 2003).
En los recuentos bacterianos de las muestras de los biorreactores (Tabla 1), luego de 80 días de tratamiento, se produjo un consumo de oxigeno que necesitan las bacteris para transformar los hidrocarburos en biomasa y dioxido de carbono, (Tabla 1), se observó un buen desarrollo, tanto de bacterias aerobias totales como de bacterias degradadoras de hidrocarburos. No se observan diferencias significativas (P < 0.05) en los valores de los tres sistemas ya que el aumento de un logaritmo está dentro del error del método. Esto demuestra que la diferencia en el rendimiento de la biodegradación no se debe a una mayor población bacteriana sino a un incremento de su capacidad degradadora de hidrocarburos gracias al agregado de nutrientes (Acuña et al. 2008).
Conclusiones
El residuo proveniente del lavado de fondo de tanque contenía bacterias en cantidad suficiente para la utilliazación de la técnicas de biodegradación de hidrocarburos de la muestra, esta presentaba un predominio de los géneros Pseudomonas sp. y Rhodococcus sp. que junto a las condiciones de 20% humedad y nutrientes en una proporción de 100:3:0.3 redujeron los hidrocarburos de 2.9 a 0.4 % medidos por EPA 418.1 infrarojo. La fracción que mejor se degrado fue la de los hidrocarburos alcanos de cadena entre 13 a 26 átomos de carbono, siendo las fracciones aromáticas más difíciles de degradar por lo que requieren tratamientos más prolongados para obtener resultados satisfactorios o el complemento de otras técnicas como la electriobiorremediación (Pucci et al. 2012a, Pucci et al. 2012b, Acuña et al. 2012b)
Agradecimientos
Agradecemos al CEIMA y a la UNPSJB por el financiamiento del trabajo. Al personal técnica del laboratorio Natalia Tonin, Mirta Leiva y Miriam Robledo.
Literatura citada
Acuña A.J, O.H. Pucci & G.N. Pucci. 2012. Effect of nitrogen deficiency in the biodegradation of aliphatic and aromatic hydrocarbons in patagonian contaminated soil. International Journal of Research and Reviews in Applied Sciences 11: 479-485.
Acuña A.J., O.H. Pucci & G.N. Pucci. 2012b. Electrobioremediation of Hydrocarbon Contaminated Soil from Patagonia Argentina. En el libro New Technologies in the Oil and Gas Industry. (J. Salgado Gómez, Ed.) Intech, Croacia, pp. 29-48.
Acuña A.J., O.H. Pucci & G.N. Pucci. 2008. Caracterización de un Proceso de Biorremediación de Hidrocarburos en Deficiencia de Nitrógeno en un Suelo de la Patagonia Argentina. Ecosistemas 17: 85-93.
ASTM 1739. 2010. http://www.astm.org/Standards/E1739.htm
Atlas R.M. 1981. Microbial degradation of petroleum hydrocarbons: an environmental perspective. Microbiological Reviews 45: 180-209.
Benavides López de Mesa J., G. Quintero, A.L. Guevara Vizcaino, et al. 2006. Bioremediación de suelos contaminados con hidrocarburos derivados del petroleo; Bioremediation of contamined soils with hidrocarbons derived from petroleum. NOVA 4: 82-90.
Bhatacharya D., P. Sarma, S. Krishnan, S. Mishra & B. Lal. 2003. Evaluation of Genetic Diversity Among Pseudomonas citronellonis Strains Isolated from Oily Sludge-Contaminated Sites. Applied and Environmental Microbiology 69: 1435-1441. http://dx.doi.org/10.1128/AEM.69.3.1435-1441.2003
Bojes H.K. & P.G. Pope. 2007. Characterization of EPA's 16 priority pollutant polycyclic aromatic hydrocarbons (PAHs) in tank bottom solids and associated contaminated soils at oil exploration and production sites in Texas. Regulatory Toxicology and Pharmacology 47: 288-295. http://dx.doi.org/10.1016/j.yrtph.2006.11.007
Díaz-Ramírez I., E. Escalante-Espinosa, E. Favela-Torres, M. Gutiérrez-Rojas & H. Ramírez-Saad. 2008. Design of Bacterial Defined Mixed Cultures for Biodegradation of Specific Crude Oil Fractions. Using Population Dynamics Analysis by DGGE. International Biodeterioration. Biodegradation. 68 (1) 21-30. doi:10.1016/j.ibiod.2007.11.001
EPA (Environmental Protection Agency). 2004. Capítulo IV (Biopilas) de EPA 510-B-95-002: How to Evaluate Alternative Cleanup Technologies for Underground Storage Tank Sites, a Guide for Corrective Action Plan Reviewers. 27 pp. EPA 9040C. pH Electrometric Measurement http://www.epa.gov/osw/hazard/testmethods/sw846/pdfs/9040c.pdf
EPA Method 418.1. 1979. Petroleum hydrocarbon, total recoverable. In: Methods for Chemical Analysis of Water and Wastes. U.S. EPA, Washington, DC, EPA 600/4-79/020.
Ferrari M.D., E. Neirotti, C. Albornoz, M.R. Mostazo & M. Cozzo. 1996. Biotreatment of hydrocarbons from petroleum tank bottom sludges in soil slurries. Biotechnology Letters 18: 1241-1246. http://dx.doi.org/10.1007/BF00129947
Foght J.M. & D.W.S. Westlake. 1988. Degradation of polycyclic aromatic hydrocarbons and aromatic heterocycles by a Pseudomonas species. Canadian Journal of Microbiology 34: 1135-1141. http://dx.doi.org/10.1139/m88-200
Gallego J.L.R., M.J. García-Martínez, J.F. Llamas, et al. 2007. Biodegradation of oil tank bottom sludge using microbial consortia. Biodegradation 18: 269-281. http://dx.doi.org/10.1007/s10532-006-9061-y
García Trejo A. 1981. Experimentos en microbiología de suelos. Compa-ía Editorial Continental S.A. Primera edición. México. Pág. 14-16, 22-27.
Ghazali F., R. Rahman, A. Salleh & M. Basri. 2004. Biodegradation of Hydrocarbons in Soil by Microbial Consortium. International Biodeterioration & Biodegradation 54: 61-67. http://dx.doi.org/10.1016/j.ibiod.2004.02.002
Kumari B., S.N. Singh & D.P. Singh. 2012. Characterization of two biosurfactant producing strains in crude oil degradation. Process Biochemistry 47: 2463-2471. http://dx.doi.org/10.1016/j.procbio.2012.10.010
Matsui T., T. Yamamoto, N. Shinzato, T. Mitsuta, K. Nakano, & T. Namihira. 2013. Degradation of oil tank sludge using long-chain alkane-degrading bacteria. Annals of Microbiology 1: 1-5.
Meshler M. & O.H. Pucci. 2006. Biodegradación de Hidrocarburos de la Comunidad Bacteriana en Condiciones de Alta Concentración en Sales de Sulfato. Ingeniería Sanitaria y Ambiental 89: 92-97.
Obras Sanitarias de la Nación. Dirección de Química y Tecnología. 1970. Métodos para examen de agua y líquidos cloacales. 111p.
Peressutti S.R., H.M. Alvarez & O.H. Pucci. 2003. Dynamics of Hydrocarbon-Degrading Bacteriocenosis of an Experimental Oil Pollution in Patagonian Soil. International Biodeterioration & Biodegradation 52: 21-30. http://dx.doi.org/10.1016/S0964-8305(02)00102-6
Pucci G.N. & O.H. Pucci. 2003. Biodegradabilidad de Componentes de Mezclas Naturales de Hidrocarburos Previamente Sometidas a Landfarming. Revista Argentina de Microbiología 35: 62-68.
Pucci G.N., A.J. Acu-a & O.H. Pucci. 2013. Electrobiorremediación de fondos de tanques petroleros. Revista Peruana de Biología 20: 199-201. http://dx.doi.org/10.15381/rpb.v20i2.2688
Pucci G.N., Acu-a A.J., Wick L.Y. & Pucci O.H. 2012a. The use if electrobioremediation in hydrocarbon release and bioremediation. International Journal of Current Research 4: 451-454.
Pucci G.N., Acu-a A.J., Wick L.Y. & Pucci O.H. 2012b. Electrobioremediation of Patagonian Soils contaminated with Hydrocarbon. Portugaliae Electrochimica Acta 30: 361-370. http://dx.doi.org/10.4152/pea.201205361
Pucci O.H., A.J. Acu-a & G.N. Pucci 2013. Biodegradación de residuos de estaciones de servicio y lavaderos industriales por la cepa Rhodococcus erythropolis ohp-al-gp. Acta Biológica Colombiana. Universidad Nacional de Colombia 18: 15-20.
Pucci G.N., A.J. Acu-a & O.H. Pucci. 2011. Biodegradación de hidrocarburos en la meseta patagónica, un resumen de la optimización de los parámetros a tener en cuenta. Ingeniería Sanitaria y Ambiental, 115: 36
Pucci O.H., M. Bak, S. Peressutti, I. Klein, C. Härting, H. Alvarez & L. Wünsche. 2000. Influence of Crude Oil Contamination on the Bacterial Community of Semiarid Soil of Patagonia (Argentina). Acta Biotechnol. 20: 129-146. http://dx.doi.org/10.1002/abio.370200207
Saikia R.R. & S. Deka. 2013. Removal of hydrocarbon from refinery tank bottom sludge employing microbial culture. Environmental Science and Pollution Research 20: 1-8. http://dx.doi.org/10.1007/s11356-013-1888-2
Standard Methods for the examinations of Water and Wastewater, 1992. 18th edition. Parte 2320. Método B.
Wang Z., M. Fingas, C. Yang & J. Christensen. 2006. Crude Oil and Refined Produc Fingerprinting, Principies. En, Environmental Forensics. (R, Morrison y B.L. Murphy Ed.) Elsevier Science, USA, pp. 339-357.
Yan P., M. Lu, Q. Yang, H.L. Zhang, Z.Z. Zhang & R. Chen. 2012. Oil recovery from refinery oily sludge using a rh amnolipid biosurfactant-producing Pseudomonas. Bioresource Technol. 116: 24-28. http://dx.doi.org/10.1016/j.biortech.2012.04.024
Zhang X., D. Xu, C. Zhu, T. Lundaa & K.E. Scherr. 2012. Isolation and identification of biosurfactant producing and crude oil degrading Pseudomonas aeruginosa strains. Chemical Engineering Journal 209: 138-146. http://dx.doi.org/10.1016/j.cej.2012.07.110
Fuentes de financiamiento:
El presente trabajo se realizó gracias al financiamiento del CEIMA (Centro de Estudios e Investigación en Microbiología Aplicada), Universidad Nacional de la Patagonia San Juan Bosco, Argentina
Informacion sobre los autores:
GP realizó el diseño experimental y análisis de FAMEs; AA realizó los análisis de hidrocarburos, GP redactó el manuscrito, y OP superviso todas las tareas. GP, AA y OP revisaron y aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Autor para correspondencia.
Email Graciela Pucci: granapu@unpata.edu.ar
Email Adrián Acuña: ajcuna@unpata.edu.ar
Email Oscar Pucci: ceima@unpata.edu.ar
Presentado: 29/09/2014
Aceptado: 13/12/2014
Publicado online: 24/04/2015













