Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.22 no.3 Lima dic. 2015
http://dx.doi.org/10.15381/rpb.v22i3.11437
doi: http://dx.doi.org/10.15381/rpb.v22i3.11437
TRABAJOS ORIGINALES
Comparación foliar morfológica y anatómica entre ejes producidos por semilla y por ramificación basal de Astrocaryum carnosum (Arecaceae)
Morphological and anatomical comparison between axes produced by seed and basal branching of Astrocaryum carnosum (Arecaceae)
Marinoli Rivas, Betty Millán* y Francis Kahn
*Autor para correspondencia
Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Av. Arenales 1256, Jesús María, Lima 11, Perú.
Email Marinoli Rivas: marinoli23@gmail.com
Email Betty Millán: bmillans@gmail.com
Email Francis Kahn: franciskahn@orange.fr
Resumen
En la palmera cespitosa Astrocaryum carnosum se describe y compara la morfología y anatomía foliar entre ejes producidos por semilla y ejes producidos por ramificación basal en tres fases de desarrollo; fase 1: hojas enteras, fase 2: hojas irregularmente pinnadas con 2 a 6 pares pinnas y fase 3 con 7 a 21 pares de pinnas. En cada caso se midieron cuatro parámetros morfológicos y 14 parámetros anatómicos para la fase 1; y 12 parámetros morfológicos y 14 parámetros anatómicos para las fases 2 y 3. Se encontraron diferencias significativas (p<0.05) en el número de hojas, largo del pecíolo, largo de la lámina, ancho de la pinna basal y media, espesor del parénquima esponjoso, tamaño del paquete de fibras no vasculares y densidad estomática.
Palabras claves: Huicungo; hábito cespitoso; ramificación basal.
Abstract
For the caespitose palm Astrocaryum carnosum are described and compared the foliar morphology and anatomy between axes produced by seed and basal branching in three stages of development; stage 1: with entire leaves; stage 2: with 2–6 pairs of irregular pinnae and stage 3: with 7–21 pairs of pinnae. For each case were considered four morphological and 14 anatomical parameters for phase 1; and 12 morphological and 14 anatomical parameters for phases 2 and 3. Significant differences (p<0.05) were found in the number of leaves, length of petiole, length of lamina, width of basal and middle pinna, thickness of spongy parenchyma, size of non–vascular fibers bundles and stomatal density.
Keywords: Huicungo; caespitose; basal branching.
Introducción
Las plantas clonales son abundantes en los bosques tropicales (Caballé 1994). Se han planteado muchas ventajas adaptativas del crecimiento clonal, tales como: la habilidad para una rápida colonización de espacios abiertos, alta competitividad y mayor sobrevivencia bajo condiciones ambientales adversas (Bond & Midgley 2001). En las palmeras de sotobosque de los bosques tropicales, el crecimiento clonal es considerado una estrategia de crecimiento más que una estrategia de propagación-dispersión, la cual es llevada a cabo principalmente por semillas (Svenning 2000).
En las palmeras, el crecimiento clonal se da por ramificación basal, este proceso implica la producción de nuevos ejes a partir de yemas laterales ubicadas en la base del eje primario (Holttum 1955, Hallé et al. 1978, Tomlinson 1990). Según Font Quer (1982) un eje está formado por un vástago con raíces. La ramificación basal se presenta en un 33% de las palmeras de América tropical (Balslev et al. 2011), las cuales son denominadas cespitosas, siendo calificas de solitarias las que no ramifican (Corner 1966). La ramificación basal es considerada una tendencia evolutiva en las palmeras, las cuales han llegado a ocupar todos los ecosistemas tropicales (Kahn y Granville 1992), debido que contribuye a reducir su tasa de mortalidad (Svenning 2000) y por qué favorece a un establecimiento más eficientemente a partir de pequeñas poblaciones, haciéndolos buenos colonizadores (Salm et al. 2007).
La sección Huicungo del género Astrocaryum abarca ocho especies cespitosas, las cuales tienen una única forma de vida, sin embargo, su distribución alcanza una gran variedad de hábitats desde la región Sub Andina hasta la Amazonía baja (Kahn & Moussa 1994, Kahn 2008, Kahn & Millán 2013). Según Machahua et al. (2015) el proceso de ramificación basal en Astrocaryum carnosum de la sección Huicungo permite una explotación óptima del espacio y asegura la continuidad de la población en el tiempo.
En este contexto, el presente trabajo describe y compara la morfología y anatomía foliar entre ejes producidos por semilla y ejes producidos por ramificación basal, en tres fases de desarrollo de la palmera Astrocaryum carnosum, con el objetivo de conocer como el tipo de crecimiento, a partir de semilla o ramificación basal, influye en la expresión de los caracteres anatómicos y morfológicos.
Material y métodos
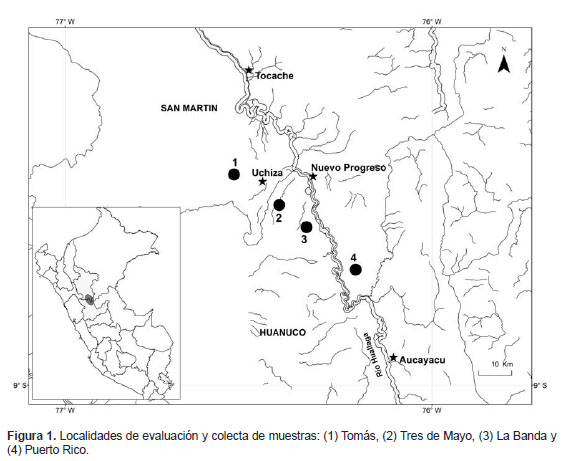
Área de estudio.– La evaluación y colecta de las muestras se llevó a cabo en cuatro localidades ubicadas en el valle del Alto Huallaga; dos pertenecientes a la región Huánuco: Tres de Mayo (8°28’46"S, 76°21’18"W) y La Banda (8°28’23"S, 76°20’03"W), y dos para la región San Martin: Tomás (8°25’30"S, 76°29’51"W) y Puerto Rico (8°33’54"S, 76°16’47"W) (Fig. 1). En el área de estudio la precipitación pluvial anual promedio es de 1340 mm3 y la temperatura anual promedio es de 25.0 °C (GTZ, PROTADU & MPT 2008). El área de estudio corresponde a un valle de sedimentación fluvialuvial, constituido por áreas relativamente planas, donde se encuentran las terrazas bajas inundables (GTZ, PROTADU & MPT 2008). La vegetación corresponde a un bosque tropical húmedo (Tosi 1960) y se caracteriza por presentar árboles que no superan los 30 m.
Especie estudiada.– Astrocaryum carnosum F. Kahn & B. Millán es una especie endémica del Perú (Millán 2006), se distribuye en el valle del Alto Huallaga, desde Tocache hasta Tingo María (Kahn & Millán 2013). Crece en bosques sobre suelos hidromórficos y bosques de restinga sobre suelos aluviales estacionalmente inundados (Kahn & Granville 1992). La palmera es cespitosa, subacaulescente o con tallo hasta 2 m de alto y 18 cm de diámetro y hojas largas con pecíolo hasta 7.5 m de largo, con hasta 120 pares de pinnas dispuestas en una mismo plano.
Durante su desarrollo, luego de germinar, las hojas de la palmera pasan por varias etapas de transformación (Tomlinson 1990). La fase 1 corresponde a las plántulas con hojas de lámina entero bífido, la fase 2 a los juveniles de hojas irregularmente pinnadas con 2 a 6 pares de pinnas y la fase 3 a los juveniles de hojas con lámina irrregularmente pinnadas con 7 a 21 pares de pinnas. Transformaciones similares se observan durante el desarrollo de los ejes producidos por ramificación basal (Fig. 2).
Muestreo y parámetros morfológicos.– Se consideraron palmeras separadas entre sí por una distancia de 40 m. Para los ejes producidos por ramificación basal se verifico la conexión del eje a la planta madre antes de colectarlo.
Para la fase 1, se muestrearon 5 ejes producidos por semilla y 5 ejes producidos por ramificación basal, provenientes de palmeras diferentes. Si bien los ejes producidos por semilla estaban en abundancia, solamente se encontraron cinco ejes producidos por ramificación basal en el estado correspondiente a la fase 1. Se midieron cuatro parámetros morfológicos: número de hojas del eje; largo del pecíolo, largo de la lámina y ancho de la lámina de una hoja del eje.
Para la fase 2 y fase 3 se muestrearon en cada caso 30 ejes producidos por semilla y 30 ejes producidos por ramificación basal. Para cada fase se midieron 12 parámetros morfológicos: número de hojas del eje; largo del pecíolo, largo de la lámina, largo de la pinna basal, ancho de la pinna basal, número de nervaduras de la pinna basal, largo de pinna media, ancho de la pinna media, número de nervaduras de la pinna media, largo de pinna apical, ancho de la pinna apical y número de nervaduras de la pinna apical de una hoja del eje.
Anatomía.– De los ejes muestreados en la evaluación morfológica, se tomaron secciones de la pinna media; para la fase 1, de 5 ejes producidos por semilla y 5 ejes producidos por ramificación basal; y para cada una de las fases 2 y 3 de 10 ejes producidos por semilla y 10 ejes producidos por ramificación basal.
Las secciones fueron fijadas en solución FAA (Formol, Ácido acético, Alcohol etílico). Se realizaron cortes transversales a mano alzada y raspados para obtener la epidermis abaxial (Johansen 1940, D’ Ambrogio 1986). La tinción fue realizada con safranina al 1% y el montaje con gelatina fenicada. Se registraron datos cuantitativos de 14 parámetros anatómicos: espesor de la lámina foliar, espesor de la epidermis adaxial, espesor de la epidermis abaxial, espesor de la hipodermis adaxial, espesor de la hipodermis abaxial, espesor del parénquima clorofiliano en empalizada, espesor del parénquima clorofiliano esponjoso, largo y ancho del paquete de fibras no vasculares adyacente a la hipodermis adaxial, largo y ancho del paquete de fibras no vasculares ubicados en el parénquima en empalizada, número de capas del parénquima clorofiliano en empalizada, número de capas del parénquima clorofiliano esponjoso y la densidad estomática. Se realizaron tres réplicas de las mediciones por eje. Las mediciones anatómicas se realizaron con el programa Leica LAS (Leica Microsystems 2013), usando un microscopio binocular de luz Leica DM–500 con una cámara digital incorporada ICC–50.
Análisis estadístico.– Los análisis se realizaron con el paquete estadístico SPSS Statistics® 20.0. Se procedió en dos pasos: i) se evaluó la distribución normal de las variables por medio de la prueba estadística de Kolmogorov-Smirnov (p< 0.05); ii) se determinó los parámetros que presentan una diferencia significativa entre los ejes producidos por semilla y los ejes producidos por ramificación basal para las fases 1, 2 y 3; aplicando el análisis de varianza (ANOVA) para los parámetros que presentaron distribución normal (p< 0.05) y la prueba de Kruskal Wallis (p< 0.05) para los parámetros que no presentaron distribución normal.
Resultados
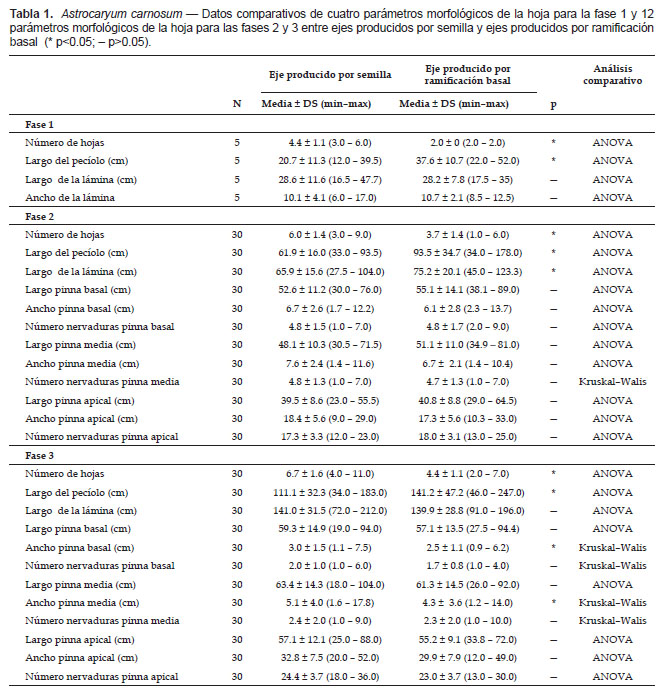
Morfología foliar.–En la fase 1, las hojas de los ejes producidos por semilla y los ejes producidos por ramificación basal presentaron en común: vaina con margen fibroso y setas negras e indumento ferrugíneo o grisáceo en la superficie abaxial, pecíolo cilíndrico con indumento color ferrugíneo o grisáceo, lámina entero bífido con indumento blanquecino en el lado abaxial y aguijones negros en los bordes. El mayor número de hojas y el pecíolo más corto en los ejes producidos por semilla son significativamente diferentes de los ejes producidos por ramificación basal (Tabla 1).
En la fase 2, las hojas de los ejes producidos por semilla y los ejes producidos por ramificación basal presentaron en común: vaina con margen fibroso y setas negras e indumento ferrugíneo o grisáceo en la superficie abaxial; pecíolo cilíndrico con indumento color ferrugíneo o grisáceo y aguijones negros presentes o ausentes; lámina pinnada con indumento blanquecino en el lado abaxial y aguijones negros en los bordes, pinna basal y media lineal–lanceolada con una o varias nervaduras principales, y pinna apical bífida con ambas partes lineal–lanceolada con varias nervaduras principales, raquis con indumento ferrugíneo o grisáceo con aguijones negros presentes o ausentes. El mayor número de hojas, el pecíolo más corto, y la lámina más corta en los ejes producidos por semilla son significativamente diferentes delos ejes producidos por ramificación basal (Tabla 1).
En la fase 3, las hojas de los ejes producidos por semilla y los ejes producidos por ramificación basal presentaron en común: vaina con margen fibroso y setas negras e indumento ferrugíneo o grisáceo en la superficie abaxial; pecíolo cilíndrico con indumento color ferrugíneo o grisáceo y aguijones negros presentes o ausentes; lámina pinnada con indumento blanquecino en el lado abaxial y aguijones negros en los bordes, pinna basal y media lineal–lanceolada con una o varias nervaduras principales, y pinna apical bífida con ambas partes lineal–lanceolada con varias nervaduras principales, raquis con indumento ferrugíneo o grisáceo con aguijones negros presentes o ausentes. El mayor número de hojas, el pecíolo más corto, y las pinnas basal y la media más anchas en los ejes producidos por semilla son significativamente diferentes de los ejes producidos por ramificación basal. (Tabla 1).
Anatomía foliar.–
En la fase 1, las hojas de los ejes producidos por semilla y los ejes producidos por ramificación basal presentaron en común:
Sección transversal: epidermis adaxial formada por una capa de células rectangulares; epidermis abaxial formada por una capa de células ovaladas y tricomas cilíndricos simples pluricelulares; hipodermis adaxial formada por una capa de células rectangulares; hipodermis abaxial formada por una capa de células rectangulares o fusiformes; parénquima clorofiliano diferenciado en empalizada y esponjoso, donde se encuentran idioblastos; fibras no vasculares solitarias o en grupos de 2 – 4 o formando paquetes rodeados por estegmatos (cuerpos de sílice), estos paquetes se distribuyen en tres filas, en la primera los paquetes presentan forma elíptica u ovoide y se ubican adyacentes a la hipodermis adaxial, en la segunda fila los paquetes presentan forma elíptica u ovoide y se ubican entre el parénquima en empalizada y esponjoso, y en la tercera fila los paquetes presentan forma circular y se ubican en el parénquima esponjoso; haz vascular mayor de forma circular u ovada, xilema compuesto por uno o dos vasos de metaxilema y floema distribuido en tres o cuatro paquetes
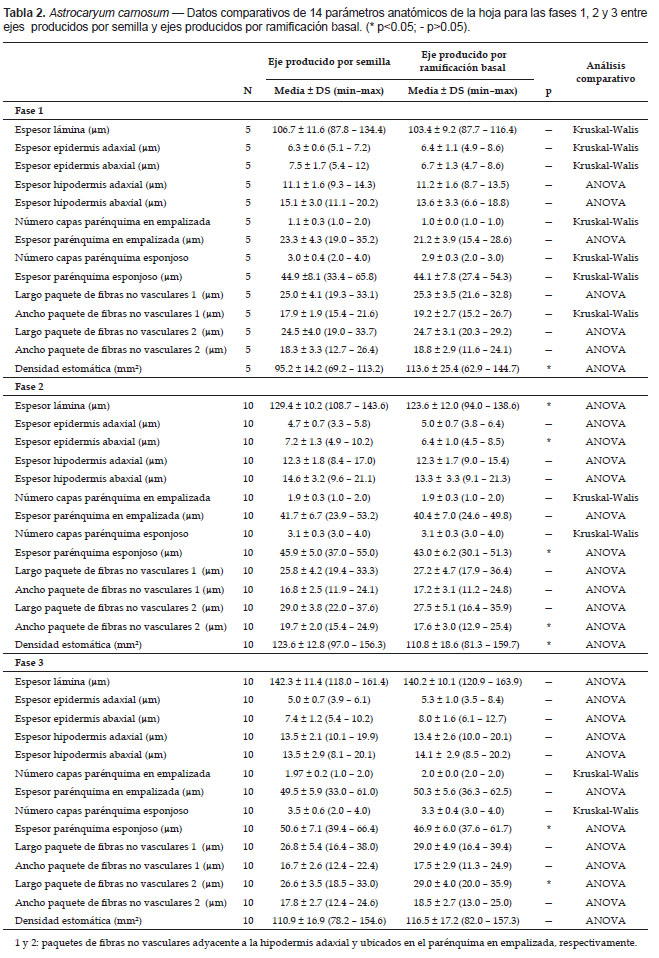
Vista superficial: epidermis adaxial formada por células con forma rectangular o poligonal dispuestas oblicuamente y epidermis abaxial formada por células con forma poligonal dispuestas verticalmente; estomas presentes solo en regiones intercostales de la superficie abaxial, formados por seis células subsidiarias (dos laterales a cada lado de las células oclusivas y dos terminales) y dos células oclusivas. La menor densidad estomática en los ejes producidos por semilla son significativamente diferentes de los ejes producidos por ramificación basal (Tabla 2).
En la fase 2, las hojas de los ejes producidos por semilla y los ejes producidos por ramificación basal presentaron en común:
Sección transversal: epidermis adaxial formada por una capa de células rectangulares; epidermis abaxial formada por una capa de células ovaladas y tricomas cilíndricos simples pluricelulares; hipodermis adaxial formada por una capa de células rectangulares; hipodermis abaxial formada por una capa de células rectangulares o fusiformes; parénquima clorofiliano diferenciado en empalizada y esponjoso, donde se encuentran idioblastos; fibras no vasculares, solitarias o en grupos de 2 – 4 o formando paquetes rodeados por estegmatos, estos paquetes se distribuyen en tres filas, en la primera los paquetes presentan forma elíptica u ovoide y se ubican adyacentes a la hipodermis adaxial, en la segunda fila los paquetes presentan forma elíptica u ovoide y se ubican en el parénquima en empalizada, y en la tercera fila los paquetes presentan forma circular y se ubican en el parénquima esponjoso; haz vascular mayor de forma circular u ovada, xilema compuesto por uno o dos vasos de metaxilema y floema distribuido en tres o cuatro paquetes.
Vista superficial: epidermis adaxial formada por células con forma rectangular o poligonal dispuestas oblicuamente y epidermis abaxial formada por células con forma poligonal dispuestas verticalmente; estomas presentes solo en regiones intercostales de la superficie abaxial, formados por seis células subsidiarias (dos laterales a cada lado de las células oclusivas y dos terminales) y dos células oclusivas. El mayor espesor de la lámina, epidermis abaxial y parénquima esponjoso; el mayor ancho del paquete de fibras no vasculares ubicado en el parénquima en empalizada y la mayor densidad estomática en los ejes producidos por semilla son significativamente diferentes de los ejes producidos por ramificación basal (Tabla 2).
En la fase 3, las hojas de los ejes producidos por semillas y los ejes producidos por ramificación basal presentaron en común:
Sección transversal: epidermis adaxial formada por una capa de células rectangulares; epidermis abaxial formada por una capa de células ovaladas y tricomas cilíndricos simples pluricelulares; hipodermis adaxial formada por una capa de células rectangulares; hipodermis abaxial formada por una capa de células rectangulares o fusiformes; parénquima clorofiliano diferenciado en empalizada y esponjoso, donde se encuentran idioblastos; fibras no vasculares, solitarias o en grupos de 2 – 4 o formando paquetes rodeados por estegmatos, estos paquetes se distribuyen en tres filas, en la primera los paquetes presentan forma elíptica u ovoide y se ubican adyacentes a la hipodermis adaxial, en la segunda fila los paquetes presentan forma elíptica u ovoide y se ubican en el parénquima en empalizada, y en la tercera fila los paquetes presentan forma circular y se ubican en el parénquima esponjoso; haz vascular mayor de forma circular u ovada, xilema compuesto por uno o dos vasos de metaxilema y floema distribuido en tres o cuatro paquetes.
Vista superficial: epidermis adaxial formada por células con forma rectangular o poligonal dispuestas oblicuamente y epidermis abaxial formada por células con forma poligonal dispuestas verticalmente; estomas presentes solo en regiones intercostales de la superficie abaxial, formados por seis células subsidiarias (dos laterales a cada lado de las células oclusivas y dos terminales) y dos células oclusivas. El mayor espesor del parénquima esponjoso y el menor largo del paquete de fibras no vasculares en el parénquima en empalizada en los ejes producidos por semilla son significativamente diferentes de los ejes producidos por ramificación basal.
Discusión
El menor número de hojas en las tres fases de desarrollo de los ejes producidos por ramificación basal puede resultar de la menor necesidad de material fotosintético, ya sea por la existencia de conexiones entre los ejes o por la competencia por el espacio con otros ejes del individuo cespitoso. Por un lado, la existencia de conexiones entre los ejes permite el transporte de agua y nutrimientos para el desarrollo de los nuevos ejes (Alpert & Mooney 1986), lo cual ha sido estudiado en otras palmeras como Astrocaryum mexicanum (Mendoza et al. 1987), Chamaedorea tepejilote (Oyama & Mendoza 1990), Geonoma congesta (Chadzon 1992) y Reinhardtia gracilis (Mendoza & Franco 1992). Por otro lado, la competencia por el espacio con los otros ejes es debido a que la translocación de recursos que se da en un ambiente inevitablemente heterogéneo, ya que cada eje compite con los otros por la luz y nutrientes dentro de cierta zona, donde la intensidad de competencia varía en función de la densidad local (Herben 2004). En el caso de los individuos producidos por semilla, el mayor número de hojas respondería a una mayor necesidad de recursos para realizar la fotosíntesis, debido a que no cuenta con el beneficio de la translocación de recursos.
Con respecto al tamaño del pecíolo, su mayor largo en los ejes producidos por ramificación basal podría interpretarse como una estrategia para alcanzar la luz, considerando que tiene que competir con los otros ejes para acceder a este recurso (Herben 2004). Este comportamiento en el incremento de la longitud del pecíolo ha sido observado en los ejes de Trifolium repens (Fabaceae) como una respuesta morfológica a la competencia por la luz, y fue considerado un rasgo principal del crecimiento vertical (Bittebiere et al. 2012). Según Chadzon (1992) este crecimiento vertical en la palmera Geonoma congesta es realizada por la elongación del tallo de los ejes más jóvenes producidos por ramificación basal. El menor ancho de las pinnas basal y media en los ejes producidos por ramificación basal, en la fase 3, podría indicar un mayor desarrollo de estos, debido que el desarrollo foliar de las palmeras implica una segmentación gradual de la lámina, la cual llega a ser uniforme en la fase adulta (Tomlinson 1990), lo que implica una reducción gradual del ancho de las pinnas, por pasar de tener varias nervaduras principales por pinna a una sola nervadura principal por pinna. Así mismo, la escasa presencia de los rametos producidos por ramificación basal en la fase 1 respecto a la abundancia de rametos producidos por semilla, observados en campo, indica que esta fase es muy breve en los ejes producidos por ramificación basal, lo cual podría indicar también una mayor tasa de crecimiento. Este rápido crecimiento de los brotes producidos por ramificación basal fue también reportado en la palmera Geonoma congesta (Chazdon 1992).
Un mayor espesor del parénquima esponjoso en los ejes producidos por semilla de la fase 2 y 3 podría estar respondiendo a una mayor capacidad fotosintética (Evert 2008), ya que estos no son subsidiados por un tipo de integración fisiológica como en el caso de los de ejes producidos por ramificación basal (Fischer & Kleunen 2002), los cuales incrementarían su supervivencia mientras su producción (capacidad fotosintética) sería solo un aspecto secundario, esto concuerda con el modelo propuesto por Maygar et al. (2004) para desarrollo de poblaciones con crecimiento clonal.
La densidad estomática puede afectar la asimilación de CO2 interviniendo en la tasa de crecimiento relativa (Lambers et al. 1998). Por tanto, una mayor densidad estomatica afecta positivamente la tasa de crecimiento, en los ejes producidos por semilla en la fase 2, y en los ejes producidos por ramificación basal en la fase 1.
El tamaño del paquete de fibras no vasculares ubicados en el parénquima en empalizada es significativamente diferente entre los ejes juveniles producidos por semilla y los ejes producidos por ramificación basal. Sin embargo, se expresa como un carácter variable ya que es mayor en la fase 2 y menor en la fase 3 de ejes producidos por semillas respecto a los ejes producidos por ramificación basal. Estas fibras no vasculares contribuyen como suplemento para el esqueleto vascular (Tomlinson 1990). Sin embargo una fracción reducida de fibras dentro de la lámina tiene el beneficio adicional de incrementar la fracción de masa relativa de tejido clorenquimático (Garnier et al. 1999, Niinemets et al. 2007).
Los resultados muestran que el tipo de crecimiento, a partir de semilla o ramificación basal, no influye en la expresión de caracteres cualitativos morfológicos y anatómicos, sin embargo si influye en la expresión de algunos caracteres cuantitativos morfológicos y anatómicos que los diferencian significativamente, caracteres que pueden estar relacionados con su adaptación y desarrollo de acuerdo a su tipo de crecimiento.
Agradecimientos
Agradecemos a Miguel Machahua por su apoyo en el trabajo de campo y a Manuel Marín por sus recomendaciones en el trabajo de laboratorio.
Literatura citada
Alpert P. & H.A. Mooney 1986. Resourse sharing among ramets in the clonal herb, Fragaria chiloensis. Oecologia 70: 227–233.
Balslev H., F. Kahn, B. Millán, J–C. Svenning, T. Kristiansen, F. Borchsenius, D. Pedersen & W. Eiserhardt. 2011. Species Diversity and Growth in Tropical American Palm Communities. The Botanical Review 77 : 381–425. DOI: http://dx.doi.org/10.1007/s12229–011–9084–x
Bittebiere A–K, N. Renaud, B. Clément & C. Mony. 2012. Morphological response to competition for light in the clonal Trifolium repens (Fabaceae). American Journal of Botany 99(4): 646–654. DOI:http://dx.doi.org/10.3732/ajb.1100487
Bond W.J. & J.J. Midgley. 2001. Ecology of sprouting in woody plants: the persistence niche. Trends in Ecology & Evolution 16(1): 45–51. DOI: http://dx.doi.org/10.1016/s0169–5347(00)02033–4
Caballé G. 1994. Ramet proliferation by longitudinal splitting in the Gabonese rainforest liana Dalhosiea africana S.Moore (Papilionaceae). Biotropica 26: 266–275.
Chadzon R.L. 1992. Effects of leaf and ramet removal on growth and reproduction of Geonoma congesta, a clonal understory palm. Journal of Ecology 79: 1137–1146. DOI: http://dx.doi.org/10.2307/2261104
Corner E.J.H. 1996. The Natural History of Palms. London: Weidenfeld and Nicholson.
D'Ambrogio A. 1986. Manual de técnicas en histología vegetal, 1ra ed. Buenos Aires, Hemisferio Sur S.A. 81 pp.
Evert, R. 2008. Esau Anatomía vegetal: Meristemas, células y tejidos de las plantas–su estructura, función y desarrollo. 3era ed. Barcelona: Omega, S.A. 614 p.
Fischer M. & M.V. Kleunen. 2002. On the evolution of clonal plant life histories. Evolutionary Ecology 15: 565–582. DOI: http://dx.doi.org/10.1023/A:1016013721469
Font Quer P. 1982. Diccionario de Botánica. 8va edn. Barcelona: Labor.
Garnier E., J.–L. Salager, G. Laurent & L. Sonié. 1999. Relationships between photosynthesis, nitrogen and leaf structure in 14 grass species and their dependence on the basis of expression. New Phytologist 143: 119–129. DOI: http://dx.doi.org/10.1046/j.1469–8137.1999.00426.x
GTZ, PROTADU & MPT. 2008. Tocache hacia el desarrollo sostenible, Plan de Ordenamiento Territorial. 177pp.
Hallé F.R., A. Oldeman & P.B. Tomlinson. 1987. Tropical trees and forest. Springer Verlag, Berlin. 442 pp.
Herben T. 2004. Physiological integration affects growth form and competitive ability in clonal plants. Evolutionary Ecology 18: 493–520. DOI: http://dx.doi.org/10.1007/s10682–004–5141–9
Holttum R.E. 1995. Growth–habits in Monocotyledons. Variations on a theme. Phytomorphology 5: 399–413.
Johansen D.A. 1940. Plant microtechnique. McGraw–Hill Book Company. New York and London. 523 p.
Kahn F. 2008. El género Astrocaryum (Arecaceae). Revista peruana de biología 15 (1): 31–48. DOI: http://dx.doi.org/10.15381/rpb.v15i3.2851
Kahn F. & J.–J. de Granville 1992. Palms in forest ecosystems of Amazonia. Springer Verlag, Berlin, 226 pp.
Kahn F. & B. Millán. 2013. Las Palmeras Huicungo— The Huicunugo palms. UNMSM–IRD, Lima, 173 pp.
Kahn F. & F. Moussa. 1994. Las palmeras del Perú. 1era edn. Lima. IFEA.
Lambers H., F.S. Chapin & T.L. Pons 1998. Plant physiological ecology. New York: Springer–Verlag. 540 p.
Leica Microsystems. 2013. Leica LAS EZ Release Notes V3.0.0.
Machahua,M., Kahn F. & B. Millán. 2015. Crecimiento por ramificación basal en dos especies de palmeras huicungo, Astrocaryum carnosym y A. huicungo. Revista peruana de biolgía 22 (1): DOI: http://dx.doi.org/10.15381/rpb.v22i1.11123
Magyar M., M. Kerstesz & B. Oborny. 2004. Resource transport between ramets alters soil resource pattern: a simulation study on clonal growth. Evolutionary Ecology 18: 469–492. DOI: http://dx.doi.org/10.1007/s10682–004–5140–x
Mendoza A. & M. Franco. 1992. Integración clonal en una palma neotropical. Bull. Inst. fr. études andines. 21 (2): 623–635. http://dx.doi.org/10.2307/2260433
Mendoza A., D. Pinero, & J. Sarukhán. 1987. Effects of experimental defoliation on growth, reproduction and survival of Astrocaryum mexicanum. Journal of Ecology 75: 545–554.
Millán B. 2006. Arecaceae endémicas del Perú. Revista peruana de biología 13 (2): 706 – 707. DOI: http://dx.doi.org/10.15381/rpb.v13i2.1940
Niinemets Ü., A. Portsmuth, D. Tena, M. Tobias, S. Matesanz & F. Valladares. 2007. Do we underestimate the importance of leaf size in plant economics? Disproportional scaling of support costs within the spectrum of leaf physiognomy. Annals of Botany 100: 283–303. DOI: http://dx.doi.org/10.1093/aob/mcm107
Oyama K. & A. Mendoza. 1990. Effects of defoliation on growth, reproduction, and survival of a neotropical dioecious palm, Chamaedorea tepejilote. Biotropica 22: 119–123. DOI: http://dx.doi.org/10.1307/2388403
Salm R., N.V. De Salles, W.J. Alonso & C. Schuck–Paim. 2007. Cross–scale determinats of palm species distribution. Acta amazónica 37:17–25. DOI: http://dx.doi.org/10.1590/S0044–59672007000100002
Svenning J.–C. 2000. Growth Strategies of clonal palms (Arecaceae) in a neotropical rainforest, Yasuní, Ecuador. Journal of Ecology 87:55–65. DOI: http://dx.doi.org./10.1071/BT98048
Tomlinson P.B. 1990. The structural biology of palms. 1ra ed. New York, Oxford University Press, Oxford. 465 p.
Tosi J.A. 1960. Zonas de Vida Natural en el Perú. Memoria explicativa sobre el Mapa Ecológico del Perú. Instituto Interamericano de Ciencias Agrícolas de la Zona Andina. Proyecto 29. Programa de Cooperación Técnica. Boletín Técnico Nº 5.
Presentado: 02/08/2015
Aceptado: 23/11/2015
Publicado online: 18/12/2015