Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.23 no.2 Lima mayo/agos. 2016
http://dx.doi.org/10.15381/rpb.v23i2.12377
10.15381/rpb.v23i2.12377
TRABAJOS ORIGINALES
Distribución espacial de Ephemeroptera, Plecoptera, Trichoptera y Coleoptera (Insecta) en una quebrada de primer orden, bosque montano, Junín, Perú
Spatial distribution of Ephemeroptera, Plecoptera, Trichoptera and Coleoptera (Insect) in a first order stream, montane forest, Junín, Peru
Janet Isabel Sajamí Reymundo*, Ana Asunción Huamantinco Araujo
Laboratorio de Invertebrados Acuáticos, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Ciudad Universitaria Av. Venezuela s/n, cuadra 34. Lima 1 – Perú.
Resumen
El objetivo de éste estudio fue estudiar la composición y distribución espacial de cuatro órdenes de insectos acuáticos Ephemeroptera, Plecoptera, Trichoptera y Coleoptera (EPTC), en una quebrada de primer orden, Chanchamayo, Perú. Se realizaron colectas bimensuales desde marzo del 2013 a enero del 2014 en cuatro microhábitats lóticos: piedra, grava, musgo y hojas retenidas en la corriente. Fueron colectados un total de 7825 individuos agrupados en 51 géneros distribuidos en 27 familias de EPTC. El microhábitat de hoja retenida en los rápidos presentó la mayor abundancia, riqueza y diversidad de EPTC. Los géneros más representativos en términos de abundancia fueron Farrodes (10.35%), Phylloicus (10.01%) y Heterelmis (6.07%). La familia Elmidae fue la más diversa con 11 géneros. Las pruebas no parametricas de Kruskall-Wallis para riqueza, abundancia, diversidad y equidad determinaron diferencias significativas (p< 0.05) entre los micro hábitat estudiados. El análisis de ordenamiento no paramétrico de escalamiento multidimensional nMDS y el análisis de similaridad ANOSIM, evidenciaron diferencias claras entre las muestras de micro hábitats.
Palabras claves: Ephemeroptera; Plecoptera; Trichoptera; Coleoptera; Distribución espacial.
Abstract
The aim of this paper was to study the composition and spatial distribution of four orders of aquatic insects Ephemeroptera, Plecoptera, Trichoptera and Coleoptera (EPTC) in a first order stream, Chanchamayo, Peru. Sampling was done bimonthly from March 2013 to January 2014 in four lotic microhabitats: stones, gravel, moss and leaf litter from rifles. There were collected 7825 individuals grouped in 51 genera distributed in 27 families of EPTC, being the first records of aquatic insects in a first order stream of a Montane Forest in the Peruvian Central Andes. The microhabitat litter from rifles presented the highest abundance, richness and diversity. The most representative genera in terms of abundance throughout the basin were Farrodes (10.35%), Phylloicus (10.01%) and Heterelmis (6.07%). The family Elmidae was the most diverse with 11 genera. The non-parametric statistical test of Kruskall-Wallis for the richness, abundance and Shannon-Wiener´s diversity and Pielou´s equi tability determined significant differences (p<0.05) between of microhabitats. The similarity analysis (ANOSIM) and clustering using the non-parametric method multidimensional scaling (nMDS) found differences between of microhabitats.
Keywords: Ephemeroptera; Plecoptera; Trichoptera; Coleoptera; spatial distribution.
Introducción
Diversos estudios basados en la comunidad de macroinvertebrados acuáticos han sido desarrollados mayoritariamente en Europa y Norteamérica estudiándolos no sólo a nivel ecológico sino como una herramienta de gestión de ecosistemas acuáticos continentales (Roldán 1996, Bonada et al. 2004, Acosta et al. 2009). En tanto que en Sudamérica este tipo de estudios son escasos sobre todo en bosques Montanos, como el Bosque Puyu Sacha de la Selva Central del Perú.
Los Ephemeroptera, Plecoptera, Trichoptera y Coleoptera (EPTC) son cuatro órdenes pertenecientes a la clase Insecta, cuya distribución espacial es poco conocida sobretodo en ecosistemas de Bosque Montano. De esta ecorregión se conoce el trabajo de Blanco (2005) que estudió el impacto de desechos rurales y urbanos sobre el río Chorobamba (1814 m de altitud), los insectos acuáticos son mencionados en este estudio de manera tangencial, como parte de los índices biológicos de calidad de agua utilizados. Salcedo y Trama (2014), también en Oxapampa, muestran varios géneros de EPTC de la zona, como parte de un manual para identificación de macroinvertebrados de la microcuenca san Alberto
Así mismo, algunos estudios han sido realizados con el fin de evaluar los factores que determinan la distribución espacial y temporal de las comunidades de invertebrados acuáticos (Oliveira et al. 1997, Jacobsen & Encalada 1998, Kikuchi & Uieda 1998, Huamantinco & Nessimian 2000). A su vez, se conoce que las preferencias de hábitats de los macroinvertebrados acuáticos son el resultado de una variedad de requerimientos de estos organismos (Beisel et al. 1998); siendo el substrato de los hábitats acuáticos, a menudo una mezcla de diversos materiales y tamaños de partículas dispuestos en mosaico (Ward 1992). El material orgánico alóctono, principalmente las hojas, se constituyen como una excelente fuente de energía para pequeños arroyos, que pueden llegar a éstos por caída directa o movimiento lateral (Benfield 1997). Es decir, los sustratos de aguas corrientes difieren enormemente de un lugar a otro, y es importante para las algas, algunos vertebrados y muchos insectos que habitan sobre sus superficies (Allan & Castillo 2007).
Así mismo, estos cuatro órdenes de insectos destacan en importancia porque son sensibles a las perturbaciones ambientales (Rosenberg & Resh 1993). Epemeroptera, Plecoptera y Trichoptera (EPT) forman parte del índice EPT para determinar la calidad del agua, mientras que Coleóptera es considerado dentro de las herramientas de bioindicación, en especial la familia Elmidae (García-Criado & Fernández-Alaez 1995 y 2001, Fossati et al. 2001, Von Ellenrieder 2007) como buenos candidatos para ser indicadores.
Por otro lado, los ecosistemas de montaña tienen gran importancia económica y ecológica (Buytaert et al. 2006, Anderson et al. 2011), debido a que son reservorios hídricos y ecológicos (Meyer et al. 2003, Anderson et al. 2011). Con el fin de contribuir al conocimiento de estos ecosistemas el objetivo de este estudio fue conocer la composición y distribución de EPTC en cuatro microhábitats (piedra, grava, musgo y hoja retenida en los rápidos) de la quebrada Pichita, quebrada de primer orden, de un bosque Montano (Chanchamayo, Perú); enfatizando la importancia del conocimiento de estos cuatro órdenes en un área sin intervención antropogénica.
Material y métodos
Área de estudio.- El estudio se realizó en la quebrada Pi-chita, quebrada permanente de primer orden, ubicada dentro de la Concesión para la Conservación del Bosque Puyu Sacha, también llamado Pichita, perteneciente al fundo Vista Alegre de la Asociación Peruana para la Promoción del Desarrollo Sostenible (APRODES), localizada en la selva central del Perú, en el departamento de Junín, provincia de Chanchamayo, distrito de San Ramón. Según la clasificación ecológica basada en zonas de vida desarrollada por Holdridge (1978) el Bosque Puyu Sacha se ubica en la zona de vida Bosque muy húmedo Montano Bajo Tropical (bmh-MBT).
La quebrada Pichita podría referirse como prístina o con bajo o nulo nivel de intervención antropogénica, afectada en pequeños sectores por la dinámica de derrumbes característicos en zonas de pendiente marcada (Reynel 2012); localizada a 75°26´14.7"W y 11°5´49.7"S a una altitud de 2295 m.
Muestreo.- El estudio comprendió seis campañas de colectas, bimensuales, desde marzo del 2013 a enero del 2014 donde se exploró un trecho aproximado de 300 m de la quebrada Pichita, caracterizada por presentar zonas de alta pendiente (hasta de 80°) y con un cauce que no supera los 2 m de ancho. Dada la ubicación de la quebrada Pichita en una zona montañosa y de abruptas pendientes sólo se consideraron los substratos en zonas de rápidos debido a que las áreas de remanso o pozas eran escasas e inaccesibles.
Se determinaron cuatro substratos o microhábitats principales: piedra o roca en la zona de rápidos, grava, musgo adherido a rocas y hojas retenidas en la corriente. Se tomaron 5 réplicas por microhábitat en cada campaña de colecta.
Los macroinvertebrados bentónicos fueron colectados mediante el uso de una red Surber de 30 x 30 (0.09 m2 de área de superficie de muestreo) con una luz de malla de 200 µm siguiendo el protocolo Monitoring wilderness stream ecosystems (Davis et al. 2001). Las muestras colectadas en campo fueron almacenadas en bolsas plásticas, etiquetadas y fijadas con alcohol al 96%. En el laboratorio fueron lavadas las muestras en un tamiz de 500 µm para la posterior identificación y conteo de individuos de Ephemeroptera,
Plecoptera, Trichoptera y Coleoptera hasta el nivel taxonómico más bajo posible, utilizando un microscopio estereoscópico con un aumento de hasta 40X y un microscopio con aumentos de 400X y 600X.
La identificación de Ephemeroptera, Plecoptera, Trichoptera y Coleoptera se realizó utilizando las claves taxonómicas de Manzo (2005), Passos et al. (2007), Manzo y Archangelsky (2008), Merrit et al. (2008), Domínguez y Fernández (2009) y Ottoboni et al. (2011).
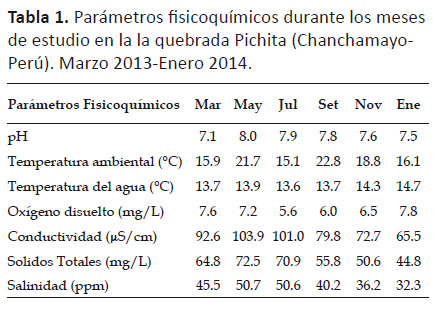
Las variables fisicoquímicas se tomaron en campo entre las 11 y 13 h en los sitios de colecta, con los instrumentos apropiados para cada caso, éstos fueron: pH, conductividad (μS/cm), salinidad (ppm), sólidos totales disueltos (mg/L), oxígeno disuelto (mg/L), temperatura ambiental (°C) y temperatura del agua (°C).
Análisis de datos.- Se calculó la abundancia relativa (%), índice de diversidad Shannon-Wiener (H’), riqueza (S) y equidad de Pielou (J’). Para determinar la existencia de diferencias significativas entre los cuatro microhábitats estudiados se realizaron pruebas no paramétricas como Kruskal-Wallis. Estos análisis de realizaron con el software SPSS versión 19 (IBM SPSS Statistics 2010). Se realizó el análisis multivariado ANOSIM para comparar los ensamblajes de especies de EPTC en los cuatro micro-hábitats estudiados. Para esto se creó una matríz de similaridad (similaridad de Bray-Curtis), a partir de la matriz de abundancia. Además se aplicó el método no paramétrico de Escalamiento Multidimensional (nMDS), tomando en consideración que valores de stress debajo de 0.2 corresponden a un buen ajuste de ordenación (Clarke & Warwick 2001). Se utilizo el software PRIMER 6 para los análisis mencionados.
Resultados
Características ambientales.- Las variables fisicoquímicas (pH, temperatura ambiental, temperatura del agua, oxígeno disuelto, conductividad eléctrica, sólidos totales disueltos y salinidad) no presentaron marcadas diferencias a lo largo del estudio. Sin embargo el oxígeno disuelto presentó su valor más bajo durante el mes de julio (5.64 mg/L) y su mayor valor en enero (7.75 mg/L) (Tabla 1).
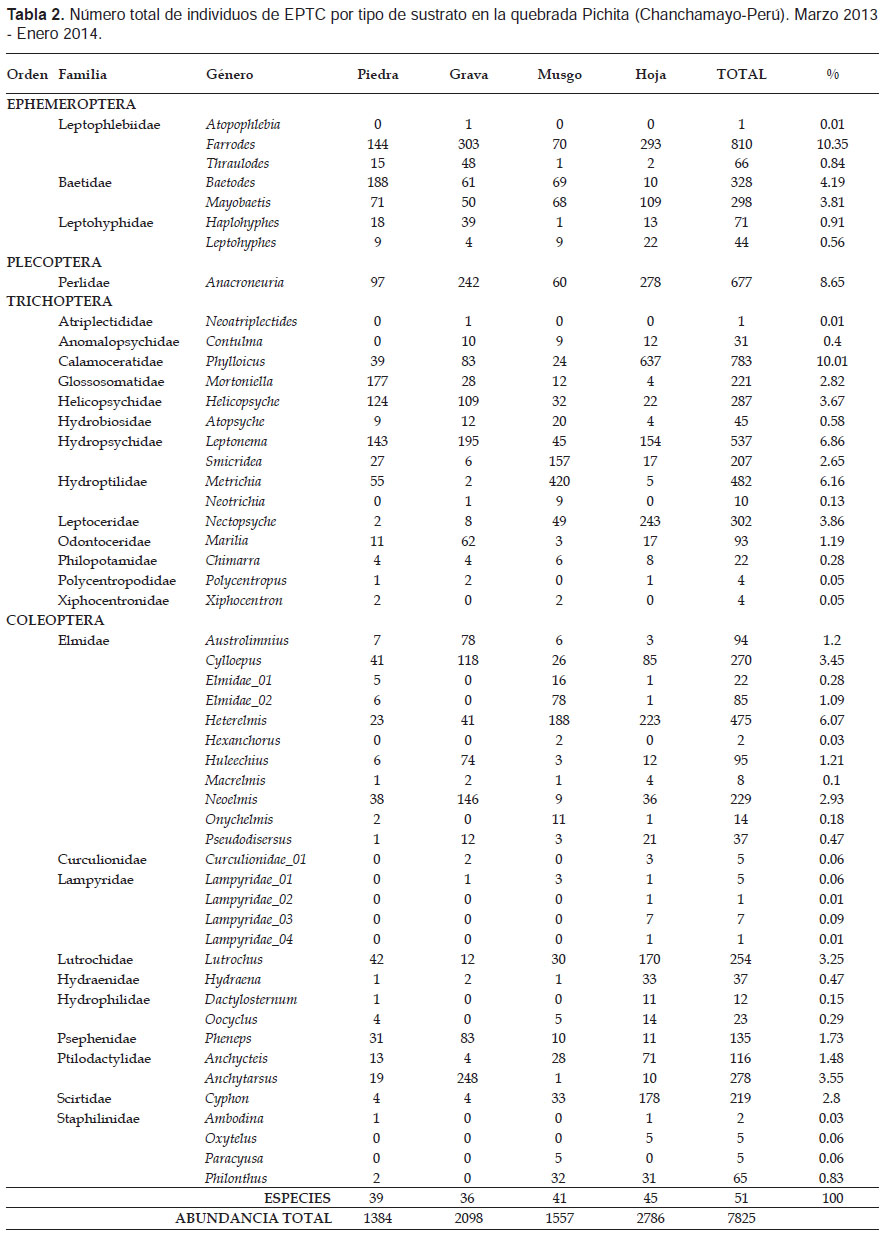
Composición espacial de EPTC.- En la quebrada Pichita entre marzo del 2013 y enero del 2014 se colectó un total de 7825 individuos agrupados en 27 familias y 51 géneros distribuidos entre los órdenes Ephemeroptera, Plecoptera, Trichoptera y Coleoptera.
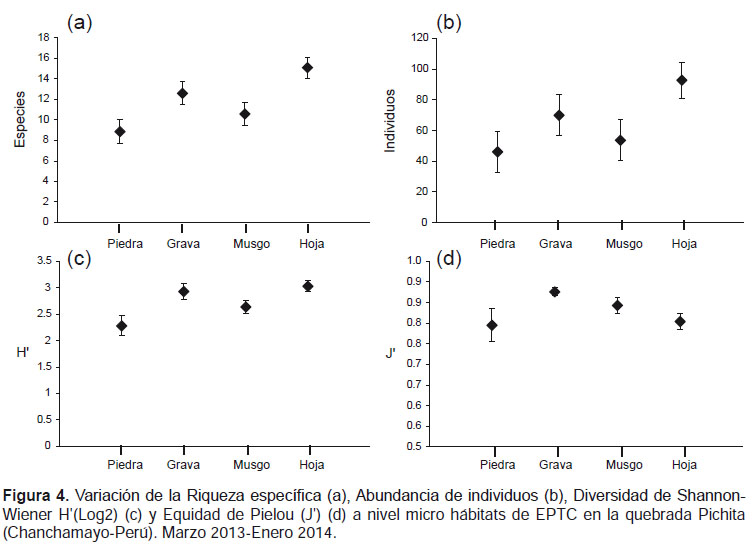
La mayor riqueza específica fue observada dentro del orden Coleoptera, con 28 especies agrupadas en 10 familias, seguido del orden Trichoptera, con 15 especies distribuidas en 13 familias; mientras que los órdenes Ephemeroptera y Plecoptera tuvieron sólo 7 y 1 especie distribuidas en tres y una familia respectivamente (Tabla 2).
El microhábitat que registró la mayor diversidad fue hoja retenida en la corriente, donde se encontró hasta 45 especies de EPTC, seguido de musgo con 41 especies, piedra con 39 especies y grava con 36 especies (Tabla 2).
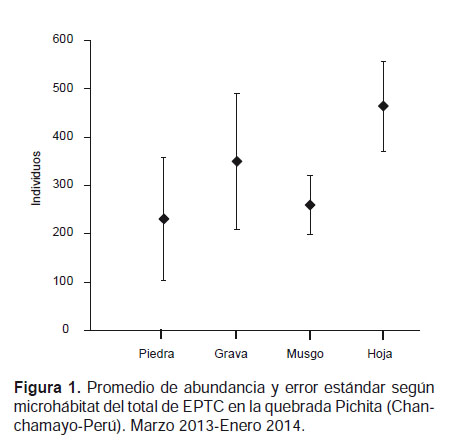
En cuanto al porcentaje de abundancia el microhábitat de hoja retenida en la corriente concentró el mayor porcentaje de EPTC 36% (2786 individuos) seguido de grava con el 27% del total de EPTC (2098 individuos), mientras que los microhábitats de musgo (20%, 1557 individuos) y piedra (18%, 1384 individuos) fueron los menos abundantes (Fig. 1).
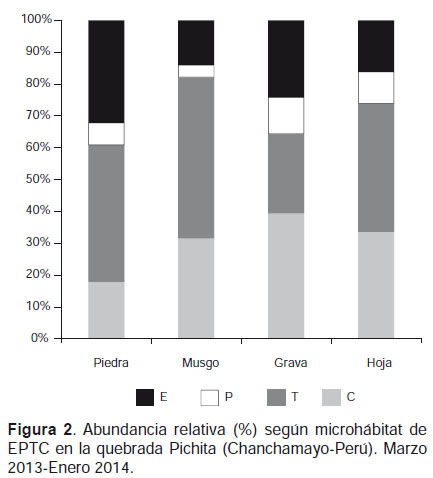
Los órdenes Trichoptera y Coleóptera fueron los más abundantes durante el estudio, estos muestran su predominancia en los substratos musgo y hoja retenida en la corriente. Sin embargo en los substratos inorgánicos, grava y piedra, Ephemeroptera muestra una importante contribución en estos substratos (Fig. 2).
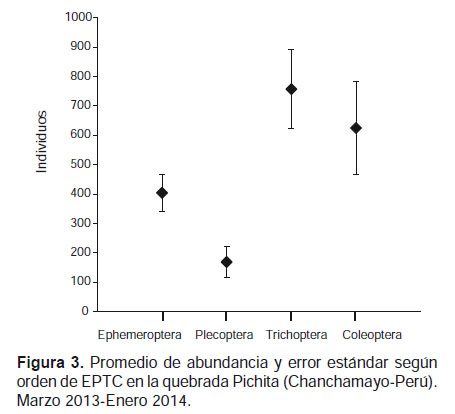
En términos de abundancia relativa el orden Trichoptera representó el 39% de la abundancia total seguido del orden Coleoptera (32%) y en menor abundancia Ephemeroptera (21%) y Plecoptera (9%) (Fig. 3).
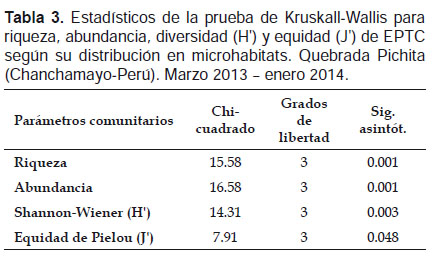
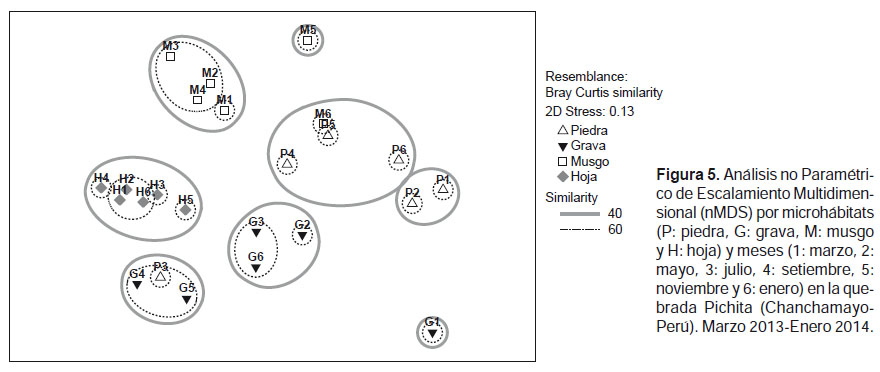
A su vez, la prueba no paramétrica de Kruskall-Wallis para "k" muestras independientes, encontró diferencias significativas (p< 0.05) de la riqueza específica, abundancia, índice de diversidad y equidad de Pielou entre los microhábitats evaluados. La riqueza, abundancia y diversidad fue mayor en hoja retenida en la corriente y menor en piedra, en tanto que la equidad fue mayor en grava y menor en piedra (Tabla 3, Fig. 4). El análisis no paramétrico de Escalamiento Multidimensional (nMDS) mostró gráficamente la separación (disimilaridad) entre los tipos de microhábitats. También se visualiza mayor cohesión entre las seis muestras de hoja, correspondientes a los diferentes meses de muestreo, como también entre las de musgo (Fig. 5). El análisis de similitud ANOSIM, mostró que existen diferencias significativas entre los microhábitats evaluados en la quebrada Pichita (R= 0.365 y p= 0.001). El género Farrodes destacó como el más abundante de los Ephemeroptera (810 individuos; 10.35% del total) y de toda la comunidad de EPTC en la quebrada Pichita.
Anacroneuria (Plecoptera) fue encontrado en todos los microhábitats evaluados pero principalmente en hoja retenida en la corriente y grava. Phylloicus fue el más abundante del orden Trichoptera (783 individuos, 10.01%), y el segundo más abundante de toda la comunidad de EPTC. Heterelmis fue el más abundante dentro de los Coleoptera (475 individuos, 6.07%) al final del estudio. Además se observó que la familia con mayor riqueza específica a lo largo del estudio fue Elmidae (Coleoptera) con un total de 11 especies (Tabla 2).
El microhábitat musgo albergo gran proporción de Smicridea y Metrichia (Trichoptera), encontrándose más del 50% de individuos en este microhábitat tal y como lo encontrado por Huamantinco y Ortíz (2010); y dentro de los géneros más abundantes de Coleoptera es de importancia la fuerte asociación de Austrolimnius, Cylloepus, Huleechius, Neoelmis, Pheneps y Anchytarsus en más del 50% de su frecuencia con el microhábitat de grava.
Discusión
El microhábitat de hoja retenida en la corriente se constituyó como el más diverso y abundante de organismos de EPTC debido a que fue encontrado durante todo el año de estudio, y sólo el microhábitat de musgo estuvo casi ausente en la temporada de menor precipitación (julio). La variación espacial en la quebrada Pichita estaría explicada por la heterogeneidad del hábitat, observándose diferencias significativas en la riqueza, abundancia, diversidad y equidad entre los microhábitats evaluados. La quebrada Pichita por ser de primer orden de un bosque Montano, recibe abundante material alóctono concordando con lo establecido en la Teoría del Río Continuo (Vannote et al. 1980).
El análisis de escalamiento multidimensional (nMDS), mostro en un solo agrupamiento al microhábitat de hoja retenida en la corriente abarcando todos los meses evaluados. Se ha señalado en la literatura la afinidad de los macroinvertebrados por el microhabitat hojarasca, predilección del macrobentos que muchos autores ya han señalado (Wallace & Webster 1996, Huamantinco & Nessimian 1999, Graça 2001, Graça et al. 2001), además de la formación de este microhábitat en épocas de menor caudal (Covich 1988) tal y como también se observó en la quebrada Pichita, ya que durante las seis campañas de evaluación siempre se observaron cúmulos de hojas retenidas en la corriente, en su mayoría en avanzado grado de descomposición, sobre todo en los meses de julio y setiembre (época seca), las mismas que constituyeron el principal microhábitat de la comunidad de EPTC.
Así mismo el microhábitat de grava fue el segundo en albergar una alta abundancia de EPTC. Esto se relaciona a la presencia de materia orgánica muerta, similar a lo encontrado por Brown (1987) y Spangler y Santiago (1987). La acumulación de partículas organicas en la grava es producto del arrastre y caída del material alóctono como troncos y hojas, que se depositan a lo largo del lecho de la quebrada. La materia orgánica muerta es uno de los principales recursos de energía para estos insectos, especialmente en ríos con gran proporción de sombra (Covich 1988, Hutchinson 1993, Wallace & Webster 1996), donde el contenido de detritus en el sedimento y el oxígeno disuelto contribuyen a determinar la estructura de la comunidad en un hábitat determinado (Jacobsen 2003); pues es sabido que en regiones tropicales el material proveniente de los márgenes, generalmente hojas, constituyen el principal componente energético en los ecosistemas de los ríos (Siccama et al. 1970, Anderson & Sedell 1979, Wallace et al. 1997).
En cuanto a los Ephemeroptera encontrados en la quebrada Pichita, el género Farrodes destacó como el más abundante sobre todo en grava y hoja retenida en la corriente, concordante a lo mencionado por Roldán (2012) quien señala que viven entre la vegetación, troncos y hojarasca; y por lo encontrado por Shimano (2012) en Mato Grosso, Brasil, quien encontró valores altos de abundancia de este género en hoja retenida en la corriente. Esta gran abundancia podría estar relacionada a la alta disponibilidad de materia orgánica fina, procedente de la degradación de las hojas, estas partículas finas son el principal alimento de Farrodes (Chará-Serna et al. 2012).
De los Trichoptera el género Phylloicus fue el más abundante en el microhábitat de hoja retenida en la corriente, debido principalmente a que este género utiliza trozos de hojas tanto para su alimentación así como para construir sus refugios transportables (Oliveira & Nessimian 2010).
Entre los Coleoptera reportados en este estudio el género Heterelmis resultó no sólo ser el más abundante dentro de la familia Elmidae, similar a los resultados de Passos et al. (2003) en Brasil; sino de toda la comunidad de coleopteros tal y como lo encontrado por Arias-Días et al. (2007). Probablemente debido a su gran capacidad de colonizar diversos microhábitats, además de las especializaciones morfológicas que presentan estos coleópteros hacen que puedan tolerar diferentes situaciones de estrés ambiental; así como, poseer más de un grupo funcional de alimentación que les permite explotar diversos microhábitats de manera eficaz (Arias-Días et al. 2007). Sin embargo se resalta que la mayoría de los insectos acuáticos pueden ser encontrados habitando más de un tipo de substrato, siendo apenas algunos grupos restringidos a un substrato específico (Sanseverino et al. 1998), donde el tipo y el tamaño del substrato poseen gran importancia en la distribución de los invertebrados bentónicos (Cummins & Lauff 1969, Minshall 1984).
Finalmente, la diversidad biótica de EPTC encontrada en la quebrada Pichita enriquece el conocimiento de las comunidades de macroinvertebrados acuáticos en Bosque Montano del Perú, constituyendo una herramienta importante para programas de biomonitoreo además de enfatizar la importancia del manejo y conservación de cabeceras de cuenca; pues una alta riqueza y diversidad en áreas protegidas enfatiza la importancia de la conservación de un hábitat, y muestra que estas áreas cumplen con su rol de la conservación de la biodiversidad (Von Ellenrieder 2007).
Agradecimientos
Agradecemos de manera especial a la ONG APRODES (Asociación Peruana para la Promoción del Desarrollo Sostenible) por el apoyo y facilidades prestadas durante la permanencia en el Bosque Puyu Sacha, Chanchamayo, Perú. Agradecemos también a los revisores anónimos que contribuyeron a mejorar el manuscrito
Literatura citada
Acosta R. 2009. Estudio de la cuenca altoandina del río Cañete (Perú):Distribución altitudinal de la comunidad de macroinvertebrados bentónicos y caracterización hidroquímica de suscabeceras cársticas. Departament d'Ecologia. Programade Doctorado en Ecología Fundamental y Aplicada. Tesis Doctoral. Universitat de Barcelona, España. 153 pp. [ Links ]
Allan J.D. & M.M. Castillo. 2007. Stream ecology; Structure and Function of Running Waters. 2nd ed. Springer, Dordretch, The Netherlands. 10(4): 436pp. http://dx.doi.org/10.1007/978-1-4020-5583-6 [ Links ]
Anderson N.H. & J.R. Sedell. 1979. Detritus Processing by Macroinvertebrates in Stream Ecosystems. Annual Reviewof Entomology 24:351-377. http://dx.doi.org/10.1146/annurev.en.24.010179.002031 [ Links ]
Anderson E.P., A.C. Encalada, J.A. Maldonado-Ocampo, et al. 2011. Environmental Flows: a Concept for Addressing Effects of River Alterations and Climate Change in the Andes. En:
S. K. Herzog, R. Martínez, P. M. Jørgensen, & H. Tiessen (Eds.), Climate Change and Biodiversity in the TropicalAndes, Vol. 326-338 pp. Inter-American Institute for Global Change Research (IAI) and Scientific Committee on Problems of the Environment (SCOPE).
Arias-Díaz D.M., G. Reinoso-Flórez, G. Guevara-Cardona, et al. 2007. Distribución espacial y temporal de los coleópteros acuáticos en la cuenca del río Coello (Tolima, Colombia). Caldasia 29(1): 177-194. [ Links ]
Benfield E.F. 1997. Comparison of litterfall input to streams. InWEBSTER, JR. and MEYER, JL., eds. Stream organicmatter budgets. Journal of North American Benthological Society, vol. 16, no. 1, p. 104-108. http://dx.doi.org/10.2307/1468242 [ Links ]
Beisel J.N., P. Usseglio-Polatera, S. Thomas, et al. 1998. Stream community structure in relation to spatial variation: the influenceof microhabitat characteristics. Hydrobiologia, vol. 389, p. 73-88. http://dx.doi.org/10.1023/A:1003519429979 [ Links ]
Blanco, A. 2005. The impact of solid and liquid wastes from a rural town on the Chorobamba river, Oxapampa, peruvian amazon. Thesis submitted in partial fulfillment of the requirements for the degree of Master of science in environmental studies. Florida International University. FIU ElectronicTheses and Dissertations. http://digitalcommons.fiu.edu/etd/1692 [ Links ]
Bonada N., C. Zamora-Muñoz, M. Rieradevall, et al. 2004. Ecological profiles of caddisfly larvae in Mediterranean streams: implications for bioassessment methods. EnviromentalPollution 132: 509-521. http://dx.doi.org/10.1016/j.envpol.2004.05.006 [ Links ]
Brown H.P. 1987. Biology of riffle beetles. Annual Review of Entomology, 32:253-273. http://dx.doi.org/10.1146/annurev.en.32.010187.001345 [ Links ]
Buytaert W., R. Celleri, B. Debievre, F. Cisneros, et al. 2006. Human impact on the hydrology of the Andean páramos.Earth-Science Reviews, 79(1-2): 53-72. http://dx.doi.org/10.1016/j.earscirev.2006.06.002 [ Links ]
Chará-Serna A., J. Chará, M. Zúñiga, R. Pearson, & L. Boyero.2012. Diets of leaf-associated invertebrates in three tropical streams. Ann. Limnol. – Int. J. Lim., 48: 139-144. http://dx.doi.org/10.1051/limn/2012013 [ Links ]
Clarke, K.R. & Warmick, R.M. 2001. Change in Marine Communities: An Approach to Statistical Analysis and Interpretation. 2nd edition. Primer-E Ltd, Plymouth, UK. 2001. [ Links ]
Covich A. 1988. Geographical and historical comparison of Neotropical stream: biotic diversity and detrital procesing in highlyvariable habitat. J. N. Am. Benthol. Soc. 7(4):361.386.http://dx.doi.org/10.2307/1467297 [ Links ]
Cummins K.W. & G.F. Lauff. 1969. The influence of substrate particle size on the microdistribution of stream macrobenthos. Hydrobiologia, Dordrecht, 34:145-181. http://dx.doi.org/10.1007/BF00141925 [ Links ]
Davis J.C., G.W. Minshall, C.T. Robinson, et al. 2001. Monitoring wilderness stream ecosystems. Gen. Tech. Rep. RMRSGTR-70. Ogden, UT: U. S. Department of Agriculture, Forest Service, Rocky Mountain Research Station. 137 pp [ Links ]
Domínguez E., C. Molineri, M.L. Pescador, M. Hubbard, C. Nieto. 2006. Ephemeroptera of South America. Series: Aquatic Biodiversity of Latin America (ABLA Series) v.2. Pensoft Publishers, pp: 646. [ Links ]
Domínguez E. & H. Fernández. 2009. Macroinvertebrados BentónicosSudamericanos. Sistemática y Biología. Fundación Miguel Lillo. Tucumán-Argentina. [ Links ]
Fossati O., J. G. Wasson, C. Hery, G. Salinas & R. Marin. 2001. Impact of sediment releases on water chemistry andmacroinvertebrate communities in clear water Andean streams (Bolivia). Archiv für Hydrobiologie - Hauptbände 151 (1):33 – 50. Doi: http://dx.doi.org/10.1127/archivhydrobiol/151/2001/33 [ Links ]
García-Criado F. & M. Fernández-Alaez. 1995. Aquatic Coleoptera (Hydraenidae and Elmidae) as indicators of the chemical characteristics of water in the Orbigo River basin (N-WSpain). Ann. Limnol. 31(3): 185-199. http://dx.doi.org/10.1051/limn/1995017 [ Links ]
García-Criado F. & M. Fernández-Alaez. 2001. Hydraenidae andElmidae assemblages (Coleoptera) from a Spanish riverbasin: good indicators of coal mining pollution? Archivfür Hydrobiologie - Hauptbände 150 (4): 641 - 660. Doi: http://dx.doi.org/10.1127/archiv-hydrobiol/150/2001/641 [ Links ]
Graça M.A.S. 2001. The role of invertebrates on leaf litter decomposition in streams-A review. International Review of Hydrobiology 86:383-393. doi: http://dx.doi.org/10.1002/15222632(200107)86:4/5<383::AID-IROH383>3.0.CO;2-D [ Links ]
Graça M.A.S., R.C.F. Ferreira, & C.N. Coimbra. 2001. Litter processing along a stream gradient: the role of invertebrates and decomposers. Journal of the North American BenthologicalSociety 20:408-420. [ Links ]
Holdridge L. 1978. Ecología basada en zonas de vida. Instituto Interamericano de Ciencias Agrícolas (IICA), San José. 216p. [ Links ]
Huamantinco A.A. & J.L. Nessimian. 1999. Estrutura e distribuição espacial da comunidade de larvas de Trichoptera (insecta) em um tributario de primeira ordem do rio Paquequer,Teresópolis, RJ. Acta Limnologica Brasiliensia. 11(2):1-16. [ Links ]
Huamantinco A.A. & J.L. Nessimian. 2000. Variation and life strategies of the Trichoptera (Insecta) Larvae community in a first order tributary of the Paquequer river, southeasternBrasil. Revista Brasileira de Biologia 60:73-82. http://dx.doi.org/10.1590/S0034-71082000000100010 [ Links ]
Huamantinco A. A. & Ortíz, W. 2010. Clave de géneros de larvas de Trichoptera (Insecta) de la Vertiente Occidental de los Andes,Lima, Perú. Revista peruana de biologia 17(1): 075- 080. http://dx.doi.org/10.15381/rpb.v17i1.54 [ Links ]
Hutchinson G. E. 1993. A Treatise on Limnology. Vol. 4. The Zoobenthos. New York: John Wiley & Sons. [ Links ] Frost TM, Carpenter SR, Ives AR, Kratz TK. 1995. Species compensation andcomplementarity in ecosystem function. Pag: 224- 239 in Jones CG, Lawton JH, eds. Linking Species & Ecosystem. New York: Chapman and Hall. [ Links ]
Jacobsen D. & A. Encalada. 1998. The macroinvertebrate fauna of Ecuadorian highland streams in the wet and dry season. Archiv Fur Hydrobiologie, Stuttgart, 142(1):553-570. [ Links ]
Jacobsen D. 2003. Altitudinal changes in diversity of macroinvertebrates from small streams in the Ecuadorian Andes. Archiv Fur Hydrobiologie 158:145-167. [ Links ]
Kikuchi R.M. & V.S. Uieda. 1998. Composição da comunidade de invertebrados de um ambiente lótico tropical e sua variação espacial e temporal. In: Nessimian, J.L. & A.L. Carvalho (eds.) Ecologia de insetos aquáticos. PPGE, UFRJ, Rio de Janeiro. p.157-173. [ Links ]
Manzo V. & M. Archangelsky. 2008. A key to the known larvae of South American Elmidae. [ Links ]
Manzo V. 2005. Key to the South America genera of Elmidae (Insecta:Coleoptera) with distributional data. Studies on NeotropicalFauna and Environment, December; 40(3): 201-208. http://dx.doi.org/10.1051/limn:2008023 [ Links ]
Merritt R.W., K.W. Cummins & M.B. Berg. 2008. An introduction to the aquatic insects of North America. Fourth edition. Dubuque: Kendall/Hunt Publishing Company, 2008. 1158pp. http://dx.doi.org/10.1899/28.1BR.266.1 [ Links ]
Meyer J., L. Kaplan, D. Newbold, D. Strayer, et al. 2003. Where riversare born: The Scientific Imperative for Defending SmallStreams and Wetlands. Washigton, D.C. Sierra Club and American Rivers. 26 pp. [ Links ]
Minshall G.W. 1984. Aquatic insect-substratum relationships. In V. [ Links ]
H. Resh and D. M. Rosenberg (eds.), The ecology of aquaticinsects. New York: Praeger Publishers: 358-400. [ Links ]
Oliveira A.L.H. & J.L. Nessimian. 2010. Spatial distribution andfunctional feeding groups of aquatic insect communitiesin Serra da Bocaina streams, southeastern Brazil. Acta Limnol. Bras. 22:424-441. http://dx.doi.org/10.4322/actalb.2011.007 [ Links ]
Ottoboni M., F. Valente & A. Fonseca. 2011. Elmidae (Coleoptera, Byrrhoidea) larvae in the state of São Paulo, Brazil: Identification key, new records and distribution. ZooKeys 151: 53–74(2011) doi: http://dx.doi.org/10.3897/zookeys.151.1879 [ Links ]
Passos M.I.S., J.L. Nessimian & L.F.M. Dorvillé. 2003. Distribuição espaço-temporal da comunidade de elmidae (Coleoptera)em um rio na floresta da Tijuca, Rio de Janeiro, RJ. Boletim do Museu Nacional. Nova série Rio de Janeiro – Brasil. Zoología N° 509. [ Links ]
Passos M.I.S, J.L. Nessimian & N. Ferreira-Jr. 2007. Chaves paraIdentificação dos Gêneros de Elmidae (Coleoptera) Ocorrentes no Estado do Rio de Janeiro. Review Brasileira de Entomologia 51 (1): 42–53. http://dx.doi.org/10.1590/S0085-56262007000100008 [ Links ]
Reynel C. 2012. Flora y Fauna del Bosque Montano nublado Puyu Sacha. Asociación Peruana para la Promoción del DesarrolloSostenible (APRODES). [ Links ]
Roldán P.G. 1996. Guía para el estudio de los macro-invertebrados acuáticos del Departamento de Antioquía. FEN-Colombia,COLCIENCIAS - Universidad de Antioquia, Medellín.217 pp. [ Links ]
Roldán P.G. 2012. Los macroinvertebrados como bioindicadores de la calidad del agua. Corporación Autónoma Regional de Cundinamarca. Bogotá, Colombia. [ Links ]
Rosenberg D.M. & V.H. Resh. 1993. Freshwater biomonitoring and benthic macroinvertebrates. New York: Chapman & Hall, 1993, 488 p. [ Links ]
Salcedo, S. & Trama, FA. 2014. Manual de identificación de macroinvertebrados acuáticos de la microcuenca San Alberto, Provincia de Oxapampa, Perú. Rizo Patrón, F.L. Ed. Chanchamayo,Perú. 116 pp. http://dx.doi.org/10.18259/acs.2013016 [ Links ]
Sanseverino A.M.; J.L. Nessimian & A.L.H. Oliveira. 1998. A fauna de Chironomidae (Diptera) em diferentes biótipos aquáticos na Serra do Subaio (Teresópolis). In: Nessimian, J.L. & Carvalho, A.L. (Eds.) Ecologia de Insetos Aquáticos. Rio de Janeiro: PPGE-UFRJ. v.5, p.253-263. (Series Oecologia Brasiliensis). [ Links ]
Siccama T.G., F.H. Bormann & G.E. Likens. 1970. The Hubbard Brook Ecosystem Study: Productivity, Nutrients, and Phytosociology of the Herbaceous Layer. Ecological Monographs 40:389-402. http://dx.doi.org/10.2307/1942337 [ Links ]
Shimano Y. 2012. Ephemeroptera (insecta) do leste Matogrossense, brasil: diversidade, distribuição funcional e estudos ecológicos da teoria neutra e teoria de nicho. Dissertação apresentada à Universidade do Estado de Mato Grosso, como parte das exigências do Programa de Pós-Graduação em Ecologia e conservação da biodiversidade, para obtenção do título de Magister Scientiae. [ Links ]
Spangler P.J. & S. Santiago. 1987. A revision of the Neotropical aquaticbeetle genera Disersus, Pseudodisersus, and Potamophilops (Coleoptera: Elmidae). Smithsonian Contributions to Zoology 446: 1-40. http://dx.doi.org/10.5479/si.00810282.446 [ Links ]
Vannote R. L.,G. W. Minshall, K. W. Cummins, J. R. Sedell, & C. E. Cushing. 1980. The river continuum concept. Canadian Journal of Fisheries and Aquatic Sciences 37: 130-137 http://dx.doi.org/10.1139/f80-017 [ Links ]
Von Ellenrieder N. 2007. Composition and structure of aquatic insectassemblages of Yungas mountain cloud forest streams in NWArgentina. Revista de la Sociedad Entomológica Argentina 66 (3-4): 57-76. [ Links ]
Wallace J.B. & J.R. Webster. 1996. The role of macroinvertebrates in stream ecosystem function. Annual Review of Entomology, 41, 115–139. http://dx.doi.org/10.1146/annurev.en.41.010196.000555 [ Links ]
Wallace J.B., S.L. Eggert, J.L. Meyer & J.R. Webster. 1997. Multiple Trophic Levels of a Forest Stream Linked to Terrestrial LitterInputs. Science 277:102-104. http://dx.doi.org/10.1126/science.277.5322.102. [ Links ]
Ward J.V. 1992. Aquatic insect ecology 1: Biology and habitat. Singapore: John Wiley and Sons, Inc. 438 p. [ Links ]
*Autor para correspondencia
Email Janet Sajamí: janetsajami@hotmail.com
Email Ana Huamantinco: ahuamantinco@hotmail.com
Información sobre los autores:
JISR y AAHA realizaron el diseño experimental, trabajos de campo, analisis y redaccion del manuscrito.
Los autores no incurren en conflictos de intereses.
Presentado: 19/11/2015
Aceptado: 23/03/2016
Publicado online: 27/08/2016