Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.23 no.2 Lima mayo/agos. 2016
http://dx.doi.org/10.15381/rpb.v23i2.12381
10.15381/rpb.v23i2.12381
TRABAJOS ORIGINALES
Diversidad y composición de murciélagos en los bosques montanos del Santuario Nacional Pampa Hermosa, Junín, Perú
Bats diversity and composition in montane forest of Pampa Hermosa National Sanctuary, Junin, Peru
Edith Arias 1*, Víctor Pacheco 1, 2, Klauss Cervantes 1, Adela Aguilar 1, José Álvarez 1
1 Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Apartado 14-0434, Lima-14, Perú.
2 Instituto de Ciencias Biológicas "Antonio Raimondi", Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, Perú.
Resumen
El Santuario Nacional Pampa Hermosa (SNPH) es un área protegida importante debido a que protege los relictos de los bosques montanos de las Yungas centrales del Perú, donde los estudios de la diversidad de murciélagos son escasos. Nuestro objetivo fue documentar la diversidad y composición de los murciélagos del SNPH y compararlo con otros bosques de las Yungas peruanas en el rango de 1200 – 2000 m. Se evaluaron cuatro localidades: Podocarpus (1900 m), Los Cedros (1600 m), Santa Isabel (1450 m) y Nueva Italia (1370 m). Se registraron 36 especies de murciélagos en las familias Phyllostomidae (30 spp.), Vespertilionidae (5 spp.) y Molossidae (1 sp.) con un esfuerzo de 560 redes-noche. Los estimadores Chao 1 y Chao 2 indicaron que se cubrió el 77% y 42% de las especies en la zona de estudio, respectivamente. Las curvas de rango-abundancia muestran a Carollia brevicauda como la más abundante en todas las localidades; se resalta la abundancia de Vampyressa melissa en las localidades de Los Cedros y Podocarpus. Se muestra una relación inversa significativa entre la riqueza de especies y la elevación (r = -0.90, P= 0.014). En rangos de 1200-1600 m, la riqueza del SNPH (35 spp.) fue mayor que en las otras Yungas presentando una mayor similitud con el Manu (Ij = 0.59); por otro lado, en rangos de 1600 – 2000 la riqueza del SNPH (14 spp.) fue la segunda más alta después del Manu (21 spp.), presentando una mayor similitud con San Ramón (Ij = 0.30). Los valores de complementariedad fueron altos entre el SNPH y los bosques de Yungas, entre 55-76% (1200-1600 m) y entre 70-83% en (1600-2000 m). Estos resultados indican que la diversidad β de los murciélagos en las Yungas peruanas es alta; sin embargo, debemos tomar en cuenta los esfuerzos dispares entre las localidades comparadas y que se requiere más trabajo de campo en zonas de vida y elevaciones aun no exploradas del SNPH para resultados más precisos.
Palabras clave: Diversidad; murciélagos; Yungas; gradiente altitudinal; Santuario Nacional Pampa Hermosa.
Abstract
The Pampa Hermosa national sanctuary (SNPH) is an important area because it preserves relict montane forests of the Peruvian central Yungas where studies of bat’s diversity are scarce. Our objective was to document the species diversity and composition of bats communities in Pampa Hermosa and make comparisons with other Peruvian Yungas forests ranging between 1200-2000 m. We sampled four localities: Podocarpus (1900 m), Los Cedros (1600 m), Santa Isabel (1450 m) and Nueva Italia (1370 m) by using 560 mist-nights. Our results show 36 species distributed in families Phyllostomidae (30 spp.), Vespertilionidae (5 spp.) and Molossidae (1 sp.). According to the estimators Chao 1 and Chao 2, we found 77% and 42% of the species in the study area, respectively. The rank-abundance curves point to Carollia brevicauda as the most abundant in all localities; abundance of Vampyressa melissa is highlighted in Los Cedros and Podocarpus. There is a significant inverse relationship between species richness and elevation (r = -0.90, P = 0.014). Altitudes of 1200-1600 m show a species richness (35 spp.) higher than other Yungas forests, and a greater similarity to those in Manu (Ij = 0.59); on the other hand, richness at altitudes of 1600-2000 (14 spp.) was the second highest after Manu (21 spp.) and more similar to San Ramon (Ij = 0.30). Values of complementarity were higher between Pampa Hermosa and other forests in the Peruvian Yungas, ranging from 55-76% (1200 – 1600 m) to 70-83% (1600 – 2000 m). These results indicate there is a high β diversity in the bat communities from the Peruvian Yungas; however, we have to take into account the disparate sampling efforts among the evaluated localities and that additional research in areas of the SNPH not yet explored must give a stronger support to our results.
Keywords: Bats; diversity; Peruvian Yungas; altitudinal gradient; Pampa Hermosa national sanctuary.
Introducción
Las Yungas Peruanas o Bosques montanos de la vertiente oriental de los Andes, se encuentran entre elevaciones de 800 a 3600 m (Tovar 2010). Su fisiografía accidentada, la heterogeneidad del clima, suelos y la densa vegetación, prestan un ambiente favorable para el desarrollo de una gran diversidad biológica, aunque escasamente conocida comparada con Selva Baja. Más aún, en las Yungas se ha registrado un mayor número de endemismos (Young & León 1999, Myers et al. 2000, Antón & Reynel 2004, Young 2007, Pacheco 2002, Pacheco et al. 2009, Tovar et al. 2010).
El conocimiento de la diversidad de murciélagos en las Yungas, ha sido documentado inicialmente por Tuttle (1970) en las Yungas centrales y posteriormente por Koopman (1978) y Graham (1983). Sumado a ello se cuentan con estudios integrales en las Yungas del sur en el Parque Nacional del Manú (PNM) y zonas aledañas (Cusco) en donde se reportaron hasta 64 especies de murciélagos en el ambiente de las Yungas (Pacheco et al. 1993, Patterson et al. 1996, Solari et al. 2006, Medina et al. 2012), constituyéndose así como una de las áreas y gradientes más diversas del mundo. Así también se cuentan con los estudios en del Parque Nacional Yanachaga Chemillén (PNYCH) ubicados en Yungas centrales, en donde se reportaron cerca de 50 especies en el ámbito de las Yungas (Vivar 2006).
Otras investigaciones en las Yungas peruanas se han desarrollado en la región sur de Vilcabamba, en la cuenca media del río Tambopata y en la cuenca del río Apurímac (Solari et al. 2001, Pacheco et al. 2007, 2011) en el sur de las Yungas, donde se documentan 33, 23 y 17 especies respectivamente. Así también en las Yungas centrales en el valle de Pozuzo en Pasco (Mena 2010), con 43 especies de murciélagos, además en San Ramón (Carrasco 2011) y Satipo (Refulio 2015), en donde se registraron 32 y 22 especies respectivamente, ambos en Junín.
La variedad de climas, suelos y vegetación referida para las Yungas peruanas, influye en las diferencias de diversidad de los murciélagos tanto a escala local como regional, tal es así que la disposición de los murciélagos en una gradiente está relacionado a sus capacidades termorreguladoras en respuesta a los factores climáticos, además de la complejidad del hábitat que ocupan (Graham 1983, Soriano 2000, McCain 2007).
El Santuario Nacional Pampa Hermosa (SNPH) localizado en el departamento de Junín, es un importante área debido a que protege los bosques relictos de cedros Cedrela spp. en la selva central (SERNANP 2012) y la cabecera de la cuenca del río Ulcumayo, una de las áreas prioritarias para la conservación de las Yungas Peruanas (Tovar et al. 2010). Además es considerado un conector entre las áreas naturales andinas y amazónicas, que en conjunto sería un corredor biológico de importancia para las Yungas centrales (SERNANP 2012). A pesar de la gran importancia del SNPH los estudios en biodiversidad son escasos, excepto por un estudio de la diversidad arbórea del área (La Torre 2003).
Nuestro objetivo fue documentar la diversidad y composición de murciélagos del Santuario Nacional Pampa Hermosa en una gradiente de 1370 a 1900 m, que incluye cuatro localidades, donde registramos la riqueza y abundancia relativa de las especies así como la relación de la riqueza con la elevación. Se analiza además la diversidad β de murciélagos en las Yungas Peruanas, comparando la riqueza de especies presentes en el SNPH con otros estudios en rangos de elevación similares, para ello utilizamos los estudios de diversidad: del Parque Nacional del Manu (Pacheco et al. 1993, Patterson et al. 1996, Solari et al. 2006, Medina et al., 2012), del Parque Nacional Yanachaga Chemillén (Vivar 2006), de San Ramón (Carrasco 2011), de la Cuenca del río Pampa Hermosa en Satipo (Refulio 2015) y de la Cuenca Media del río Tambopata (Pacheco et al. 2011). Por último listamos a las especies con alguna categoría de amenaza, endemismo y sugerimos la conservación de los bosques montanos del SNPH.
Material y métodos
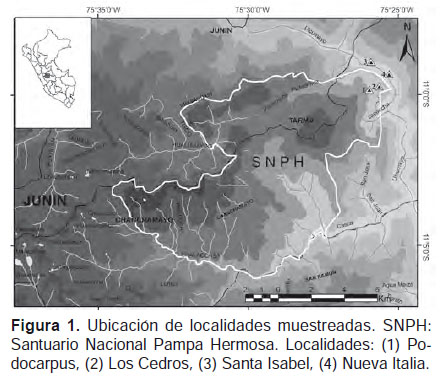
Área de estudio.- El área de estudio se ubica en el Santuario Nacional Pampa Hermosa (SNPH) y su zona de amortiguamiento, en la cuenca del río Ulcumayo, provincia de Chanchamayo del departamento de Junín, Perú (Fig. 1). Según la clasificación de ecorregiones del Perú de Brack-Egg (1986), el área corresponde a las Yungas o conocido también como Bosques montanos de la vertiente oriental de los Andes (Tovar et al. 2010). Presentan Zonas de Vida de Bosque tropical montano bajo muy húmedo y Bosque premontano tropical muy húmedo (Holdridge 1967, La Torre et al. 2007). Se evaluaron cuatro localidades:
(1) Podocarpus (1900 m).-Se encuentra dentro de la Zona de Vida de Bosque tropical montano bajo muy húmedo (La Torre et al. 2007), la temperatura media anual correspondiente a esta elevación es de 15 a 19 °C y la precipitación pluvial es de 1500–3000 mm/año (Galdo 1985, Young & León 1999, La Torre et al. 2007). Es un bosque primario con árboles de 15 m de altura y DAP de 15 cm en promedio. Las especies arbóreas dominantes pertenecen a las familias Podocarpaceae y Clusiaceae (La Torre et al. 2007), menos comunes son Lauraceae, Moraceae, Cecropiaceae y Piperaceae. La cobertura del dosel es de 50% aproximadamente, con presencia de gran cantidad de epífitas de las familias Bromeliaceae y Araceae; la vegetación en el sotobosque es escasa con grandes claros en donde se evidencia el crecimiento reciente de árboles. Presenta un suelo de tipo franco arenoso de color pardo oscuro, con un pH de 4.0 a 7.0 (La Torre 2003). La hojarasca en el suelo presenta una profundidad de 10 cm aproximadamente; el ambiente es muy húmedo, con la presencia de musgos, hongos y líquenes en los troncos de los árboles y helechos (Fig. 1, Tabla 1).
(2) Los Cedros (1600 m).- Se encuentra dentro de la Zona de Vida de Bosque tropical montano bajo muy húmedo (La Torre et al. 2007), la temperatura media anual es de 15 a 19 °C y la precipitación pluvial es de 1500 – 3000 mm/año (Galdo 1985, Young & León 1999, La Torre et al. 2007). Es un bosque primario con árboles de 20 m de altura y DAP entre 17 a 25 cm, aunque en algunos casos pueden llegar a tener una altura 35 m y DAP mayor a 100 cm (Cedrela lilloi). Las familias más representativas son Meliaceae, Moraceae, Lauraceae, Urticaceae, Piperaceae y Bombacaceae. El dosel presenta una cobertura densa (75%), por lo que no se observan muchos claros; en el sotobosque se encuentran plántulas de la familia Aracaceae, Piperaceae además de helechos arbóreos. El suelo presenta una textura franco arenoso de color pardo oscuro, con un pH de 4.0 a 7.0 (La Torre et al. 2003), el nivel de hojarasca llega a unos 5 cm de profundidad aproximadamente. El ambiente es muy húmedo lo que favorece al crecimiento de musgos y hongos, además de encontrar un pequeño cuerpo de agua que se origina cuesta arriba (Fig. 1, Tabla 1).
(3) Santa Isabel (1450 m).- Se encuentra en la Zona de Vida de Bosque premontano tropical muy húmedo (Holdridge 1967), la temperatura media anual es de 16 a 30 °C y la precipitación pluvial anual es de 1900 a 2100 mm/año (Galdo 1985, Young & León 1999, La Torre et al. 2007). Es un bosque secundario al margen de la cuenca del río Ulcumayo fuertemente usado para cultivos de café, en donde aún persisten parches de bosques aledaños a estos cultivos. Los árboles presentan una altura de 20 m y DAP de 15 cm en promedio, entre las familias más representativas se encuentra Bombacaceae, Fabaceae, Lauraceae, Cecropiaceae y Moraceae. La cobertura del dosel es menor al 50% por lo que se observa la presencia de grandes claros. El sotobosque es bastante denso y cubierto por hierbas y arbustos de las familias Piperaceae y Solanaceae; el suelo es de tipo franco arenoso de color pardo oscuro, con un pH de 4.0 a 7.0 (La Torre et al. 2003) el nivel de hojarasca es menor a de 3 cm. El ambiente es húmedo por lo que aún se observa la presencia de musgos en los troncos de los árboles (Fig. 1, Tabla 1).
(4) Nueva Italia (1370 m).- Pertenece a la Zona de Vida de Bosque muy húmedo premontano tropical (Holdridge 1967), la temperatura media anual es de 16 a 30 °C y la precipitación pluvial es de 1900 a 2100 mm/año (Galdo 1985, Young & León 1999, La Torre et al. 2007). Es un bosque secundario al margen de la cuenca del río Ulcumayo usado para cultivos de café, cítricos y caminos permanentes. Los árboles presentan una altura de 20 m y DAP entre 10 a 30 cm, siendo las familias Lauraceae, Cecropiaceae, Fabaceae y Moraceae las más representativas y las que conforman una cobertura de dosel menor al 50%. El sotobosque es denso conformado por hierbas, arbustos y arbolillos de las familias Solanaceae, Piperaceae y Lauraceae respectivamente. El suelo presenta una textura franco arenoso de color pardo oscuro, con un pH de 4.0 a 7.0 (La Torre et al. 2003); el nivel de hojarasca es mínimo con 3 cm aproximadamente. El ambiente es húmedo con presencia aún de musgos y líquenes (Fig. 1, Tabla 1).
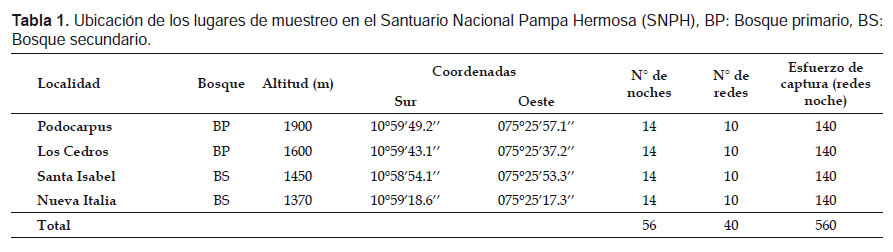
El estudio se realizó en dos periodos para cada localidad; Nueva Italia, Los Cedros y Podocarpus fueron evaluadas en los meses de mayo y octubre del año 2011. La localidad de Santa Isabel se evaluó en los meses de mayo-junio y setiembre del año 2012. Los meses de mayo y junio fue un periodo de transición entre la época húmeda y seca, mientras que setiembre y octubre fue un periodo de transición entre la época seca y húmeda Se utilizaron 10 redes de neblina de 12 x 2.5 m por siete noches en cada localidad para cada periodo evaluado, haciendo un total de 14 noches por localidad (Tabla 1). Las redes fueron ubicadas en sitios óptimos para la captura de murciélagos, como vías de vuelo, claros de bosques, posibles refugios, sitios cercanos a cursos de agua y cerca de plantas en fructificación y floración (Simmons & Voss 1998). Todas las redes fueron colocadas a nivel de sotobosque y permanecieron abiertas desde las 18:00 h hasta las 24:30 h y fueron revisadas por intervalos de 40 minutos. Para tener un ejemplar de referencia de la zona evaluada, se colectaron al menos dos especímenes por especie y se preservaron como alcohólicos con cráneo removido o como pieles con cráneo y carcasa. Los especímenes que fueron liberados en campo se identificaron con ayuda de claves taxonómicas de Pacheco y Solari (1997), Tirira (2007) y Díaz et al. (2011). Finalmente los especímenes colectados fueron identificados mediante comparación con especímenes de la colección del Departamento de Mastozoología del Museo de Historia Natural de San Marcos (MUSM), para luego ser depositados con sus respectivos número de catálogo MUSM.
El acumulado de la riqueza total de las especies se realizó mediante una curva de acumulación de especies con el programa EstimateS V 9.0 (Colwell 2013). Para predecir el número de las especies probables (esperadas) en el área de estudio, se utilizó el método no paramétrico con los estimadores Chao 1 y Chao 2. El estimador Chao 1 se basa en las abundancias y se enfoca en las especies poco abundantes o raras, mientras que el estimador Chao 2 utiliza datos de presencia-ausencia (Chao & Lee 1992, Colwell & Coddington 1994). Para el estimador Chao 1, las especies estimadas (S1*) es igual a Sobs + (a2/2b), en donde Sobs es igual a las especies observadas, "a" es el número de singletons (especies que solo aparecen una vez con un individuo) y "b" el número de doubletons (especies que aparecen dos veces con un individuo cada vez). Para Chao 2, S1* es igual a Sobs + (L2/2M), en donde "L" es el número de especies que ocurren en una sola muestra (especies únicas) y "M" es el número de especies que ocurre en exactamente dos muestras (Colwell & Coddington 1994). La proporción de especies registradas se obtiene mediante Sobs/S1*.
El esfuerzo de muestreo se calculó multiplicando el número de redes por las noches evaluadas (redes-noche) (Tabla 1). La abundancia relativa (AR) de cada especie (sin recapturas) se calculó en base al esfuerzo de captura total de cada localidad, se estandarizó la AR tomando el número de capturas por cada 10 redes-noche (Pacheco et al. 2011).
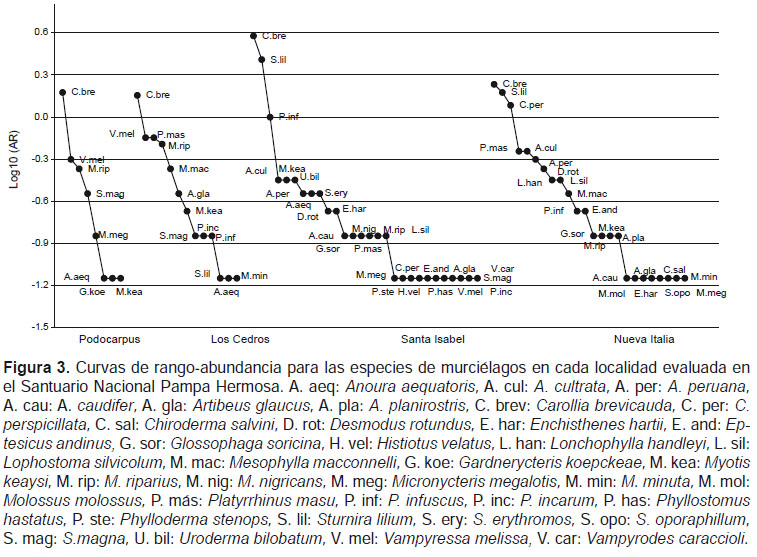
La composición del ensamblaje de murciélagos se determinó mediante las curvas de rango-abundancia para cada localidad muestreada, mediante el logaritmo base 10 de la abundancia relativa (AR) de cada especie en cada localidad, para luego ser graficadas. De esta manera se puede observar el número de especies y la dominancia o rareza de cada una para cada localidad muestreada (Feinsinger 2001).
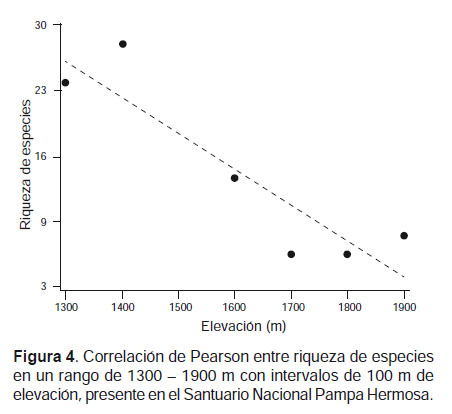
Se analizó la relación de la riqueza de especies con la elevación en un rango de elevación entre 1300 ‒ 1900 m con intervalos de 100 m, que contenían las elevaciones de las cuatro localidades evaluadas. Para elevaciones en donde no se tienen datos de riqueza se siguió las consideraciones de Patterson et al. (1996), quienes presumen que una especie registrada en dos intervalos de elevación puede estar también presente entre dichos intervalos. Se utilizó el coeficiente de correlación de Pearson (r) que va desde -1 a 1, en donde se considera la correlación es positiva si r > 0 o negativa si r < 0. El análisis se realizó en el paquete estadístico InfoStat V 2015 (Di Rienzo et al. 2015).
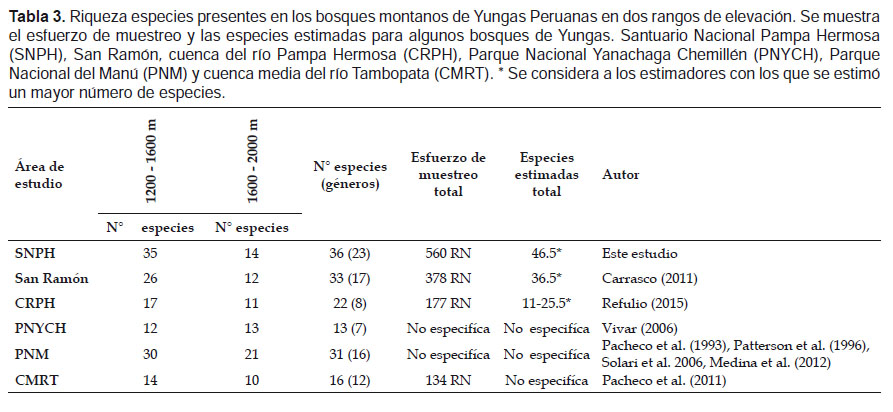
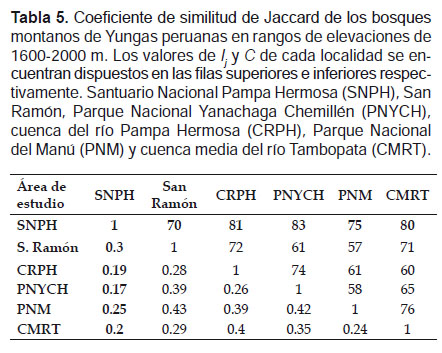
Por otro lado, para estimar la diversidad β, se comparó la riqueza de especies presentes en SNPH con otros trabajos realizados en las Yungas Peruanas en rangos de elevación comprendidos entre 1200 ‒ 1600 m y 1600 ‒ 2000 m, considerando dichos rangos debido a que fueron las elevaciones comúnmente estudiadas en los estudios citados. Se incluyeron los estudios realizados en Yungas centrales: en San Ramón (Carrasco 2011), en el Parque Nacional Yanachaga Chemillén (PNYCH) (Vivar 2006) y en la cuenca del Río Pampa Hermosa (CRPH) en Satipo (Refulio 2015), y los de Yungas del sur: en el Parque Nacional del Manu (PNM) (Pacheco et al. 1993, Patterson et al. 1996, Solari et al. 2006, Medina et al. 2012) y la cuenca medio del río Tambopata (CMRT) (Pacheco et al. 2011).
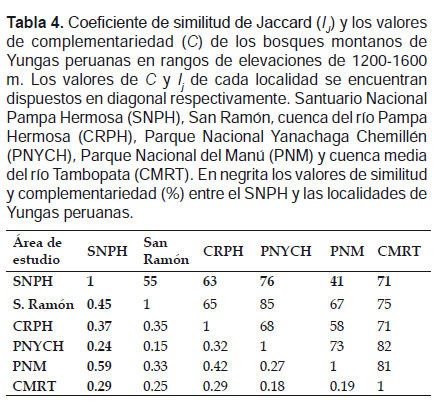
La diversidad β se estimó a través del análisis de similitud mediante el coeficiente de similitud de Jaccard (Ij) con un análisis de cluster y UPGMA (Unweighted Pair Group Method with Arithmatic Mean), mediante el programa PAST V 3.0 (Hammer et al. 2001). Además se realizó un análisis de disimilitud mediante los valores de complementariedad (Cjk ) entre los bosques. La complementariedad es igual a Cjk= Ujk/Sjk, en donde Ujk representan a las especies únicas y Sjk la riqueza total de especies (Colwell & Coddington 1994).
Resultados
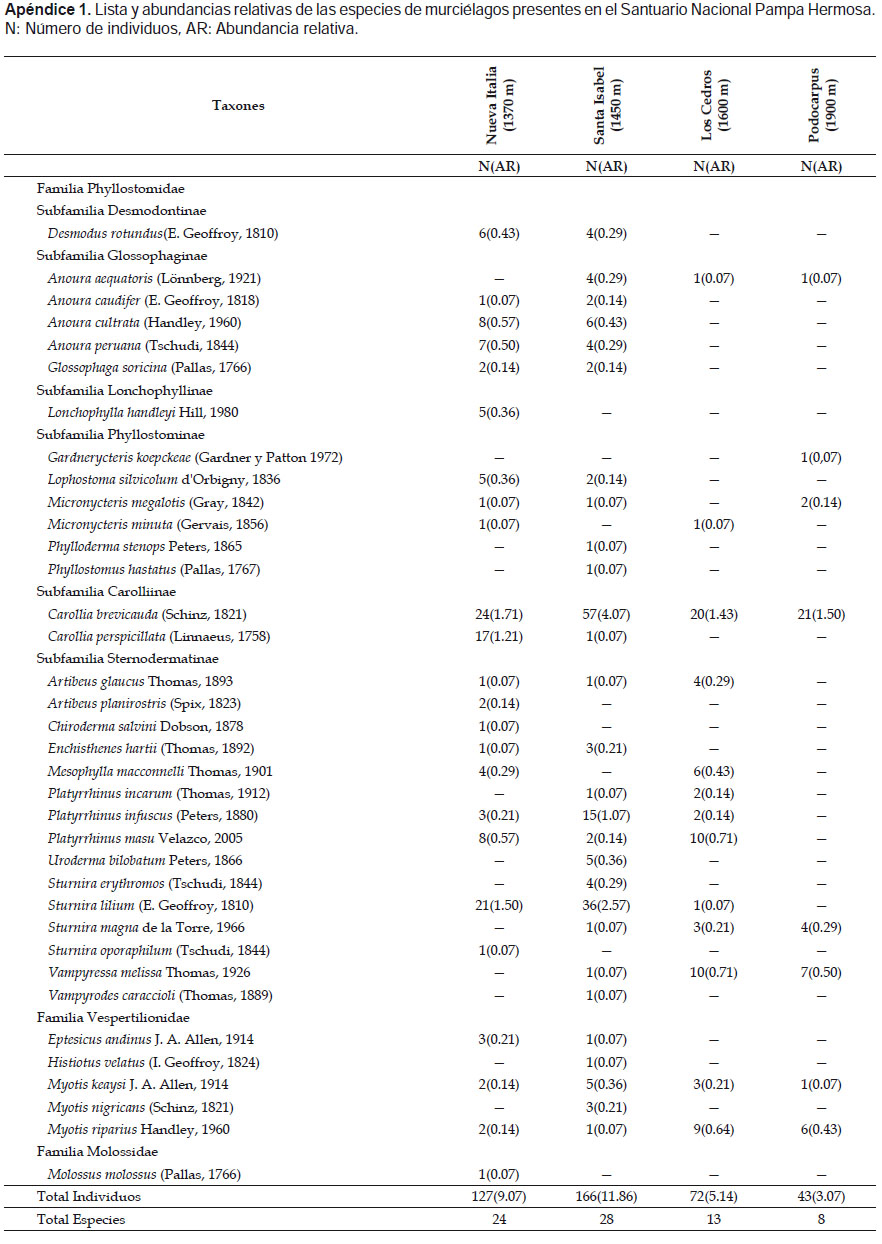
Con un esfuerzo de muestreo total de 560 redes-noche (RN), se capturaron 408 individuos (181 colectados, 222 liberados y cinco recapturas), identificándose 36 especies en tres familias: 30 especies de Phyllostomidae (83.3%), cinco de Vespertilionidae (13.8%) y una de Molossidae (2.7%). Del total de capturas, las subfamilias Stenodermatinae (39.5 %) y Carolliinae (34.3%) fueron las más abundantes, mientras Lonchophyllinae (1.2%) fue la más rara (Apéndice 1).
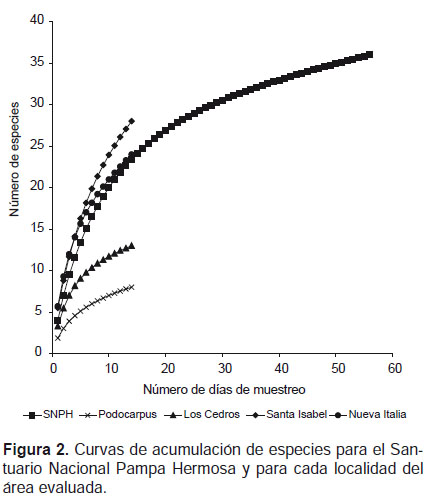
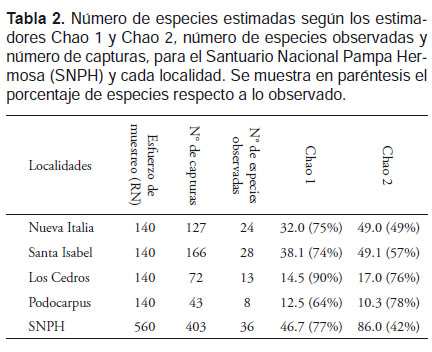
Para toda el área evaluada el número de especies estimadas (S1*) según los estimadores Chao 1 y Chao 2 fue 46.7 y 86 especies respectivamente. Por tanto, las 36 especies registradas, representan el 77% (Chao 1) o el 42% (Chao 2) de las especies esperadas para el SNPH. Según el estimador Chao 1, Los Cedros fue la localidad mejor muestreada, alcanzando el 90% de sus especies, seguida de Nueva Italia, Santa Isabel y Podocarpus. En contraste el estimador Chao 2, muestra que Podocarpus fue la localidad que alcanzó el mayor porcentaje de especies (76%), seguida de Los Cedros, Santa Isabel y Nueva Italia (Fig. 2, Tabla 2). Ambos estimadores muestran que en Los Cedros se registró un porcentaje alto de las especies presentes en dicha localidad. Si bien para ambos estimadores la riqueza del SNPH es mayor a la registrada, la curva empieza a hacerse asintótica en los últimos días de evaluación (Fig. 2).
Dentro de los registros de interés reconocemos a la especie Anoura peruana (Tschudi, 1844), considerada como subespecie de Anoura geoffroyi (Gray, 1838) y posteriormente validada a especie plena por Mantilla-Meluk y Baker (2010). Así mismo consideramos a Anoura aequatoris (Lönnberg, 1921) del complejo caudifer, como especie valida siguiendo las consideraciones de Mantilla-Meluk y Baker (2006) y Pacheco et al. (2009). Un registro importante es la especie endémica Gardnerycteris koepckeae, descrita por primera vez como Mimon koepckeae por Gardner y Patton (1972) y redescubierta después de 40 años por Hurtado et al. (2014), quienes la redescribieron y ampliaron su distribución hasta Junín. Posteriomente koepckeae fue trasferida al nuevo género Gardnerycteris (Hurtado & Pacheco 2014).
Nuevos registros para el departamento de Junín son: G. koepckeae, Histiotus velatus, Myotis riparius y Phylloderma stenops. La especie Vampyrodes caraccioli cuyo límite superior alcanzaba los 1050 m, amplía su rango de elevación en las Yungas Peruanas hasta los 1450 m.
El análisis de las curvas de rango-abundancia mostró una curva más larga para Santa Isabel (28 spp.) lo que indica una mayor diversidad de especies, en contraste con la localidad de Podocarpus (8 spp.) (Fig. 3). Las especies que presentaron las AR mínimas, esto es con un solo individuo, se presentan en la cola de las curvas, Santa Isabel y Nueva Italia, presentaron un mayor número de especies con AR mínima (11 y ocho especies respectivamente), mientras que Los Cedros y Podocarpus presentaron cada una tres especies (Fig. 3).
La localidad que presentó la mayor abundancia relativa fue Santa Isabel (11.86) seguida de Nueva Italia (9.07), Los Cedros (5.14) y Podocarpus (3.07). En todas las localidades la especie más abundante fue Carollia brevicauda; en Podocarpus, ésta fue seguida por Vampyressa melissa y Myotis riparius; en Los Cedros por Platyrrhinus masu y V. melissa; en Santa Isabel por Sturnira lilium y Platyrrhinus infuscus y en Nueva Italia por S. lilium y Carollia perspicillata (Fig. 3, Apéndice 1)
A través del análisis de correlación de Pearson en los rangos de elevación analizados, se observó que el número de especies disminuye con la elevación, mostrando una correlación negativa (r = -0.90) y estadísticamente significativa (P = 0.014) (Fig. 4).
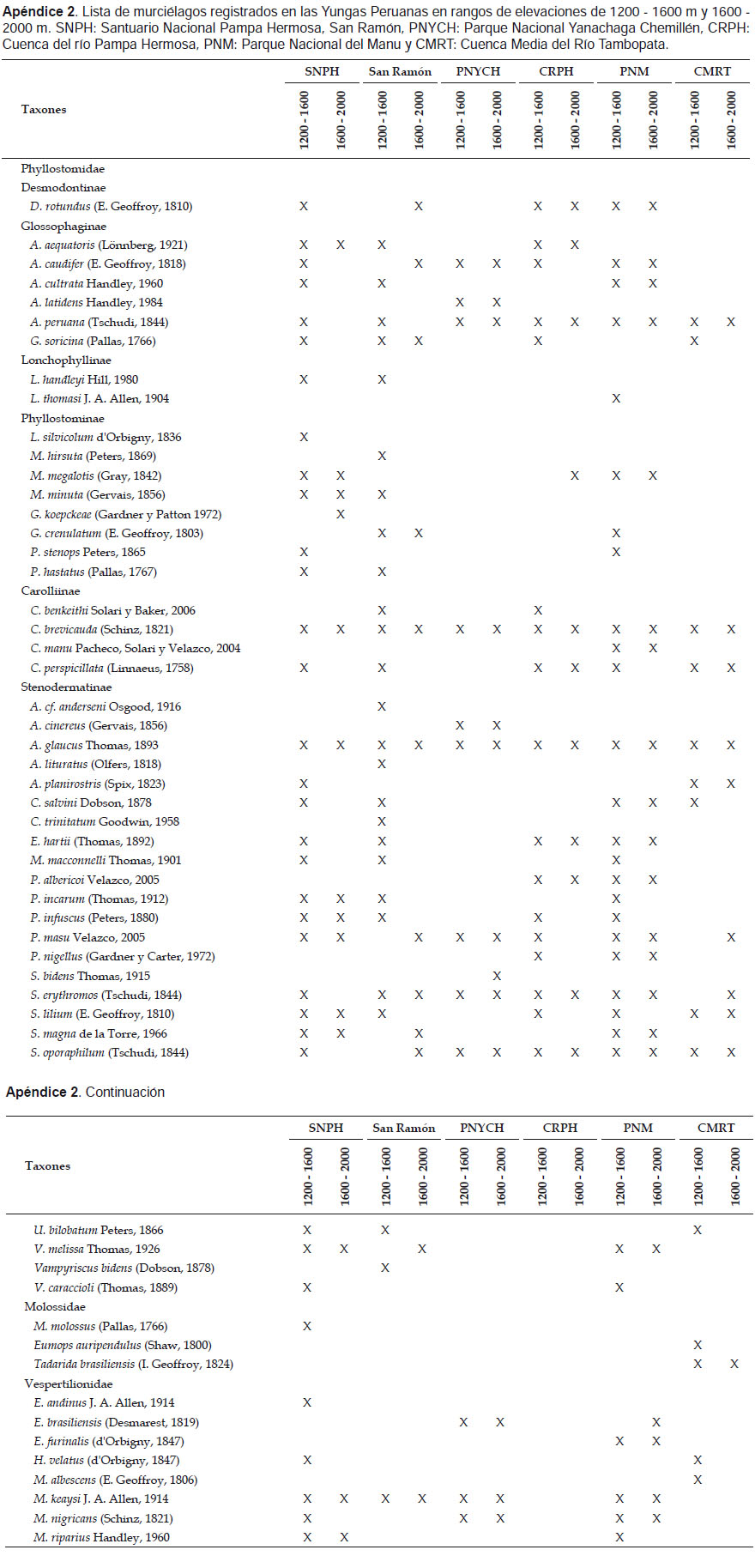
En el rango altitudinal de 1200 a 1600 m se registraron en el Santuario Nacional Pampa Hermosa (SNPH) 35 especies pertenecientes a 22 géneros, este valor es mayor que lo reportado en otros trabajos realizados en las Yungas peruanas en elevaciones similares (Tabla 3). Más de la mitad de las especies de la subfamilia Phyllostominae y la familia Vespertilionidae registradas en Yungas, estuvieron presentes en dichas elevaciones del SNPH, lo que indica una mayor riqueza de insectívoros para esta zona (Apéndice 2).
Por otro lado, en el rango de 1600 ‒ 2000 m se registraron 14 especies distribuidas en nueve géneros, riqueza que fue menor, comparada con el Parque Nacional del Manú (21 spp.); mientras que fue similar con los otros bosques de Yungas (Tabla 3). La riqueza de especies de Phyllostominae en dicho rango fue mayor que los demás bosques, pero la riqueza de Vespertilionidae fue mayor en el PNM (Apéndice 2).
La similitud del ensamblaje de murciélagos en el rango de 1200‒1600 m, fue mayor entre el SNPH y el PNM (Ij = 0.59) compartiendo 24 especies, y menor entre el SNPH y el PNYCH (Ij = 0.24) compartiendo nueve especies. El nivel de complementariedad entre los bosques del SNPH y el PNM resultó ser bajo (41%), mientras que entre la SNPH y el PNYCH fue alto (76%) (Tabla 4). En elevaciones entre 1600‒2000 m, la similitud resultó ser baja entre todos los bosques, por tanto sus valores de complementariedad fueron altos. La mayor similitud se observó entre el SNPH y San Ramón (Ij = 0.3) compartiendo seis especies, siendo su nivel de complementariedad muy alto (83%) (Tabla 5).
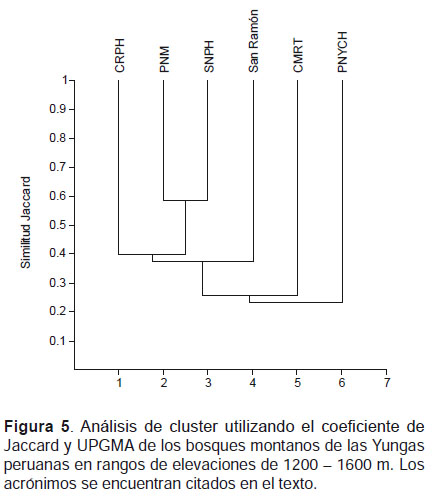
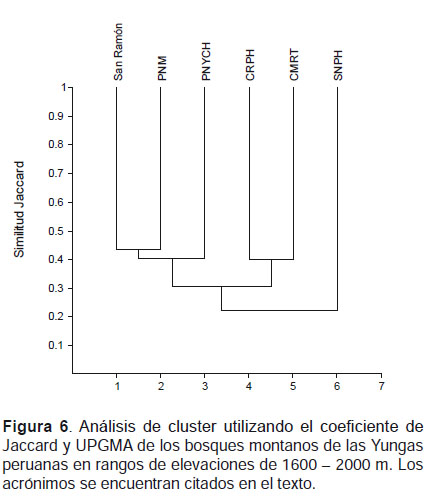
A través de los valores de similitud en elevaciones entre 1200‒1600 m, se observó que el SNPH se agrupó con el PNM, mientras que la CRPH y San Ramón fueron independientes al igual el PNYCH que presentó la menor similitud con el SNPH (Fig. 5). En elevaciones entre 1600 ‒ 2000 m, el SNPH formó un grupo independiente quedando separado de los otros bosques. El PNM resultó ser más similar a San Ramón formando un grupo, a su vez el PNYCH resulto más cercano a ellos. La CRPH formó un grupo con la CMRT (Fig. 6).
En este estudio se registran cinco especies listadas en alguna categoría de conservación por la legislación peruana (D.S N°. 004-2014-MINAGRI) y la lista roja de la Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales (IUCN 2015). Según la legislación peruana el murciélago Gardnerycteris koepckeae especie endémica del Perú (Pacheco et al. 2009), es la más amenazada encontrándose En Peligro Crítico (CR), seguido se encuentran los murciélagos Histiotus velatus y Vampyressa melissa citados dentro de la categoría Vulnerable (VU). Las especies Sturnira oporaphilum y Anoura cultrata son considerados por la IUCN (2015) dentro de la categoría de Casi Amenazada (NT).
Discusión
Registramos por primera vez 36 especies de murciélagos en los bosques montanos del SNPH donde la familia Phyllostomidae fue la más diversa, lo que es concordante con lo esperado para el Neotrópico y otras localidades de las Yungas en el Perú (Pacheco et al. 2009). La diversidad de las familias Molossidae y Vespertilionidae podría estar subrepresentada, porque ambas familias presentan un sistema de ecolocación muy desarrollado lo que dificulta su captura en redes, además forrajean mayormente en dosel (Kalko 1998, Simmons & Voss 1998).
Según Walther & Moore (2005), Chao 1 y Chao 2 están dentro de los cuatro estimadores que presentan una mejor precisión en la estimación de riqueza, comparados a otros estimadores paramétricos y funciones asintóticas. Ambos estimadores sugieren que la riqueza total de las especies registradas en el SNHP sería mayor a la obtenida, con diferencias más notables en las localidades de menor elevación. Los estudios en las Yungas de Pasco y Junín con un esfuerzo de muestreo de 72 RN y 378 RN respectivamente, consideran como óptimo el registro del 70% de sus especies (Mena 2010, Carrasco 2011). Sustentados con estos resultados, nosotros consideramos como óptimo el 77% de las especies registradas (Chao 1) con el esfuerzo realizado (560 RN). El registro de solo 42% de las especies con Chao 2 en un esfuerzo de 560 RN para todo el Santuario, respondería a que el estimador estaría siendo afectado por la representatividad de las capturas (Colwell & Coddington 1994). Por tanto, se sugiere que Chao 2 no sería adecuado para estimar la riqueza del Santuario, debido a que estaría sobreestimando la riqueza real (Tabla 2).
Aunque todas las localidades tuvieron el mismo esfuerzo, solo en Los Cedros se alcanzó hasta el 90% de sus especies (Chao 1), lo que indica un esfuerzo de muestreo satisfactorio. Por tanto, según Chao 1 la probabilidad de encontrar más especies en Los Cedros es menor en comparación a Podocarpus (64%), Santa Isabel (74%) y Nueva Italia (75%) en donde aún se esperaría un mayor número de especies (Tabla 2). Este hecho se presentaría debido a que el factor altitudinal influye en la riqueza de murciélagos, por ejemplo en Santa Isabel se encontró el doble del número de especies que Los Cedros (Tabla 2). Por otro parte, en Podocarpus se estimó menos del 70% (Chao 1) de las especies lo que puede estar influenciado por factores como los días de luna, la temperatura y precipitación que reducen la actividad de los murciélagos (Erkert 1974, Reith 1982, Mancina 2008) y que se presentaron en los meses de muestreo para Podocarpus.
Las especies Gardnerycteris koepckeae, Histiotus velatus, Myotis riparius y Phylloderma stenops son nuevos registros de murciélagos para el departamento de Junín, incrementando su diversidad (Tuttle 1970, Koopman 1978, Carrasco 2011, Refulio 2015), y resultando en un total de 56 especies de murciélagos.
La mayor diversidad en la localidad de Santa Isabel (1450 m), puede estar atribuida a factores altitudinales (que se explicarán a detalle más adelante), sumado a condiciones favorables para los murciélagos como disponibilidad de recursos y refugios que ofrecería Santa Isabel. Estudios indican que los cafetales al ser cultivados en asociación con plantas de sombra, pueden albergar un ensamblaje de murciélagos igual o mayor a los bosques continuos a estos cultivos; muchas de las plantas asociadas a los cafetales son consumidas por los murciélagos, además de ser junto con el café refugios de paso (Sosa et al. 2008, Saldaña-Vázquez 2008, Kraker-Castañeda & Pérez-Consuegra 2011). Por tanto, factores altitudinales y disponibilidad de recurso local y refugios, explicarían la mayor diversidad de murciélagos en Santa Isabel.
Por otro lado, es destacable la abundancia de Vampyressa melissa en las localidades de Podocarpus y Los Cedros, en comparación a Santa Isabel en donde su abundancia fue menor, y en Nueva Italia en donde no se encontró ningún individuo (Fig. 3, Apéndice 1). Los estudios en las Yungas indican que el rango altitudinal de V. melissa se encuentra entre 1000 ‒ 2200 m (Solari et al. 2006, Carrasco 2011), rango que abarca las cuatro localidades muestreadas en nuestro estudio. Nosotros predecimos que la abundancia de la especie en mención, se relacionaría al buen estado de conservación de Podocarpus y Los Cedros, localidades dentro del Santuario. Vampyressa melissa consume principalmente frutos de la familia Moraceae en Los Cedros y Podocarpus (Arias en preparación), una de familias indicadoras de bosques prístinos a más de 1500 m según La Torre et al. (2007).
En cuanto a Carollia brevicauda, especie más abundante en todo el SNPH, presenta un rango altitudinal muy amplio, encontrándose para el ámbito de las Yungas hasta los 2400 m (Solari et al. 2006, Vivar 2006, Carrasco 2011). La mayor abundancia de C. brevicauda en Santa Isabel, en comparación a las localidades restantes, fue notoria (Fig. 3, Apéndice 1). Algunos estudios en bosques tropicales relacionan la abundancia del género Carollia con ambientes perturbados y en regeneración, en donde se encuentran una vegetación pionera conformada por familias como Piperaceae y Solanaceae, principales en su dieta (Willig et al. 2007, Gonçalves et al. 2008, Klingbeil & Willig 2009). Por consiguiente, la mayor abundancia de C. brevicauda en Santa Isabel, podría estar relacionada a la disponibilidad de recursos ofertantes que presentan los bosques secundarios de la localidad.
El análisis de correlación de Pearson mostró la existencia de una relación inversa entre el número de especies y la elevación (Fig. 4). Este patrón ya ha sido observado en estudios de diversidad de murciélagos en gradientes de las Yungas peruanas (Graham 1983, Patterson et al. 1996, Vivar 2006), en donde además se indica una disminución de especies más drástica desde los 1000 m hasta los 2500 m. Si bien, dichos estudios abarcan una gradiente de 2.8 ‒ 3.5 km (entre 200 ‒ 3500 m), nuestros resultados son comparables, debido a que comparten el rango de elevación para las Yungas.
Nuestras comparaciones de la riqueza de murciélagos en elevaciones de 1200 ‒ 1600 m, indicaron una mayor riqueza en el SNPH comparada San Ramón, la cuenca del río Pampa Hermosa y el PNYCH (Carrasco 2011, Refulio 2015, Vivar 2006), áreas de las Yungas centrales, además del Parque Nacional del Manu (PNM) y la cuenca media de río Tambopata (CMRT) (Pacheco et al. 1993, Patterson et al. 1996, Solari et al. 2006, Medina et al. 2012, Pacheco et al. 2011), al sur de Yungas. En elevaciones 1600 ‒ 2000 m, la riqueza de murciélagos del SNPH descendió notablemente a más de la mitad del número de especies que se registró en elevaciones de 1200 ‒ 1600 m, siendo menor a bosques como el PNM, pero siendo aún mayor a los otros bosques de las Yungas (Tabla 3).
Como se observa en los estudios de Graham (1983), Patterson et al. (1996) y Vivar (2006), que abarcan una gradiente desde tierras bajas hasta las Yungas; la elevación es determinante en la riqueza y distribución de murciélagos, con cambios más notorios en elevaciones mayores a los 1000 m, en donde se observan una disminución de especies de tierras bajas y la aparición de especies montanas. Algunos estudios comprueban que factores climáticos, como la temperatura y precipitación relacionados a los cambios altitudinales, influyen directamente en la riqueza de los murciélagos (Graham 1983, MacGain 2007). Se ha mencionado que la eficiente capacidad termorreguladora de algunos murciélagos, les permitiría acceder a zonas montanas y por tanto limitaría la presencia de algunas especies, siendo un factor importante en su riqueza y distribución (Soriano 2000, Mello et al. 2008).
Por otro lado, Graham (1983) mencionó que la complejidad del hábitat referida a características vegetativas de las Yungas, sería también un factor relacionado a los cambios de riqueza de murciélagos en gradiente. Este hecho fue sugerido anteriormente para aves (Terborgh 1971), en una gradiente de las Yungas peruanas.
La heterogeneidad de la geografía y topología de las Yungas peruanas propician diferencias climáticas y vegetativas a escala local y regional (Young & León 1999, Tovar 2010). Este hecho estaría relacionado a las diferencias de la diversidad de murciélagos encontradas en los diferentes bosques de las áreas analizadas, aunque son necesarios análisis específicos para comprobar lo argumentado.
El ensamblaje de murciélagos del SNPH muestra una riqueza inusual de insectívoros de la subfamilia Phyllostominae y la familia Vespertilionidae, comparados a otros bosques las Yungas peruanas (Apéndice 2). Soriano (2000) indicó que la capacidad termorreguladora (hipotermia facultativa o topor) de solo algunos grupos de murciélagos, entre ellos los Vespertilionidae, les permiten acceder a ambientes con bajas temperaturas; en la familia Phyllostomidae en general, está condición está presente pero no es constante (Speakman & Thomas 2003). Por otro lado, los estudios de Wilson et al. (1996) y Mena (2010) indicaron que los Phyllostominae se encontraron mayormente en bosques maduros con mayor cobertura arbórea o bajos niveles de fragmentación. En el SNPH, los Phyllostominae estuvieron presentes en ambos rangos de elevación analizados, en el PNM solo algunas especies alcanzaron elevaciones mayores a 1200 m. En la CRPH se registró solo una especie de Phyllostominae en elevaciones mayores a 1800 m en donde según Refulio (2015) aún se encontraban parches de bosques; en la CMRT estuvieron presentes solo en elevaciones menores a 1000 m donde se presentaba un ecotono y un bosque poco perturbado (Pacheco et al. 2011).
El SNPH tal vez preste un ambiente con condiciones climáticas favorables para una eficiente termorregulación por parte de los Phyllostominae, que les permitiría alcanzar una mayor riqueza, comparada con otros bosques de las Yungas; por lo que estudios comparativos con respecto a las capacidades fisiológicas de los Phyllostominae en respuesta a las condiciones climáticas de los bosques en distintas gradientes, se hacen necesarios. En adición, los bosques poco perturbados del Santuario, podrían relacionarse también a su mayor riqueza.
En el caso de la familia Vespertilionidae, la riqueza es mayor en SNPH, PNM y el PNYCH, a diferencia de los bosques de San Ramón, la CRPH y la CMRT, donde la riqueza es baja; este hecho puede estar relacionado a los bajos niveles de fragmentación de los bosques que presentan las áreas naturales protegidas citadas. En un estudio en los bosques tropicales del Parque Nacional de Cerros de Amotape (ambientes no alterados y alrededores), la riqueza de Vespertilionidae fue mayor en localidades con bosques más conservados que en localidades con ambientes alterados, en donde la riqueza fue menor o estuvo ausente (Cadenillas 2010). Tal es así que al igual que Phyllostominae, la riqueza de Vespertilionidae estaría relacionada al estado de los bosques de las Yungas.
Los bajos valores en los índices de similitud entre el SNPH y los bosques de las Yungas peruanas, sumados a los valores de complementariedad (Tabla 4, 5), indican una diversidad β muy alta. La mayor similitud registrada entre el SNPH y el PNM (1200‒1600 m), reflejaría la alta diversidad del SNPH comparable al PNM de las Yungas del sur que cuentan con cerca de 20 años de investigaciones. En rangos de elevación 1600 ‒ 2000 m además de observarse una similitud menor del SNPH con los otros bosques de las Yungas centrales, el Santuario formó un grupo independiente (Fig.6), lo que reflejaría la particular composición de murciélagos del Santuario en dicho rango de elevación.
Los resultados de disimilitud reflejan una diversidad β alta para los murciélagos en las Yungas peruanas. Estos patrones de diversidad β, ya habían sido encontrados en Perú en una gradiente en el sureste de los Andes (Patterson et al. 1998), en donde además de los murciélagos se observa una alta diversidad β en aves y roedores, y en un estudio de diversidad de roedores en la cuenca del río Apurímac en donde se observa la alta diversidad beta comparada con otras Yungas (Pacheco et al. 2013). Por lo tanto se espera que la alta diversidad β podría observarse también en otros taxones presentes en las Yungas peruanas.
Nosotros documentamos el primer estudio de diversidad de murciélagos en el Santuario Nacional Pampa Hermosa, hábitats que presentan una alta riqueza mayor que otros bosques montanos de las Yungas en elevaciones de 1200 ‒ 1600 m y que probablemente sea también alta en elevaciones 1600 ‒ 2000 m, en donde aún faltan registrar especies.
Las diferencias en la riqueza de murciélagos en una gradiente altitudinal, serían producto de las diferencias climáticas y características de la vegetación en las Yungas peruanas que estarían correlacionadas con la riqueza, lo que propicia una alta diversidad β en las Yungas peruanas.
Aunque los esfuerzos de muestreo sean dispares entre los bosques de las Yungas analizadas, se observa en general una alta riqueza en los bosques montanos del Santuario. La estimación de las especies predice que la riqueza del SNPH en las localidades evaluadas, sería aún mayor a la registrada. Estudios en elevaciones aún no exploradas en el SNPH podrían sostener su alta riqueza.
Los alarmantes grados de fragmentación debido a la deforestación por la agricultura y pastoreo, son una de las principales amenazas para las Yungas (Tovar et al. 2010, Tejedor et al. 2012). Esta situación podría afectar de manera directa al SNPH que presenta zonas de recuperación que se interconecta con áreas aún no exploradas, como lo son las zonas de protección estricta y silvestre (SERNANP 2012). Además de ello es necesario conocer los roles ecológicos que cumplen los murciélagos en estos hábitats como polinizadores, dispersores de semillas y controladores de insectos, entre otros. A través del conocimiento de la diversidad de murciélagos en toda la gradiente del SNPH y los roles que cumplen, se podrá entender los servicios ambientales de los murciélagos en estos hábitats poco conocidos.
Sugerimos que se impulsen mayores investigaciones en los bosques montanos del Santuario Nacional Pampa Hermosa, área representativa de las Yungas peruanas, en donde encontramos a la especie endémica Gardnerycteris koepckeae categorizada En Peligro Crítico (CR) (D.S N°. 004-2014-MINAGRI) y donde aún se podría registrar más especies endémicas según lo reporta Pacheco et al. (2009) para las Yungas.
Agradecimientos
A la jefatura del SNPH por las facilidades para el permiso de colecta correspondiente, especialmente a la Jefa del Santuario Ing. Anamelva Zambrano. Así mismo a la Dirección General de Flora y Fauna Silvestre del Ministerio de Agricultura y Riego por el permiso de colecta fuera de áreas protegidas, Resolución Directoral N°0272-2012-AG- DGFFS-DGEFFS. Un agradecimiento muy especial a Alexis Larico, Anthony Almeyda, Jaime Pacheco, Melisa Del Alcazar, David Aybar, Angie Uturunco y Ursula Cernaqué quienes apoyaron en el trabajo de campo. A la familia Aguilar y especialmente a nuestro guía local Fernando Aguilar por su apoyo en el trabajo de campo. Otro agradecimiento a Richard Cadenillas, Sandra Velazco y Carlos Jiménez, por la revisión del manuscrito y sus valiosas sugerencias. También agradecemos a Idea Wild por la donación de equipos de campo otorgados a Edith Arias.
Literatura citada
Antón D. & C. Reynel. 2004. Relictos de bosques de excepcional diversidad en los Andes Centrales del Perú. Universidad Nacional Agraria La Molina, Herbario de la Facultad de Ciencias Forestales. 325 pp. [ Links ]
Brack-Egg E. 1986. Las Ecorregiones del Perú. Boletín de Lima 44: 57-70. [ Links ]
Cadenillas R.E. 2010. Diversidad, ecología y análisis biogeográfico de los murciélagos del Parque Nacional Cerros de Amotape, Tumbes, Perú. Tesis de Magíster en Zoología con mención en Sistemática y Evolución. Universidad Nacional Mayor de San Marcos Facultad de Ciencias Biológicas. 111 pp. [ Links ]
Carrasco F.M. 2011. Diversidad y distribución de especies dequirópteros en relictos de bosque de la provincia de Chanchamayo, Junín. Tesis de Magíster Scientiae en Conservaciónde Recursos Forestales. Universidad Agraria La Molina.Lima, Perú. 99 pp. [ Links ]
Chao A. & S.M Lee. 1992. Estimating the number of classes via samplecoverage. Journal of America Statistical Association 87: 210-217. http://dx.doi.org/10.1080/01621459.1992.10475194
Colwell R.K. 2013. EstimateS: Statistical Estimation of species richness and shared species from samples. Version 9 and earlier. User’s Guide and application. http://purl.oclc.org/estimates.Acceso 19/05/2014.
Colwell R.K & J.A. Coddington. 1994. Estimating terrestrial biodiversity through extrapolation. Philosophical Transactionsof the Royal Society B: Biological Sciences. 345: 101-118. http://dx.doi.org/10.1098/rstb.1994.0091
Díaz M., L.F. Aguirre & R.M. Bárquez. 2011. Clave de identificación de los murciélagos del cono sur de Sudamérica. Centro de Estudios en Biología Teórica y Aplicada. Cochabamba, Bolivia. 94 pp. [ Links ]
Di Rienzo J.A., F. Casanoves, M.G Balzarini et al. 2015. InfoStat versión 2015. Grupo InfoStat, FCA, Universidad Nacional de Córdoba. <http://www.infostat.com.ar/index.php?mod=page&id=46 xx>. Acceso 16/10/2015. [ Links ]
D.S. N°. 004-2014-MINAGRI. 2014. Decreto Supremo que apruebala actualización de la lista de clasificación y categorizaciónde las especies amenazadas de fauna silvestre legalmente protegidas. El Peruano, Normas Legales, 08.04.2014:520497520504. [ Links ]
Erkert H.G. 1974. The effect of moonlight on the activity of nocturnal mammals. Oecologia 14: 269–287. http://dx.doi.org/10.1007/BF01039797. [ Links ]
Feinsinger P. 2001. Designing Field Studies for Biodiversity and Conservation. Island Press. Washington D. C. [ Links ]
Galdo L. 1985. Evaluación de escorrentía superficial y erosión hídrica bajo diferentes tipos de cobertura vegetal en San Ramón, Chanchamayo. Tesis de Ingeniero Forestal. UniversidadNacional del Centro del Perú, Huancayo, Perú. 121 pp. [ Links ]
Gonçalves da Silva A.G, O Gaona & RA Medellín. 2008. Diet and trophic structure in a community of fruit-eating bats inLacandon forest, México. Joirnal of Mammalogy. 89(1):43-49. http://dx.doi.org/10.1644/06-MAMM-A-300.1.
Graham G.L. 1983. Changes in bat species diversity along an elevational gradient up the Peruvian Andes. Journal of Mammalogy 64 (4): 559-571. http://dx.doi.org/10.2307/1380511. [ Links ]
Hammer Ø., D.A.T. Harper & P.D. Ryan. 2001. Past: Paleontologica Statistics software package for education and data analysis. Paleontologia Electrónica 4: 9p. <http://palaeo-electronica.org/2001_1/past/issue1_01.htm>. Acceso 03/12/2014. [ Links ]
Holdridge L.R. 1967. Life zone ecology. Tropical Science Center, San José, Costa Rica. 216 pp. [ Links ]
Hurtado N., E. Arias & V. Pacheco. 2014. Redescription of Mimon koepckeae (Chiroptera: Phyllostomidae). Zoologia31 (4): 377–388. http://dx.doi.org/10.1590/S198446702014000400009. [ Links ]
Hurtado N. & V. Pacheco. 2014. Análisis filogenético de MimonGray, 1847 (Mammalia, Chiroptera, Phyllostomidae) con la descripción de un nuevo género. Therya 5 (3): 751-791. http://dx.doi.org/10.12933/therya-14-230. [ Links ]
IUCN 2015. (en línea). IUCN Red list of threatened species. Versión 2015 <www.iucnredlist.org>. Acceso 30/07/2015. [ Links ]
La Torre-Cuadros M.A. 2003. Composición florística y diversidad enel bosque relicto Los Cedros de Pampa Hermosa (Chanchamayo, Junín) e implicancias para su conservación.Tesis Magíster Scientiae en Conservación de RecursosForestales. Universidad Nacional Agraria La Molina, Lima,Perú. 141 pp. [ Links ]
La Torre-Cuadros M.A., S. Herrando-Pérez & K.R. Young. 2007.Diversity and structural patterns for tropical montane and premontane forests of central Peru, with an assessment of theuse of higher-taxon surrogacy. Biodiversity Conservation. 16:2965–2988. http://dx.doi.org/10.1007/s10531-007-9155-9 [ Links ]
Kalko E.K. 1998. Organisation and diversity of tropical bat communities through space and time. Zoology 101: 281-297. [ Links ]
Klingbeil B.T. & M.R. Willig. 2009. Guild-specific responses of bats to landscape composition and configuration in fragmentedAmazonian rainforest. Journal of Applied Ecology 46: 203–213. http://dx.doi.org/10.1111/j.1365-2664.2008.01594.x [ Links ]
Koopman K.F. 1978. Zoogeography of Peruvian bats with specialemphasis on the role of the Andes. American MuseumNovitates 2651: 1-33. [ Links ]
Kraker-Castañeda C. & S.G. Pérez-Consuegra. 2011. Contribución de los cafetales bajo sombra en la conservación de murciélagos en la antigua Guatemala, Guatemala. Acta Zoológica Mexicana (n.s.), 27 (2): 291-303. [ Links ]
Mancina C. 2008. Effect of moonlight on nocturnal activity of two Cuban nectarivores: the Greater Antillean longtongued bat (Monophyllus redmani) and Poey´s flower bat (Phyllonycteris poeyi). Bat Research News 49: 71-74. [ Links ]
Mantilla-Meluk H. & R.J. Baker. 2006. Systematics of small Anoura (Chiroptera: Phyllostomidae) from Colombia, with description of a new species. Occasional Papers, Museum of Texas Tech N° 261. [ Links ]
Mantilla-Meluk H. & R.J. Baker. 2010. New Species of Anoura (Chiroptera: Phyllostomidae) from Colombia, with systematic remarks and notes on the distribution of the A. geoffroyi complex. Occasional Papers, Museum of Texas Tech N° 292. [ Links ]
McCain C.M. 2007. Could temperature and water availability drive elevational species richness patterns? A global case study for bats. Global Ecology and biogeography 16: 1-13. http://dx.doi.org/10.1111/j.1466-822x.2006.00263.x. [ Links ]
Medina C.E., H. Zeballos & E. López. 2012. Diversidad de mamíferosen los bosques montanos del Valle de Kosñipata, Cusco, Perú. Mastozoología Neotropical 19 (1): 85-104. [ Links ]
Mello M.A.R, E.K.V Kalko & W.R Silva. 2008. Diet and abundance of the bat Sturnira lilium (Chiroptera) in a brazilian montaneAtlantic forest. Journal of Mammalogy. 89(2):485–492.DOI: http://dx.doi.org/10.1644/06-MAMM-A-300.143-49. [ Links ]
Mena J.L. 2010. Respuestas de los murciélagos a la fragmentación del bosque en Pozuzo, Perú. Revista Peruana de Biología 17 (3):277 – 284. http://dx.doi.org/10.15381/rpb.v17i3.2. [ Links ]
Myers N., R.A. Mittermeier, C.G. Mittermeier, et al. 2000. Biodiversityhotspots for conservation priorities. Nature 403: 853–858. [ Links ]
Patterson B.D., V. Pacheco & S. Solari. 1996. Distribution of bats alongan elevational gradient in the Andes of south-eastern Peru. Journal of Zoology (London) 240: 637-68. http://dx.doi.org/10.1111/j.1469-7998.1996.tb05313.x. [ Links ]
Patterson B.D., D.F. Stotz, S. Solari, et al. 1998. Contrasting patterns of elevational zonation for birds and mammals in the Andes of southeastern Peru. Journal of Biogeography 25: 593-607.http://dx.doi.org/10.1046/j.1365-2699.1998.2530593.x. [ Links ]
Pacheco V., B.D. Patterson, J.L. Patton, et al. 1993. List of mammal species known to occur in Manu Biosphere Reserve, Perú. Publicaciones del Museo de Historia Natural. UNMSM (A) 44: 1-12. [ Links ]
Pacheco V. & S. Solari. 1997. Manual de los murciélagos peruanos con énfasis en las especies hematófagas. Lima – Perú. MHN,UNMSM. 70 pp. [ Links ]
Pacheco, V. 2002. Mamíferos del Perú. Pp 503–550. En Diversidad y Conservación de los Mamíferos Neotropicales (G. Ceballos y J. Simonetti, Eds). CONABIO-UNAM. México, D.F. [ Links ] Pacheco V., E. Salas, L. Cairampoma, et al. 2007. Contribución al conocimiento de la diversidad y conservación de los mamíferos en la cuenca del río Apurímac, Perú, Perú. Revista Peruana de Biología 14 (2): 169- 180. http://dx.doi.org/10.15381/rpb.v14i2.1722. [ Links ]
Pacheco V., R. Cadenillas, E. Salas, et al. 2009. Diversidad y endemismo de los mamíferos del Perú. Revista Peruana de Biología 16 (1): 005- 032. http://dx.doi.org/10.15381/rpb.v16i1.111. [ Links ]
Pacheco V., G. Márquez, E. Salas, et al. 2011. Diversidad de mamíferosen la cuenca media del río Tambopata, Puno, Perú. Revista Peruana de Biología 18 (2): 231 – 244. http://dx.doi.org/10.15381/rpb.v18i2.246. [ Links ]
Pacheco, V., E. Salas, C. Barriga y E. Rengifo. 2013. Small mammal diversity in disturbed and undisturbed montane forest in thearea of influence of the PERU LNG pipeline, Rio Apurimacwatershed, Ayacucho, Peru. Pp 90-100. In: BiodiversityMonitoring of a Trans-Andean Megaproject, ed.F. Dallmeier, G. Servat and A. Alonso, Washington, D.C.: Smithsonian Institution Scholarly Press. [ Links ]
Refulio S.M. 2015. Diversidad de murciélagos a lo largo de una gradiente altitudinal en las Yungas de la cuenca del río Pampa Hermosa Junín, Perú. Tesis para optar al título profesional de Biólogo con mención en Zoología. Universidad Nacional Mayor de San Marcos Facultad de Ciencias Biológicas. 60 pp. [ Links ]
Reith C.C. 1982. Insectivorous bats fly in shadow to avoid moonlight. Journal of Mammalogy 63: 685-690. http://dx.doi.org/10.2307/1380284. [ Links ]
Saldaña-Vázquez R.A. 2008. Comparación de la diversidad de murciélagos filostómidos en fragmentos de bosque mesófilo de montaña y cafetales de sombra del centro de Veracruz. Tesis de Maestro en Ciencias en Ecología y Manejo de Recursos Naturales. Instituto de Ecología A.C. Xalapa, Veracruz,México. 76 pp. [ Links ]
Speakman J. & D. Thomas. 2003. Physiological ecology and energetics of bats. Pp 430-492. In Bat Ecology (T. Kunz & M. Fenton, eds). [ Links ]
SERNANP. 2012 (en línea). Plan Maestro del Santuario NacionalPampa Hermosa, periodo 2012-2017. Servicio Nacionalde Áreas Naturales Protegidas por el Estado – SERNANP, Resolución Presidencial Nº 213-2012-SERNANP. 55pp. [ Links ]
Simmons N.B. & R. S. Voss. 1998. The mammals of Paracou, French Guiana: a Neotropical lowland rainforest fauna, Part 1.Bat. Bulletin of the American Museum of Natural History.237: 219. [ Links ]
Solari S., E. Vivar, P. Velazco et al. 2001. Small mammals of the south ern Vilcabamba region, Peru. Pp. 110-116. In: Biological and Social Assessment of the Cordillera Vilcabamba, Peru (L.E. Alonso, A. Alonso, T.S. Shulenberg and F. Dallmeier, eds.) RAP Working Papers, 12 and SI/MAB Series, 6.Washington, D.C. [ Links ]
Solari S., V. Pacheco, L. Luna, et al. 2006. Mammals of the Manu Biosphere Reserve. Fieldiana: Zoology. 110: 13:22. In"Mammals and birds of the Manu Biosphere Reserve, Peru" (B. D. Patterson, D. F. Stotz, and S. Solari, Eds.). Fieldiana, Zoology, 110. [ Links ]
Soriano P.J. 2000. Functional structure of bat communities in tropical rainforests and Andean cloud forests. Ecotropicos 13(1): 1-20. [ Links ]
Sosa V.J, E. Hernández-Salazar, D. Hernández-Conrique, et al. 2008. Murciélagos. Capítulo 13. Pp 181-192. En: R.H. Manson,
V. Hernández-Ortiz, S. Gallina, K. Mehltreter (Eds.). Agro-ecosistemas cafetaleros de Veracruz: Biodiversidad manejo y conservación. Instituto de Ecología A.C. (INECOL)e Instituto Nacional de Ecología (INE-SEMARNAT).México. 348 pp.
Tejedor N., E. Álvarez, S. Aragon, et al. 2012. Evaluación del estado de conservación de los bosques montanos en los Andestropicales. Ecosistemas 21(1-2): 148-166. [ Links ]
Terborgh J. 1971. Distribution on environmental gradients: Theory and a preliminary interpretation of distributional patterns in the avifauna of the Cordillera Vilcabamba, Peru. Ecology 52(1): 23-40. [ Links ]
Tirira D. 2007. Guía de campo de los mamíferos del Ecuador. Ediciones Murciélago Blanco. Publicación especial sobe losmamíferos del Ecuador 6. Quito. 576 pp. [ Links ]
Tovar A., C. Tovar, J. Saito, et al. 2010. Yungas peruanas-bosques montanos de la vertiente oriental de los Andes del Perú: Una perspectiva ecorregional de conservación. Centro de datos para la conservación de la Universidad Agraria La Molina. Lima, Perú. 150 pp. [ Links ]
Tuttle M.D. 1970. Distribution and zoogeography of peruvian bats, with comments on natural history. The University of KansasScience Bulletin. Vol. 49. Pp 45-86. [ Links ]
Vivar E. 2006. Análisis de distribución altitudinal de mamíferos pequeños en el Parque Nacional Yanachaga Chemillén, Pasco, Perú.Tesis de Magíster en Zoología con mención en Sistemática y Evolución. Universidad Nacional Mayor de San Marcos Facultad de Ciencias Biológicas. 103 pp. [ Links ]
Walther B.A & J.L Moore. 2005. The concepts of bias, precision and accuracy, and their use in testing the performance of species richness estimators, with a literature review of estimator performance. Ecography 28: 815-829. http://dx.doi.org/10.1111/j.2005.0906-7590.04112.x. [ Links ]
Willig M.R., S.J. Presley & C.P. Bloch, et al. 2007. Phyllostomidbats of lowland Amazonia: Effects of habitat alteration on abundance. Biotropica 39 (6): 737–746. http://dx.doi.org/10.1111/j.1744-7429.2007.00322.x. [ Links ]
Wilson D.E., C.F. Ascorra, S. Solari, et al. 1996. Bats as indicators of habitat disturbance. - En: Manu: The biodiversity ofsoutheastern Peru. Smithsonian Institution Press, Lima. Pp. 613-625. [ Links ]
Young K. & B. León. 1999. Peru’s humid eastern montane forest: An overview of their physical setting, biological diversity, human use and settlement, and conservation needs. Central for Research on the Cultural and Biological Diversity on Andean Rainforests. (DIVA). Technical Report 5.
Young, B. 2007. Distribución de las especies endémicas en la vertiente oriental de los Andes en Perú y Bolivia. NatureServe, Arlington, Virginia, EE UU. Pp. 112. [ Links ]
Apéndice 1.
Apéndice 2.
* Autor para correspondencia
Email, Edith Arias: ediari_char@yahoo.es
Email, Víctor Pacheco: vpachecot@unmsm.edu.pe
Email, Klauss Cervantes: klauss.cervantes@gmail.com
Email, Adela Aguilar: alelaaguilar@yahoo.com
Email, José Álvarez: josealvarez.u@gmail.com
Fuentes de financiamiento:
Vicerrectorado de Investigación de la Universidad Nacional Mayor de San
Marcos, proyectos CON/CON N° 111001031 y 121001061.
Información sobre los autores:
EA y VP diseñaron el estudio, la identificación taxonómica y realizaron
el análisis de datos. EA, KC, AA y JA realizaron el trabajo de campo y gabinete. EA, VP y KC redactaron el trabajo. EA, VP, KC, AA y JA aprobaron el trabajo.
Los autores no incurren en conflicto de intereses.
Permisos de colecta: Permiso de colecta N°02-2011 SERNANP-DGANP-J/SNPH y Resolución Directoral N°0272-2012-AG- DGFFS-DGEFFS.
Presentado: 27/10/2015
Aceptado: 05/06/2016
Publicado online: 27/08/2016