Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.23 no.3 Lima set./dic. 2016
http://dx.doi.org/10.15381/rpb.v23i3.12866
10.15381/rpb.v23i3.12866
NOTA CIENTÍFICA
Actividad inhibitoria del crecimiento bacteriano por cobre nanoestructurado obtenido de minerales de la región Marañón: comparación con cobre comercial
Bacterial growth inhibitory activity for nanostructured copper minerals obtained from the Marañon region: comparison with commercial copper
Jaime Sánchez-Venegas 1*, Mirtha Pillaca 2, Carlos V. Landauro 2, Pablo Ramirez 1, Daniel Lovera 3, Jordán Bernaldo 1, Anika Eca 1 y Fernando De la Cruz 1
1 Laboratorio de Microbiología Molecular y Biotecnología, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos, Lima, PERÚ.
2 Instituto de Investigación de Física, Facultad de Ciencias Físicas, Universidad Nacional Mayor de San Marcos, Lima, PERÚ.
3 Instituto de Investigación de la Facultad de Ingeniería Geológica, Minera, Metalúrgica y Geográfica, Universidad Nacional Mayor de San Marcos, Lima, PERÚ.
*Autor para correspondencia: E-mail Jaime Sánchez-Venegas: jaime.sanchez@unmsm.edu.pe
ORCID Jaime Sánchez-Venegas: http://orcid.org/0000-0002-2160-2428
E-mail C. Landauro: clandauros@unmsm.edu.pe
E-mail P. Ramírez: pabloramirezroca@gmail.com
E-mail D. Lovera: dloverad@unmsm.edu.pe
E-mail M. Pillaca: mirthapq@gmail.com
E-mail J. Bernaldo: jbernaldoa@gmail.com
E-mail A. Eca: anikaeca@gmail.com
E-mail F. De la Cruz: fernandodelacruzcalvo@gmail.com
Resumen
En el presente trabajo se reporta la actividad inhibitoria del crecimiento bacteriano por nanopartículas de cobre cementado y de cobre comercial. Se utilizaron las cepas de Staphylococcus aureus ATCC 6538 (Gram positiva) y Escherichia coli ATCC 35218 (Gram negativa) para determinar el efecto inhibitorio mediante la concentración mínima inhibitoria de las nanopartículas diluidas en caldo de cultivo nutritivo y distribuidas en placas de ELISA. Las muestras de cobre cementado (obtenidas por procesos hidrometalúrgicos) y de cobre comercial fueron nanoestructuradas empleando un equipo de molienda mecánica. Los resultados indican que las nanopartículas de cobre comercial (a 2.5 horas de molienda) muestran acción inhibitoria del crecimiento de la cepa S. aureus y no así en la cepa E. coli. Asimismo, se determinó que la concentración mínima inhibitoria de la muestra de cobre comercial fue de 20 μg/mL frente a S. aureus. El cobre cementado (en su forma sólida y nanoestructurada) no mostró efecto inhibitorio del crecimiento en ninguna de las dos cepas estudiadas.
Palabras claves: Actividad inhibitoria del crecimiento; bacterias Gram positivas; bacterias Gram negativas; nanopartículas de cobre; molienda mecánica.
Abstract
In this paper, we report on the bacterial growth inhibitory activity of nanoparticles of cemented and commercial copper. Strains of Staphylococcus aureus ATCC 6538 (Gram positive) and Escherichia coli ATCC 35218 (Gram negative) were used to determine the inhibitory effect by the minimal inhibitory concentration of the nanoparticles diluted in nutrient culture broth and distributed in ELISA plates. The copper cements (obtained from hydrometallurgical processes) and the commercial one were nanostructured employing a mechanical milling equipment. The results indicate that commercial copper nanoparticles (after 2.5 hours of milling) show growth inhibitory action of S. aureus strain. However, in the case of E. coli strains no inhibitory action has been observed. It was also determined that the minimal inhibitory concentration of the commercial copper is 20 μg/mL against S. aureus. On the other hand, copper cements (in solid and nanostructured form) do not show inhibitory effects.
Keywords: Growth inhibitory activity, Gram positive bacteria, Gram negative bacteria, copper nanoparticles, mechanical milling.
Introducción
Las posibles aplicaciones de cobre como catalizadores, sensores de gas, material de ánodo para baterías de iones de litio, entre otras, han llamado mucho la atención de la industria (Zhang et al. 2014, Xu et al. 2011, Yusoff et al. 2013, Jadhav et al. 2011). Más aún, el uso de su inherente propiedad antibacteriana para la disminución de la contaminación del ambiente (como purificadores de agua) y optimización en la conservación de los alimentos, son aplicaciones como solución a problemas de relevancia actual (Sharifahmadian et al. 2013, Mohammad et al. 2012, Subramanian et al. 2014). Algunos ejemplos de uso de nanoparticulas como bactericidas son tanto en textiles (camisas, por ejemplo) como en refrigeradoras (conservación de alimentos) y lavadoras (Perelshtein et al. 2009). Lamentablemente, estos productos son importados y, por consiguiente, costosos.
Los estudios sobre el mecanismo de acción de toxicidad de las nanoparticulas, que causan la inhibición del crecimiento de las bacterias, atribuyen básicamente a dos factores: a la capacidad de la nanopartícula de unirse a la membrana bacteriana por interacción electrostática causando despolarización y alteración de su integridad lo que produce filamentación de la célula; y a la internalización de las nanopartículas a través de los poros de la membrana bacteriana por su pequeño tamaño, produciéndose solubilidad de estas las que generan la formación de radicales libres, esto es, las especies reactivas de oxigeno (EROs) y peroxidación de lípidos, causando estrés oxidativo en la bacteria por desestabilización de la composición de la membrana, interrupción del transporte de electrones, oxidación de proteínas, degradación del DNA y perturbación y destrucción de las mitocondrias, conduciendo a la muerte del microorganismo (Azam et. al. 2012a, Azam et. al. 2012b, Chatterjee et al. 2014, Deryabin et al. 2013, Mohammad et al. 2012).
Por otro lado el trabajo de Baek y An (2011), al hacer estudios de toxicidad microbiana, muestra que las nanopartículas de cobre (CuO) son más toxicas que las nanoparticulas de otros metales como NiO, ZnO y Sb2O3. Por consiguiente, sabiendo que Perú es un país minero donde el cobre es su principal mineral, es natural pensar en darle valor agregado a este metal. En particular, la región geológica conocida como Complejo Marañón, ubicada en los Andes central y oriental de la Región de Huánuco, contiene minerales metálicos como cobre, zinc, plata u oro en forma de rocas de minerales sulfurados. Actualmente, varios procesos metalúrgicos tales como la hidrometalurgia, pirometalurgia y electrometalurgia, se emplean para recuperar el cobre es ampliamente utilizado debido a su alta eficiencia en comparación con otras técnicas (Lovera et al. 2010). Más aún, se espera que la nanoestructuración (Koch 1989) del cobre provea aún más potencial para su empleo como material antibacteriano. Sin embargo, la producción de estos nano-sistemas por vías químicas es costosa, por lo cual la obtención de cobre nano-estructurado por medio de molienda mecánica (vía física) es una opción de bajo costo de producción (Baláž 2008, Anand et al. 2013, Koch 2007, 1993).
Dentro de este contexto, en el presente trabajo se estudia si el cobre nanoestructurado (tanto aquel obtenido por procesos metalúrgicos propios como el comercial) presenta actividad inhibitoria del crecimiento de bacterias. Ambas muestras de cobre fueron nanoestructuradas empleando la técnica de molienda mecánica y posteriormente caracterizadas por difracción de rayos X. La comparación de la actividad antibacteriana de ambas muestras nanoestructuradas fueron estudiadas mediante diluciones de las nanopartículas en caldo nutritivo más rojo de fenol distribuidos en pocillos de placas de ELISA, utilizando las cepas de Staphylococcus aureus y Escherichia coli.
Materiales y métodos
Materiales para la síntesis de cobre.-Para obtener cementos de cobre de alta pureza se usó como materia prima minerales procedentes del Complejo Marañón. Este complejo consiste de una secuencia de rocas metamórficas que afloran en ambas márgenes del río Marañón, y consisten de esquistos micáceos, cloritosos de coloración gris y verde, los cuales están cortados por vetas de cuarzo lechoso de diferente grosor (Lovera et al. 2010). Con fines comparativos, también se estudió el cobre comercial de alta pureza Sigma-Aldrich©.
Cobre cementado.- El proceso de la cementación del cobre ha sido reportado en trabajos previos (Lovera et al. 2012, Lovera et al. 2010). El mineral de calcopirita sulfurado, extraído del Complejo Marañón, se solubilizó en soluciones de ácido sulfúrico diluido, luego el proceso de tostación se realizó a 400 °C durante 20 minutos y posteriormente el mineral fue lixiviado. La solución lixiviada se purificó mediante el proceso de LIX-SX, siguiendo el esquema propuesto por Fathi Habashi (Habashi 1999) con lo que finalmente se obtuvo el cemento de cobre.
Cobre comercial.- El polvo metálico de cobre puro comercial se adquirió de la firma Aldrich con tamaño de partícula de 10 μm y pureza de 99.9%. Este material se empleó como referente de alta calidad estructural y pureza elemental.
Nanoestructuración de las muestras de cobre.- Las muestras de cobre reportadas en este trabajo fueron nanoestructuradas utilizando la técnica de molienda mecánica. El equipo de molienda utilizado fue un molino vibratorio de alta energía (SPEX 8000). Además, se empleó un contenedor de acero inoxidable junto con billas de acero. La razón de carga (masa-polvo/masa-billas) utilizada fue de 7/1. Las muestras de cobre comercial fueron nanoestructuradas por 2.5 y 5 horas, mientras que el cemento de cobre por 2, 5, 7 y 10 horas. Todo el proceso de molienda se realizó en atmósfera de gas inerte (argón).
Caracterización estructural y microestructural.- Los productos obtenidos (en su forma sólida así como su contraparte nanoestructurada) fueron caracterizados por las técnicas de difracción de rayos X (DRX), empleando radiación Cu-Kα (λ= 1.5406 Å) a 40 kV y 40 mA. Todas las medidas fueron realizadas a temperatura ambiente.
Cepas de bacterias usadas para la actividad inhibitoria del crecimiento.- Para determinar el efecto inhibitorio del crecimiento de bacterias que ejercen las nanopartículas de cobre comercial (NPCu-comercial) y nanopartículas de cobre cementado (NPCu-cementado), se emplearon cultivos jóvenes de cepas de bacterias ATCC (American Type Culture Collection): Staphylococcus aureus ATCC 6538 (Gram positiva) y Escherichia coli ATCC 35218 (Gram negativa).
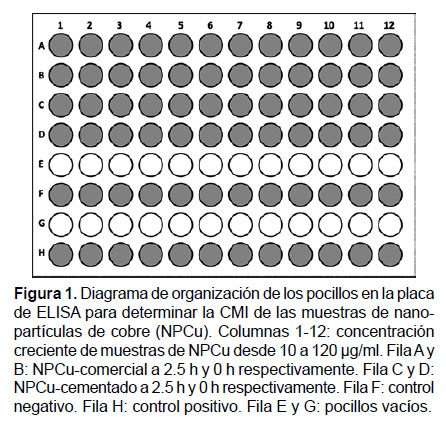
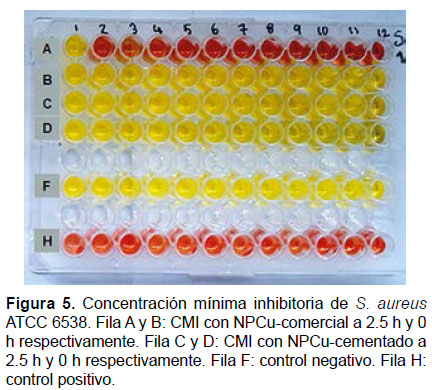
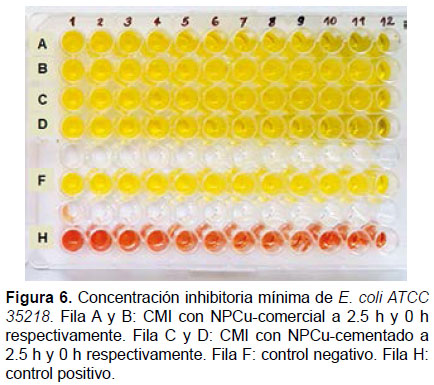
Determinación de la concentración mínima inhibitoria.- La concentración mínima inhibitoria (CMI) de las nanopartículas de cobre en estudio sobre las bacterias S. aureus ATCC 6538 y E. coli ATCC 35218, se determinó por el método descrito por Sarker et al. (2007) en placas de ELISA al cual se hizo modificaciones que se describen más adelante. Se analizaron doce concentraciones de cada muestra de nanopartícula, las que fueron distribuidas en placas de ELISA de 96 pocillos en forma creciente (desde 10 μg/mL hasta 120 μg/mL), las NPCu-comercial fueron distribuidos en las filas A y B, y las NPCu-cementado en las filas C y D (Fig. 1).
Para el ensayo de la CMI, la modificación que se realizó al método de Sarker et al. (2007), consistió en usar como medio de cultivo para el crecimiento de bacterias, caldo nutritivo, al cual se incorporó el indicador rojo de fenol (composición en g/L: sacarosa 10; peptona de caseína 5.0; peptona de carne 5.0; cloruro de sodio 5.0 y rojo de fenol 0.018) ajustado a un pH de 7.4 ± 0.2. Para realizar el inóculo bacteriano se hizo un cálculo previo considerándose un volumen exacto en el cual se va a realizar la inoculación, en nuestro caso fue el 10% (20 μL) del volumen total del pocillo (200 μL). Para ello, se diluyó en 1/20 la suspensión bacteriana, equivalente al patrón 0.5 de McFarland (1 x 108 UFC/mL), a fin de obtener 5 x 105 UFC/mL en cada pocillo de la placa. La inoculación con la suspensión bacteriana estandarizada se realizó dentro de los 15 minutos de preparada la misma, para evitar que el número de microorganismos aumente por duplicación. Cada pocillo fue inoculado utilizando una micropipeta automática multicanal. Para el control negativo, las cepas bacterianas fueron cultivadas en caldo nutritivo que tiene el indicador rojo de fenol y se agregó el antibiótico estreptomicina a una concentración de 120 μg/mL. Para el control positivo las cepas bacterianas fueron cultivadas en el mismo medio de cultivo en ausencia de antibiótico (Fig. 1). Concluida la inoculación bacteriana, las placas de ELISA fueron selladas e incubadas a 37 °C por 24 horas. El viraje del medio a rojo grosella indicó crecimiento microbiano.
Resultados
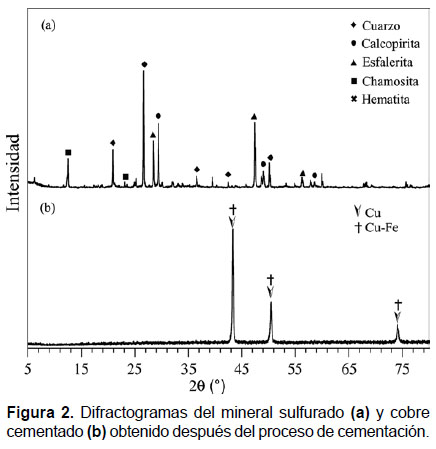
Difractogramas del proceso de cementación del cobre.- Después del procedimiento realizado para la cementación del cobre a partir del mineral de calcopirita sulfurado mediante solubilización con ácido sulfúrico diluido, proceso de tostación y lixiviación; se determinó que el mineral sulfurado está compuesto principalmente de las siguientes fases: cuarzo, calcopirita, esfalerita y chamosita, entre otros; como se muestra en el difractograma de la Figura 2(a). Finalmente, después del proceso de LIX-SX estas fases desaparecen completamente y se obtiene el cemento de cobre o "cobre cementado" como se muestra en el difractograma de la Figura 2(b). El cual está compuesto de las fases de cobre (84.54%) y Cu80Fe20 (15.45%). La fase de cobre cementado tiene una celda unitaria cúbica, Grupo espacial Fm3m, y parámetro de red a= 3.616 Å.
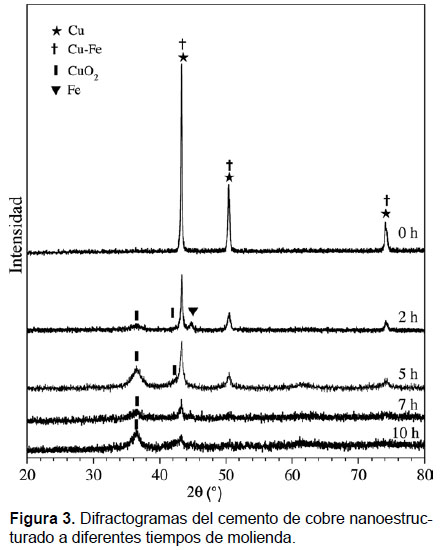
Los difractogramas de rayos X del cemento de cobre nanoestructurado en función del tiempo de molienda se muestran en la Figura 3. Se puede observar un ensanchamiento del ancho a media altura así como una disminución de los picos de difracción de Cu. Esto indica una reducción del tamaño de grano del orden de ~150 nm (cero horas, cobre cementado sin moler) hasta ~20 nm al cabo de cinco horas de molienda. Asimismo, se puede observar que la muestra con dos horas de molienda presenta, adicionalmente, las fases de cuprita (CuO2) y Fe. La presencia de la fase de Fe puede ser debido a la disolución de la fase Cu80Fe20 durante el proceso de molienda. Sin embargo, la contribución de la fase de Fe no se observa para otros tiempos de molienda. Estos resultados indicarían que parte de átomos de Fe, de la fase de Cu80Fe20 están como impurezas en la estructura cristalina del cobre cementado (Todaka et al. 2002).
Cabe mencionar que a pesar que la molienda se realizó bajo una atmósfera de argón, la formación de óxido de cobre podría estar relacionada con la presencia de impurezas de oxígeno en el cemento de cobre. Además, se puede observar que después de cinco horas de molienda los picos de la fase de Cu disminuyen drásticamente y en consecuencia, la fase CuO2 es predominante.
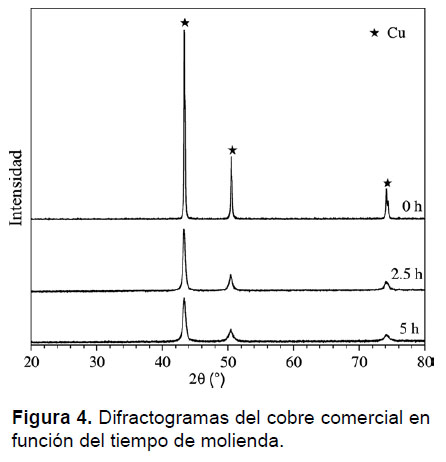
En la Figura 4 se muestran difractogramas del cobre comercial sin moler (0 h) y molido a 2.5 h y 5 h. Se observa que la intensidad relativa de los picos de difracción disminuye. Asimismo, se observa una reducción del tamaño de grano, alcanzando valores de hasta 20 nm. No se observa la formación de ninguna fase adicional (por ejemplo, no hay presencia de la fase CuO2, como en el caso del cobre cementado), lo cual muestra la alta pureza del material.
Determinación de la concentración mínima inhibitoria
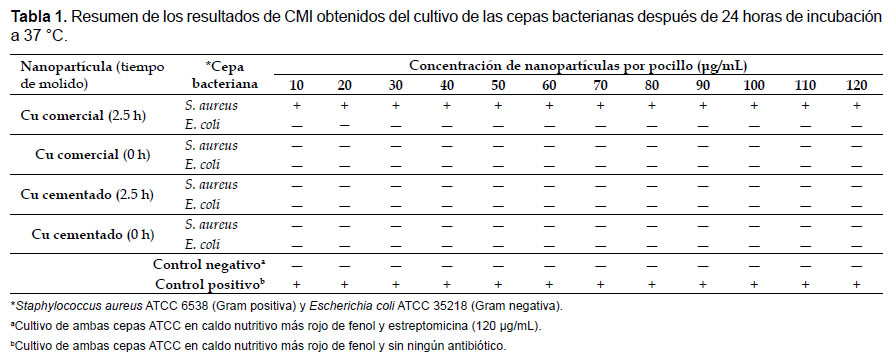
Los ensayos de la CMI de las dos muestras de nanopartículas fueron realizadas por triplicado para cada cepa bacteriana, obteniéndose los mismos resultados. Una vez transcurrido el periodo de incubación a 37 °C de las placas de ELISA se observaron cambios en la coloración de los pocillos detectados a simple vista. Se consideró como crecimiento bacteriano todo cambio de color en el medio de cultivo de amarillo a rojo grosella, dado que se realizaron tres replicas el estado de positivo o negativo fue determinado según el estado más frecuente dentro de las réplicas. Se observó inhibición del crecimiento de S. aureus ATCC 6538 por la NPCu-comercial con 2.5 horas de molido a partir de la concentración de 20 μg/mL (Fig. 5). No se observó ninguna inhibición de crecimiento de E. coli ATCC 35218 con las nanopartículas estudiadas (Fig. 6). En la Tabla 1 se resume los resultados obtenidos de la CMI de los dos tipos de nanopartículas (cobre comercial y cobre cementado) frente a las dos cepas bacterianas usadas para el ensayo.
Discusión
En el presente trabajo se realizó un estudio de la actividad inhibitoria del crecimiento bacteriano por nanopartículas de cobre cementado comparando con las de cobre comercial. Los resultados obtenidos muestran que las nanopartículas de cobre comercial, a una concentración de 20 μg/mL, inhibe el crecimiento de la bacteria Gram positiva S. aureus ATCC 6538 y no así en la Gram negativa E. coli ATCC 35218, mientras que las nanopartículas de cobre cementado no mostró ningún efecto inhibitorio en las dos cepas estudiadas. Para tales resultados, utilizamos muestras de cobre nanoestructuradas obtenidas a partir de los minerales de cabeza del Complejo Marañon que presentan características claramente diferentes a aquellas obtenidas del cobre comercial. Si bien es cierto que ambas nanopartículas muestran la presencia de cobre de cierta pureza, el grado de contaminación en el cemento de cobre es mayor por la presencia de fases espurias, formación de óxidos, además de la contaminación natural del proceso de molienda que es igual en ambos tipos de cobre (comercial y cemento). Por tanto, la contaminación de las nanoestructuras influye en el efecto inhibitorio del crecimiento de las bacterias tal como fue reportado en varios trabajos de investigación que utilizaron métodos diferentes al nuestro para obtener diferentes tipos y tamaños de nanoestructuras de metales como el Cu y Ag (Chatterjee et al. 2014, Leyva 2013, Chatterjee et al. 2012, Monge 2009, Nanda & Saravanan 2009) y nanoparticulas de óxidos de metales como CuO, NiO, ZnO, Sb2O3, Fe2O3 (Azam et al. 2012a y 2012b, Baek & An 2011, Jadhav et al. 2011).
El efecto inhibitorio del crecimiento microbiano que ejerce estas nanoestructuras han sido probadas en diferentes especies Gram positivas (S. aureus, Bacillus subtilis, Listeria monocytogenes) y Gram negativas (E. coli, Pseudomonas aeruginosa, Salmonella typhi, Klebsiella pneumoniae). Por consiguiente, el rol del tipo de nanoparticulas obtenidas y la sensibilidad de las bacterias no solo está relacionado a la estructura de la pared celular de las bacterias Gram positivas y negativas, sino que existen varios factores adicionales que influyen en la susceptibilidad o tolerancia de las bacterias a estas nanoestructuras. Por ejemplo, se ha determinado que E. coli es altamente susceptible a nanopartículas de CuO, mientras que S. aureus y B. subtilis son menos susceptibles (Baek & An 2011, Azam et al. 2012b). Si comparamos estos resultados de susceptibilidad a las nanopartículas de CuO con nuestros resultados, usando nanopartículas de cobre comercial, observamos resultados adversos, una alta susceptibilidad de S. aureus y una alta tolerancia de E. coli a las concentraciones probadas (desde 10 hasta 120 μg/mL). Existen otros reportes como el de Chatterjee et al. (2012) quienes sintetizan nanopartículas de Cu por un método distinto al nuestro y obtienen buenos resultados de actividad antibacteriana a E. coli y S. aureus, ellos argumentan que sus resultados se deben a la formación de iones de Cu inicial más que a iones de Cu proveniente del CuO (Chatterjee et al. 2012, Chatterjee et al. 2014).
Estos análisis indican que los efectos antibacterianos de las nanoparticulas se deben a cómo son sintetizados, lo que conlleva a suponer que las nanoestructuras de cobre metálico que obtuvimos por molienda mecánica, tienen un efecto distinto a las nanopartículas obtenidas por otros métodos. Una posible razón por la que no se observa un efecto inhibitorio de las nanopartículas de cobre cementado en las cepas estudiadas, puede deberse a la falta de mayor nanoestructuración y sobre todo a la falta de pureza (en comparación con el cobre comercial), lo cual deberá estudiarse con mayor detalle antes de descartar su posible acción inhibitoria. Lo importante de trabajar con los cementos de cobre nanoestructurado ha sido demostrar que se cuenta con la tecnología local para obtener cementos de cierta pureza de cobre a partir de los minerales de cabeza que se extraen de zonas mineras del país (en este caso del Complejo Marañón).
Este grado de pureza se puede mejorar, optimizando los procesos metalúrgicos, consiguiendo niveles similares al cobre comercial. Logrando esto, ya se estaría en la situación de darle un valor agregado a este cobre (de producción local), modificando su estructura a escala nanoscópica, tal que presente efectos inhibitorios como se ha obtenido con el cobre comercial.
Por otro lado, la carencia de efecto inhibitorio de las muestras de cobre cementado, indican dos hechos importantes a tener en cuenta para obtener materiales con aplicaciones bactericidas: (i) El cobre nanoestructurado presenta efectos inhibitorios del crecimiento de ciertas bacterias; es decir, el tamaño de grano del cobre es determinante para inhibir el crecimiento de estas bacterias. Así, surge una pregunta importante sobre cuál es el tamaño de grano ideal para optimizar la concentración mínima inhibitoria y sobre las razones fundamentales de ese valor. Este es un tema de investigación que merece ser profundizado porque nos permitiría entender mejor los mecanismos de inhibición del crecimiento de bacterias. (ii) La pureza de material nanoestructurado y/o su caracterización microestructural detallada, son condiciones importantes para determinar la capacidad inhibitoria de ciertos materiales. Por consiguiente esta capacidad inhibitoria no es solo un efecto de la nanoescala, hay también factores de composición y de impurezas, contaminación que pueden afectar la propiedad inhibitoria y por ello deben estudiarse con mucho cuidado (como es el caso del cobre cementado).
Agradecimientos
A Jorge León responsable del laboratorio de Ecología Microbiana del Instituto de Investigación de Ciencias Biológicas Antonio Raimondi, de la Universidad Nacional Mayor de San Marcos por proporcionar las cepas bacterianas utilizadas en la investigación.
Literatura citada
Anand B., M. Molli, S. Aditha, et al. 2013. Excited state assisted threephoton absorption based optical limiting in nanocrystalline Cu2Se and FeSe2. Opt. Commun. 304: 75-79. doi: http://dx.doi.org/10.1016/j.optcom.2013. 04.037 [ Links ]
Azam A, A.S. Ahmed, M. Oves, et al. 2012a. Size-dependent antimicrobial properties of CuO nanoparticles against Gram positive and -negative bacterial strains. Int J Nanomedicine. 7: 3527-3535. doi: http://dx.doi.org/10.2147/IJN.S29020 [ Links ]
Azam A., A.S. Ahmed, M. Oves, et al. 2012b. Antimicrobial activity of metal oxide nanoparticles against Gram-positive and Gramnegative bacteria: a comparative study. Int J Nanomedicine. 7: 6003-6009. doi:10.2147/IJN.S35347 [ Links ]
Baek Y-W. & Y-J An. 2011. Microbial toxicity of metal oxide nanoparticles (CuO, NiO, ZnO, and Sb2O3) to Escherichiacoli, Bacillus subtilis, and Streptococcus aureus. Sci Total Environ 409: 1603–1608. doi: http://dx.doi.org/10.1016/j.scitotenv.2011.01.014 [ Links ]
Baláž P. 2008. Mechanochemistry in Nanoscience and Minerals Engineering. Springer-Verlag, Berlin Heidelberg. 413 p. doi: http://dx.doi.org/10.1007/978-3-540-74855-7
Chatterjee A.K., R. Chakraborty & T. Basu. 2014. Mechanism of antibacterial activity of copper nanoparticles. Nanotechnology 25: 135101 (12pp). doi: http://dx.doi.org/10.1088/09574484/25/13/135101 [ Links ]
Chatterjee A.K., R. Kumar Sarkar, A.P. Chattopadhyay et al. 2012. A simple robust method for synthesis of metallic copper nanoparticles of high antibacterial potency against E. coli. Nanotechnology 23: 085103 (11pp). doi: http://dx.doi.org/10.1088/0957-4484/23/8/085103 [ Links ]
Deryabin D.G., E. S. Aleshina, A. S. Vasilchenko et al. 2013. Investigation of copper nanoparticles antibacterial mechanisms testedby luminescent Escherichia coli strains. Nanotechnologies inRussia, 8 (5-6): 402–408. doi: http://dx.doi.org/10.1134/S1995078013030063. [ Links ]
Habashi F. 1999. A Textbook of Hydrometallurgy. 2nd ed. Canada. Metallurgie Extractive Quebec. 750 p. ISBN 2-980-32477-9 [ Links ]
Jadhav S., N. Gaikwad, N. Nimse, et al. 2011. Copper Oxide Nanoparticles: Synthesis, Characterization and Their AntibacterialActivity. J. Clust. Sci. 22: 121-129. ISSN: 1572-8862. [ Links ]
Koch C.C. 2007. Nanoestructured materials: Processing, properties y applications (2nd ed.), William Andrew Publishing, New York, EEUU. 784 p. eBook ISBN: 9780815518426. [ Links ]
Koch C.C. 1993. The synthesis and structure of nanocrystallinematerials produced by mechanical attrition: A review. Nanostructured Materials. 2: 109-129. [ Links ]
Koch C.C. 1989. Materials Synthesis by Mechanical Alloying.Ann. Rev. Mater. Sci. 19,121-143. doi: http://dx.doi.org/10.1146/annurev.ms.19.080189.001005. [ Links ]
Lovera D., R. Soto, A. Solís, et al. 2012. Procesamiento hidrometalúrgico de los minerales sulfurados del complejo Marañón parala obtención de cobre electrolítico. Revista Latinoamericana de Metalurgia y Materiales. S4: 35-41. [ Links ]
Lovera D., V. Arias, J. Quiñones et al. 2010. Cinética de la reacción de cementación de cobre a partir de minerales sulfurados delcomplejo Marañón. Revista del Instituto de Investigación FIGMMG 13 (26): 43-49.ISSN versión electrónica: 16823087. ISSN versión impresa: 1561-0888. [ Links ]
Leyva G. 2013. Nanopartículas de plata: tecnología para su obtención,caracterización y actividad biológica. Investigación en Discapacidad, 2 (1): 18-22. www.medigraphic.org.mx [ Links ]
Monge M. 2009. Nanopartículas de plata: métodos de síntesis endisolución y propiedades bactericidas. An. Quím. 2009,105(1), 33-41. 2009 Real Sociedad Española de Química www.rseq.org [ Links ]
Mohammad J.H., K.M. Fromm, A. A. Ashkarran, et al. 2012. Antibacterial properties of Nanoparticles. Trends in Biotechnology 30 (10): 499-511. doi: http://dx.doi.org/10.1016/j.tibtech.2012.06.004 [ Links ]
Nanda A. & M. Saravanan. 2009. Biosynthesis of silver nanoparticles from Staphylococcus aureus and its antimicrobial activity against MRSA and MRSE. Nanomedicine: NBM, 5:452456, doi: http://dx.doi.org/10.1016/j.nano.2009.01.012 [ Links ]
Perelshtein I., G. Applerot & N. Perkas. 2009. CuO-cotton nanocomposite: Formation, morphology, and antibacterial activity. Surface & Coatings Technology 204: 54–57. doi: http://dx.doi.org/10.1016/j.surfcoat. 2009.06.028 [ Links ]
Sarker S.D, L. Nahar & Y. Kumarasamy. 2007. Microtitre plate-based antibacterial assay incorporating resazurin as an indicator ofcell growth, and its application in the in vitro antibacterial screening of phytochemicals. Methods, 42(4), 321-324. doi:http://dx.doi.org/10.1016/j.ymeth. 2007.01.006 [ Links ]
Sharifahmadian O., H. R. Salimijazi, M. H. Fathi et al. 2013. Study of the Antibacterial Behavior of WireArcSprayed Copper Coatings. J. Therm. SprayTechnol. 22: 371-379. doi: http://dx.doi.org/10.1007/s11666-012-9842-2 [ Links ]
Subramanian B., K. Anu Priya, S. Thanka Rajan et al. 2014. Antimicrobial activity of sputtered nanocrystalline CuO impregnated fabrics. Materials Letters 128: 1-4. doi: http://dx.doi.org/10.1016/j.matlet.2014.04.056 [ Links ]
Todaka Y., P.G. McCormick, K. Tsuchiya, et al. 2002. Synthesis of Fe-Cu Nanoparticles by mechanochemical processing usinga ball mill. Mater. Trans. Jpn. Inst. Met. 43 (4): 667-673. ISSN: 1347-5320 (Online), 1345 a 9678 (impression). [ Links ]
Xu M., F. Wang., M. Zhao, et al. 2011. Synthesis of copper oxide nanostructures via a composite-Hydroxide-mediated approach:Morphology control and the electrochemical performances as anode material for lithium ion batteries PhysicaE 44 (2): 506-510.ISSN: 13869477. [ Links ]
Yusoff N., N.M. Huang, M.R. Muhamad, et al. 2013. Hydrothermal synthesis of CuO/functionalized grapheme nanocompositesfor dye degradation. Mater. Lett. 93: 393-396. doi: http://dx.doi.org/10.1016/j.matlet.2012.10.015 [ Links ]
Zhang Q., K. Zhang, D. Xu, G. Yang et al. 2014. CuO nanostructures:Synthesis, characterization, growth mechanisms, fundamental properties, and applications. Progress in Materials Science 60: 208–337. doi: http://dx.doi.org/10.1016/j.pmatsci.2013.09.003 [ Links ]
Fuentes de financiamiento: Trabajo financiado por el Vicerrectorado de Investigación de la UNMSM (Proyecto Multidisciplinario, Código N° PM12014L01).
Información sobre los autores:
JS-V y PR dirigieron los experimentos microbiológicos. CVL diseño, dirigió y analizó los procesos físicos. MP, realizó la síntesis y caracterización de nanoestructuras. JB y AE realizaron los experimentos microbiológicos y de actividad inhibitoria. FD colaboró en los ensayos microbiológicos preliminares. DL extrajo los minerales sulfurados del Complejo Marañón y realizó los procesos metalúrgicos. JS-V, CVL y PR redactaron, revisaron y aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Presentado: 07/04/2016
Aceptado: 08/09/2016
ublicado online: 20/12/2016