Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.24 no.1 Lima ene./abr. 2017
http://dx.doi.org/10.15381/rpb.v24i1.13103
NOTA CIENTÍFICA
Aislamiento y caracterización del bacteriófago Va1 específico a Vibrio alginolyticus
Isolation and characterization of specific bacteriophage Va1 to Vibrio alginolyticus
Carla Fernández Espinel 1*, Violeta Flores Dominick 1, Marco Medina Morillo 1
Instituto del Mar del Perú, Laboratorio de Patobiología Acuática, Centro de Investigaciones Acuícolas "Alexander Von Humboldt", Esquina Gamarra y General Valle S/N Chucuito, Callao, Lima. Perú
Email Carla Fernández: cafernandez@imarpe.gob.pe
Email Marco Medina: mmedina@imarpe.gob.pe
Email Violeta Flores: vflores@imarpe.gob.pe
Resumen
Vibrio alginolyticus está asociado a enfermedades en acuicultura. El uso indiscriminado de antibióticos ha conllevado a la búsqueda de alternativas en el tratamiento de enfermedades bacterianas, entre ellas la aplicación de bacteriófagos, los cuales infectan y destruyen selectivamente bacterias. En ese sentido, en este trabajo se aisló un bacteriófago altamente lítico a V. alginolyticus el cual fue denominado Va1, con el objetivo de evaluar los parámetros físicos químicos en los cuales es viable. Para esto, se evaluó al bacteriófago Va1 en diferentes condiciones de pH, temperatura, cloroformo. El fago Va1 presenta mayores títulos a 20 y 30 °C y pH de 5 a 8 disminuyendo su viabilidad a partir de 40 °C y en unidades de pH menores de 5. La exposición al cloroformo redujo la viabilidad del fago Va1 en un 25%. A partir de la curva de un paso se determinó que el periodo de latencia y el tamaño de la explosión fueron de 20 minutos y 192 UFP/centro infectivo respectivamente. Al microscopio electrónico de transmisión el fago Va1 evidencio una cabeza icosaedrica y una cola no contráctil, características propias de la familia Podoviridae. En conclusión, el fago Va1 presenta características potenciales para su uso en fagoterapia.
Palabras clave: Bacteriófago; fagoterapia; Vibrio alginolyticus; acuicultura.
Abstract
Vibrio alginolyticus is associated with diseases in aquaculture. The misuse of antibiotics has led to the search for alternatives in the treatment of bacterial diseases, among them the application of bacteriophages that infect and destroy bacteria selectively. In this way, a highly lytic V. alginolyticus bacteriophage, termed Va1, was isolated, with the aim to evaluate its physical chemical parameters. For this purpose, different temperature, pH, chloroform exposure and host range conditions were evaluated. The temperature stability of phage Va1 showed higher titers at 20 and 30 °C decreasing from 40 °C. With respect to pH, the highest titers for the bacteriophage were between 5 and 8, and chloroform exposure reduced viability of the Va1 phage by 25%. The one-step curve determined that the latency period and the burst size were 20 minutes and 192 PFU / infective center respectively. Under the transmission electron microscope, the Va1 phage showed an icosahedral head and a non-contractile tail, belonging to the Podoviridae family. In conclusion, Va1 phage presents potential characteristics for use in phage therapy.
Keywords: Bacteriophage; phagotherapy; Vibrio alginolyticus; aquaculture.
Introducción
Vibrio alginolyticus es una bacteria Gram negativa, presente en todos los ambientes y organismos marinos y se encuentra asociado a enfermedades oportunistas (Thompson & Austin 2006), esto debido a su capacidad de adhesión al mucus del huésped, el cual es un factor crucial en el mecanismo de virulencia (Luo et al. 2016).
En acuicultura, las enfermedades infecciosas, especialmente las bacterianas, son los principales problemas en la expansión en esta industria y son fuente de pérdidas económicas (Flegel 2006). En ese sentido, se ha reportado a V. alginolyticus como el causante de enfermedades en organismos acuáticos cultivados (Gómez-León et al., 2005, Martins et al. 2010), especialmente en los estadios iniciales de vida (Zorrilla et al. 2003) produciendo septicemia, hemorragias, úlceras a nivel epitelial con necrotización progresiva (Gómez-León et al. 2005) y acumulación de líquido ascítico en la cavidad peritoneal (Paperna 1984). A consecuencia de ello, el uso de antibióticos tradicionales ha sido la estrategia más aplicada contra las infecciones bacterianas, pero su uso indiscriminado ha originado la aparición de bacterias multidrogo resistentes, lo que ha conllevado en muchas ocasiones, al desarrollo de patologías que no pueden ser tratadas con antibióticos convencionales e incluso al desarrollo de cepas bacterianas resistentes que pueden infectar a otros organismos, incluyendo al hombre (Defoirdt et al. 2007).
Por ello, en los últimos tiempos las investigaciones se han orientado en la búsqueda de tratamientos alternativos. Los bacteriófagos, virus que infectan bacterias, son considerados como una alternativa prometedora para prevenir y controlar enfermedades de etiología bacteriana en cultivos acuícolas (Ronda et al. 2003, Lomelí 2011, Nakai & Park 2002); por medio de ellos, las enfermedades bacterianas podrían ser tratadas de una forma específica y selectiva, sin afectar la microbiota normal en los sistemas de cultivos acuícolas (Clark & March 2004), además de no generar resistencia bacteriana a antibióticos (Sulakvelidze et al. 2001, Loc-Carrillo & Abedon 2011). Sin embargo, para fines aplicativos, es necesario comprender en primera instancia, el comportamiento del fago en diferentes condiciones fisicoquímicas, para aumentar las probabilidades de éxito de la terapia fágica.
El objetivo de este estudio fue el aislamiento y caracterización de un bacteriófago lítico contra Vibrio alginolyticus ATCC® 33787 para optimizar su aplicación como agente terapéutico en acuicultura.
Materiales y métodos
Cepa bacteriana huésped y cinética de crecimiento. La cepa de V. alginolyticus ATCC ® 33787, proporcionada por el Banco de Germoplasma del Instituto del Mar del Perú, fue utilizada como bacteria huésped para el aislamiento del bacteriófago. Esta cepa fue cultivada en caldo Tripticasa de soya (TSB) con 1% de NaCl (Merck, Alemania) a 25 °C por 24 horas. En las pruebas sucesivas, se utilizó V.alginolyticus ATCC® 33787 en fase logarítmica de su crecimiento (6 horas).
Aislamiento y purificación de bacteriófagos. El bacteriófago fue aislado del líquido ascítico procedente de un ejemplar de Paralichthys adspersus "lenguado", con signos aparentes de enfermedad, procedente del laboratorio de Cultivo de Peces del Instituto del Mar del Perú. La superficie epitelial del ejemplar fue desinfectada con alcohol de 70°, posteriormente, por abdominocentesis se extrajo el líquido ascítico del interior de la cavidad peritoneal utilizando una jeringa hipodérmica de 20 mL. Las muestras fueron almacenadas en frascos de 50 mL. En seguida, se realizó el aislamiento del bacteriófago siguiendo la metodología de Phumkhachorn (2010) con modificaciones. Las muestras fueron centrifugadas a 3300x g a 4 °C por 20 minutos y el sobrenadante fue filtrado por medio de un equipo de filtración con filtro de membrana de 0.22 µm de porosidad (Merck Millipore®, Alemania). La muestra filtrada fue enriquecida con un volumen igual de caldo Tripticasa de Soya (TSB) (Merck®, Alemania), suplementado con 1% de NaCl y con CaCl 20 mM, a la cual se le adicionó 1 mL de un cultivo de V. alginolyticus ATCC ® 33787. Esta mezcla fue incubada a 25 °C por 24 horas.
Luego de la incubación, la bacteria fue removida mediante centrifugación a 3300xg a 4 °C por 15 minutos y en seguida el sobrenadante fue filtrado (0.22 µm PES Syringe Filter MS®). Posteriormente, se realizó la prueba del "spot test" según Phumkhachorn (2010), para la cual, 80 µL de sobrenadante filtrado fue inoculado sobre un tapiz de V. alginolyticus ATCC ® 33787 previamente mezclado con 3 mL de agar Tripticasa de Soya TSA (70%) 1% NaCl a 45 °C y vertido sobre placas con TSA (100%) 1% NaCl. La presencia de zonas de aclaramiento fue verificada luego de 24 horas de incubación a 25 °C como evidencia de la presencia de bacteriófagos.
La purificación del bacteriófago se realizó mediante la técnica de la doble capa según Hernández (2007). A partir del sobrenadante filtrado, se realizaron diluciones seriadas en buffer fosfato salino (PBS). Un mililitro de cada dilución fue mezclado con 1 mL de un cultivo de V. alginolyticus ATCC® 33787 en tubos estériles conteniendo 3 mL de TSA (70%) con 1 mL de ClCa2 20 mM (45 °C), los cuales se vertieron sobre placas con agar TSA (100%) y se incubaron a 25 °C por 24 horas. Transcurrido el tiempo de incubación, se evidenció la formación de placas de lisis las cuales fueron recortadas con ayuda de un asa de siembra con el aro de nicrom en ángulo recto, trasladadas y depositadas en microtubos de 2 mL conteniendo PBS estéril. En seguida, se agregaron 3 gotas de cloroformo y se agitaron en vortex por 1 minuto. Posteriormente, las muestras se centrifugaron a 3300xg a 4 °C por 10 minutos y se filtraron a 0.22 µm. El filtrado fue almacenado en microtubos estériles de 1.5 mL a 4 °C.
Para la cuantificación de las unidades formadoras de placas por mililitro (UFP.mL‒1) se utilizó la siguiente fórmula (Segundo et al. 2010):
UFP.mL‒1= (Número de placa* Factor de dilución)/ Volumen de la alícuota.
Caracterización del bacteriófago Va1
Evaluación de Termoestabilidad. El test de estabilidad térmica del bacteriófago aislado, fue realizado de acuerdo a la metodología utilizada por Haq (2012). Un mililitro de PBS conteniendo bacteriófagos (título: 6 x 108 UFP.mL‒1), fueron dispensados en tubos de ensayo, los cuales fueron sometidos a temperaturas de 20, 30, 40, 50 y 60 °C en baño maría, por 1 hora. Concluido el tiempo se determinó el título final de los bacteriófagos mediante la técnica de la doble capa. Los tratamientos fueron realizados por triplicado.
Evaluación de la sensibilidad al cloroformo. La evaluación de la sensibilidad de los bacteriófagos al cloroformo fue realizado de acuerdo a la metodología utilizada por Wong (1994). Medio mililitro de bacteriófagos en solución PBS (título: 7 x 107 UFP. mL‒1) fueron dispensados en tubos de ensayo a los cuales se les adicionó 0.1 mL de cloroformo (grado: PA) e inmediatamente se mezclaron por 10 minutos a temperatura ambiente utilizando un Vortex. Una vez concluido el tiempo, los tubos de ensayo fueron sometidos a centrifugación, a 3300xg a 4 °C por 10 minutos. El sobrenadante fue utilizado para determinar el título final de bacteriófagos. El mismo procedimiento fue llevado a cabo con el grupo control al cual se sustituyó el cloroformo por solución salina estéril 0.85%. Los tratamientos fueron realizados por triplicado.
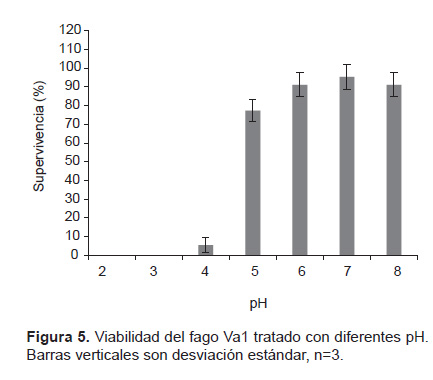
Evaluación de la sensibilidad a diferentes pH. La evaluación de la sensibilidad de los bacteriófagos a diferentes pH fue realizado de acuerdo a la metodología utilizada por Haq (2012). Quinientos microlitros de bacteriófagos en solución buffer PBS (título: 7 x 107 UFP.mL‒1) fueron dispensados en tubos de ensayo los cuales contenían 5 mL de PBS, el cual fue previamente ajustado en intervalos de 1 unidad de pH, desde 2 hasta 8, utilizando HCl 1N o NaOH 1N a 25 °C durante una hora. Concluido el tiempo, se determinó el título final de los bacteriófagos mediante la técnica de la doble capa. Los tratamientos fueron realizados por triplicado.
Evaluación del espectro de hospedero. Se utilizó la técnica del "spot test" según Phumkhachorn (2010) modificada. Cincuenta microlitros de cada cepa indicadora se dispensaron en tubos de 13 x 100 mm conteniendo 3 mL de agar TSA (70%) a 45 °C. Esta mezcla se vertió sobre placas Petri de 16 x 150 mm conteniendo agar TSA (100%) con la finalidad de formar un césped bacteriano. Una vez solidificada la doble capa, se goteo 50 µL del bacteriófago para cada una de las cepas indicadoras.
Las cepas indicadoras fueron: Listonella anguilarum NCIMB 6, V. splendidus NCIMB 1, Photobacterium damselae subsp. damselae NCIMB 2184, P. damselae subsp. piscicida NCIMB 2058, V. harveyi NCIMB 1280, Flexibacter maritimus NCIMB 2153, Aeromonas hydrophila (ATCC®7966TM), A. hydrophila (ATCC®49140TM), A. hydrophila (ATCC®35654TM), A. salmonicida (ATCC®33658TM), Streptococcus iniae (ATCC ® 29178TM), Enterobacter cloacae subsp. cloacae (ATCC® 13047™), Alcaligenes faecalis subsp. faecalis (ATCC® 35655™), Enterococcus faecalis (ATCC® 14506™), Edwardsiella tarda (ATCC® 15947™), Citrobacter braakii (ATCC® 10625™), Escherichia coli (ATCC® 25922™), V. alginolyticus (ATCC® 17749™), V. alginolyticus ( ATCC ® 33787), Yersinia ruckeri (ATCC® 29473™), Pseudomonas fluorescens (ATCC® 13525™), P. putida (ATCC® 31483™) y V. parahaemolyticus (ATCC® 17802™).
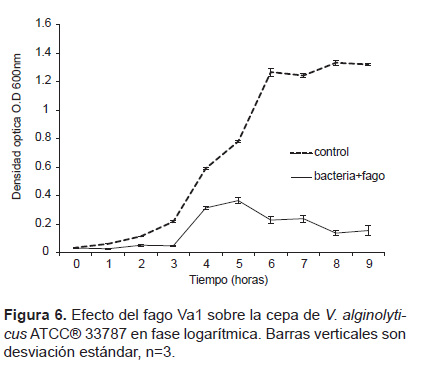
Reducción del crecimiento bacteriano. El test de cinética de infección del bacteriófago fue realizado de acuerdo a la metodología utilizada por Haq (2012). Un mililitro de un cultivo de V. alginolyticus ATCC® 33187 fue inoculado en matraces conteniendo 50 mL de caldo TSB 1% NaCl al que se le adicionó 1 mL del bacteriófago en solución PBS (título: 8 x 108 UFP.mL-1). Posteriormente se incubaron a 25 °C en agitación continua. Se utilizó un grupo control al cual no se le inoculó bacteriófagos. La densidad óptica (DO600) fue medida en intervalos de 1 hora por 9 horas. La prueba se realizó por triplicado.
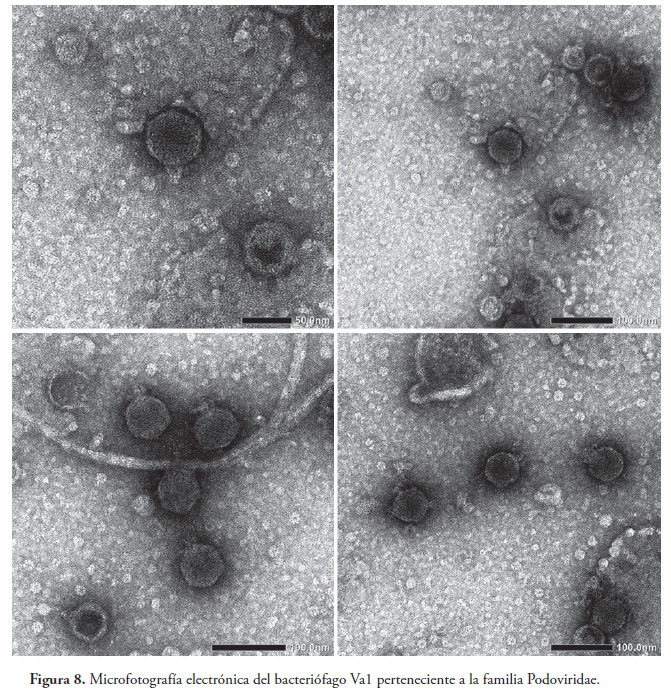
Morfología de los bacteriófagos.La morfología de los bacteriófagos aislados fue observada mediante Microscopía Electrónica de Transmisión (TEM), con tinción negativa y acetato de uranilo 2%. Las muestras fueron examinadas utilizando un microscopio electrónico de transmisión (JEOL JEM-1200EX) a 80 kV.
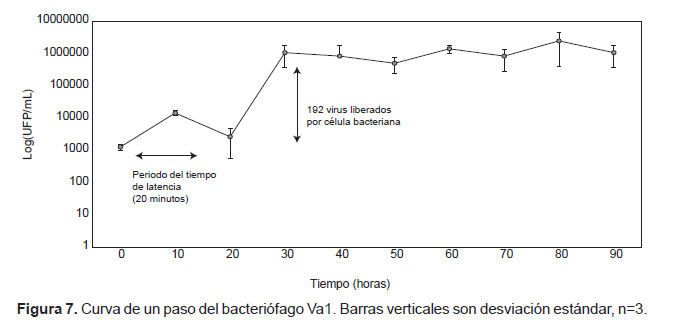
Curva de un paso. El periodo de latencia y el tamaño de la explosión fueron determinados a partir de la curva de un paso, la que fue realizada de acuerdo a la metodología utilizada por Phumkhachorn (2010). Diez mililitros de V. alginolyticus ATCC® 33787 en fase logarítmica fueron centrifugados a 3300xg a 4 °C por 20 minutos. El sobrenadante fue descartado y el pellet fue resuspendido en 10 mL de caldo TSB 1% NaCl ajustado a 108 UFC.mL‒1. A esta suspensión se le adiciono 5 mL de bacteriófagos en PBS (7 x 10 8 UFP/mL) a una MOI de 0.1 (Middelboe et al. 2010) y se incubó a 25 °C por 30 minutos. Una vez concluido el tiempo de incubación, la mezcla fue centrifugada a 3300xg a 4 °C por 20 minutos y el pellet fue resuspendido en 50 mL de caldo TSB 1% NaCl. Se tomaron muestras cada 10 minutos en un periodo de 3 horas e inmediatamente fueron tituladas por el método de la doble capa (Hernández 2007). La prueba se realizó por triplicado.
Resultados
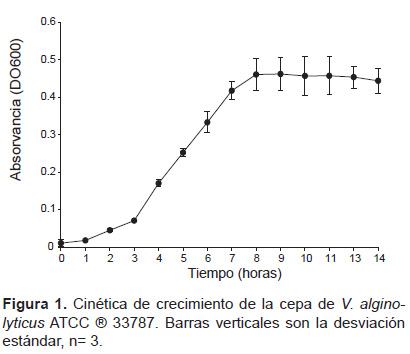
Cinética de crecimiento de la cepa V. alginolyticus ATCC® 33787. La cinética de crecimiento de V. alginolyticus ATCC® 33787 evidenció que entre las 3 horas y las 9 horas la cepa se encuentra en la fase logarítmica de su crecimiento. (Fig. 1)
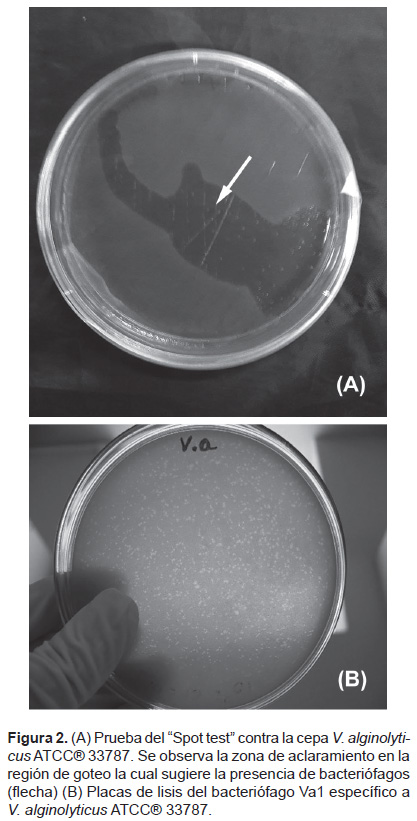
Aislamiento y purificación de bacteriófagos. La prueba del spot test, utilizando a V. alginolyticus ATCC® 33787 como la cepa indicadora, dio positivo a la presencia de bacteriófagos (Fig. 2A. Además, mediante el método de la doble capa, se aisló un bacteriófago al cual se le nombró como Va1. Las placas de lisis observadas fueron claras, uniformes, de forma circular y pequeñas de aproximadamente 0.1 – 0.5 mm de diámetro promedio (Fig. 2B).
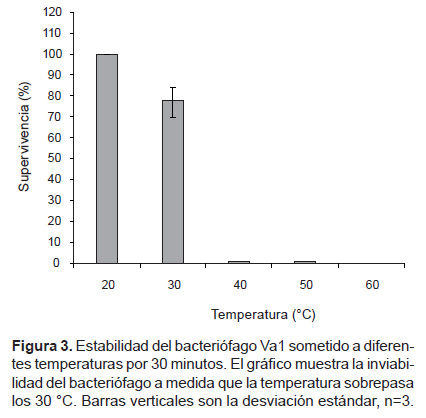
Evaluación de la Termoestabilidad. Los resultados evidencian que el bacteriófago Va1 es estable hasta los 20 y 30° C por 60 minutos, disminuyendo su viabilidad a partir de los 40 y siendo nula a 60 °C. (Fig. 3).
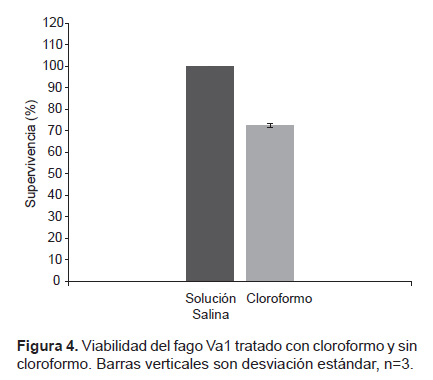
Evaluación de la sensibilidad al cloroformo. La viabilidad del bacteriófago Va1 fue reducida casi un 25% al exponerla al cloroformo (Fig. 4).
Resistencia a diferentes pH. El fago Va1 mantiene su viabilidad en un rango de pH entre 5 a 8, adicionalmente observamos que a pH 2, 3 y 4 la infectividad del fago es prácticamente nula (Fig. 5).
Espectro de hospedero. De las 23 cepas utilizadas para determinar el espectro de hospedero del bacteriófago Va1 por medio de la prueba del "spot test", V. alginolyticus ATCC® 33787 evidencio una elevada susceptibilidad en la región de goteo, reflejada por el crecimiento nulo de la cepa, adicionalmente se evidenció un ligero aclaramiento para V. parahaemolyticus ATCC® 17802™. (Tabla 1).
Reducción del crecimiento bacteriano. La infección de V. alginolyticus ATCC® 33787 con el fago Va1 (7 x 108 UFP.ml-1) fue monitoreada por 9 horas. Se observó que el bacteriófago Va1 es capaz de lisar a V. alginolyticus ATCC® 33787 impidiendo su normal crecimiento. (Fig. 6).
La curva de un paso. Los parámetros de multiplicación del ciclo lítico del bacteriófago Va1 fueron determinados a partir de la curva de un paso (Fig. 7). Se determinó que el periodo de latencia dura aproximadamente 20 minutos, y el tamaño de la explosión fue de 192 fagos por centro infectivo.
Microscopia electrónica. Se observó que el fago Va1 pertenece a la familia Podoviridae por presentar cabeza de forma icosaédrica con un talo corto no contráctil y un diámetro menor al diámetro de la cabeza. (Fig. 8).
Discusión
En el presente trabajo se aisló un bacteriófago altamente lítico contra la cepa de V. alginolyticus ATCC ® 33787 a partir del líquido ascítico de un ejemplar de P. adspersus con signos aparentes de enfermedad, lo que sugiere la posible presencia de Vibrio alginolyticus en la infección, ya que se encuentra asociado a enfermedades oportunistas (Thompson & Austin 2006). Además, otros autores han reportado el aislamiento de bacteriófagos líticos contra V. alginolyticus a partir de muestras de ambiente acuático (Lin et al. 2012, Kalatzis et al. 2016).
El fago Va1 aislado contra V. alginolyticus produjo placas claras de un diámetro de 0.5 a 1 mm de diámetro. Estos diámetros de placas son semejantes a los reportados por Hidaka y Tokushige (1978) y Solís et al. (2016) para otros fagos contra bacterias del género Vibrio, quienes aislaron placas de 0.5 mm y 1mm contra V. parahaemolyticus y V. cholerae respectivamente.
La microscopia electrónica reveló que el fago Va1 concuerda morfológicamente con los fagos ØA318 (Lin et al. 2012) y VAP1 (Heo et al. 2012) ambos especificos a V. alginolyticus y el fago VpV262 (Hardies et al. 2003) específico a V. parahaemolitycus. El fago Va1 se clasifica dentro del tipo C en el manual de Bradley (1967), clasificación que corresponde a la familia Podoviridae, que se caracteriza por tener una cabeza de seis lados, una cola no contráctil más corta que el diámetro de la cabeza y presencia de ácido nucleico del tipo ADN (Bradley 1967, Ackermann 2001, Sillankorva et al. 2008, Moebus & Nattkemper 1981 ).
La curva de un paso mostró las etapas implicadas en el ciclo de multiplicación de los bacteriófagos. El periodo de latencia y el tamaño de la explosión son parámetros esenciales para comprender las propiedades y variación entre fagos y hospederos (Middelboe et al. 2010; Wang 2005). Algunos autores han reportado para el género Vibrio, periodos de latencia de 30, 120 y 65 minutos y tamaño de explosión de 78 y 23 partículas víricas por centro infectivo (Phumkhachorn y Rattanachaikunsopon 2010, Sung Lee et al. 2014). Sin embargo, la curva de un paso depende del índice de multiplicidad de infección (MOI), la cual se sugiere que debe utilizarse en un rango de 0.1 y 0.01 debido a que una MOI más alta incrementa la probabilidad de que una bacteria sea infectada por más de un fago incrementado así el número total de fagos por centro infectivo (Middelboe et al. 2010). Así, el fago Va1 tiene un tamaño de explosión de 192 unidades víricas por centro infectivo utilizando un índice de multiplicidad de infección (MOI) de 0.1 comparado con otros fagos específicos a V. alginolyticus cuyo tamaño de explosión fue de 97 y 44 fagos por centro infectivo utilizando un MOI de 0.01 (Kalatzis et al. 2016). Se ha evidenciado que mientras más corto es el periodo de latencia y mayor el tamaño de explosión, el bacteriófago puede ser aplicado con mayores probabilidades de éxito en fagoterapia (Middelboe et al. 2010, Abedon et al. 2001), ya que al producirse más partículas virales a partir de un centro infectivo, aumentan las posibilidades de controlar mejor las poblaciones bacterianas.
El pH ácido disminuye la viabilidad del bacteriófago Va1, mientras que a unidades de pH cercanas al valor neutro se mantiene estable. Resultados similares fueron hallados en bacteriófagos de otros vibrios (Phumkhachorn y Rattanachaikunsopon 2010). La importancia de este ensayo radica en la posibilidad de aplicaciones futuras de fagoterapia vía oral, en ese sentido, el bacteriófago de este estudio estaría probablemente limitado de administrarse por esta vía. Además, el bacteriófago Va1 es estable entre 20 y 30 °C y disminuye su viabilidad conforme la temperatura se eleva. Lin et al. 2012, reportaron que la estabilidad para el fago OA318 específico a V. alginolyticus estuvo en 20 y 40 °C. Posiblemente las limitaciones respecto a los parámetros ambientales extremos se deba al origen natural de sus bacterias huésped, ya que los vibrios se han reportado en ambiente marinos (Thompson & Austin 2006), donde la temperatura y el pH se mantienen constantes.
El resultado de la prueba de rango de hospederos fue positivo para V. alginolyticus ATCC® 17749™ y V. alginolyticus ATCC® 33787™ y negativo para la mayoría de cepas testigos a los que fue enfrentado el fago Va1. La cepa V. parahaemolyticus ATCC® 17802™ resultó en un ligero aclaramiento cuando se enfrentó con el fago Va1. Esto se debería probablemente a que V. parahaemolyticus y V. alginolyticus son cepas altamente homogéneas, entre 99,88 y 61,77% de nucleótidos idénticos (Osorio & Klose 2000). Sin embargo, el aclaramiento para V. parahaemolyticus fue considerado (+/-) por que no se evidenció una lisis total, a pesar del elevado título del fago Va1.
En el proceso de purificación de bacteriófagos, el cloroformo cumple un rol importante al lisar al remanente bacteriano, sin embargo en este estudio se evidenció que su utilización disminuyó la viabilidad del bacteriófago en un 25%. Resultados similares fueron reportados por Wong (1996). En ese sentido, en nuestro laboratorio, hemos evitado el uso de este químico en el proceso de purificación con resultados satisfactorios.
En conclusión, el bacteriófago aislado en este estudio, con un periodo de latencia corto y un tamaño de explosión alto, presenta características potenciales para su utilización en pruebas de fagoterapia cuya técnica representa una alternativa al tratamiento con antibióticos para el tratamiento de enfermedades bacterianas en el campo de la acuicultura.
Agradecimientos
Los autores desean agradecer al Dr. Toshihiro Nakai, Profesor de la Universidad de Hiroshima, Japón, por su ayuda en la toma de fotografías electrónicas. Al laboratorio de Cultivo de Peces Marinos del Instituto del Mar del Perú.
Literatura citada
Abedon S., T. Herschler, D. Stopar. 2001. Bacteriophage LatentPeriod Evolution as a Response. Applied Environmental Microbiology. 67(9):4233-4241. https://doi.org/10.1128/AEM.67.9.4233-4241. [ Links ]
Ackermann H. 2001. Frequency of morphological phage descriptions in the year 2000. Archives of Virology 146: 843–857 [ Links ]
Bradley D. 1967. Ultrastructure of bacteriophages and bacteriocins. Bacteriological Reviews. 31(4):230–314. [ Links ]
Clark J., & J. March. 2004. Bacterial virases as human vaccines. Expert Review of Vaccines 3(4):463-476. https://doi.org/10.1586/14760584.3.4.463 [ Links ]
Defoirdt T., N. Boon, P. Sorgeloos, et al. 2007.Alternatives to antibiotics to control bacterial infections: luminescent vibriosis in aquaculture as an example. Trends Biotechnology. 25(1):472–479. https://doi.org/10.1016/j.tibtech.2007.08.001 [ Links ]
Flegel T. 2006. Detection of major penaeid shrimp viruses in Asia, a historical perspective with emphasis on Thailand. Aquaculture. 258(1):1-33. https://doi.org/10.1016/j.aquaculture.2006.05.013 [ Links ]
Gómez J., L. Villamil, M. Lemos, et al. 2005. Isolation of Vibrio alginolyticus and Vibrio splendidus from aquacultured carpet shell clam (Ruditapesdecussatus) larvae associated with mass mortalities. Applied Environmental Microbiology. 71(1):98–104. https://doi.org/10.1128/AEM.71.1.98-104.2005. [ Links ]
Hardies S., A. Comeau. Et al. 2003. The complete sequence of marine bacteriophage VpV262 infecting vibrio parahaemolyticus indicates that an ancestral component of a T7 viral supergroup is widespread in the marine environment. Virology. 310(2):359-271. http://dx.doi.org/10.1016/S0042-6822(03)00172-7 [ Links ]
Hernández A. 2007. Aislamiento, caracterización y detección precoz de bacteriófagos de Streptococcus thermophilus en la industria láctea. Memoria, Doctor, Biología Funcional y Molecular. Universidad de Oviedo, España. [ Links ]
Heo Y., C. Lee, M. Baek. Et al. 2012. Morphological characterization of Vibrio alginolyticus specific bacteriophage isolated from fish farms on west coast of Korea. Journal of fish pathology. 25(3):165–172. https://doi.org/10.7847/jfp.2012.25.3.165. [ Links ]
Hidaka T. & A. Tokushige. 1978. Isolation and Characterization of Vibrio parahaemolyticus Bacteriophages in Sea Water. Memoirs of Faculty of Fisheries. 27(1):79-90. [ Links ]
Haq U, Chaudhry W, Andleeb S, et al. 2012. Isolation and Partial Characterization of a Virulent Bacteriophage IHQ1 Specific for Aeromonas punctata from Stream Water. Microbial Ecology. 63:954–963. https://doi.org/10.1007/s00248-011-9944-2. [ Links ]
Kalatzis P., R. Bastías, C. Kokkari, et al. 2016. Isolation and characterization of two lytic bacteriophages, St2 and Grn1; phage therapy application for biological control of vibrio alginolyticus in aquaculture live feeds. PLOS ONE. https://doi.org/10.1371/journal.pone.0151101. [ Links ]
Lin Y., C. Chiu & F. Chang.2012. Characterization of a new phage, termed A318, which is specific for Vibrio alginolyticus. Arch Virology. Springer Vienna. 157(5):917–926. https://doi.org/10.1007/s00705012-1244-8 [ Links ]
Loc-Carrillo C., & S, Abedon. 2011. Pros and cons of phage therapy bacteriophage. Landes Bioscience. 1(2):111-114. https://doi.org/10.4161/bact.1.2.14590. [ Links ]
Lomelí C. 2011. La fagoterapia como estrategia para reducir la mortalidad por Vibriosis en larvas de camaron blanco Litopenaeus vannamei. Memoria, Magister en Ciencias en manejo de Recursos Marinos. IPN-CICIMAR. La Paz B.C.S. Acceso online 18/04/2015. [ Links ]
Luo G., L. Huang, Y. Sun, Y. Qin, X. Xu, L. Zhao, Q. Yan. 2016. flrA, flrB and flrC regulate adhesion by controlling the expression of critical virulence genes in Vibrio alginolyticus. Emerging Microbes & Infections. 5. https://doi.org/10.1038/emi.2016.82 [ Links ]
Martins M., J. Mouriño, G. Fezer, et al. 2010. Isolation and experimental infection with Vibrio alginolyticus in the sea horse, Hip-pocampus reidi Ginsburg, 1933 (Osteichthyes: Syngnathidae) in Brazil. Brazilian Journal of Biology 70(1):205-209. http://dx.doi.org/10.1590/S1519-69842010000100028 [ Links ]
Middelboe M., A. Chan & S. Bertelsen. 2010. Isolation and life cycle characterization of lytic viruses infecting heterotrophic bacteria and cyanobacteria. MAVE. 13:118–133. https://doi.org/10.4319/mave.2010.978-0-9845591-0-7.118 [ Links ]
Moebus K., & H. Nattkemper. 1981. Bacteriophage sensitivity patterns among bacteria isolated from marine waters. Helgoländer Meeresuntersuchungen 34:375– 385.Doi: 10.1007/BF02074130. [ Links ]
Nakai T., & S. Park.2002. Bacteriophage therapy of infectious diseases in aquaculture. Research in Microbiology. 153(1):13-18. https://doi.org/10.1016/S0923-2508(01)01280-3 [ Links ]
Osorio C., & K. Klose. 2000. A region of the transmembrane regulatory protein toxR that tethers the transcriptional activation domain to the cytoplasmic membrane displays wide divergence among Vibrio species. Journal of Bacteriology. 182(2):526–528. https://doi.org/10.1128/JB.182.2.526-528.2000 [ Links ]
Paperna I. 1984. Review of diseases affecting cultured Sparus aurata and Dicentrarchus labrax. París. 465-482. [ Links ]
Phumkhachorn P. & P. Rattanachaikunsopon. 2010. Isolation and partial characterization of a bacteriophage infecting the shrimp pathogen Vibrio harveyi. African Journal of Microbiology Research 4(16):1794-1800. [ Links ]
Ronda C., M. Vázquez, R. López.2003. Los bacteriófagos como herramienta para combatir infecciones en acuicultura. Revista AquaTIC. 18:3-10. [ Links ]
Segundo N., E. Hernández, O. López, O. Torres. 2010. Los bacteriófagos como una alternativa en el tratamiento de enfermedades infecciosas Bacterianas (Fagoterapia). Revista Mexicana de Ciencias Farmacéuticas. 41(3):17-26 [ Links ]
Sillankorva S., P. Neubauer & J. Azeredo. 2008. Isolation and characterization of a T7-like lytic phage for Pseudomonas fluorescens. BMC Biotechnology. 8:80–91. https://doi.org/10.1186/1472-6750-8-80 [ Links ]
Solís A., U. Hernández, A. Navarro, et al. 2016. Genetic characterization of ØVC8 lytic phage for Vibrio cholerae O1. Virology Journal. 13-47. https://doi.org/10.1186/s12985-016-0490-x [ Links ]
Sulakvelidze A., Z. Alavidze & G. Morris. (2001). MinireviewBacteriophage Therapy. Antimicrobial Agents and Chemotherapy. 45(3):649-659. https://doi.org/10.1128/AAC.45.3.649-659.2001 [ Links ]
Sung Lee H., S. Choi, H. Shin, et al. 2014. Vibrio vulnificus Bacte-riophage SSP002 as a Possible Biocontrol Agent. Applied and Environmental Microbiology. 80(2):515-524. https://doi.org/10.1128/AEM.02675-13 [ Links ]
Thompson F., B. Austin. 2006. The biology of vibrios. Wallingford, D.C. pp. 357–411. [ Links ]
Wong A. 1994. Purificación y caracterización biológica del bacteriófago uB-19 especifico de Bacillus thuringiensis Memoria, Magister en Ciencias con especialidad en Microbiología. México. Acceso online 18/04/2015. [ Links ]
Zorrilla I., S. Arijo, M. Chabrillon, et al. 2003. Vibrio species isolated from diseased farmed sole (Solea senegalensis, Kaup) and evaluation of the potential virulence role of their extracellular products. Journal Fish Disease. 26(2):103-108. DOI: 10.1046/j.1365-2761.2003.00437.x. [ Links ]
Información sobre los autores: CFE, VFD y MMM, realizaron el aislamiento, las pruebas de caracterización y redactaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Presentado: 06/12/2016
Aceptado: 19/02/2017
Publicado online: 20/04/2017