Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.24 no.2 Lima mayo/agos. 2017
http://dx.doi.org/10.15381/rpb.v24i2.13499
NOTA CIENTÍFICA
Caracterización química y evaluación de la actividad antifúngica del aceite esencial foliar de Lippia alba contra Colletotrichum gloeosporioides
Chemical characterization and evaluation of the antifungal activity of the Lippia alba essential oil against Colletotrichum gloeosporioides
Alexander Pérez Cordero*, Leonardo Chamorro Anaya y Deimer Vitola Romero
Universidad de Sucre, Laboratorio de Investigaciones Microbiológicas, Grupo de Investigación Bioprospección Agropecuaria, Dirección postal: Carrera 28 #5-267 Sincelejo, Sucre-Colombia.
*Autor para correspondencia.
E-mail Alexander Pérez: alexander.perez@unisucre.edu.co
E-mail Leonardo Chamorro Anaya: lema1906@hotmail.com
E-mail Deimer Vitola Romero: fitoquimicapn@gmail.com
Resumen
El objetivo de este estudio fue caracterizar y evaluar in vitro la eficiencia del aceite esencial foliar de Lippia alba contra Colletotrichum gloeosporioides. Se extrajo el aceite esencial a partir de las hojas mediante el método de hidrodestilación asistida por microondas (MWHD) y se identificaron sus metabolitos mediante una cromatografía de gases acoplada a espectrometría de masas (GC/MS). La evaluación in vitro se realizó empleando 4 concentraciones del aceite esencial (500, 1000, 3000 y 10000 ppm) diluidas en acetona; se utilizó un control positivo con Benomil 1 g/L, un control negativo con acetona y un testigo absoluto; la eficiencia del aceite se midió mediante el porcentaje de índice antifúngico (%I.A). El componente mayoritario en el aceite esencial fue el citral (34.62 a 40.03%) y que el mayor %I.A se encontró a la concentración de 10000 ppm (97.8%), muy similar a la del Benomil (100%). Lo anterior demostraría la eficacia del aceite esencial de L. alba para controlar a C. gloeosporioides, y su posible uso como fungicida biológico.
Palabras clave: Aceites esenciales; fitopatógenos; fungicidas; antracnosis; Lippia alba; Colletotrichum gloeosporioides.
Abstract
The aim of this study was to characterize and evaluate the in vitro efficiency of leaf essential oil of Lippia alba against Colletotrichum gloeosporioides. Essential oil from the leaves was extracted by the method of assisted microwave hydrodistillation (MWHD) and metabolites were identified by gas chromatography coupled to mass spectrometry (GC/ MS). The in vitro evaluation was performed using 4 concentrations of essential oil (500, 1000, 3000 and 10000 ppm) diluted in acetone; positive control with Benomyl 1 g /L, a negative control with acetone and absolute control was used; oil efficiency was measured by the percentage of antifungal index (% IA). It was found that the major component was in the essential oil citral (34.62 to 40.03%) and the highest %I.A was found to 10000 ppm concentration (97.8%) very similar to Benomyl (100%). This would demonstrate the efficacy of the L. alba essential oil to control C. gloeosporioides, and its possible use as a biological fungicide.
Keywords: Essential oils; phytopathogens; fungicides, anthracnose; Lippia alba; Colletotrichum gloeosporioides
Introducción.
El hongo Ascomiceto Colletotrichum gloeosporioides (Penz.) Penz. & Sacc. (teleomorfo: Glomerella cingulata (Stoneman) Spauld. & H. Schrenk) es el agente causal de la antracnosis en diferentes plantas tropicales (Bussaman et al. 2012). Es un hongo facultativo, ya que puede vivir como saprofito o como patógeno en una planta (Nesher et al. 2011). Dentro del género Colletotrichum se encuentran especies que causan importantes enfermedades en un amplio rango de plantas las cuales incluyen legumbres, cereales, verduras y frutos cultivables (Talhinhas et al. 2005). C. gloeosporioides afecta a los cultivos de mora (Rubus glaucus Benth.) (Rueda-Hernández et al. 2013), aguacate (Persea americana Mill.) (Giblin et al. 2010, Guetsky et al. 2005), mango (Mangifera indica L.) (Giblin et al. 2010, Serra et al. 2011), ñame (Dioscorea spp.) (Raj et al. 2013, Abang et al. 2004), entre otros.
La implementación de fungicidas para el control de enfermedades en los cultivos se ha convertido en una práctica común en muchos lugares del mundo (Chen et al. 2001), pero la exposición a estos compuestos se les han atribuido efectos negativos en la salud como neurotoxicidad crónica y aguda, así como la aparición de varios tipos de cáncer (Weisenburger 1993), sin mencionar los problemas medioambientales que ellos ocasionan. Para el control en campo de Colletotrichum spp. así como otros hongos fitopatógenos, se suele emplear fungicidas de tipo benzimidazol como el Benomil; sin embargo el rápido desarrollo de cepas resistentes a este compuesto ha limitado su amplio uso (Nakaune & Nakano 2007). Por lo anterior, se hace necesario la implementación de otro tipo de sustancias para combatir las enfermedades en los cultivos.
Muchos compuestos químicos obtenidos de organismos vivos son empleados como agentes de protección de cultivos agrícolas (Copping & Duke 2007), observándose el incremento en su uso en los últimos años (Sette-de-Souza et al. 2014, Copping & Duke 2007). Dentro de los productos naturales se encuentran los aceites esenciales, los cuales ejercen diferentes actividades biológicas, las cuales incluyen su potencial antibacteriano y antifúngico (Anaruma et al. 2010). Los aceites esenciales de plantas representan una alternativa fitoterapéutica, porque actúan como pesticidas de riesgo reducido en el control integrado de enfermedades fúngicas (Palhano et al. 2004).
Una de las plantas productoras de aceites esenciales corresponde a Lippia alba (Mill.) N.E. Br. ex Britton & P. Wilson. Esta planta es un arbusto perteneciente a la familia Verbenaceae originaria de los Andes (Chile-Perú), y se le puede encontrar en las regiones tropicales y subtropicales de Centro, Suramérica y las islas del Caribe (Manica-Cattani et al. 2009) y es ampliamente usada en las dos primeras zonas para diferentes propósitos (Glamočlija et al. 2011). Su aceite esencial es producido principalmente en sus hojas a través del metabolismo secundario de la planta (Blank et al. 2015).
Al aceite esencial de L. alba se le han atribuido propiedades antifúngicas (Shukla et al. 2009, Geromini et al. 2015), antibacterianas (Veras et al. 2011, Lima et al. 2015), insecticidas (Shukla et al. 2011, Vera et al. 2014) y viricidas (Ocazionez et al. 2010, Meneses et al. 2009). Algunos autores han reportado la actividad antifúngica contra C. gloeosporioides del aceite esencial de L. alba (Anaruma et al. 2010, Rozwalka et al. 2008) al igual que el de otras especies dentro del género Lippia (Regnier et al. 2008, Regnier et al. 2010).
Por lo tanto, el objetivo de este estudio fue hacer una caracterización química del aceite esencial de L. alba y comprobar su actividad fungicida contra C. gloeosporioides para ser utilizado en un futuro como un fungicida biológico.
Materiales y métodos
Recolección y procesamiento del material vegetal.- Las plantas de L. alba fueron recolectadas de forma manual en el mes de octubre-diciembre de 2014 en la Universidad de Sucre- Sede Puerta Roja ubicada en el Municipio de Sincelejo- Sucre- Colombia a los 9°18’55.193”N y 75°23’20.894”W.
La identificación de esta planta fue realizada en el Herbario de la Universidad de Sucre y un ejemplar fue conservado bajo el registro Voucher N° 000830. Las muestras fueron conservadas en sacos de polietileno, y puestas en un lugar limpio y libre de humedad hasta su procesamiento (Arango et al. 2015). Luego se tomaron las hojas, se seleccionaron y se lavaron con agua de grifo; y finalmente fueron troceadas para someterlas al proceso de extracción de sus aceites.
Obtención del aceite esencial foliar.- Mediante el método de hidrodestilación asistida por microondas (MWHD) se obtuvo el aceite esencial foliar de L. alba y para ello, se usó un equipo de hidrodestilación con capacidad para 2 L (balón de destilación). Se tomaron aproximadamente 300 g de material vegetal y fueron introducidos en el balón de extracción junto con 250 mL de agua destilada. Como fuente de radiación microondas se empleó un horno convencional (Panasonic ANE61424LO4G), y el material vegetal se sometió a un tiempo de extracción de 30 minutos divididos en 3 ciclos de 10 minutos cada uno. El aceite esencial se recuperó en un recipiente tipo Dean Stark, y se separó por decantación e inmediatamente fue almacenado a 4 °C en un vial ámbar de 4 mL hasta su uso.
Caracterización química del aceite esencial.- Se efectuó mediante una Cromatografía de Gases acoplada a Espectrometría de Masa (GC/MS), utilizando un equipo de cromatografía de gases Agilent 6890N acoplado a un detector selectivo de masa Agilent 5973N. Los índices de Kóvats se determinaron en una columna capilar ligeramente polar DB_5MS longitud de 30 m x320 μm x0.5 μm. El gas de arrastre usado fue Helio con una presión de 0.27 psi y un promedio de velocidad de flujo de 40 cm/s. La temperatura inicial del horno fue de 150 °C y la final de 350 °C. La temperatura del inyector fue de 250 °C y la del detector fue de 300 °C. La identidad de los componentes se asignó por comparación del espectro de masas obtenido experimentalmente para cada componente con los reportados en las bases de datos de NIST98.L, NIST02.L, NIST5a.L. y Demo.L.
Evaluación in vitro de la actividad antifúngica del aceite esencial foliar.- Ésta se realizó utilizando una cepa de C. gloeosporioides, identificada y donada por la Universidad de los Andes sede Bogotá, Colombia. Este aislado se activó en medio de cultivo papa dextrosa agar (PDA) durante 5 días, y de allí se tomaron discos de la periferia del micelio (donde hay crecimiento activo del hongo) (Phoulivong et al. 2010) de aproximadamente 6 mm de diámetro, los cuales fueron sembrados sobre la superficie del medio PDA enriquecido con cloranfenicol, ampicilina y rifampicina, para minimizar la contaminación por bacterias en el medio. A estos inóculos se les adicionó directamente 30 μL de aceite esencial de L. alba disuelta en acetona a 500, 1000, 3000 y 10000 ppm; se utilizó un control positivo con Benomil (1 g/L) y un testigo absoluto sin ningún tipo de tratamiento. Los ensayos se incubaron durante 8 días a 30 °C con un fotoperiodo de 12:12 horas (luz: oscuridad).
La actividad antifúngica se evaluó midiendo el crecimiento radial de cada aislado con las diferentes concentraciones después del día octavo, usando un calibrador Vernier (±0.05 mm). El resultado se interpretó como porcentaje de índice antifúngico:
% I.A= [1 ‒ (Da / Db)] x 100
Donde Da corresponde al crecimiento de cada tratamiento y Db al crecimiento del testigo absoluto (Guo et al., 2008). Para determinar la eficiencia del aceite, se restó el %I.A del control negativo (acetona) al %I.A de cada aceite esencial y se comparó con el control positivo.
Análisis estadístico.- Todos los análisis fueron realizados en el software R v3.2.0 (R Development Core Team 2008). Cada tratamiento se realizó por triplicado, bajo un diseño completamente al azar. Se empleó la prueba de Shapiro Wilk para verificar la normalidad de los datos, y luego se usaron test no paramétricos como la prueba H de Kruskal Wallis y el Test post hoc de Bonferroni/Dunn para las diferencias entre las medianas de los tratamientos.
Resultados y discusión
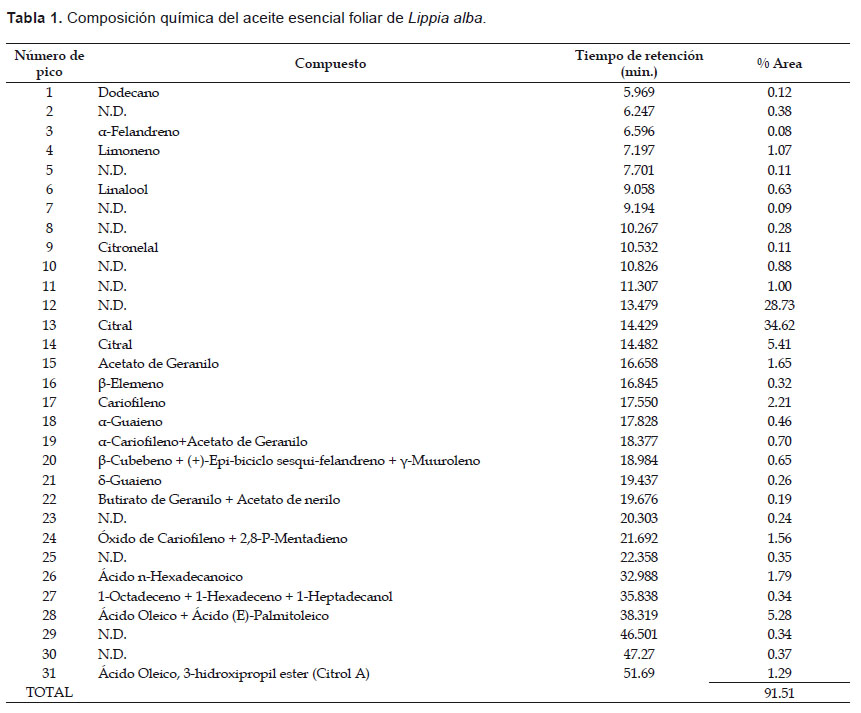
Composición química del aceite esencial de L. alba.- El componente mayoritario en el aceite esencial foliar de L. alba corresponde al Citral a concentración entre 34.62% a 40.03%. Otro metabolito el cual no fue identificado obtuvo la segunda mayor concentración (28.73%), seguido por el Ácido Oleico + Ácido (E)-Palmitoleico (5.28%) y Cariofileno (2.21%) (Tabla 1). Otros estudios han reportado a los isómeros del citral como componentes mayoritarios: Glamočlija et al. (2011) (geranial 50.94% y neral 33.32%), López et al. (2011) (33% geranial y 25% neral), Mesa-Arango et al. (2009) (23.6% neral y 30.5% geranial), Shukla et al. (2009) (geranial 22.2%y neral 14.2%).
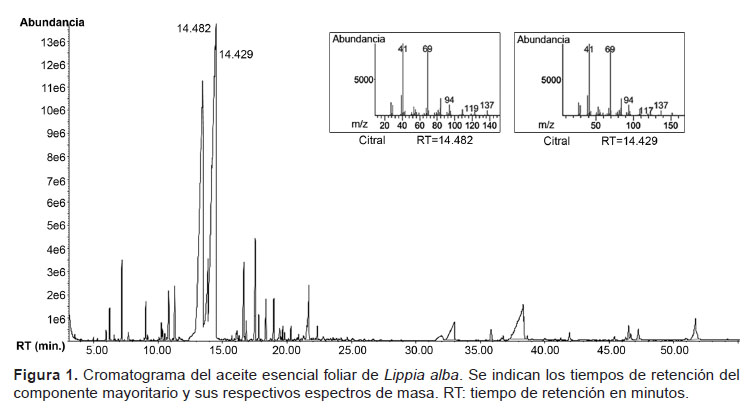
Además del citral, también se han reportado otros metabolitos como los compuestos mayoritarios en el aceite esencial de L. alba: Carvona 51% (Meneses et al. 2009), Linnalol 76.30% (Anaruma et al. 2010), Carvona 25.3% (Mesa-Arango et al. 2009), Limoneno 43.6% (Senatore & Rigano 2001). Son muchos los factores que afectan la presencia y cantidad de los metabolitos presentes en estos aceites esenciales, entre los cuales incluyen: las variaciones fisiológicas, las condiciones ambientales, las variaciones geográficas, los factores genéticos y la evolución, las condiciones sociales y políticas de la zona de muestreo; y, la cantidad de material vegetal/espacio y las necesidades de mano de obra (Figueiredo et al. 2008). El perfil cromatográfico del aceite esencial de L. alba se puede observar en la Figura 1.
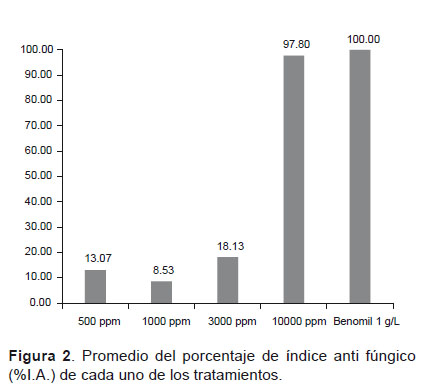
Evaluación de la actividad antifúngica contra C. gloeosporioides.- Se presentó la mayor inhibición en el tratamiento con el aceite esencial de L. alba a una concentración de 10000 ppm (97.8%) seguido por la concentración de 3000 ppm (18.13%), 500 ppm (13.07%) y por último 1000 ppm (8.53%) (Fig. 2). Los efectos de la concentración de 10000 ppm del aceite esencial de L. alba sobre C. gloeosporioides presentó efectos similares con la actividad mostrada en el control positivo, Benomil (100%) (Fig. 3).
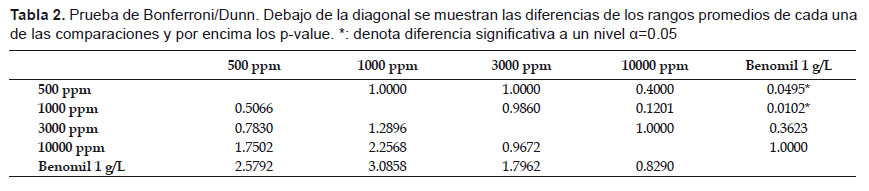
Los datos arrojados por el presente estudio mostraron anormalidad entre ellos (p<0.001), y con la prueba de Kruskal Wallis se demostró diferencia significativa entre las medianas de los tratamientos (p<0.05). Al comparar los tratamientos por parejas mediante la prueba de Bonferroni/Dunn (Tabla 2) solamente se encontraron diferencias significativas entre las medianas del control positivo (Benomil 1 g/L) con los tratamientos del aceite esencial a 500 y 3000 ppm, es decir, aquellos a 10000 y 3000 ppm estadísticamente son similares al control positivo.
Otros estudios han reportado la actividad del aceite esencial de L. alba contra C. gloeosporioides. Anaruma et al. (2010) reportaron una concentración mínima inhibitoria a 0.3 mg/mL y Rozwalka et al. (2008) un porcentaje de inhibición del micelio entre 70.8% – 15.7% desde el día tercero al décimo. Para otras especies del género Lippia se ha encontrado el potencial antifúngico de sus aceites esenciales, por ejemplo, L. scaberrima a una concentración de 2000 μL/L inhibió significativamente el crecimiento de C. gloeosporiodes (Regnier et al. 2010); y a 2400 μL/L lo inhibió en un 100% (Regnier et al. 2008).
La actividad fungicida encontrada en el aceite esencial de L. alba puede deberse principalmente por la acción del componente mayoritario encontrado: el citral. Por lo general, la acción inhibitoria del citral, al igual que componentes relacionados como el citronelal (encontrado a una concentración de 0.11%) y el α-pineno, se ve reflejado en la granulación del citoplasma, ruptura de la membrana celular e inactivación o inhibición de la síntesis de enzimas intra y extracelulares (García et al. 2008).
La efectividad a altas concentraciones del aceite esencial foliar de L. alba para inhibir el crecimiento de C. gloeosporioides podria atribuirse principalmente a la volatilización de los constituyentes de los aceites y/o inestabilidad en presencia de aire, la luz, el calor, la humedad y metales (Simões & Spitzer 2000), lo cual modifica la atmósfera del interior de las cajas de Petri (Rozwalka et al. 2008).
Literatura citada
Abang M.M., P. Hoffmann, S. Winter, et al. 2004. Vegetative Compatibility Among Isolates of Colletotrichum gloeosporioides from Yam (Dioscorea spp.) in Nigeria. Journal of Phytopathology 152(1):21–27. http://dx.doi.org/10.1046/j.14390434.2003.00795.x [ Links ]
Anaruma N.D., F.L. Schmidt, M.C. Teixeira, et al. 2010. Control of Colletotrichum gloeosporioides (penz.) Sacc. In yellow passion fruit using Cymbopogon citratus essential oil. Brazilian Journal of Microbiology 41:66–73. http://dx.doi. org/10.1590/S1517-83822010000100012 [ Links ]
Arango Ó., A.M. Hurtado, D. Pantoja, et al. 2015. Actividad inhibitoria del aceite esencial de Lippia origanoides H.B.K sobre el crecimiento de Phytophthora infestans. Acta Agronómica 64(2):116–124. http://dx.doi.org/10.15446/ acag.v64n2.42964 [ Links ]
Blank A.F., L.C. Alves, M.D.F. Arrigoni-Blank, et al. 2015. Chemical Diversity in Lippia alba (Mill.) N. E. Brown Germplasm. The Scientific World Journal 2015:1–11. http://dx.doi. org/10.1155/2015/321924 [ Links ]
Bussaman P., P. Namsena, P. Rattanasena, et al. 2012. Effect of crude leaf extracts on Colletotrichum gloeosporioides (Penz.) Sacc. Psyche 2012:1-6. http://doi.org/10.1155/2012/309046 [ Links ]
Chen S.K., C.A. Edwards & S. Subler. 2001. Effects of the fungicides benomyl, captan and chlorothalonil on soil microbial activity and nitrogen dynamics in laboratory incubations. Soil Biology & Biochemistry 33:1971–1980. doi:10.1016/ S0038-0717(01)00131-6 [ Links ]
Copping L.G. & S.O. Duke. 2007. Natural products that have been used commercially as crop protection agents. Pest Management Science 63(6):524–554. http://dx.doi.org/10.1002/ps.1378 [ Links ]
Figueiredo A.C., J.G. Barroso, L.G. Pedro, et al. 2008. Factors affecting secondary metabolite production in plants: volatile components and essential oils. Flavour and fragrance journal 23:213–226. http://dx.doi.org/10.1002/ffj.1875 [ Links ]
Garcia R., E.S.S. Alves, M.P. Santos, et al. 2008. Antimicrobial activity and potential use of monoterpenes as tropical fruits preservatives. Brazilian Journal of Microbiology 39(1):163–8. http:// doi.org/10.1590/S1517-838220080001000032 [ Links ]
Geromini K.V.N., F.B. Roratto, F.G. Ferreira, et al. 2015. Fungicidal effect of Lippia alba essential oil on a white-rot fungus. Maderas. Ciencia y Tecnología 17(1):29–38. http://doi. org/10.4067/S0718-221X2015005000003 [ Links ]
Giblin F.R., L.M. Coates & J.A.G. Irwin. 2010. Pathogenic diversity of avocado and mango isolates of Colletotrichum gloeosporioides causing anthracnose and pepper spot in Australia. Australasian Plant Pathology 39(1):50–62. http://doi. org/10.1071/AP09055 [ Links ]
Glamočlija J., M. Soković, V. Tešević, G.A. Linde, et al. 2011. Chemical characterization of Lippia alba essential oil: an alternative to control green molds. Brazilian Journal of Microbiology 42:1537–1546. http://doi.org/10.1590/ S1517-838220110004000041 [ Links ]
Guetsky R., I. Kobiler, X. Wang, et al. 2005. Metabolism of the Flavonoid Epicatechin by Laccase of Colletotrichum gloeosporioides and Its Effect on Pathogenicity on Avocado Fruits. Phytopathology 95(11):1341–1348. http://doi.org/10.1094/PHYTO-95-1341 [ Links ]
Guo Z., R. Xing, S. Liu, et al. 2007. The influence of the cationic of quaternized chitosan on antifungal activity. International Journal of Food Microbiology, 118(2):214–217. http://doi.org/10.1016/j.ijfoodmicro.2007.07.003 [ Links ]
Lima P.J., A.M. Lucchese, R. Gambari, et al. 2015. Essential oils and isolated compounds from Lippia alba leaves and flowers: Antimicrobial activity and osteoclast apoptosis. International Journal of Molecular Medicine 35:211-217. http://dx.doi.org/10.3892/ijmm.2014.1995 [ Links ]
López M.A., E.E. Stashenko & J.L. Fuentes. 2011. Chemical composition and antigenotoxic properties of Lippia alba essential oils. Genetics and Molecular Biology 34(3):479–488. http:// doi.org/10.1590/S1415-47572011005000030 [ Links ]
Manica-Cattani M., J. Zacaria, G. Pauletti, et al. 2009. Genetic variation among South Brazilian accessions of Lippia alba Mill. (Verbenaceae) detected by ISSR and RAPD markers. Brazilian Journal of Biology 69(2):375–380. http://dx.doi. org/10.1590/S1519-69842009000200020 [ Links ]
Meneses R., R.E. Ocazionez, J.R. Martínez, et al. 2009. Inhibitory effect of essential oils obtained from plants grown in Colombia on yellow fever virus replication in vitro. Annals of Clinical Microbiology and Antimicrobials 8(8):1–6. http:// doi.org/10.1186/1476-0711-8-8 [ Links ]
Mesa-Arango A.C., J. Montiel-Ramos, B. Zapata, et al. 2009. Citral and carvone chemotypes from the essential oils of Colombian Lippia alba (Mill.) N.E. Brown: composition, cytotoxicity and antifungal activity. Memórias Do Instituto Oswaldo Cruz 104(6):878–884. http://dx.doi.org/10.1590/ S0074-02762009000600010 [ Links ]
Nakaune R., & M. Nakano. 2007. Benomyl resistance of Colletotrichum acutatum is caused by enhanced expression of b -tubulin 1 gene regulated by putative leucine zipper protein CaBEN1. Fungal Genetics and Biology 44:324–1335. http://doi.org/10.1016/j.fgb.2007.03.007 [ Links ]
Nesher I., A. Minz, L. Kokkelink, et al. 2011. Regulation of pathogenic spore germination by cgrac1 in the fungal plant pathogen colletotrichum gloeosporioides. Eukaryotic Cell 10(8):1122–1130. http://doi.org/10.1128/EC.00321-10 [ Links ]
Ocazionez R. E., R. Meneses, F.Á. Torres, et al. 2010. Virucidal activity of Colombian Lippia essential oils on dengue virus replication in vitro. Memórias Do Instituto Oswaldo Cruz 105(3):304–309. http://dx.doi.org/10.1590/S0074- 02762010000300010 [ Links ]
Palhano F.L., T.T.B Vilches, R.B. Santos, et al. 2004. Inactivation of Colletotrichum gloeosporioides spores by high hydrostatic pressure combined with citral or lemongrass essential oil. International Journal of Food Microbiology 95(1): 61–66. http://doi.org/10.1016/j.ijfoodmicro.2004.02.002 [ Links ]
Phoulivong S., L. Cai, H. Chen, et al. 2010. Colletotrichum gloeosporioides is not a common pathogen on tropical fruits. Fungal Diversity 44(1):33–43. http://doi.org/10.1007/ s13225-010-0046-0 [ Links ]
R Development Core Team (2008). R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. ISBN 3-900051-07-0, URL http://www.R-project.org. [ Links ]
Raj M., V. Hegde, M.L. Jeeva, et al. 2013. Molecular diagnosis of Colletotrichum gloeosporioides causing Anthracnose/Dieback disease in Greater Yam (Dioscorea alata L.). Archives of Phytopathology and Plant Protection 46(8):927–936. http://doi.org/10.1080/03235408.2012.755336 [ Links ]
Regnier T., S. Combrinck, W. du Plooy, et al. 2010. Evaluation of Lippia scaberrima essential oil and some pure terpenoid constituents as postharvest mycobiocides for avocado fruit. Postharvest Biology and Technology 57(3):176–182. http:// doi.org/10.1016/j.postharvbio.2010.03.010 [ Links ]
Regnier T., W. du Plooy, S. Combrinck, et al. 2008. Fungitoxicity of Lippia scaberrima essential oil and selected terpenoid components on two mango postharvest spoilage pathogens. Postharvest Biology and Technology 48(2):254–258. http:// doi.org/10.1016/j.postharvbio.2007.10.011 [ Links ]
Rozwalka L.C., M.L.R.Z. Da Costa, L.L. May de Mio, et al. 2008. Extratos, decoctos e óleos essenciais de plantas medicinais e aromáticas na inibição de Glomerella cingulata e Colletotrichum gloeosporioides de frutos de goiaba. Ciência Rural 82(2):301–307. http://dx.doi.org/10.1590/S0103- 84782008000200001 [ Links ]
Rueda-Hernández K.R., A. Saldarriaga, G.E. Cadavid-Restrepo, et al. 2013. Differential Organ Distribution, Pathogenicity and Benomyl Sensitivity of Colletotrichum spp. from Blackberry Plants in Northern Colombia. Journal of Phytopathology 116(4):246–253. http://doi.org/10.1111/jph.12040 [ Links ]
Senatore F. & D. Rigano. 2001. Essential oil of two Lippia spp. (Verbenaceae) growing wild in Guatemala. Flavour and Fragrance Journal 16:169–171. DOI: 10.1002/ffj.972 [ Links ]
Serra I.M.R.D.S., M. Menezes, R.S.B. Coelho, et al. 2011. Molecular analysis in the differentiation of Colletotrichum gloeosporioides isolates from the cashew and mango trees. Brazilian Archives of Biology and Technology, 54(6):1099–1108. http://doi.org/10.1590/S1516-89132011000600004 [ Links ]
Sette-de-Souza P.H., S.E. do Rego Carneiro, M.R. Macedo-Costa, et al. 2014. Antibacterial activity and phytochemical screening of extracts of Lippia alba (Mill). NE Brown. African Journal of Microbiology Research 8(29):2783–2787. http://doi. org/10.5897/AJMR2014.6791 [ Links ]
Shukla R., A. Kumar, P. Singh & N. Kishore. 2009. Efficacy of Lippia alba (Mill.) N.E. Brown essential oil and its monoterpene aldehyde constituents against fungi isolated from some edible legume seeds and aflatoxin B1 production. International Journal of Food Microbiology 135(2):165–170. http://doi. org/10.1016/j.ijfoodmicro.2009.08.002 [ Links ]
Shukla R., P. Singh, B. Prakash, et al. 2011. Efficacy of essential oils of Lippia alba (Mill.) N.E. Brown and Callistemon lanceolatus (Sm.) Sweet and their major constituents on mortality, oviposition and feeding behaviour of pulse beetle, Callosobruchus chinensis L. Journal of the Science of Food and Agriculture 91(12):2277–2283. DOI: 10.1002/jsfa.4453 [ Links ]
Simões C.M.O. & V. Spitzer. 2000. Óleos voláteis. In: Simões C.M.O. et al. Farmacognosia: da planta ao medicamento. Porto Alegre/Florianópolis: UFRGS/UFSC. Cap.18. [ Links ]
Talhinhas P., S. Sreenivasaprasad & H. Oliveira. 2005. Molecular and Phenotypic Analyses Reveal Association of Diverse. Applied and Environmental Microbioloy 71(6):2987–2998. http:// doi.org/10.1128/AEM.71.6.2987 [ Links ]
Vera S.S., D.F. Zambrano, S.C. Méndez-Sanchez, et al. 2014. Essential oils with insecticidal activity against larvae of Aedes aegypti (Diptera: Culicidae). Parasitology Research 113(7):2647– 2654. http://doi.org/10.1007/s00436-014-3917-6 [ Links ]
Veras H.N.H., A.R. Campos, F.F.G. Rodrigues, et al. 2011. Enhancement of the antibiotic activity of erythromycin by volatile compounds of Lippia alba (Mill.) N.E. Brown against Staphylococcus aureus. Pharmacognosy Magazine 7(28):334–337. DOI: 10.4103/0973-1296.90415 [ Links ]
Weisenburger D.D. 1993. Human health effects of agrichemical use. Human Pathology 24(6):571–576. http://doi. org/10.1016/0046-8177(93)90234-8 [ Links ]
Fuentes de financiamiento: Grupo de investigación en Bioprospección Agropecuaria perteneciente a la Universidad de Sucre. Sincelejo- Colombia.
Información sobre los autores:
APC, LCA: realizaron el diseño experimental; DVR realizó la extracción del aceite esencial y el análisis cromatográfico; DVR: realizó los ensayos in vitro, realizó el análisis estadístico y redactó el manuscrito; ALP; LCA supervisaron todas las actividades; APC, LCA, DVR: revisaron y aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Presentado: 25/07/2016
Aceptado: 20/02/2017
Publicado online: 20/07/2017