Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.24 no.3 Lima set./dic. 2017
http://dx.doi.org/10.15381/rpb.v24i3.13911
NOTA CIENTÍFICA
Multiplicación in vitro y embriogénesis somática de Perezia pinnatifida (Asteraceae) planta medicinal andina
In vitro multiplication and somatic embryogenesis of Perezia pinnatifida (Asteraceae) medicinal Andean plant
Percy Olivera-Gonzales, Rosa Espinoza del Río, Carmen Tamariz-Angeles*
Laboratorio de Biología, Universidad Nacional Santiago Antúnez de Mayolo (UNASAM), Av. Centenario 200, Huaraz-Ancash, Perú.
* Autor para correspondencia
E-mail Percy Olivera-Gonzales: poliverag@unasam.edu.pe
E-mail Rosa Espinoza del Río: blancax7912@hotmail.com
E-mail Carmen Tamariz-Angeles: ctamariz@unasam.edu.pe
Resumen
Se presentan los procedimientos para la propagación in vitro de Perezia pinnatifida (Humb. & Bonpl.) Wedd., conocida como "valeriana". Se utilizaron las metodologías de multiplicación de brotes y embriogénesis somática indirecta. El medio de cultivo basal para todas las etapas fue Murashige y Skoog a mitad de sales, suplementado con sacarosa 2.0%, phytagel 0.3% y pH 5.67; y fue usado con o sin fitohormonas en los diferentes tratamientos. Los suplementos hormonales fueron: para la multiplicación de brotes BAP 1.0 mg.L-1 + ANA 0.01 mg.L-1 ó BAP 1.0 mg.L-1; para la inducción de callos embriogénicos ANA ó 2,4-D (1.0 mg.L-1 y 2.0 mg.L-1); y para la germinación de embriones BAP (0.5 y 1.0 mg.L-1) o BAP 0.5 mg.L-1 + ANA 0.05 mg.L-1. El mayor número de brotes se obtuvo en el medio suplementado con BAP 1.0 mg.L-1. En la embriogénesis somática, ANA a 1.0 mg.L-1 indujo mayor área de callos embriogénicos, y BAP a 0.5 mg.L-1 permitió mayor germinación de los embriones somáticos.
Palabras clave: Planta medicinal; Micropropagación, embrión somático; Cultivo de tejidos vegetales; propagación clonal.
Abstract
This work inform on in vitro propagation of the "valeriana" Perezia pinnatifida (Humb. & Bonpl.) Wedd. Shoot multiplication and indirect somatic embryogenesis methodologies were performed. The basal culture medium for all stages was Murashige and Skoog, middle of salts supplemented with 2.0% sucrose, 0.3% phytagel and pH 5.67; the treatments were prepared with or without phytohormones. The hormonal supplements for the shoot multiplication were: BAP 1.0 mg.L-1 + ANA 0.01 mg.L-1, and BAP 1.0 mg.L-1; for embryogenic callus induction were: ANA or 2,4-D (1.0 mg.L-1 and 2.0 mg.L-1); and for the embryo germination were: BAP (0.5 and 1.0 mg.L-1) or BAP 0.5 mg.L-1 + ANA 0.05 mg.L-1. BAP 1.0 mg.L-1 produced the higher number buds. For somatic embryogenesis, ANA 1.0 mg.L-1 induced a greater area of embryogenic callus, and BAP 0.5 mg.L-1 allowed major germination of the somatic embryos.
Keywords: Medicinal plant; Micropropagation; Somatic embryo; Plant tissue culture; clonal propagation.
Introducción
Las herramientas biotecnológicas que involucran el cultivo in vitro son de gran importancia como técnicas de conservación ex situ (Barnicoat et al. 2011) porque pueden ser aplicadas para conseguir una propagación rápida y masiva de especies de plantas de interés, como aquellas en riesgo de extinción, endémicas, raras, medicinales, entre otras (Shekhawat et al. 2015); así mismo provee ADN para estudios moleculares, plántulas para estudios ecológicos y material para usos económicos (Sarasan et al. 2006). Entre estas técnicas se encuentran la micropropagación, embriogénesis somática, organogénesis y criopreservación (Khan et al. 2012).
La micropropagación puede ser usada con un enfoque de conservación, permitiendo obtener numerosas plantas libres de patógenos y virus, en tiempos cortos y espacios reducidos (Khan et al. 2012). Por otro lado, la embriogénesis somática, permite regenerar plantas completas, y es ampliamente usada por la biotecnología y estudios en embriología (Su & Zhang 2009); su principal ventaja es la producción de numerosas plantas a partir de una célula y permite la evaluación, tamizaje (Khan et al. 2012) y mejoramiento genético (Das et al. 2002). En estas técnicas, la regeneración dependerá del tipo de explante, concentración y combinación de reguladores de crecimiento y nutrientes (Khan et al. 2012).
En este contexto, Perezia pinnatifida conocida como "valeriana", "china valeriana", "sacha margarita", "sotuma" y "sutuma", es una hierba acaule, que habita en laderas rocosas, pastizales y pajonales de los Andes y punas del Perú entre los 3300 y 5000 m de altitud. Su distribución se extiende hasta el noroeste de Argentina y norte de Chile (Cano et al. 2011, Katinas 2012, Montesinos 2012). En medicina tradicional, sus raíces y rizomas son utilizadas por sus efectos sedantes, diuréticos y diaforéticos (De La Cruz et al. 2007, Katinas 2012). Al igual que muchas plantas herbáceas andinas esta especie es colectada de su estado silvestre con sus raíces y flores para ser comercializada en las mercados o ferias populares, de tal modo que su alta demanda la coloca en riesgo de sobreexplotación (De la Cruz et al. 2007).
En el presente trabajo se informa acerca del cultivo in vitro de P. pinnatifida mediante la multiplicación de brotes y embriogénesis somática indirecta. Este trabajo constituye el primer reporte de propagación de esta especie.
Materiales y métodos
Material vegetal. Las plantas de Perezia pinnatifida (Humb. & Bonpl.) Wedd. fueron compradas en la feria de plantas medicinales de la ciudad de Huaraz. La identificación botánica y deposito se realizó en el Herbario David Smith de la Universidad Nacional Santiago Antúnez de Mayolo (UNASAM).
Desinfección de las yemas. Las plantas fueron limpiadas y se obtuvieron yemas apicales con 3 – 4 hojas y 1.0 cm de rizoma. Luego se lavaron en solución jabonosa al 20% por 20 min. y se enjuagó con agua de caño con agitación constante 3 veces por 3 min. La desinfección se realizó bajo condiciones de esterilidad y se usaron: NaClO 3% a 5, 10 y 15 min., y HgCl2 0.1% a 5 y 10 min. Luego las yemas fueron lavadas con agua destilada estéril tres veces por 2 minutos. El material desinfectado fue colocado en tubos de 25 mm de diámetro conteniendo 2.0 mL de agua peptonada estéril 0.1% (p/v) y pH 5.7. Se utilizaron 40 plantas por tratamiento. A los 7 días de cultivo se calculó el porcentaje de desinfección y sobrevivencia en cada tratamiento.
Establecimiento de las yemas. Las yemas que no mostraron síntomas de contaminación fueron trasladadas al medio Murashige y Skoog a mitad de sales (MS 1/2, Sigma), suplementado con sacarosa 2% y phytagel 0.3% y pH 5.7. Las condiciones ambientales fueron: fotoperiodo de 16 horas luz y temperatura ambiental (16 – 22 ºC). El establecimiento fue de 15 días. El medio descrito se usó en todas las etapas con la adición de fitohormonas según el caso, y las condiciones ambientales descritas fueron las mismas en todas las etapas. Multiplicación de brotes.Las yemas establecidas y sin contaminantes fueron trasladadas al medio de cultivo consideradas en el establecimiento con la adición de fitohormonas. Se prepararon tres tratamientos: libre de fitohormona, BAP 1.0 mg.L-1 + ANA 0.01 mg.L-1, y BAP 1.0 mg.L-1. Se usaron 20 yemas por tratamiento. Se evaluó la formación de brotes a los 45 días.
Inducción de formación callos. Se utilizaron brotes de P. pinnatifida de 20 a 30 mm de longitud obtenidas de la multiplicación in vitro. Previo a la inducción, los brotes estuvieron en medio libre de hormonas por 30 días. Para inducir la formación de callos embriogénicos se prepararon cinco tratamientos: libre de hormona, ANA 1.0 y 2.0 mg.L-1 y 2.4-D 1 y 2 mg.L-1. Se sembraron 4 brotes por magenta con 15 mL de medio de cultivo y por cada tratamiento se usaron 10 magentas. El cultivo fue a condiciones ambientales indicadas en el establecimiento. La presencia y área de callo se evaluó a los 30 días.
Proliferación de embriones somáticos. Los brotes inducidos fueron transferidos a medio libre de hormonas y condiciones ambientales indicadas en el establecimiento, a los 15 días se les cortaron las hojas y fueron trasladados nuevamente a un medio libre de hormonas. La presencia y área de callo en estas condiciones se evaluó cada 30 días.
Maduración y germinación de embriones somáticos. Los callos embriogénicos obtenidos en la etapa anterior fueron transferidos a medios basales nuevos suplementados con BAP a 0.5 y 1.0 mg.L-1; BAP 0.5 mg.L-1 + ANA 0.05 mg.L-1. Se transfirió un callo por cada magenta con 15 mL de medio, y se realizaron 10 repeticiones por tratamiento. El cultivo se realizó a las condiciones ambientales antes establecidas y se evaluó el área del callo y la cantidad de embriones germinados a los 45 días.
Análisis estadísticos. En todas las etapas se usó el Diseño Completamente al Azar (DCA). Se calcularon medias y desviaciones estándar por tratamiento. También se aplicó el análisis de varianza ANOVA y las pruebas de comparación de medias de Duncan entre tratamientos con un nivel de significancia p < 0.05.
Resultados
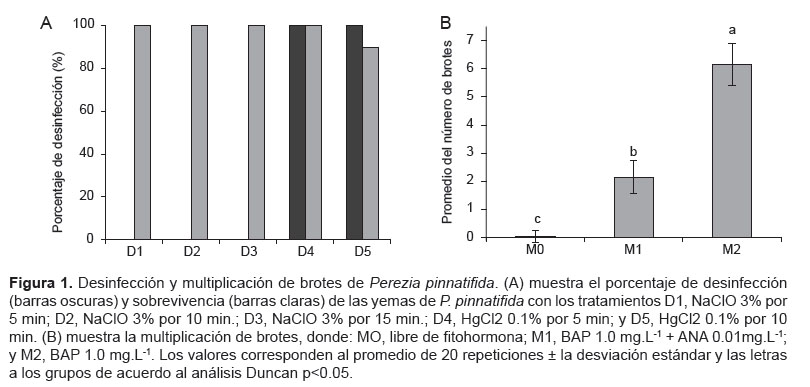
Desinfección de las yemas. El dicloruro de mercurio (HgCl2) al 0.1% fue el único compuesto que logró desinfectar las yemas de P. pinnatifida, obteniéndose 100% de desinfección a 5 y 10 min. de exposición con porcentajes de supervivencia de 100 y 90% respectivamente. Por lo tanto, el tratamiento con HgCl2 0.1% por 5 min. fue el mejor tratamiento de desinfección (Fig. 1A).
Multiplicación de brotes. En el proceso de multiplicación de brotes de P. pinnatifida, el tratamiento con BAP 1,0 mg.L-1 produjo la mayor cantidad de brotes (6.2 ±0.7 por yema) respecto a los otros tratamientos (Fig. 1B y Fig. 5).
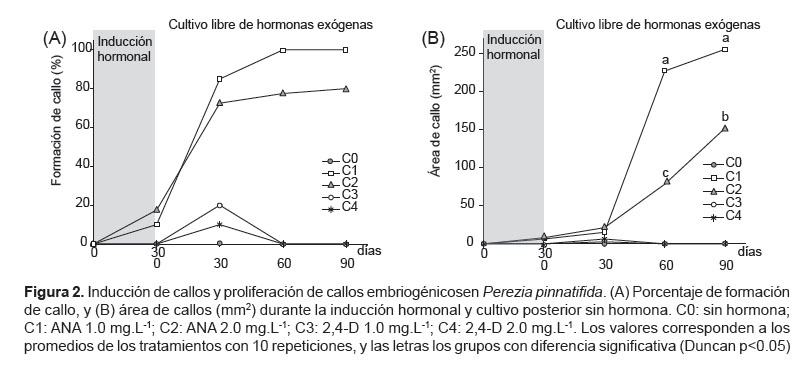
Inducción de callos y proliferación embriones somáticos. Como se observa en la Figura 2A, a 30 días de exposición hormonal sólo los explantes en los medios con ANA 1 y 2 mg L-1 mostraron una ligera formación de callos con porcentaje de 10 y 17% respectivamente. Sin embargo, durante la proliferación de embriones en medio libre de hormonas, todas las muestras provenientes del tratamiento con ANA 1 mg L-1 formaron callos a los 90 días de iniciado la inducción; así mismo entre los 60 y 120 días los callos crecieron hasta alcanzar un área promedio de 255.8 ± 78.5 mm2 (Fig. 2B); así mismo se observaron callo friable y callo embriogénico con las fases globular, corazón y torpedo (Fig. 6D).
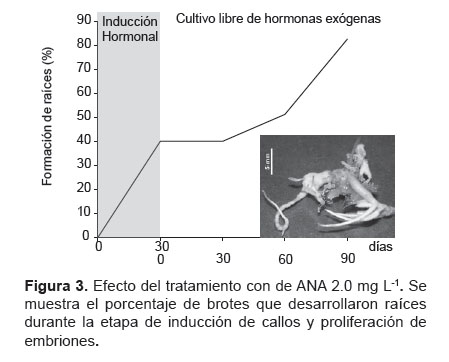
En el caso de las muestras del tratamiento con ANA 2.0 mg L-1, se observó la formación acelerada de callos hasta los 60 días iniciada la inducción (72.5%), y entre los 60 y 120 días aumentó ligeramente el área, obteniéndose a los 120 días sólo el 84% de muestras con callo con 152.2 ± 37.0 mm2 de área (Fig. 2B). Sin embargo, este tratamiento indujo el desarrollo de raíces (Fig. 3).
Maduración y germinación de los embriones somáticos. Para esta etapa se seleccionaron los callos embriogénicos hasta la fase torpedo del medio libre de hormonas y provenientes del tratamiento de inducción con ANA 1.0 mg.L-1 porque los callos con ANA 2 mg L-1 formaron raíces (Fig. 2 y Fig. 3), y los provenientes de 2,4-D no desarrollaron callos adecuados y murieron (Fig. 2).
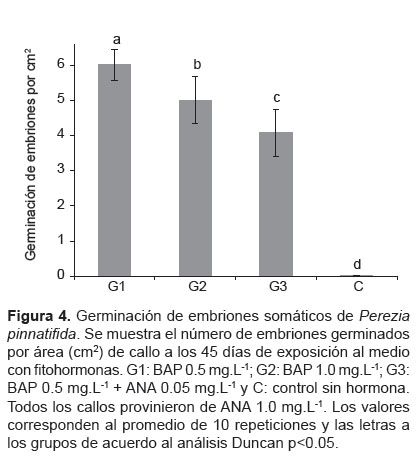
A los 45 días de exposición hormonal se encontró que el medio con BAP 0.5 mg L-1 promovió la maduración y mayor germinación de embriones obteniéndose hasta 6.0 ± 0.4 plántulas por cm de callo (Fig. 4). Las Figuras 6E y 6F se muestra el estado cotiledonar y la plántula luego de la germinación.
Discusión
El cultivo in vitro de tejidos es una herramienta que requiere material libre de microorganismos no solo en la introducción y establecimiento sino también durante la incubación y manipulación de los cultivos (Roca & Mroginski 1993). Por lo tanto, se usan desinfectantes tales como hipoclorito de sodio, hipoclorito de calcio, etanol, dicloruro de mercurio, peróxido de hidrógeno, etc. para eliminar microorganismos superficiales (Borges et al. 2009). El hipoclorito de sodio es el mas usado, pero no fue efectivo en la desinfección de las yemas de P. pinnatifida al 3% con 5, 10 y 15 min. de exposición, aunque mostró 100% de sobrevivencia dejando la posibilidad de incrementar los tiempos de exposición. Por otro lado, el HgCl2, que es menos usado por su alta tóxicidad y difícil remoción durante el enjuague (Roca & Mroginski 1993), a 0.1% por 5 min. mostró 100% de desinfección y sobrevivencia de las yemas. La aplicación de este desinfectante también fue efectiva en yemas de P. coerulescens (Olivera et al. 2010), rizomas de Curcuma longa (Islam et al. 2004), segmentos nodales pilosos de Passiflora foetida (Shekhawat et al. 2015) porque la carga microbiana dependería de la ubicación y tipo de tejido. Adicionalmente, a 10 min. de exposición la sobrevivencia de las yemas de P. pinnatifida decreció (Fig. 1A) porque el dicloruro de mercurio puede fenolizar y dañar los tejidos provocando la muerte de los explantes (Olmos et al. 2004, Espinosa et al. 2005, Royero et al. 2007).
Para la formación de brotes se evaluó la multiplicación en medio libre de hormonas y con la adición exógena de citoquinina (BAP) o la combinación citoquinina-auxina (BAP + ANA). La adición de BAP incrementa la formación de brotes en diversas plantas medicinales (Aslam et al. 2013, Shekhawat et al. 2015, Elamvaluthi et al. 2016); probablemente porque las citoquininas activan a las yemas axilares de los explantos desencadenando la proliferación de brotes (Aremu et al. 2016). En concordancia, la adición de BAP en el cultivo in vitro de P. pinnatifida fue esencial para la multiplicación de brotes, al igual que en Chlorophytum borivilianum (Shekhawat et al. 2015). Por otro lado, en varias especies la adición de BAP + ANA mejoraron la multiplicación de brotes (Farzana et al. 1998, Lara et al. 2003 y Mostofa et al. 2016) y podría deberse a que las citoquininas y las auxinas, además de sus roles específicos, actúan en coordinación regulando el crecimiento y desarrollo de la planta, incluso las auxinas solas o en combinación con citoquininas estimulan la producción de brotes de algunas especies (Aremu et al. 2016). Contrariamente, en P. pinnatifida la combinación de BAP + ANA disminuyó la formación de brotes, tal como también se reporta en P. coerulescens (Olivera et al. 2010).
Por otro lado, la embriogénesis somática de P. pinnatifida se logró en tres etapas: inducción de callo, formación y proliferación de embriones somáticos, maduración y germinación. Los callos son formas indiferenciadas de células y pueden ser inducidos con la aplicación exógena de auxina-citoquinina (Ikeuchi et al. 2013); en el caso de P. pinnatifida se obtuvo callos friables a 30 días de exposición de ANA (1.0 mgL-1). Para la etapa de formación y proliferación de callos, de acuerdo a Su y Zhang (2009) la remoción de la auxina exógena desencadena la acumulación de auxina endógena en los pro-embriones conduciendo al desarrollo de los embriones somáticos. En concordancia, los callos embriogénicos de P. pinnatifida se lograron a los 60 días de la trasferencia de las muestras provenientes de ANA 1.0 mgL-1 al medio libre de hormonas (Fig. 2). Por otro lado, las auxinas también intervienen en la formación de raíces (Sharmin et al. 2014) lo cual explicaría la formación de callos y raíces en el tratamiento con ANA 2.0 mg.L-1 (Fig. 3). En relación al efecto del 2,4-D, que es un compuesto ampliamente usado en la formación de callos (Elamvaluthi et al. 2016, González et al. 2006) porque funciona como auxina a bajas concentraciones; sin embargo contrariamente, en P. pinnatifida produjo marchites y muerte de las yemas a 1 2 mg.L-1 y las condiciones evaluadas, porque esta hormona sintética es mas estable y podría tener efectos tóxicos sobre las dicotiledóneas (Eyer et al. 2016).
De acuerdo a Ammirato (1989) las células del centro embriogénico del callo se dividen rápidamente y se forman embriones globulares que crecen y desarrollan pasando por los estados de corazón, torpedo y cotiledonar, luego maduran y germinan dando lugar a plantas completas. En este sentido, durante la proliferación de embriones de P. pinnatifida a partir del callo proveniente del tratamiento con ANA 1.0 mg.L-1, se encontró el estado globular bien definido a los 60 días, y los estados de corazón y torpedo a los 90 días del cultivo libre de hormonas; mientras que no se observó el estado cotiledonar, la maduración y germinación. Por lo tanto, los callos embriogénicos fueron transferidos a medios con BAP solo o en combinación con ANA (Fig. 5), porque las hormonas exógenas cumplen funciones importantes en la morfogénesis de la planta en estas etapas (Sharmin et al. 2014), lográndose la mayor regeneración de embriones a los 45 días de exposición a BAP 0.5 mg.L-1 (Fig. 4), mientras que mayores concentraciones de citoquinina y la combinación citoquinina-auxina redujeron la germinación.
Finalmente, se ha comprobado que P. pinnatifida puede ser propagada mediante el cultivo de tejidos in vitro a través de la multiplicación de brotes y por embriogénesis somática indirecta.
Fuentes de financiamiento: Dirección General de Investigación de la Universidad Nacional Santiago Antúnez de Mayolo, proyecto "Caracterización fitoquímica, biológica y molecular de plantas altoandinas peruanas con potencial en la industria farmacológica".
Información sobre los autores: POG, CTA y REdR diseñaron la investigación, POG y REdR desarrollaron la parte experimental, POG y CTA escribieron el borrador del manuscrito, POG, CTA y REdR aprobaron el manuscrito.
Los autores no incurren en conflictos de intereses.
Literatura citada
Ammirato P.V. 1989. Recent progress in somatic embryogenesis. International Association for Plant Tissue Culture News lett 57: 2–16. [ Links ]
Aremu A. O., L. Plackova, A. Pencik, et al. 2016. Auxin-cytokinin interaction and variations in their metabolic products in the regulation of organogenesis in two Eucomis species. New Biotechnology 33:883–890. doi: http://doi.org/10.1016/j.nbt.2016.09.001 [ Links ]
Aslam J., A. Mujib & M. P. Sharma. 2013. In vitro micropropagation of Dracaena sanderiana Sander ex Mast: An important indoor ornamental plant. Saudi Journal of Biological Sciences 20: 63–68. Doi: https://doi.org/10.1016/j.sjbs.2012.11.005 [ Links ]
Barnicoat H., R. Cripps, J. Kendon et al. 2011. Conservation in vitro of rare and threatened ferns—case studies of biodiversity hotspot and island species. In Vitro Cellular & Developmental Biology Plant 47(1): 37–45. Doi: https://doi.org/10.1007/s11627-010-9303-x [ Links ]
Borges M., E. Estrada, I. Pérez & S. Meneses. 2009. Uso de distintos tratamientos de desinfección en el cultivo in vitro de Dioscorea alata L. clon caraqueño. Rev. Colomb. Biotecnol. XI (2): 127-135. [ Links ]
Cano A., A. Delgado, W. Mendoza et al. 2011. Flora y vegetación de suelos crioturbados y hábitats asociados en los alrededores del abra Apacheta, Ayacucho-Huancavelica (Perú). Revista peruana biologia 18(2): 169 – 178. doi: http://dx.doi.org/10.15381/rpb.v17i1.56 [ Links ]
Das D., M. Reddy, K. Upadhyaya & SK. Sopory. 2002. An efficient leaf-disc culture method for the regeneration via somatic embryogenesis and transformation of grape (Vitis vinifera L.). Plant Cell Reports 20: 991-1005. doi: http://dx.doi.org/10.1007/s00299-002-0441-4 [ Links ]
De la Cruz H., G. Vilcapoma & P. Zevallos. 2007. Ethnobotanical study of medicinal plants used by the Andean people of Canta, Lima, Peru. Journal of Ethnopharmacology 111: 284–294. doi: http://dx.doi.org/10.1016/j.jep.2006.11.018 [ Links ]
Elamvaluthi M., S. Saravanan & P.C. Sathyanarayanan. 2016. Optimization of in vitro regeneration of Phyllanthus amarus and its antibacterial potential. Journal of Academia and Industrial Research 5 (4): 54 – 57. [ Links ]
Espinosa J., O. Trillos, R. Hoyos, L. Afanador & G. Correa. 2005. Potencial de propagación in vitro para el tomate de árbol partenocárpico Cyphomandra betacea Cav. (Sendt). Revista Facultad Nacional de Agronomía Medellín 58(1): 2685 – 2695. [ Links ]
Eyer L., T. Vain, B. Parizkova, et al. 2016. 2,4-D and IAA amino acid conjugates show distinct metabolism in Arabidopsis. PLoS ONE, 11(7):1–18. doi: http://doi.org/10.1371/journal.pone.0159269 [ Links ]
Farzana K., T. Husnain & S. Riazuddini. 1998. Effect of age seedling and phytohormones on micropropagation of indica rice (Oryza sativa L.) from meristem culture. Journal of Plant Biology 41(2): 93-96. doi: http://doi.org/10.1007/BF03030394 [ Links ]
González J. A., M. Oropeza, T. E. Vargas & E. de García. 2006. Embriogénesis somática en dos especies del genero Plantago (Plantago major L. y Plantago hirtella Kunth). Agronomía Tropical 56(4): 689-695. [ Links ]
Ikeuchi M., K. Sugimoto, & A. Iwase. 2013. Plant callus: mechanisms of induction and repression. The Plant Cell 25(9):3159–73. doi: http://doi.org/10.1105/tpc.113.116053 [ Links ]
Islam M., K. Kloppstech & J. Jacobsen. 2004. Efficient procedure for in vitro microrhizome induction in Curcuma longa L. (Zingiberaceae) a medicinal plant of Tropical Asia. Plant Tissue Culture 14(2): 123 – 134. [ Links ]
Katinas L. 2012. Revisión del genero Perezia (Compositae). Boletín de la Sociedad Argentina de Botánica 47 (1-2): 159-261. [ Links ]
Khan S., F Al-Qurainy & M. Nadeem. 2012. Biotechnological approaches for conservation and improvement of rare and endangered plants of Saudi Arabia. Saudi Journal of Biological Sciences 19(1):1–11. doi: http://doi.org/10.1016/j.sjbs.2011.11.001. [ Links ]
Lara A., R. Valverde, L. Gómez & N. Hidalgo. 2003. Micropropagación de la planta medicinal Psychotria acuminata. Agronomía Costarricense 27(2): 7-20. [ Links ]
Montesinos D. B. 2012. Lista anotada de nuevas adiciones para la flora andina de Moquegua, Perú. Rev. peru. biol. 19(3): 307–316. doi: http://dx.doi.org/10.15381/rpb.v19i3.1045Links ]doi.org/10.15381/rpb.v19i3.1045" target="_blank">.
Mostofa M. A., I. Hoque, Md. Mostofa, et al. 2016. In vitro regeneration of a common medicinal plant, Ocimum sanctum
L. for mass propagation. African Journal of Biotechnology 15(24): 1269 – 1275. doi: http://dx.doi.org/10.5897/AJB2015.15200
Olivera P., C. Tamariz & M. Gutiérrez–Correa. 2010. Desinfección e influencia del bencil aminopurina (BAP) y ácido naftalén acético (ANA) en la multiplicación in vitro de Perezia coerulescens Wedd, planta medicinal altoandina. Revista Aporte Santiaguino 3(1): 117 – 124. [ Links ]
Olmos S., G. Luciani & E. Galdeano. 2004. Métodos de propagación y conservación de germoplasma. En: Echenique V., C. Rubinstein, E. Hopp & L. Mroginski, eds. Biotecnología y mejoramiento vegetal II. INTA, Buenos Aires. Pp. 161-172. [ Links ]
Roca W. y L. Mroginski. 1993. Cultivo de tejidos en Agricultura, Fundamentos y Aplicaciones. Cali: Centro Internacional de Agricultura Tropical. [ Links ]
Royero M., T. Vargas & M. Oropeza. 2007. Micropropagación y organogénesis de Dioscorea alata (ñame). Interciencia 32(4): 247 – 252. [ Links ]
Sarasan V., R.Cripps, M. Ramsay et al.2006. Conservation in vitro of Threatened Plants: Progress in the past Decade. In Vitro Cellular & Developmental Biology – Plant 42(3), 206-214. doi: http://dx.doi.org/10.1079/IVP2006769 [ Links ]
Sharmin S. A., Md. Jahangir, Md. Mominul et al. 2014. Somatic Embryogenesis and Plant Regeneration in Wedelia calendulacea Less. an Endangered Medicinal Plant. Brazilian Archives of Biology and Technology 57 (3): 394 – 401. doi: http://dx.doi.org/10.1590/S1516-8913201401840 [ Links ]
Shekhawat M. S., N. Kannan, M. Manokari et al. 2015. In vitro regeneration of shoots and ex vitro rooting of an important medicinal plant Passiflora foetida L. through nodal segment cultures. Journal of Genetic Engineering and Biotechnology, 13(2), 209–214. Doi: http://doi.org/10.1016/j.jgeb.2015.08.002 [ Links ]
Su Y. H. & X. S. Zhang.2009. Auxin gradients trigger de novo formation of stem cells during somatic embryogenesis. Plant Signaling & Behavior 4(7):574–576. doi: http://doi.org/10.4161/psb.4.7.8730 [ Links ]
Presentado: 03/01/2017
Aceptado: 30/06/2017
Publicado online: 28/10/2017