Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.25 no.2 Lima abr./jun. 2018
http://dx.doi.org/10.15381/rpb.v25i2.14689
TRABAJOS ORIGINALES
Aclimatación a la alta temperatura y tolerancia al calor (TL50) en 6 variedades de Chenopodium quinoa*
High temperature acclimation and termotolerance (TL50) in 6 varieties of Chenopodium quinua*
Kimberlayn M. Sanabría A. y Herbert O. Lazo R.**
Universidad Nacional San Agustín de Arequipa [Perú], Facultad de Ciencias Biológicas, Departamento Académico de Biología, Laboratorio de Fisiología y Biotecnología Vegetal.
Resumen
Se estudió la capacidad de aclimatación de 6 variedades de Chenopodium quinoa Willd. (Kancolla, Salcedo, Ccoito, Negra collana, Pasancalla e Illpa) a alta temperatura. Las plantas de quinua se obtuvieron a partir de semillas, las que crecieron en macetas, en un sombreadero, hasta el estado fenológico de 6 hojas verdaderas. Estas fueron expuestas a un tratamiento por calor en una cámara de crecimiento con termostato a 34/32 °C día/noche (D/N) por 3 días y a baja intensidad luminosa. Las no aclimatadas crecieron en las mismas condiciones pero a la temperatura de 22/20 °C D/N. La tolerancia a la alta temperatura se determinó exponiendo discos de hojas a diferentes tiempos (8, 16, 32 y 64 min) a 50 °C (baño maría), midiendo la termoestabilidad de la membrana celular, por la pérdida electrolitos utilizando un conductimetro. El grado de termotolerancia fue hallado según el TL50(tiempo letal al 50% de daño). Los resultados muestran que las variedades Pasancalla e Illpa presentaron capacidad de aclimatación, la variedad más termotolerante fue la variedad Illpa TL50= 64 min cuando fue aclimatada y la más sensible fue la variedad Pasancalla TL50= 8 min cuando no fue aclimatada. También se observó que el porcentaje de daño celular se incrementó a medida que el tiempo de exposición a la alta temperatura fue mayor.
Palabras clave: Chenopodium quinoa; alta temperatura; termotolerante; TL; aclimatación.
Abstract
The capacity of acclimatization at high temperature of 6 varieties (Kancolla, Salcedo, Ccoito, Negra collana, Pasancalla and Illpa) of Chenopodium quinoa Willd was studied. Quinoa plants were obtained from seeds, which grew in pots, in a grennhouse, until the phenological stage of 6 true leaves. These were exposed to a heat treatment in a growth chamber with a thermostat at 34/32 °C day/night (D/N) for 3 days and at low light intensity. The non-acclimated plants grew under the same conditions but at temperature of 22/20 °C D/N. The tolerance to high temperature was determined by exposing leaf discs at different times (8, 16, 32 and 64 min) at 50 °C (warm bath), measuring the thermostability of the cell membrane trough the loss of electrolytes with a conductimeter. The degree of thermotolerance was found according to the TL50 (time lethal to 50% of damage). The results showed that the varieties Pasancalla and Illpa presented acclimatization capacity, the most thermotolerant variety was the variety Illpa TL50 = 64 min when it was acclimatized and the most sensitive was Pasancalla TL50 = 8 min when it was not acclimatized. It was also observed that the percentage of cell damage increased as the exposure time to the high temperature was higher.
Keywords: Chenopodium quinoa; heat stress; termotolerant; TL; acclimatization.
Introducción
El estrés por calor se define a menudo como el aumento de la temperatura más allá de un umbral para un período de tiempo suficiente para causar daños irreversibles en el crecimiento y desarrollo de la planta. En general, la elevación de la temperatura de 10 a 15 °C por encima de la temperatura ambiente, es considerada como estrés por calor. Sin embargo, el estrés por calor es una función compleja de intensidad (temperatura en grados), duración y tasa de incremento de temperatura (Wahid et al. 2007).
El estrés por calor es señalado como uno de los principales factores abióticos desfavorables al limitar el crecimiento y desarrollo de plantas de estación fría (Huang et al. 1998a, 1998b; Larkindale & Huang 2004a), especialmente cuando se ha predicho que la temperatura media incrementará entre 1.5 y 6 °C en climas futuros (Houghton et al. 2001). Esto puede conducir a la inhibición de la fotosíntesis (Berry & Bjorkman 1980, Paulsen 1994, Karim et al. 1999), daños de la membrana celular (Blum & Ebercon 1981), la senescencia y muerte de las células en las plantas (Abernethy et al. 1989).
Temperaturas muy altas ocasionan severos daños celulares e incluso la muerte celular en minutos, lo que podría atribuirse a un severo daño en la organización celular (Schoffl et al. 1999). Pero cuando las temperaturas son altas y moderadas, los daños o muerte pueden ocurrir solo después de una exposición prolongada; las lesiones directas debido a altas temperaturas incluyen desnaturalización y agregación de proteínas, e incremento de la fluidez de los lípidos de la membrana; y las lesiones indirectas producto del calor incluyen inactivación de enzimas en cloroplastos y mitocondrias, inhibición de la síntesis de proteínas, degradación de proteínas y pérdida de la integridad de la membrana (Howarth 2005). La tolerancia al calor es generalmente definido como la habilidad de la planta para crecer y producir un rendimiento económico a alta temperatura (Peet & Willits 1998).
Las plantas adquieren termotolerancia por exposición a un incremento gradual de temperatura (aclimatación al calor) (Vierling 1991, Hong et al. 2003,), la cual en el ambiente, ocurre frecuentemente de forma natural. Las membranas celulares son uno de los componentes más sensibles al estrés por calor en la célula de la planta (Raison et al. 1980, Chaves-Barrantes & GutiérrezSoto 2016), ya que conducen a la pérdida de solutos orgánicos e inorgánicos (electrolitos) de la célula (Levit t1980). La habilidad de mantener la alta termoestabilidad de la membrana bajo estrés al calor está relacionada positivamente con la tolerancia de toda la planta al estrés por calor (Howarth et al. 1997, Marcum 1998, Chaves-Barrantes & Gutiérrez-Soto 2016).
La quinua, Chenopodium quinoa Willd, es una planta originaria de los Andes, el cultivo de este grano se realiza desde el nivel del mar hasta los 4500 m de altitud, su valor nutritivo es superior al de los cereales tradicionales (Tapia 1997), y es uno de los cultivos promisorios para la alimentación humana (National Research Council, 1989).
El Perú es el segundo productor de quinua después de Bolivia; sus principales mercados son Estados Unidos y Canadá, en donde se está empezando a consumir quinua peruana por su calidad (ADEX Data Trade/Aduanas 2015). Además, en el Perú el consumo interno de quinua ha tenido un incremento del 20% en comparación con lo que se consumía hace cinco años. Del total de la producción nacional de este grano, el 40% se dirige hacia el mercado interno y el resto hacia el mercado externo (Martínez & Borda 2012).
En este escenario, es necesario averiguar el efecto de la alta temperatura en la termoestabilidad de la membrana celular y el grado de termotolerancia de 6 variedades de Ch. quinoa, para contribuir con el conocimiento de las variedades que mejor se adapten al cambio climático o a zonas con climas más cálidos.
El objetivo de este estudio fue el de evaluar el efecto de la alta temperatura en la termoestabilidad de la membrana celular y su relación con la tolerancia al calor en 6 variedades de Ch. quinoa aclimatadas y no aclimatadas, y como objetivos específicos, fue el de determinar el porcentaje de daño a diferentes tiempos de exposición a temperatura de 50 °C, la capacidad de aclimatación y el grado de termotolerancia en relación al TL50 de 6 variedades de Ch.quinoa aclimatadas y no aclimatadas.
Material y métodos
Material biológico. Se empleó semillas de seis variedades de Ch. quinoa, correspondientes a las variedades: Kancolla, Salcedo, Ccoito, Negra CCollana, Pasancalla e Illpa, proporcionados por el Instituto Nacional de Investigación Agraria y Agroindustrial de Puno (INIA), Estación Illpa. El trabajo experimental se realizó en el Laboratorio de Fisiología y Biotecnología Vegetal, del Departamento Académico de Biología en la Universidad Nacional de San Agustín, Arequipa-Perú.
Condiciones de crecimiento. Las semillas fueron sembradas en macetas de un 1 kg de capacidad, y se empleó como sustrato: arena, tierra de chacra y tierra vegetal en una proporción de 1:1:2. Para la fertilización se utilizó fertilizante foliar Fertiplant® (NPK, 30:10:10) a los 3 días de su emergencia y una vez por semana, hasta que tuvieran 6 hojas verdaderas. Tratamientos de choque térmico.Los tratamientos de choque térmico fueron aplicados aproximadamente a los 60 días (Blum & Ebercon 1981) después de la siembra (6 hojas verdaderas).
Pre-tratamiento de calor (aclimatación). En una cámara de crecimiento con termostato se colocaron 3 macetas conteniendo cada una 4 plantas de una variedad de Ch. quinoa. Las condiciones de crecimiento fueron de 34oC/32oC D/N por 3 días y a baja intensidad luminosa (lámpara fluorescente de 40 watts) (Sheng et al. 2006).
Medida de la estabilidad de la membrana celular. La conductividad eléctrica (CE) se ha utilizado también como índice de la estabilidad de la membrana para identificar genotipos tolerantes al calor en muchos cultivos (Blum & Ebercon 1981). Según la metodología descrita por Blum y Ebercom (1981), se cortaron 5 discos de hojas (12 mm de diámetro) de los cultivares en estudio, los que fueron colocados rápidamente en tubos de prueba de 1 x 20 cm. Se lavó la muestra tres veces con agua bidestilada a temperatura ambiente (21 °C), y se eliminó el agua del tubo de ensayo, dejando que la muestra permanezca húmeda tapando el tubo con una película de papel aluminio con el fin de evitar que se deseque, durante el tratamiento
Para el screening se tomaron 5 pares de hojas totalmente expandidas, de 5 diferentes plantas. Los tubos de ensayo fueron sumergidos en baño maría y expuestos a 50 °C (tratamiento) y a 21 °C (control), por 8, 16, 32 y 64 minutos. Después del tratamiento se añadió 5 mL de agua bidestilada a cada tubo y se colocó a 10 °C por 24 horas. Después de equilibrar a temperatura ambiente por 1 hora, se midió la conductividad de cada tubo, luego se llevaron los tubos a una autoclave por 15 minutos a 121 °C para matar todo el tejido, y se midió nuevamente la conductividad en todos los tubos. El cálculo de la estabilidad de la membrana celular (EMC) se realizó aplicando la siguiente formula:
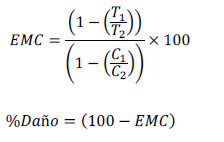
Donde:
T1= conductividad antes del autoclavado de la muestra tratada con temperatura (50 °C).
T2= conductividad después del autoclavado de la muestra tratada con temperatura (50 °C).
C1=control antes del autoclavado de la muestra no tratada a temperatura (50 °C).
C2=control después del autoclavado de la muestra no tratada a temperatura (50 °C).
Con estos datos se construyó una curva de porcentaje daño celular (eje Y) y tiempo de exposición (eje X), se ajustó con el Test de Probit, para la determinación del tiempo letal medio (TL50).
Diseño experimental. Se empleó un diseño completamente randomizado (DCR), con arreglo factorial 6 (variedades) x 2 (temperaturas) x 4 (tiempos). Se aplicaron 5 repeticiones por tratamiento y se analizaron con un análisis de varianza (ANOVA), para establecer diferencias entre y dentro los factores. Como unidad experimental se tomó un tubo de prueba (1 x 20 cm) conteniendo 5 discos de hojas (12 mm de diámetro), las cuales fueron extraídas de una misma planta.
Para el tiempo letal medio (TL50) se realizó una prueba de rangos múltiples, para hallar diferencias de medias entre y dentro las variedades. Los datos fueron analizados en el paquete estadístico Statgraphics® Centurion XVI y las gráficas fueron realizadas en el programa GraphPad Prism5 (Software, Inc, USA).
Resultados
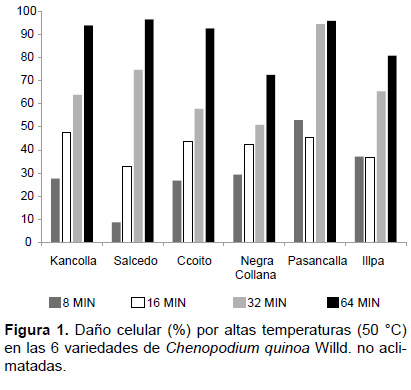
Porcentaje de daño por alta temperatura (50 °C) en relación al tiempo de exposición. El porcentaje de daño celular se incrementó en todas las variedades a medida que el tiempo de exposición a alta temperatura (50 °C) aumento. De las 6 variedades, la variedad Salcedo presento menor porcentaje de daño a los 8 min y 16 min (8.68% y 32.62%), la variedad Ccoito a los 32 min y la variedad Illpa a los 64 min de exposición. La variedad que presentó mayor porcentaje de daño a los 8 y 32 min fue la variedad Pasancalla, a los 16 min fue la variedad Kancolla, y a los 64 min de exposición el daño fue similar para las variedades Kancolla, Salcedo, Ccoito y Pasancalla (Fig. 1).
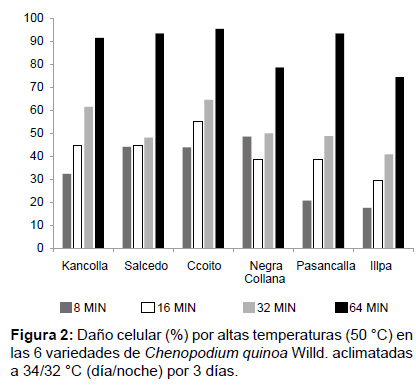
De las 6 variedades aclimatadas (34/32 °C) de Ch. quinoa, la variedad Illpa presento menor porcentaje de daño a los 8 min, 16 min, 32 min y 64 min de exposición en contraste con las otras variedades, y la variedad que presento mayor porcentaje de daño a los 8 min fue la variedad Negra Collana (48.72%), la variedad Ccoito a los 16 min y 32 min (55.43%), sin embargo a los 64 min de exposición, el porcentaje de daño fue similar en las variedades Kancolla, Salcedo, Ccoito y Pasancalla (Fig. 2).
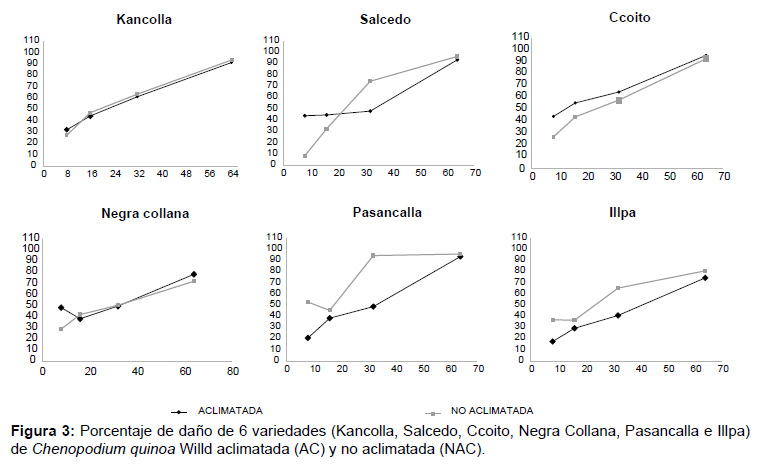
Capacidad de aclimatación de 6 variedades de Chenopodium quinoa. El porcentaje de daño producido por diferentes tiempos de exposición (8, 16, 32, y 64 min) a alta temperatura (50 °C), (Fig. 3) en el grupo de plantas aclimatadas (AC) y no aclimatadas (NAC), no presentaron diferencias significativas (p>0.05), para las variedad Kancolla por lo que no se observó capacidad de aclimatación al ser expuestas a 34 /32 °C (D/N) por 3 días, sin embargo las variedades Salcedo, Ccoito, Negra Collana, Pasancalla e Illpa presentaron diferencias altamente significativas (p<0.01) entre los grupos AC y NAC.
En la variedad Salcedo, el grupo de plantas AC presentó mayor daño celular a los 8 y 16 min de exposición en contraste con las NAC, sin embargo a los 32 y 64 min se observó mayor daño en las NAC. La variedad Ccoito presento mayor porcentaje de daño en el grupo de plantas AC en todos los tiempos de exposición a alta temperatura (50 °C) La variedad Negra Collana presento mayor daño a los 8 min de exposición en el grupo AC y similar daño a los 16, 32 y 64 min, las variedades Pasancalla e Illpa presentaron menor daño celular el grupo de plantas AC en todos los tiempos de exposición en contraste con las NAC, presentando así capacidad de aclimatación al ser expuesta 34/32 °C (D/N) por 3 días.
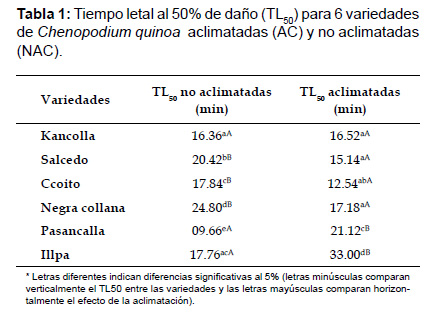
Grado de termotolerancia medido a través del TL50 (tiempo letal al 50% de daño). Los resultados de termotolerancia, se muestran en la Tabla 1; la variedad no aclimatada (NAC) que presento mayor termotolerancia a la temperatura de 50 °C fue la variedad Negra Collana (TL50 33.00 min) seguida de la variedad Salcedo (TL50 20.42 min) , mientras que la variedad más sensible fue la Pasancalla (TL50 9.66 min), asimismo no se presentaron diferencias significativas (p>0.05) entre el TL50 de la variedad Kancolla e Illpa y Ccoito e Illpa. La variedad
aclimatada (Tabla 1) mas termotolerante fue Illpa (TL50 33.00 min) seguida de la variedad Pasancalla (TL50 21.12 min) y la variedad más sensible fue la variedad Ccoito (TL50 12.54 min). No se presentaron diferencias significativas (p>0.05) entre el TL50 de la variedad Kancolla con las variedades Salcedo y Negra Collana, y entre la variedad Salcedo con las variedades Ccoito y Negra Collana.
La variedad Kancolla no presento diferencias significativas(p>0.05) entre el grupo de plantas NAC (TL50 16.36 min) con las AC (TL50 16.52 min), las variedades Salcedo, Ccoito y Negra Collana presentaron menor TL50 para el grupo de plantas AC en contraste con las NAC (p<0.05), sin embargo las variedades Pasancalla e Illpa presentaron mayor TL50 para el grupo de plantas AC (TL50 21.12 y 33.00 min) en contraste con las NAC (TL50 09.66 y 17.76 min) respectivamente (p<0.05).
Discusión
El escaso establecimiento de las plántulas en campo debido al incremento de la temperatura del aire y suelo, es una de las mayores causas de la muerte de plántulas de Pearl millet (Pennisetum glaucum L.), cereal de grano y cultivo forrajero de importancia en muchas partes de los trópicos semiáridos (Peacock et al. 1993). Los riesgos de los semilleros secos y calientes durante el establecimiento del cultivo son altos, con temperaturas superficiales de suelo frecuentemente mayores a 50°C al mediodía (Gupta 1986, Peacock et al 1993, Howarth et al. 1997). Estas condiciones de temperatura se repiten durante muchos días después de la siembra y causan daño térmico y como consecuencia la muerte las plántulas (O’Neill & Diaby 1987, Peacock et al. 1993).
Peacock et al. (1993) desarrollaron una técnica en campo para el screening de plántulas de Pearl millet donde evaluaron la emergencia y sobrevivencia de plántulas en suelos con altas temperaturas en superficie, donde las evaluaciones en el entorno ambiental fueron ideales ya que las variables climáticas estaban potencialmente disponibles, sin embargo reportaron que existieron dificultades con respecto a la evaluación en campo, particularmente por la presencia de otros factores de estrés abiótico, por lo que la evaluación fue limitada. Sin embargo, Howarth et al. (1997) reportaron métodos desarrollados en laboratorio para la evaluación de la termotolerancia de plántulas de Pearl millet, está técnica realizada en laboratorio tuvo ventajas, y pudieron realizarse bajo condiciones controladas. Esta técnica de screening es una herramienta sencilla y que puede ser usada directamente en programas de mejoramiento de termotolerancia de plántulas o combinada con análisis genéticos para identificar marcadores moleculares vinculados a la genómica y metabolómica, y relación con procesos fisiológicos, en el estudio de la tolerancia a alta temperatura (Hanumappa & Nguyen, 2010; Li et al., 2011; Li et al., 2015).
La técnica que mide la pérdida electrolitos dentro del medio después de la exposición al estrés proporciona un indicador del daño a la membrana celular causado por dicho estrés, y puede ser usada para evaluar el daño inducido por el estrés en muchas especies (Sullivan 1972, Martineu et al. 1979, Blum & Ebercom 1981). Para el caso de Chenopodium quinoa se realizó el screening bajo condiciones de laboratorio, midiéndose la perdida de electrolitos producto del estrés por alta temperatura (50 °C), con la finalidad de proporcionar un indicador del daño de la membrana celular producto del estrés térmico.
El estrés al calor aumenta la energía cinética y el movimiento de las moléculas a través de las membranas resultando en el aflojamiento de sus enlaces químicos, por lo que, la bicapa lipídica de las membranas se vuelven más fluidas, debido a la desnaturalización de proteínas y/o o por los cambios en los niveles ácidos grasos insaturados y saturados (Liu et al. 1996, Hanumappa & Nguyen 2010, Li et al. 2015). El porcentaje de daño por exposición a alta temperatura por la pérdida de electrolitos de la célula, a partir de mediciones conductométricas es un método fiable y fácil de realizar (Savchenko et al. 2002). Muthappa et al. (2007) evaluaron la termoestabilidad de la membrana celular en diversos campos de cultivos, incluyendo el trigo de primavera, señalando un aumento significativo en el rendimiento en lugares calientes a partir de la selección de líneas con membranas termoestables, que se determinó por mediciones en las hojas bandera en la antesis. Así mismo, Wardlow et al. (1980) reportaron una alta correlación entre la termoestabilidad de la membrana y rendimiento de grano, aplicando también pruebas de termoestabilidad de la membrana en diversos cultivos.
Se conoce que las plantas han desarrollado diversos mecanismos para hacer frente a los efectos nocivos del estrés por calor; en particular, bajo estrés térmico no letal. Las plantas pueden ser inducidas para ajustar la condición de estrés, como es la aclimatación al calor, y es bien sabido que esta puede mejorar la capacidad de adaptarse a condiciones ambientales adversas, que resulta de cambios de muchas respuestas fisiológicas y bioquímicas en la planta (Quan et al. 2004, Hanumappa & Nguyen 2010).
El presente trabajo estableció la relación entre la exposición al estrés térmico no letal con la aclimatación al calor, mostrando que esta respuesta no fue similar para todas las variedades de C. quinoa estudiadas, como se ha descrito en otras especies (Anderson et al. 1990). Los resultados sólo demostraron tal asociación para dos variedades de C. quinoa, de las seis variedades investigadas. No obstante, existen varios métodos de estudio para seleccionar especies tolerantes al calor, en esta investigación se mostró la tasa de daño de la membrana celular debido al estrés por calor, por la medida de la pérdida de electrolitos de las células con un conductimetro.
Anderson et al. (1990) utilizando este mismo método, determinaron que plantas de Capsicum que crecieron a 20/22°C presentaron un daño letal al ser expuestas a 51 °C; sin embargo las plantas que fueron expuestas a una aclimatación por 24 h a 38 °C incrementaron la tolerancia al calor, pero el tratamiento de 24 h adicionales no ocasiono un mayor aumento en la tolerancia y tampoco produjo una desaclimatación. Del mismo modo, Chen et al. (1982) reportaron que plantas aclimatadas de tomate, frijol, y las plantas de patata eran más tolerantes que las plantas no aclimatadas, y sus datos sugieren que la desaclimatación es un proceso más lento que la aclimatación; asimismo Lester (1986) también encontró que la aclimatación es un proceso más rápido que la desaclimatación y Sheng et al. (2006) describe la exposición a un periodo de pre aclimatación por 3 días a 30 °C a dos variedades de Césped de estación fría, obteniendo una mayor termoestabilidad de la membrana celular en las variedades aclimatadas.
En este trabajo los resultados mostraron que plantas de 2 variedades de C. quinoa expuestas a una aclimatación por 3 días a 34/32 °C, presentaron capacidad de aclimatación en comparación con las plantas que crecieron a 22/20 °C (condiciones normales), como se ha descrito en otros trabajos donde la tolerancia a la alta temperatura varia con el genotipo (Ingram & Buchanam 1984), y exposición previa a la temperatura (Chen et al. 1982), por lo que las variedades de Pasancalla e Illpa presentaron capacidad de aclimatación y las variedades Kancolla, Salcedo, Ccoito y Negra cCollana no se aclimataron, respuesta que probablemente se presentó por no poseer los mecanismos de aclimatación dependientes de su genotipo.
Conclusiones
El porcentaje de daño se vio incrementado con el aumento del tiempo de exposición a alta temperatura (50 °C) en las 6 variedades de Ch. quinoa aclimatadas y no aclimatadas. Para el grupo de plantas NAC, se concluyó que a tiempos cortos de exposición a alta temperatura (50 °C) la variedad Salcedo presenta menor porcentaje de daño y la variedad Pasancalla es la más afectada y a tiempos de exposición más prolongados las variedades Negra Collana e Illpa presentan menor porcentaje de daño celular. Para el grupo de plantas AC, las variedades Pasancalla e Illpa fueron quienes presentaron menor porcentaje de daño a tiempos de exposición cortos a alta temperatura (50 °C), y las variedades Negra Collana y Ccoito fueron las más afectadas. Sin embargo a tiempos de exposición más prolongados la variedad Negra Collana e Illpa presentaron menor porcentaje de daño celular en comparación a las demás variedades.
Se determinó que las variedades Pasancalla e Illpa presentaron capacidad de aclimatación ya que la media del porcentaje de daño fue menor en el grupo AC en comparación de las NAC. Las variedades Kancolla, Salcedo, Ccoito y Negra Collana no presentaron capacidad de aclimatación, ya que el daño celular (%) en el grupo AC fue menor que el grupo NAC.
Se determinó el grado de termotolerancia en relación al TL50, donde la variedad más termotolerante no aclimatada fue la variedad Negra Collana y la más sensible fue la variedad Pasancalla. En el grupo de plantas AC la variedad Illpa fue la más termotolerante y la variedad Ccoito la más sensible. Las variedades Pasancalla e Illpa presentaron mayor TL50 para el grupo AC en contraste con las NAC, la variedad Kancolla no presento diferencias entre el grupo de plantas NAC con las AC.
Información sobre los autores:
* Basada en: Sanabria K. 2014. Efecto de la temperatura en la termoestabilidad de la membrane celular y su relación con la tolerancia al calor en 6 variedades de Chenopodium quinoa Willd. "quinua" aclimatadas y no aclimatadas. Tesis para optar el título profesional de Biólogo. Universidad Nacional de San Agustín. Arequipa-Perú.
Los autores no incurren en conflictos de intereses.
Literatura citada
Abernethy R.H., D.S. Thiel, N.S. Peterson & K. Helm. 1989. Thermotolerance is developmentally dependent in germinating wheat seed. Plant Physiol. 89, 569–576. [ Links ]
Anderson J., G. McCollum & R. Warren. 1990. High Temperature Acclimation in Pepper Leaves. Hortscience 25(10): 1272–1274. 1990. [ Links ]
Berry J. & O. Bjorkman. 1980. Photosynthetic response and adaptation to temperature in higher plants. Ann. Rev. Plant Physiol. 31, 491–543. [ Links ]
Blum A. & A. Ebercon. 1981. Cell Membrane Stability as a Measure of Drought and Heat Tolerance in Wheat. Crop Science 21 (1): 43–47. https://doi.org/10.2135/cropsci1981.0011183X002100010013x. [ Links ]
Chaves-Barrantes, Néstor Felipe, y Marco Vinicio Gutiérrez-Soto. 2016. Crop physiological responses to high temperature stress. I. Molecular, biochemical and physiological aspects. Mesoamerican Agronomy 28 (1): 237–53. [ Links ]
Chen H.H., Z.Y. Shen & P.H Li. 1982. Adaptability of crop plants to high temperature stress. Crop Sci. 22:719-725. [ Links ]
Gupta J.P. 1986. Moisture and thermal regimes of the desert soils of Rajasthan, India and their management for higher plant production. Journal of Hydrological Science 31: 347-359. [ Links ]
Hanumappa M. & H.T. Nguyen. 2010. Genetic approaches toward improving heat tolerance in plants. In: Genes for plant abiotic stress, Ed. Jenks, M. y A.J. Wood, Wiley-Blackwell, pp. 221-260. [ Links ]
Hong S.W., U. Lee & E. Vierling. 2003. Arabidopsis hot mutants define multiple functions required for acclimation to high temperatures. PlantPhysiol.132, 757–767. [ Links ]
Houghton J.T., Y. Ding, D.J. Griggs, M. Noguer, P.J. van der Linden, X. Dai, K. Maskell, and C.A. Johnson. (eds.) 2001. Climate Change 2001: The Scientific Basis. Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA, 881pp. [ Links ]
Howarth C.J. 2005. Genetic improvements of tolerance to high temperature.In:Ashraf, M., Harris, P.J.C. (Eds.), Abiotic Stresses: Plant Resistance Through Breeding and Molecular Approaches. Press Inc., New York. [ Links ]
Howarth C., C. Pollock & J. Peacock. 1997. Development of laboratory-based methods for assessing seedling thermotolerance in pearl millet. Institute of Grassland and Environmental Research, Plas Gogerddan, Aberystwyth SY23 3EB, UK. [ Links ]
Huang B., X. Liu & J.D Fry. 1998a. Shoot physiological responses of two bentgrass cultivars to high temperature and poor soil aeration. Crop Sci. 38, 1219–1225. [ Links ]
Huang B., X. Liu & J.D Fry. 1998b. Effects of high temperature and poor soil aeration on root growth and viability of creeping bentgrass. Crop Sci. 38, 1618–1622. [ Links ]
Ingram D.L. & D.W. Buchanan. 1984. Lethal high temperatures for roots of three citrus rootstock. J. Amer. Soc. Hort. Sci. 109:189–193. [ Links ]
Karim M.A., Y. Fracheboud & P. Stamp. 1999. Photosynthetic activity of developing leaves of Zea mays is less affected by heat stress than that of developed leaves. Physiol. Plant 105, 685–693. [ Links ]
Larkindale J. & B. Huang. 2004a. Changes of lipid composition and saturation level in leaves and roots for heat-stressed and heat-acclimated creeping bentgrass (Agrostis stolonifera). Environ. Exp. Bot. 51, 57–67. [ Links ]
Levitt, J. 1980. Response of plants to environmental stresses. Vol 1 Chilling, freezing and high temperature stresses. 2nd ed. Academic Press, New York. 497pp [ Links ]
Li S., Q. Fu, L. Chen, W. Huang & D. Yu. 2011. Arabidopsis thaliana WRKY25, WRKY26, and WRKY33 coordinate induction of plant thermotolerance. Planta 233:1237-1252. [ Links ]
Li Q., Q. Zheng, W. Shen, D. Cram, D.B. Fowler, Y. Wei & J. Zou. 2015. Understanding the biochemical basis of temperatureinduced lipid pathway adjustments in plants. The Plant Cell 27, 86-103. [ Links ]
Liu X., J.A. Anderson& N.O. Maness. 1996. Protein synthesis inhibitors block high-temperature acclimation in bell pepper leaves. HortScience 31(2), 160-161. [ Links ]
Martínez M.F. & W. Borda. 2012. Quinua Orgánica en Arequipa y Puno, dos Divisiones del Mismo Valor. Biodiversidad y Biocomercio. [ Links ]
Muthappa S.K., G. Kumar, V. Srikanthbabu & U. Makarla. 2007. Assessment of variability in acquired thermotolerance: potential option to study genotypic response and the relevance of stress genes. J. Plant Physiol. 164, 111–125. [ Links ]
National Research Council. 1989. Lost crops of the Incas: Little known plants of the Andes with promise for worldwide cultivation. p. 148-161. Natl. Acad. Press, Washington D. C., USA. [ Links ]
O'Neill M.K. & M. Diaby. 1987. Effects of high soil temperature and water stresses on Mali an pearl millet and sorghum during seedling stage. Journal of Agronomy and Crop Science 159:192-198. [ Links ]
Paulsen G.M. 1994. High Temperature Responses of Crop Plants (Chapter 14). In: K.J. Boote, J.M. Bennett, T.R. Sinclair, G.M. Paulsen, editors, 1994. Physiology and Determination of Crop Yield. ASA, CSSA, SSSA, Madison, WI. pp: 365–89. https://doi.org/10.2134/1994.physiologyanddetermination.c25. [ Links ]
Peacock J.M., P. Soman, R. Jayachandran, A.U. Rani, C.J. Howarth & A. Thonaas. 1993. Effects of high soil surface temperature on seedling survival in pearl millet. Experimental Agriculture 29: 215-225. [ Links ]
Peet M.M. & D.H. Willits. 1998. The effect to night temperature on greenhouse grown tomato yields in warm climate. Agric. Forest Meteorol. 92,191–202. [ Links ]
Quan R., M. Shang, H. Zhang, Y. Zhao & J. Zhang. 2004. Engineering of enhanced glycine betaine synthesis improves drought tolerance in maize. Plant Biotech. J. 2, 477–486. [ Links ]
Raison J.K., J. A. Berry, P.A. Armond & C.S. Pike. 1980. Membrane properties in relation to the adaptation of plant to temperature stress. P: 261-273, In: N.C, Turner and P.J, Kramer (eds.). Adaptation of plants to water and high temperatures stress. Wiley, New York. [ Links ]
Savchenko G.E., E.A. Klyuchareva, L.M. Abrabchik & E.V. Serdyuchenko. 2002. Effect of periodic heat shock on the membrane system of etioplasts. Russ. J. Plant Physiol. 49, 349–359. [ Links ]
Schoffl F., R. Prandl & A. Reindl. 1999. Molecular responses to heat stress. In: Shinozaki, K, Yamaguchi-Shinozaki, K. (Eds.), Molecular Responsesto Cold, Drought, Heat and Salt Stress in Higher Plants. R.G. Landes Co.,Austin, Texas, pp. 81–98. [ Links ]
Sheng X., L. Jianlong, Z. Xinquan, W. Hong & C. Langjun. 2006. Effects of heat acclimation pretreatment on changes of membrane lipid peroxidation, antioxidant metabolites, and ultrastructure of chloroplasts in two cool-season turfgrass species under heat stress. Environmental and Experimental Botany 56 274–285. [ Links ]
Sullivan C.Y. 1972. Mechanism of heat and drought resistance in grain sorghum and methods of measurement. In: Rao NGP, House LR, eds. Sorghum in the Seventies. New Delhi: Oxford and India Book House, 247-264. [ Links ]
Tapia M. 1997. Cultivos andinos subexplotados y su aporte a la alimentación. 2da. ed. 273 p. FAO, Oficina Regional para América Latina y el Caribe, Santiago, Chile. [ Links ]
Vierling E. 1991. The role of heat shock proteins in plants. Annu. Rev. Plant Physiol. Plant Mol, Biol, 42: 579-620. [ Links ]
Wahid A., S. Gelani, M. Ashraf & M.R. Foolad. 2007. Heat tolerance in plants. Enviromental and experimental Botany 61, 199-223. [ Links ]
Wardlow I.F., I. Sofield & P.M. Cartwright. 1980. Factors limiting the rate of dry matter accumulation in the grains of wheat grown at high temperature. Aust J Plant Physiol 1980; 7:387–400. [ Links ]
Presentado: 09/08/2017
Aceptado: 12/02/2018
Publicado online: 30/05/2018
**Autor para correspondencia
Email Herbert Lazo: hlazor@unsa.edu.pe
Email Kimberlayn SanabrÃa: k.sanabria.a@gmail.com