Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.25 no.3 Lima July/Set. 2018
http://dx.doi.org/10.15381/rpb.v25i3.15214
NOTA CIENTÍFICA
Diagnóstico morfológico y molecular de Cyclocoelum mutabile (Trematoda: Cyclocoelidae) en el Perú
Morphological and molecular diagnosis of Cyclocoelum mutabile (Trematoda: Cyclocoelidae) in Peru
Luis A. Gomez-Puerta 1*, Martha Y. Salas 1 , Maria T. Lopez-Urbina 2 , Armando E. Gonzalez 1
1 Universidad Nacional Mayor de San Marcos, Facultad de Medicina Veterinaria, Laboratorio de Epidemiología y Economía Veterinaria. Av. Circunvalación 2800, San Borja. Lima, Perú.
2 Universidad Nacional Mayor de San Marcos, Facultad de Medicina Veterinaria, Laboratorio de Microbiología y Parasitología. Av. Circunvalación 2800, San Borja. Lima, Perú.
Resumen
Cyclocoelum mutabile , un digeneo de la familia Cyclocoelidae, fue hallado parasitando los sacos aéreos de una polla de agua común (Gallinula chloropus), proveniente de alrededores del Refugio de Vida Silvestre Pantanos de villa, localizada en el distrito de Chorrillos en Lima, Perú. Un total de 7 parásitos fueron colectados e identificados por métodos morfológicos como C. mutabile. El diagnóstico fue confirmado por análisis molecular, amplificando los genes mitocondriales citocromo c oxidasa subunidad 1 (cox1) y deshidrogenasa NADH subunidad 1 (nad1). Las secuencias de nucleótidos de los aislados se compararon con secuencias previas de GenBank, y mostraron una similitud entre ellas (> 96%). Este hallazgo constituye el primer registro de C. mutabile para el Perú. Además, el trabajo realiza una breve descripción del parásito, así como la discusión de sus hospederos y distribución geográfica en Sudamérica.
Palabras clave: Trematoda; Cyclocoelidae; Cyclocoelum mutabile; Gruiformes; Gallinula chloropus.
Abstract
Cyclocoelum mutabile , a digenea of the family Cyclocoelidae, was found parasitizing the air sacs of a common moorhen (Gallinula chloropus), from the surroundings of the Pantanos de Villa Wildlife Refuge, located in Chorrillos, a district of Lima, Peru. A total of 7 parasites were collected and identified as C. mutabile by morphological methods. Diagnosis was confirmed by molecular analysis and partially amplified mitochondrial genes cytochrome c oxidase subunit 1 (cox1) and NADH dehydrogenase subunit 1 (nad1). Nucleotide sequences from the isolates were compared with previous sequences from GenBank, and they showed a high similarity between them (> 96%). This finding constitutes the first record of C. mutabile in Peru. Also, this work makes a brief description of the parasite, as well as the discussion of its hosts and geographic distribution in South America.
Keywords: Trematoda; Cyclocoelidae; Cyclocoelum mutabile; Gruiformes; Gallinula chloropus.
Introducción
Los digeneos de la familia Cyclocoelidae Stossich, 1902 están conformados por 22 géneros y 128 especies que parasitan principalmente el sistema respiratorio y cavidad abdominal de aves que se alimentan de moluscos (Dronen & Blend 2015). Los miracidios de estos digeneos muestran un bajo nivel de especificidad para el hospedero y logran infectar varias familias de caracoles, los cuales actúan como hospederos intermediarios (Taft 1972, Scott et al. 1982). El desarrollo en los caracoles se limita a una sola generación de cercarias, las cuales se enquistan como metacercarias dentro del mismo caracol (Taft 1974).
Cyclocoelum mutabile (Zeder, 1800), miembro de esta familia, es un parásito cosmopolita que infecta los sacos de aire de aves migratorias, principalmente aves gruiforme de la familia Rallidae (McLaughlin 1976, McKindsey et al. 1994). Se ha demostrado que las aves infectadas con este digeneo llegan en temporada de primavera al hemisferio norte (McLaughlin 1986).
En el continente americano, C. mutabile parasita con frecuencia al ave gruiforme gallareta americana (Fulica americana Gmelin, 1789), y ha sido registrada en diversas localidades de Canadá y Estados Unidos (McLaughlin 1976). Así mismo, C. mutabile ha sido registrado en el ave gruiforme polla de agua común ( Gallinula chloropus galeata (Lichtenstein, 1818)) en Argentina, Brasil y Estados Unidos (Lumsden & Zischke 1963, Fernandes 1976, Lunaschi et al. 2007), en el ave Charadriiforme jacana centroamericana ( Jacana spinosa gymnostoma (Wagler, 1831)) de México (Lamothe-Argumedo & Orozco-Flores 2000), en la gallareta ligas rojas (Fulica armillata Vieillot, 1817) y en el rascón moteado ( Pardirallus maculatus (Boddaert, 1783)) en Argentina (Lunaschi et al. 2007). En la presente nota, se utiliza el diagnóstico morfológico y molecular para demostrar la presencia de C. mutabile en el Perú, parasitando a la polla de agua común (G. chloropus).
Material y métodos
En setiembre del 2017, una polla de agua común (G. chloropus) fue hallada muerta en alrededores del Refugio de Vida Silvestre Pantanos de villa, localizada en el distrito de Chorrillos en Lima, Perú. El ave fue remitida a la Facultad de Medicina Veterinaria (FMV) de la Universidad Nacional Mayor de San Marcos (UNMSM). Durante la necropsia del ave se colectó un total de 7 digeneos, los cuales estaban localizados en los sacos aéreos del ave. Los digeneos fueron fijados y preservados en etanol al 70% en viales debidamente rotulados. Los digeneos se depositaron en la colección parasitológica del Laboratorio de Epidemiología y Economía Veterinaria de la FMV-UNMSM, con numero de depósito No 909 (SERFOR RDG N° 023-2018).
Para el diagnóstico morfológico, los parásitos se tiñeron con tricrómico de Gomori, fueron deshidratados en series sucesivas de etanol hasta etanol absoluto. Luego, los digeneos fueron clarificados en eugenol y montados en láminas porta objeto con bálsamo de Canadá. Las imágenes y medidas se obtuvieron usando un microscopio Carl Zeiss Axioskiop-40 y el programa Leica IM50 Versión, 4.0 R117. Las medidas se expresan en milímetros (mm) y micrómetros (µm), y son mencionadas en rango con el promedio y error estándar (ES) en paréntesis.
Para el diagnóstico molecular, se amplificaron parcialmente los genes mitocondriales: citocromo c oxidasa subunidad 1 (cox1) y NADH deshidrogenasa subunidad 1 (nad1). El ADN se extrajo de tres digeneos usando el kit comercial DNeasy Blood & Tissue Kits (Qiagen, Valencia, CA, USA) siguiendo las instrucciones del fabricante. Se utilizó la reacción en cadena de la polimerasa (PCR) usando los protocolos y cebadores descritos por Bowles y McManus (1994) y Kostadinova et al. (2003), respectivamente. Los productos de PCR se secuenciaron en un secuenciador automatizado ABI 3100 (Applied Biosystems). Las secuencias se ensamblaron utilizando el programa ChromasPro Versión, 1.7.6, y se compararon con secuencias de referencias obtenida del GenBank mediante el BLASTn (https://blast.ncbi.nlm.nih.gov) y fueron alineadas utilizando el programa BioEdit versión 7.2.5. El Programa MEGA7 (http://www.megasoftware.net/) fue utilizado para generar un árbol filogenético a través del método "neighborjoining " con la distancia de 2-parámetros de Kimura (Tamura et al. 2004). Las secuencias obtenidas en este estudio fueron registradas en el GenBank con acceso No MH091805 - MH091810. La nomenclatura taxonómica para el digeneo sigue a Dronen y Blend (2015). La nomenclatura taxonómica del hospedero sigue a Schulenberg et al. (2010).
Resultados
Según las características morfológicas de los digeneos estudiados, así como el diagnóstico molecular de los genes mitocondriales nad1 y cox1 parcialmente amplificados, se sugiere que los digeneos corresponden al género Cyclocoelum Brandes, 1892 y la especie a C. mutabile .
Cyclocoelum mutabile (Zeder, 1800)Clase: Trematoda
Subclase: Digenea
Orden: Echinostomida
Familia: Cyclocoelidae Stossich, 1902
Subfamilia: Cyclocoelinae Stossich, 1902
Género: Cyclocoelum Brandes, 1892
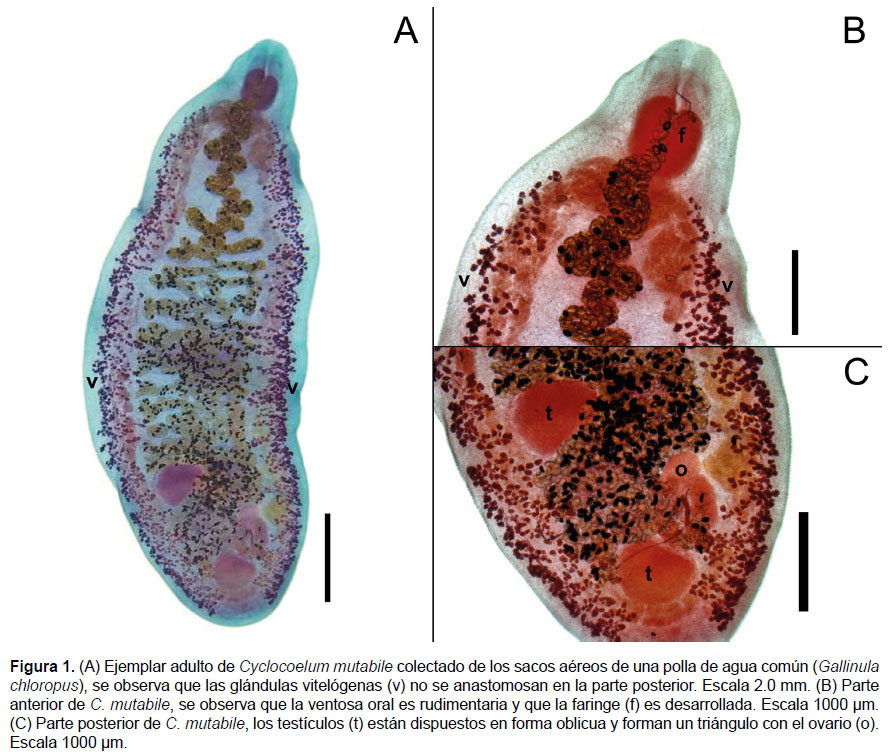
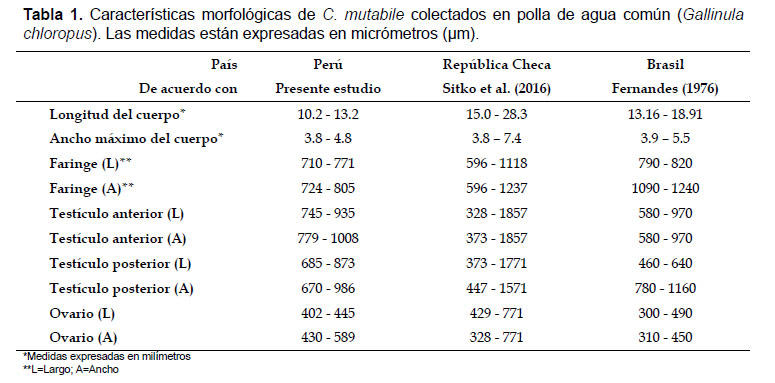
Descripción basada en 4 especímenes adultos y enteros.
Digeneos de cuerpo alargado con extremidades redondeadas. Tiene un largo de 10.2 – 13.2 (12.2; ES = 2.71) mm y un ancho máximo de 3.8 – 4.8 (4.5; ES = 0.91) mm a nivel del tercio posterior del cuerpo (Figura 1a). Ventosa oral muy rudimentaria en posición terminal, tiene un largo de 580 – 642 (614; ES = 13) µm y un ancho de 601 – 822 (723; ES = 49) µm. Ventosa ventral o acetábulo ausente. Presenta faringe desarrollada de 710 – 771 (741; ES = 15) µm de largo y 724 – 805 (759; ES = 20) µm de ancho (Figura 1b). Esófago corto y ciegos simples que se anastomosan en el extremo posterior. Poro genital localizado en la parte media ventral y anterior de la faringe, en la línea media del cuerpo.
Testículos grandes y esféricos, ligeramente ovalados y simétricos, se localizan en el extremo posterior del cuerpo. Los testículos están dispuestos en forma oblicua y forman un triángulo con el ovario (Figura 1c). El testículo anterior se sitúa en posición dextral a la línea media y mide 745 – 935 (831; ES = 40) µm de largo por 779 – 1008 (889; ES = 50) µm de ancho. El testículo posterior situado en posición sinestral a la línea media y mide 685 – 873 (803; ES = 41) µm de largo por 670 – 986 (837; ES = 79) µm de ancho. La vesícula seminal se encuentra dentro del saco cirro, el cual es pequeño y se abre en el poro genital. El saco del cirro mide 886 – 912 (901; ES = 6) µm de largo y 168 – 289 (208; ES = 28) µm de ancho.
El ovario es de forma esférica y se localiza en el lado opuesto del testículo anterior, mide 402 – 445 (416; ES = 10) µm de largo por 430 – 589 (485; ES = 36) µm de ancho. Las glándulas vitelógenas son simétricas y se distribuyen lateralmente a los ciegos intestinales, sin llegar a unirse a nivel posterior del cuerpo. El útero es desarrollado y ocupa todo el espacio intercecal formando pliegues y sin cubrir los ciegos, desembocando en el poro genital. Los huevos dentro del útero miden 112 – 118 (116; ES = 0.6) µm de largo y 54 – 60 (57; ES = 0.6) µm de ancho.
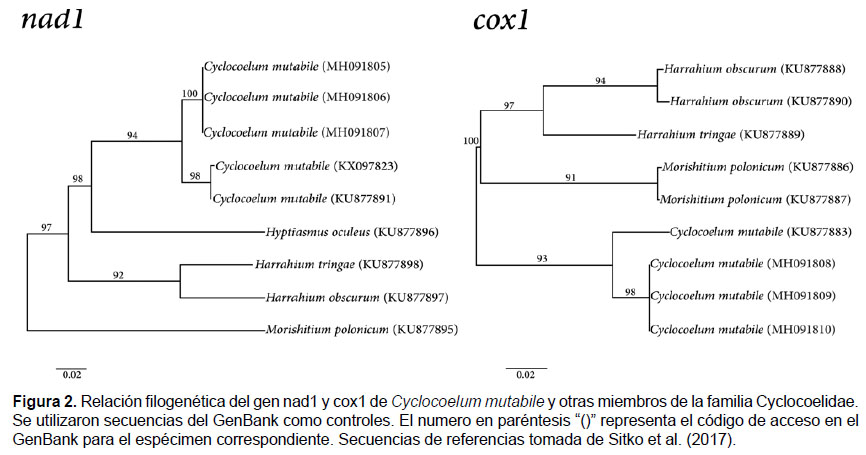
Se amplifico un total de 414 pares de bases (pb) del gen cox1 para los tres especímenes de C. mutabile (MH091805 - MH091807) y mostraron una identidad del 100%. Estos fueron comparados con el único registro de C. mutabile del GenBank (acceso No KU877883) (Sitko et al. 2017), y tuvieron una identidad del 96%. La amplificación parcial del gen nad1 de C. mutabile del presente estudio (MH091808 - MH091810) fue de 455pb, y mostraron una identidad del 100%. Las secuencias nad1 obtenidas de C. mutabile fueron comparadas con los registros del GenBank (acceso No KX097823 y KU877891) (Sitko et al. 2017), y mostraron una identidad de 97% (Fig.2).
Discusión
Los parámetros morfológicos de los digeneos del presente estudio coincidieron con las descripciones para C. mutabile, miembro de la familia Cyclocoelidae (Tabla 1). El diagnóstico fue confirmado al analizar parcialmente la secuencia de los genes mitocondriales cox1 y nad1, llegando a ser 96% y 97% similares con otras secuencias de C. mutabile registradas en el GenBank, respectivamente.
En este estudio, el análisis molecular de C. mutabile se realizó amplificando parcialmente los genes cox1 y nad1, se ha demostrado que estos genes son marcadores genéticos de poblaciones para varias especies de digeneos como Fasciola hepatica (Linnaeus, 1758) y Schistosoma japonicum (Katsurada, 1904) (Mas-Coma et al. 2009, Gobert et al. 2014). En nuestro estudio, C. mutabile mostró una diferencia de nucleótidos de 4% y 3% para los genes cox1 y nad1, respectivamente. Resultados similares han sido reportados para otras especies de helmintos analizando estos genes (Kedra et al. 2001, Lavikainen et al. 2008, Reaghi et al. 2016).
En el Perú, se han registrado 3 digeneos de la familia Cyclocoelidae: Selfcoelum ovopunctatum (Stossich, 1902) en el faláropo tricolor (Phalaropus tricolor (Vieillot, 1819)) en Trujillo (Freitas e Ibañez 1964), Harrahium sp. en el playero pata amarilla (Tringa flavipes (Gmelin, 1789)) de Cajamarca y La Libertad, Uvitellina sp. en el playero pata amarilla de Cajamarca y la Libertad (Tantalean et al. 1992), y en la cigüeñuela común (Himantopus himantopus (Linnaeus, 1758)) de Lambayeque (Tantalean et al. 1992). El presente hallazgo representa la cuarta especie de la familia Cyclocoelidae registrada para el Perú.
Cyclocoelum mutabile , originalmente descrito como Monos-toma mutabile por Zeder (1800), representa la especie tipo del género Cyclocoelum, género establecido por Brandes (1892). Este digeneo fue colectado de la cavidad abdominal de la polla de agua común (G. chloropus) y de la focha común (Fulica atra Linnaeus, 1758), ambas provenientes de Alemania. Posteriormente, el digeneo ha sido registrado en diversos países del mundo, esto debido a que los principales hospederos (G. chloropus y F. atra) corresponden a aves migratorias.
En Sudamérica, C. mutabile ha sido registrada en las aves G. chloropus galeata de Argentina y Brasil (Fernandes 1976, Lunaschi et al. 2007), y en F. armillata y en P. maculatus de Argentina (Lunaschi et al. 2007). El presente hallazgo representa el primer de registro de C. mutabile para el Perú, ampliando así la distribución geográfica del parásito.
Información sobre los autores:
LAGP y MYS: realizaron los muestreos; LAGP, MTLU y AEG: analizaron los datos; LAGP, MYS, MTLU y AEG redactaron, revisaron y aprobaron el manuscrito.
Los autores no incurren en conflicto de intereses.
Literatura citada
Bowles J. & D.P. McManus. 1994. Genetic characterization of the Asian Taenia, a newly described taeniid cestode of humans. American Journal of Tropical Medicine and Hygiene 50: 33 – 44. https://doi.org/10.4269/ajtmh.1994.50.1.TM0500010033 [ Links ]
Brandes G. 1892. Révision der Monostomiden. Centralblatt für Bakteriologie und Parasitenkunde 12: 504 – 511. [ Links ]
Dronen N.O. & C.K. Blend. 2015. Updated keys to the genera in the subfamilies of Cyclocoelidae Stossich, 1902, including areconsideration of species assignments, species keys and the proposal of a new genus in Szidatitreminae Dronen, 2007. Zootaxa. 4053:1 – 100. doi: https://doi.org/10.11646/zootaxa.4053.1.1 [ Links ]
Fernandes B.M.M. 1976. Sobre as especies brasileiras da familiaCyclocoelidae Kossack 1911 (Trematoda, Cyclocoelidae). Memorias do Instituto Oswaldo Cruz 74: 289 – 294. doi: http://dx.doi.org/10.1590/S0074-02761976000300008 [ Links ]
Freitas J.F.T. & N. Ibañez. 1964. Sobre un trematodo Cyclocoelidae parasite de ave migratoria. Revista Médica de Cirugía Trujillo. 2, 97 – 107. [ Links ]
Gobert G.N., H. You & D. P. McManus. 2014. Gaining biological perspectives from schistosome genomes. Molecular andBiochemical Parasitology 196: 21 – 28. doi: https://doi.org/10.1016/j.molbiopara.2014.07.007 [ Links ]
Kedra A.H., V.V. Tkach, Z. Swiderski & Z. Pawlowski. 2001. Intraspecific variability among NAHD dehydrogenasesubunit 1 sequences of Taenia hydatigena. ParasitologyInternational 50: 145 – 148. doi: https://doi.org/10.1016/S1383-5769(01)00064-2 [ Links ]
Kostadinova A., E.A. Herniou, J. Barrett & D. T. J. Littlewood. 2003. Phylogenetic relationships of Echinostoma Rudolphi, 1809 (Digenea: Echinostomatidae) and relatedgenera re-assessed via DNA and morphological analyses.Systematic Parasitology 54: 159 – 176. doi: https://doi.org/10.1023/A:1022681123340 [ Links ]
Lamothe-Argumedo R. & A. Orozco-Flores. 2000. Nota sobre Cyclocoelum obscurum (Trematoda: Cyclocoelidae) registradopor primera vez en Baja California Sur, México. Anales del Instituto de Biología. Serie Zoología 71: 89 – 92. [ Links ]
Lavikainen A., V. Haukisalmi, M.J. Lehtinen, H. Henttonen, A. Oksanen & S. Meri. 2008. A phylogeny of members of the family Taeniidae based on the mitochondrial cox1 and nad1gene data. Parasitology 135: 1457 – 1467. doi: https://doi.org/10.1017/S003118200800499X [ Links ]
Lumsden R.D. & J.A. Zischke. 1963. Studies on the trematodes of Louisiana birds. Zeitschrift für Parasitenkunde 22: 316 –366. doi: https://doi.org/10.1007/BF00260192 [ Links ]
Lunaschi L.I., F. Cremonte & F.B. Drago. 2007. Checklist of digeneanparasites of birds from Argentina. Zootaxa 1403: 1 – 36. doi: https://doi.org/10.11646/zootaxa.1403.1.1 [ Links ]
Mas-Coma S., M.A. Valero & M.D. Bargues. 2009.Chapter 2.Fasciola, lymnaeids and human fascioliasis, with a global overview on disease transmission, epidemiology, evolutionary genetics, molecular epidemiology and control. Advances in Parasitology 69: 41 – 146. doi: https://doi.org/10.1016/S0065-308X(09)69002-3 [ Links ]
McKindsey C.W., J.K. Goring & J.D. McLaughlin. 1994. In vivo andin vitro studies on the viability and the infectivity to coots, Fulica americana, of Cyclocoelum mutabile metacercariae from three species of snails. Canadian Journal of Zoology 72: 1186 – 1190. doi: https://doi.org/10.1139/z94-159 [ Links ]
McLaughlin, J.D. 1986. The biology of Cyclocoelum mutabile(Trematoda) infections in American coots. Proceedings of the Helminthological Society of Washington 53: 177 – 1 81. [ Links ]
McLaughlin J.D. 1976. Experimental studies on the life cycle of Cyclocoelum mutabile (Zeder) (Trematoda: Cyclocoelidae).Canadian Journal of Zoology 54: 48 – 54. doi: https://doi.org/10.1139/z76-005 [ Links ]
Reaghi S., A. Haghighi, M.F. Harandi, A. Spotin, K. Arzamani & S. Rouhani. 2016. Molecular characterization of Fasciola hepatica and phylogenetic analysis based on mitochondrial(nicotiamide adenine dinucleotide dehydrogenase subunit I and cytochrome oxidase subunit I) genes from the North-East of Iran. Veterinary World 9: 1034-1038. doi: 10.14202/vetworld.2016.1034-1038 [ Links ]
Schulenberg T.S., D.F. Stotz, D.F. Lane, J.P. ONeill & T.A. Parker III.2010. Aves de Perú. Princeton University Press, Princeton, New Jersey, 660 p. [ Links ]
Scott M.E., M.E. Rau & J.D. McLaughlin. 1982. A comparison of aspects of the biology of two subspecies of Typhlocoelum cucumerinum (Digenea: Cyclocoelidae) in three familiesof snails (Physidae, Lymnaeidae and Planorbidae). International Journal for Parasitology 12: 123 – 133. doi: https://doi.org/10.1016/0020-7519(82)90007-8 [ Links ]
Sitko J., J. Bizos & P. Heneberg. 2017. Central European parasitic flatworms of the Cyclocoelidae Stossich, 1902 (Trematoda: Plagiorchiida): molecular and comparative morphological analysis suggests the reclassification of Cyclocoelum obscurum (Leidy, 1887) into the Harrahium Witenberg, 1926. Parasitology 144: 368 – 383. doi: https://doi.org/10.1017/S0031182016001955 [ Links ]
Taft S.J. 1972. Aspects of the life history of Cyclocoelum oculeum (Trematoda: Cyclocoelidae). Journal of Parasitology 58:882 – 884. doi: https://doi.org/10.2307/3286577 [ Links ]
Taft S.J. 1974. Notes on the larval stages of Cyclocoelum vanelli(Trematoda: Cyclocoelidae). Journal of Parasitology 60:904. doi: https://doi.org/10.2307/3278506 [ Links ]
Tamura K., M. Nei & S. Kumar. 2004. Prospects for inferring very large phylogenies by using the neighbor-joining method. Proceedings of the National Academy of Sciences of theUnited States of America 101: 11030 – 11035. doi: http://dx.doi.org/10.1073/pnas.0404206101 . [ Links ]
Tantalean V.M., B.L. Sarmiento & P.A. Huiza. 1992. Digeneos (Trematoda) del Perú. Boletín de Lima 80: 47 – 84. [ Links ]
Zeder J.G.H. 1800. Erster Nachtrag zur Naturgeschichte der Eingeweidewümer mit zufässen und Anmerkungen. Herausgegeben von Johann Georg Heinrich Zeder. Goez, J.A.E. (Ed.).Siegfried Liver-genuinly Crusius, Leipzig, Germany, 320 p. [ Links ]
*Autor para correspondencia:
E-mail: Luis A. Gomez-Puerta: lgomezp@unmsm.edu.pe; lucho92@yahoo.com
E-mail: Martha Y. Salas: msalasfa@gmail.com
E-mail: Maria T. Lopez-Urbina: mlopezu@unmsm.edu.pe
E-mail: Armando E. Gonzalez: agonzalezz@unmsm.edu.pe
Presentado: 22/03/2018
Aceptado: 02/08/2018
Publicado online: 25/09/2018