Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.25 no.3 Lima jul./set. 2018
http://dx.doi.org/10.15381/rpb.v25i3.14786
COMENTARIOS
La epibiosis en los grandes vertebrados marinos de México: una revisión y su relevancia ecosistémica
Epibiosis in the large marine vertebrates from Mexico: a review and their ecosystemic relevance
Marco Violante-Huerta 1
1 Universidad Nacional Autónoma de México, Posgrado en Ciencias del Mar y Limnología. Circuito exterior s/n, Ciudad Universitaria, C.P.04510, Ciudad de México, México.
Resumen
En este trabajo se revisan los casos de epibiosis reportados en los grandes vertebrados de México. La revisión de literatura incluye las publicaciones realizadas al mes de junio de 2018 considerando los 17 estados del litoral costero de la república mexicana. Se encontraron 21 trabajos de investigación, los cuales reportan un total de 73 especies epibiontes de flora y fauna asociados superficialmente a ocho especies de grandes vertebrados marinos: Lepidochelys olivácea, Eretmochelys imbricata, Chelonia mydas, Trichechus manatus manatus, Fe resa attenuata, Crocodylus acutus, C. moreletii, Caiman crocodilus chiapasius . El grupo epibionte dominante fueron los crustáceos, especialmente los cirrípedos. La interacción predominante fue el comensalismo, sin embargo se reconocieron grupos parasitarios como los copépodos del genero Balaenophilus que afectan principalmente a tortugas marinas. Se analizó la relevancia del estudio del biofilm, así como sus implicaciones ecológicas, taxonómicas por la presencia de nuevas especies para la ciencia y de conservación de las especies basibiontes para establecer criterios que ayuden a comprender su importancia en los ecosistemas marinos y por lo tanto fomentar su estudio en la región.
Palabras clave : ballena; cocodrilo; manatí del Caribe; tortugas marinas; simbiosis.
Abstract
The aims of this work is review epibiosis reported on the large marine vertebrates from Mexico. The literature review include reporting cases on any of 17 states of the littoral coast of the Mexican Republic, and those published until June 2018. Twenty one papers were found, which report a total of 73 species of flora and fauna superficially associated with eight species of large marine vertebrates: Lepidochelys olivacea, Eretmochelys imbricata, Chelonia mydas, Trichechus manatus manatus, Feresa attenuata, Crocodylus acutus, C. moreletii, Caiman crocodilus chiapasius . The dominant epibiont group was the crustaceans, especially barnacles. The predominant interaction was commensalism, however, parasitic groups were recognized such as the copepods genus Balaenophilus that affects mainly to sea turtles. The relevance of the study of the biofilm, as well as the ecological implications, the presence of new marine species and the conservation of the basibionts species were analyzed to establish criteria that help to understand the importance in marine ecosystems and therefore encourage their study in the region.
Keywords: Caribbean manatee; crocodile; marine turtles; symbiosis; whale.
Introducción
La epibiosis es una interacción facultativa de un ser vivo (epibionte) que habita sobre otro (basibionte) superficialmente (Wahl 1989). Este tipo de interacción es muy común en organismos marinos como algas, invertebrados y vertebrados, sin embargo, su presencia, distribución y proporción en el basibionte está en función de su capacidad para la generación de sustancias químicas o formas de locomoción (sésil o errante) que permitan la colonización de organismos pioneros y/o incrustantes (Wahl et al. 2012). En su primera fase, el proceso de colonización se da principalmente por bacterias que, en conjunto con algunos grupos de eucariontes como diatomeas, hongos y protozooarios, generan una película delgada sobre la superficie del hospedero (basibionte) llamada biofilm, que representa un medio rico en nutrientes y alimento para organismos de mayor tamaño, por lo que se da un proceso de sucesión ecológica que interfiere en los flujos de información, energía y materia entre el basibionte y su hábitat (Wahl et al. 2012).
Por otro lado, las interacciones de epibiosis han sido utilizadas de diversas maneras, por ejemplo como indicadores de conectividad entre regiones (Liria-Loza 2011), salud de los hospederos (basibiontes) (Halvorsen & Keith 2008) e incluso indicadores de la existencia de nuevas entidades taxonómicas, esto por su marcada especificidad en la relación epibionte-basibionte (Frankovich et al. 2015a, b). En México, los estudios de epibiosis predominantes son los relacionados con sistemas de manglar (Salgado-Barragán & Hendrickx 2002a, b; García-Guerrero & Hendrickx 2003; Ruiz & López-Portillo 2014), mientras que en organismos marinos de gran tamaño como tortugas marinas, cocodrilos, manatíes y cetáceos, el registro de la epibiota que les acompaña es escaso. Por lo anterior, el presente trabajo plantea una revisión exhaustiva del conocimiento actual de la epibiosis en los grandes vertebrados marinos de México con el fin de analizar el tipo de interacciones reportadas y su relevancia ecosistémica para determinar nuevas posibles líneas de investigación en la región.
Búsqueda de literatura
Para la recolección de bibliografía especializada en el tema se consideró la información generada de epibiosis del litoral costero de México, abarcando las playas y estuarios de los 17 estados costeros (Pacífico mexicano, Golfo de México y Caribe mexicano), en donde se observaron interacciones superficiales con grandes vertebrados marinos. Se consultaron fuentes de información como artículos científicos (originales, notas y revisiones), reportes técnicos, tesis y resúmenes de congresos nacionales encontrados en las principales bases de datos de acceso abierto y buscadores académicos como Google, Google Scholar, Scopus, JSTOR, Latindex, Web of science, BioOne, Researchgate y Elsevier, así como índices institucionales de las principales universidades y centros de investigación nacionales (con énfasis en aquellas con estudios en ciencias marinas y limnología), con el fin de acceder a las tesis no disponibles en la red.
Se utilizaron palabras clave como: México, epibionte, parasitismo, ectoparásito, biofilm, colonizadores, cocodrilo, manatí, tortuga marina, ballena, delfín, cirrípedo, mamíferos marinos, en su versión plural y singular en español e inglés.
Registros epibiontes
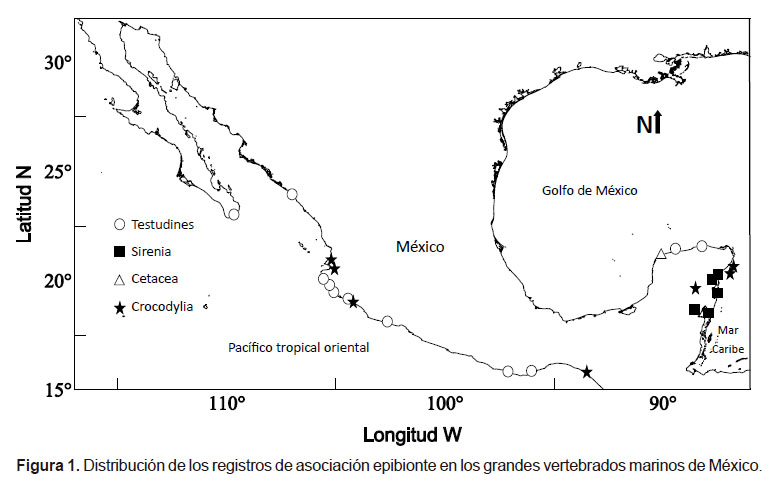
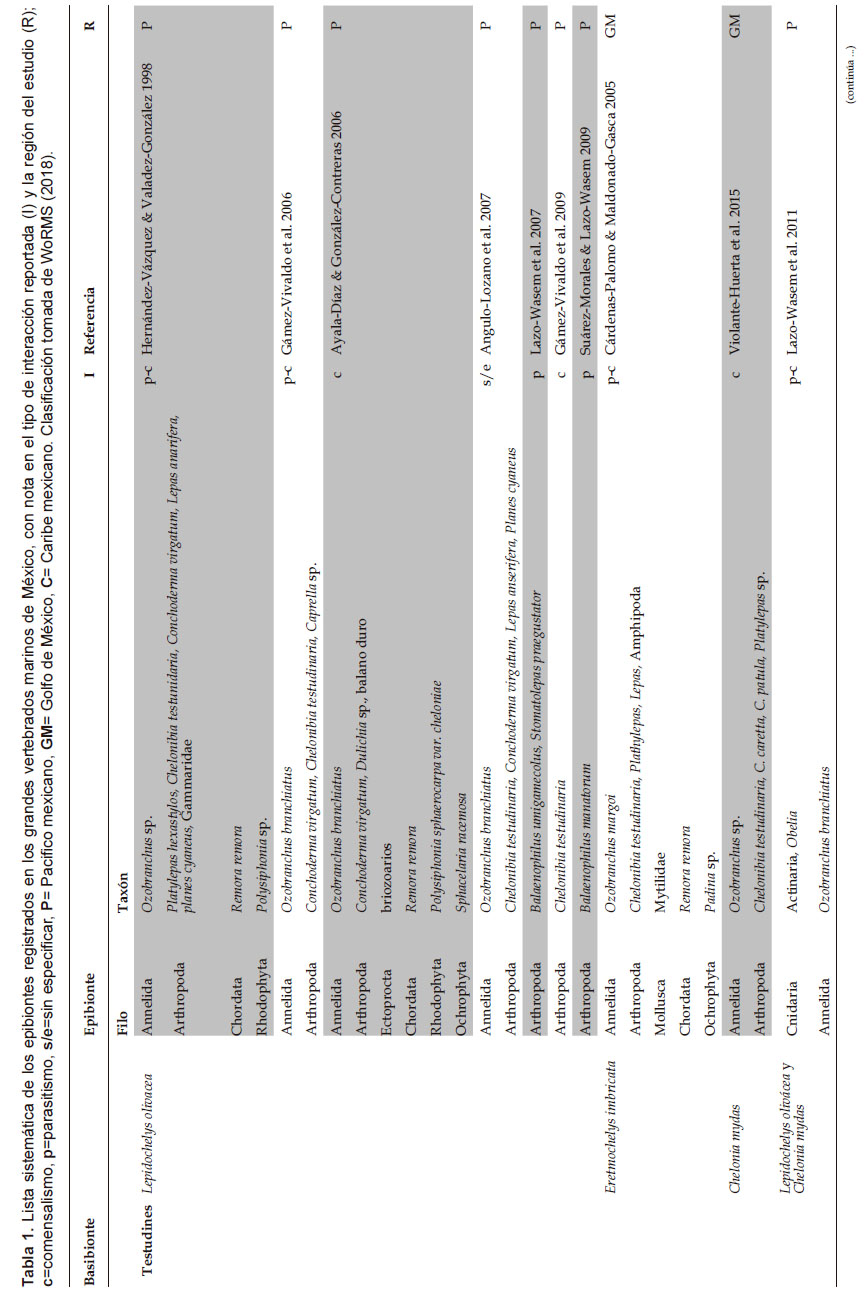
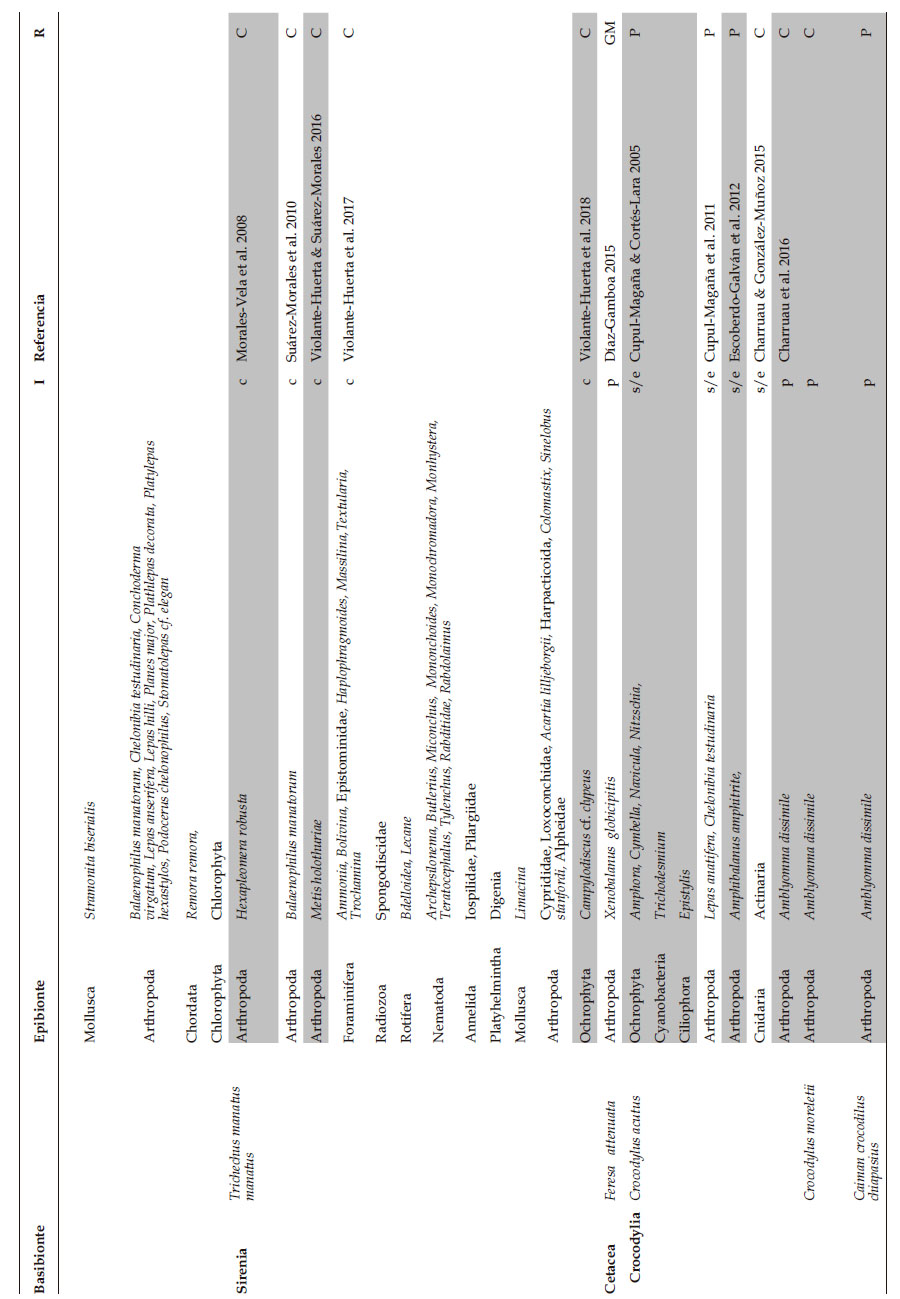
Al mes de junio de 2018, la literatura sobre los registros de epibiosis en los grandes vertebrados marinos de México asciende a 21 trabajos de investigación (Tabla 1), entre los cuales, 19 son artículos en revistas científicas, una tesis de licenciatura y un resumen de congreso que, en su conjunto, reportan un total de 73 especies epibiontes pertenecientes a 16 fila que fueron observadas en 8 especies de grandes vertebrados marinos: tortugas marinas (3), manatí del Caribe, orca pigmea y cocodrilos (3) en diferentes estados del país (ej. Jalisco, Colima, Yucatán, Quintana Roo), siendo más abundantes en el Pacífico mexicano en comparación con el Golfo de México y Caribe mexicano (Fig. 1; Tabla 1). Entre los epibiontes más reportados, los crustáceos son los dominantes con 29 taxa, de los cuales las especies de cirrípedos son las más comúnmente encontradas (13 taxa) en tortugas marinas, cetáceos y cocodrilos. Además, se han reportado otros grupos taxonómicos como nematodos (10), foraminíferos (7), diatomeas (5), anélidos (4), entre otros (Tabla 1).
Tipo de interacción epibionte
El comensalismo es el tipo de interacción predominante en los reportes de epibiosis en los grandes vertebrados marinos de México (Tabla 1) por lo que los epibiontes no tendrían efecto negativo sobre la salud del basibionte, sin embargo, especies comoBalaenophilus umigamecolus Ogawa, Matasuzaki & Misaki , Balaenophilus manatorum Ortiz, Rogelio Lalana & Torres Fundora, Stomatolepas praegustator Pilsbry y Ozobranchus branchiatus Menzies, observados en tortugas marinas; Xenobalanus globicipitis Steenstrup observado en orca pigmea; y Amblyomma dissimile Koch observado en cocodrilos, son ampliamente reconocidas como organismos que causan daño cutáneo o del caparazón de las especies basibiontes en su estado adulto.
Los reportes de las dos especies de copépodo del género Balaenophilus Aurivillius P.O.C. fueron asociados a heridas o irritaciones en la piel de tortugas marinas adultas-juveniles (Lazo-Wasem et al. 2007; Suárez-Morales & Lazo-Wasem 2009), sin haber reportes en ejemplares neonatos en México. Crespo-Picazo et al. (2017) han encontrado que la interacción parasitaria con organismos recién eclosionados en cautiverio tiende a aumentar la tasa de mortalidad de los neonatos de tortugas marinas infectadas ya que el consumo de citoqueratina de la piel por parte de los copépodos, sumado a su alta abundancia, provocan la infección necrótica de la piel por la presencia de bacterias oportunistas que se encuentran en el medio. Por estos motivos, es importante el estudio de la interacción identificada en México en organismos silvestres y en cautiverio, debido a que podría coincidir con lo observado por Crespo-Picazo et al. (2017) en neonatos de tortuga marina cautivas.
En manatíes, los reportes de epibiosis por copépodos harpacticoides como B. manatorum y Metis holothuriae Edwards no indicaron daño cutáneo en las áreas donde fueron recolectados, en su lugar, resaltan la presencia de diferentes estadios del desarrollo de vida de los copépodos (Suárez-Morales et al. 2010; Violante-Huerta & Suárez-Morales 2016; Violante-Huerta et al. 2017), lo que indicaría que la superficie de la piel del manatí representa un sustrato idóneo para el establecimiento de dichas poblaciones y en contraste con lo observado en tortugas marinas, la interacción con sirenios seria comensal en México.
La alta prevalencia de los copépodos del género Balaenophilus en tortugas marinas puede ser consecuencia de la capacidad de nado que desarrollaron los copépodos altamente especializados para la búsqueda de tortugas marinas, debido a que aprovechan su piel como recurso alimenticio (Domènech et al. 2017). Esta capacidad de desplazamiento de los copépodos aumenta la probabilidad de infección entre tortugas marinas que tengan contacto o se encuentren distribuidas de forma agregada como lo sugiere Domènech et al. (2017), lo cual podría ser similar en las poblaciones de manatí que comparten hábitat en el Caribe mexicano y Golfo de México.
Ozobranchus branchiatus se alimenta principalmente de sangre de tortugas marinas, en zonas de piel blanda (Violante-Huerta et al. 2015) en donde pueden o no presentarse fibromas que indican la infección por un virus de herpes común en tortuga verde, tortuga boba y tortuga golfina. Greenblatt et al. (2004) examinaron el ADN de ejemplares de Ozobranchus presentes en tortuga verde por medio de PCR cuantitativa para determinar la carga viral del FPTHV (fibropapiloma asociado a virus de herpes en tortugas marinas, por sus siglas en ingles), y encuentran que las especies del genero Ozobranchus son los principales vectores del virus a nivel especifico, más que por la infección directa del agua marina.
Por su parte, el acaro A. dissimile no representa un riesgo para la salud de los cocodrilos en México aparentemente, sin embargo, es importante realizar estudios microbiológicos debido a que esta especie es conocida como vector de Ehrlichia rumi nantium Dumler, bacteria que provoca la hidropericardia que afecta a animales domésticos como el ganado y las aves (Scott & Durden 2015).
La relación entre la epibiosis y el ectoparasitismo (conceptos comúnmente usados como uno solo) es muy estrecha, ya que de acuerdo con Mouritsen (2017) la biota asociada superficialmente con organismos que carecen de estrategias de defensa ante organismos colonizadores que pueden o no representar un riesgo para la salud del basibionte, es autorregulada por exclusión competitiva entre los epibiontes presentes y parásitos oportunistas, por lo que es importante establecer la relación simbiótica con el basibionte.
Relevancia ecosistémica
El análisis de la biota epibionte es imprescindible para entender mejor el funcionamiento de los ecosistemas a micro y macro escala, debido a que la megafauna marina tiende a establecer procesos migratorios entre ambientes marinos y estuarinos por lo que podrían funcionar como corredores ecológicos de especies epibiontes que tengan alta tolerancia a los cambios de las condiciones fisicoquímicas de medio (ej. cirrípedos), contribuyendo a su dispersión (Liria-Loza 2011). Además, la presencia del biofilm sobre un organismo vivo tiene un efecto importante en la interacción del medio acuático con la superficie viva (piel o escama) ya que regula el intercambio de componentes fisicoquímicos como la radiación de luz solar, intercambio de gases, infecciones bacterianas y/o parasitarias, etc., así como el papel que representa en el flujo de energía y materia del ecosistema al presentar organismos pioneros de primer orden trófico como bacterias y microalgas (Wahl et al. 2012).
El grado de especificidad en la interacción permitiría afirmar que hay una alta probabilidad de encontrar nuevas especies de epibionte, tal como lo demostraría la alta frecuencia de especies nuevas de diatomeas epibiontes que han sido reportadas recientemente en tortugas marinas y sirenios, por ejemplo: Tursiocola densyii Frankovich y M.J. Sullivan sp. nov. (Frankovich et al. 2015a);Tursiocola ziemanii Frankovich y M.J. Sullivan, sp. nov., Tursiocola varicopulifera Frankovich y M.J. Sullivan, sp. nov. y Tursiocola costata Frankovich & M.J. Sullivan, sp. nov. (Frankovich et al. 2015b); Achanthes elongata Majewska et Van de Vijversp. nov. y Achanthes squaliformis Majewska et Van de Vijver sp. nov. (Majewska et al. 2017); Tripterion societatis Riaux-Gobin, Witkowski y Ector sp. nov. (Riaux-Gobin et al. 2017). Las nuevas especies de diatomeas epibiontes mencionadas anteriormente fueron recolectadas del caparazón de tortugas marinas o de la piel de manatí T. manatus ya que se reconoce a ambos basibiontes como sustratos idóneos para el asentamiento y desarrollo de organismos fotosintéticos alrededor del planeta (Frankovich et al. 2015b; Robinsón et al. 2016; Violante-Huerta et al. 2017; Violante-Huerta et al. 2018).
También se reportó la presencia de un nuevo linaje de diatomeas heterótrofas (no fotosintéticas), así como tres nuevas especies apocloroticas del genero Tursiocola sobre la piel de manatíes de Florida (Frankovich et al. 2018). Razón por la que en México, el estudio de los organismos fotosintéticos epibiontes y la fauna epibionte que le acompaña representaría una oportunidad para el hallazgo de nuevas especies antes desconocidas para la ciencia. Por lo anterior, es necesario aplicar técnicas moleculares para la identificación certera de la epibiota que permitan la determinación de la diversidad presente sobre los vertebrados marinos, como lo realizaron Rivera et al. (2018) para la caracterización del biofilm en tortugas marinas, en donde sugieren que el método utilizado minimiza el tiempo de análisis, reduce la necesidad de especialistas por grupo taxonómico y aumenta la posibilidad de encontrar nuevas especies en menor tiempo usando bases de datos genéticos de referencia.
La escasa investigación sobre epibiosis en México puede estar vinculada a la problemática general del estudio sistemático de los grandes vertebrados marinos, como problemas taxonómicos de los basibiontes, la escala geográfica del muestreo e inclusive la temporalidad, son todos factores que dificultan un numero estadísticamente significativo de basibiontes (Robinson et al. 2017), máxime cuando las poblaciones de los grandes vertebrados marinos tienen un estatus de vulnerabilidad en la lista roja de especies amenazas de la IUCN y por consecuente de protección por su reducido tamaño poblacional en México (NOM-059-SEMARNAT-2010 2010). Sin embargo, es importante considerar la aplicación de estudios que analicen la epibiota de organismos con relevancia de conservación, ya que éstos basibiontes representan micro ecosistemas móviles en donde se desarrollan procesos de dispersión de especies, participación en el flujo de energía, especiación, etc. factores que le brindan un valor agregado que puede servir como argumento de conservación adicional al basibionte per se en México y la región.
Agradecimientos
El autor agradece al Consejo Nacional de Ciencia y Tecnología (CONACYT) por el otorgamiento de la beca de posgrado.
Información sobre los autores:
MVH realizó la búsqueda de información, el ordenamiento de los datos, la interpretación y la escritura del trabajo final.
El autor declara no tener conflicto de intereses.
Literatura citada
Angulo-Lozano L., P. Nava-Duran & M. Frick. 2007. Epibionts of Olive Ridley Turtles Nesting at Playa Ceuta, Sinaloa, Mexico. Marine Turtle Newsletter 118: 13-14. [ Links ]
Ayala-Díaz M. & I. González-Contreras. 2006. Epibiontes de Tortuga Golfina (Lepidochelys olivácea) en las Costas de San José del Cabo, Baja California Sur. Tesis de Licenciatura. Universidad Autónoma de Baja California Sur. 63 p. Acceso 20/04/2018. [ Links ]
Cárdenas-Palomo N. & A. Maldonado-Gasca. 2005. Epibiontes de tortugas de carey juveniles Eretmochelys imbricata en el Santuario de Tortugas Marinas de Río Lagartos, Yucatán, México. CICI MAR Oceánides 20(1,2): 29-35. [ Links ]
Charruau P. & R. González-Muñoz. 2015. Epibiont sea anemones inhabiting the American crocodile Crocodylus acutus. Marine Biodiversity 46:11-12. https://doi.org/10.1007/s12526-015-0337-5 [ Links ]
Charruau P., J. Pérez-Flores, J.R. Cedeño-Vázquez, et al. 2016. Occurrence of Amblyomma dissimile on wild crocodylians in southern Mexico. Diseases of aquatic organisms 121(2): 167-171. https://doi.org/10.3354/dao03042 [ Links ]
Crespo-Picazo J.L., D. García-Parraga, F. Domènech, et al. 2017. Parasitic outbreak of the copepod Balaenophilus manatorum in neonate loggerhead sea turtles (Caretta caretta) from a head-starting program. BMC Veterinary Research 13: 154. https://doi.org/10.1186/s12917-017-1074-8 [ Links ]
Cupul-Magaña F.G. & M.C. Cortés-Lara. 2005. Primer registro de epibiontes en ejemplares juveniles de Crocodylus acutus en el medio silvestre / First record of epibionts in Crocodylus acutus juvenile individuals in the wild. Caldasia 27(1):147-149. http://dx.doi.org/10.15446/caldasia [ Links ]
Cupul-Magaña F.G., A. Rubio-Delgado, A. Escobedo-Galván, et al. 2011. First report of the marine barnacles Lepas anatifera and Chelonibia testudinaria as epibionts on American crocodile (Crocodylus acutus). Herpetology Notes 4:213-214. [ Links ]
Díaz-Gamboa R. 2015. Varamiento de orcas pigmeas (Feresa attenuata Gray, 1874) en Yucatán: reporte de caso. Bioagrociencias 8(1): 36-43. [ Links ]
Domènech F., J. Tomás, J.L. Crespo-Picazo, et al. 2017. To swim or not to swim: potential transmission of Balaenophilus Manatorum (Copepoda: Harpacticoida) in marine turtles. PloS one 12(1): e0170789. https://doi.org/10.1371/journal.pone.0170789 [ Links ]
Escobedo-Galván A.H., J.H. Gaviño-Rodríguez, E.A. Reyes-Herrera, et al. 2012. Occurrence of Amphibalanus amphitrite (Darwin, 1854)(Cirripedia, Balanidae) on Crocodylus acutus (Reptilia, Crocodylia) in Colima, Mexico. Crustaceana 85(9): 1145-1148. https://doi.org/10.1163/15685403-00003118 [ Links ]
Frankovich T., M.J. Sullivan & N. Stacy. 2015a. Tursiocola denysii sp. nov. (Bacillariophyta) from the neck of Longgerhead sea turtles (Caretta caretta). Phytotaxa 234(3): 227-236. doi:10.11646/phytotaxa.234.3.3. [ Links ]
Frankovich T., M.J. Sullivan & N. Stacy. 2015b. Three New Species of Tursiocola (Bacillariophyta) from the Skin of the West Indian Manatee (Trichechus manatus). Phytotaxa 204(1): 033-048. https://doi.org/10.11646/phytotaxa.204.1.3 [ Links ]
Frankovich T., M.P. Ashwort, M.J. Sullivan, et al. 2018. Epizoic and Apochlorotic Tursiocola species (Bacillariophyta) from the Skin of Florida Manatees (Trichechus manatus latirostris). Protist (en prensa). https://doi.org/10.1016/j.protis.2018.04.002 [ Links ]
Gámez-Vivaldo S., D. Osorio-Sarabia, C. Peñaflores-Salazar, et al. 2006. Identificación de parásitos epibiontes de la tortuga Golfina (Lepidochelys olivácea) que arribó a playas de Michoacán y Oaxaca, México. Veterinaria Mexicana 37(4): 431-440. [ Links ]
Gámez-Vivaldo S., L.J. García-Márquez, D. Osorio-Sarabia, et al. 2009. Patología de las tortugas marinas (Lepidochelys olivacea) que arribaron a las playas de Cuyutlán, Colima, México. Veterinaria Mexicana 40(1): 69-78. [ Links ]
García-Guerrero M. & M.E. Hendrickx. 2003. Distribution of isopods (Peracarida, Isopoda) associated with prop roots of Rhizophora mangle in a tropical coastal lagoon, southeastern Gulf of California, Mexico. Crustaceana 76: 1153-1169. https://doi.org/10.1163/156854003773123393 [ Links ]
Greenblatt R.J., T. Work, G.H. Balazs, et al. 2004. The Ozobranchus leech is a candidate mechanical vector for the fibropapilloma-associated turtle herpesvirus found latently infecting skin tumors on Hawaiian green turtles (Chelonia mydas). Virology 321(1): 101-110. https://doi.org/10.1016/j.virol.2003.12.026 [ Links ]
Halvorsen K. & E. Keith. 2008. Inmunosuppression cascade in the Florida manatee (Trichechus manatus latirostris). Aquatic Mammals 34:412-419. https://doi.org/10.1578/AM.34.4.2008.412 [ Links ]
Hernández-Vázquez S. & C. Valadez-González. 1998. Observaciones de los epizoarios encontrados sobre la tortuga Golfina Lepidochelys olivácea en La Gloria, Jalisco. México. Ciencias Marinas 24(1): 119-125. https://doi.org/10.7773/cm.v24i1.733 [ Links ]
Lazo-Wasem E., T. Pinou, A. Peña-De-Niz, et al. 2007. New Records of the Marine Turtle Epibiont Balaenophilus umigamecolus (Copepoda: Harpacticoida: Balaenophilidae): New Host Records and Possible Implications for Marine Turtle Health. Bulletin of the Peabody Museum of Natural History 48(1):153-156. https://doi.org/10.3374/0079-032X(2007)48[153:NROTMT]2.0.CO;2 [ Links ]
Lazo-Wasem E., T. Pinou, A. Peña-De-Niz, et al. 2011. Epibionts Associated with the Nesting Marine Turtles Lepidochelys olivacea and Chelonia mydas in Jalisco, Mexico: A Review and Field Guide. Bulletin of the Peabody Museum of Natural History 52(2):221-240. https://doi.org/10.3374/014.052.0203. [ Links ]
Liria-Loza A. 2011. Ecosistemas errantes: epibiontes como indicadores biogeográficos de tortugas marinas en Canarias. Tesis Doctoral. Universidad de Las Palmas de Gran Canaria. España. [ Links ]
Majewska R., M. De Stefano, L. Ector, et al. 2017. Two new epizoic Achnanthes species (Bacillariophyta) living on marine turtles from Costa Rica. Botanica marina 60(3):303-318. https://doi.org/10.1515/bot-2016-0114 [ Links ]
Morales-Vela B., E. Suárez-Morales, J. Padilla-Saldívar, et al. 2008. The tanaid Hexapleomera robusta (Crustacea: Peracarida) from the Caribbean manatee, with comments on other crustacean epibionts. Journal of the Marine Biological Association of the United Kingdom 88(3):591-596. https://doi.org/10.1017/S0025315408000672 [ Links ]
Mouritsen K.N. 2017. Periwinkle regulation: parasitism and epibiosis are linked. Marine Ecology Progress Series 579:227-231. https://doi.org/10.3354/meps12277 [ Links ]
NOM-059-SEMARNAT-2010. 2010. Norma Oficial Mexicana de Protección ambiental-Especies nativas de México de flora y fauna silvestres-Categorías de riesgo y especificaciones para su inclusión, exclusión o cambio-Lista de especies en riesgo. Diario Oficial de la Federación (DOF), jueves 30 de diciembre de 2010. Pp 78. [ Links ]
Riaux-Gobin C., A. Witkowski, J.P. Kociolek, et al. 2017. New epizoic diatom (Bacillariophyta) species from sea turtles in the Eastern Caribbean and South Pacific. Diatom Research 32(1):109-125. https://doi.org/10.1080/0269249X.2017.1299042 [ Links ]
Rivera S.F., V. Vasselon, K. Ballorain, et al. 2018. DNA metabarcoding and microscopic analyses of sea turtles biofilms: Complementary to understand turtle behavior. PloS one, 13(4): e0195770. https://doi.org/10.1371/journal.pone.019577010.1371/journal.pone.0195770 [ Links ]
Robinson N.J., R. Majewska, E.A. Lazo-Wasem, et al. 2016. Epibiotic diatoms are universally present on all sea turtle species. PloS one 11(6): e0157011. https://doi.org/10.1371/journal.pone.0157011 [ Links ]
Robinson N., C. Figgener, C. Gatto, et al. 2017. Assessing potential limitations when characterising the epibiota of marine megafauna: Effect of gender, sampling location, and inter-annual variation on the epibiont communities of olive ridley sea turtles. Journal of Experimental Marine Biology and Ecology 497:71-77. https://doi.org/10.1016/j.jembe.2017.09.012 [ Links ]
Ruiz M. & J. López-Portillo. 2014. Variación espacio-temporal de la comunidad de macroinvertebrados epibiontes en las raíces del mangle rojo Rhizophora mangle (Rhizophoraceae) en la laguna costera de La Mancha, Veracruz, México. Revista de Biología Tropical 62(4): 1309-1330. https://doi.org/10.15517/rbt.v62i4.12582 [ Links ]
Salgado-Barragán J. & M.E. Hendrickx. 2002a. Distribution and abundance of barnacles (Crustacea: Cirripedia) associated with prop roots of Rhizophora Mangle L. in a lagoon of Northwest Mexico. In: M.E. Hendrickx (Ed.), Contributions to the study of East Pacific Crustaceans Vol. 1. Instituto de Ciencias del Mar y Limnología, UNAM. Mexico, pp. 45-60. [ Links ]
Salgado-Barragán J. & M.E. Hendrickx. 2002b. Panopeid crabs (Crustacea: Brachyura: Panopeidae) associated with prop roots of Rhizophora mangle L. in a tropical coastal lagoon of the SE Gulf of California, México. In: Escobar-Briones E. & F. Alvarez (Eds.), Modern approaches to the study of Crustacea, Kluwer Academic/Plenum Publishers. pp. 1-7. https://doi.org/10.1007/978-1-4615-0761-1 [ Links ]
Suárez-Morales E. & E. Lazo-Wasem. 2009. On the morphology of Balaenophilus manatorum (Ortíz, Lalana, and Torres) (Copepoda: Harpacticoida) from Sea Turtles of the Mexican Pacific with Notes on Intraspecific Variation. Comparative Parasitology 76(1):84-92. https://doi.org/10.1654/4351.1 [ Links ]
Suarez-Morales E., B. Morales-Vela, J. Padilla-Saldivar, et al. 2010. The copepod Balaenophilus manatorum (Ortíz, Lalana and Torres, 1992)(Harpacticoida), an epibiont of the Caribbean manatee. Journal of Natural History 44(13-14): 847-859. https://doi.org/10.1080/00222931003615711
Scott J. & L.A. Durden. 2015. Amblyomma dissimile Koch (Acari: Ixodidae) parasitizes bird captured in Canada. Systematic & Applied Acarology 20(8):854–860. https://doi.org/10.11158/saa.20.8.2 [ Links ]
Violante-Huerta M., J.A. Lara-Rodríguez, J. Aménica-Calderón, et al. 2015. Caracterización de la epibiosis en tortugas marinas (Chordata: Cheloniidae) arribadas en el municipio de Progreso, Yucatán, México. XXII Congreso Nacional de Zoología, Mazunte, México. [ Links ]
Violante-Huerta M. & E. Suárez-Morales. 2016. The epiphytic copepod Metis holothuriae (Edwards, 1891) (Harpacticoida), a new epibiont of the caribbean manatee. Crustaceana 89(5):639-644. https://doi.org/10.1163/15685403-00003538 [ Links ]
Violante-Huerta M., R. Díaz-Gamboa & U. Ordóñez-López. 2017. Antillean manatee Trichechus manatus manatus (Sirenia: Trichechidae) as a motile ecosystem of epibiont fauna in the Caribbean Sea, Mexico. Therya 8(3):273-276. https://doi.org/10.12933/therya-17-517 [ Links ]
Violante-Huerta M., U. Ordóñez-López & R. Díaz-Gamboa. 2018. La diatomea epizoica Campylodiscus cf. clypeus (Bacillariophyta: Surirellaceae), un nuevo simbionte del manatí del Caribe en México. Caldasia 40(1):195-198. https://doi.org/10.15446/caldasia.v40n1.65956 [ Links ]
Wahl M. 1989. Marine epibiosis. 1. Fouling and antifouling; some basic aspects. Mar. Ecol. Progr. Ser. 58: 175-189. https://doi.org/10.3354/meps058175 [ Links ]
Wahl M., F. Goecke, A. Labes, et al. 2012. The second skin: ecological role of epibiotic biofilms on marine organisms. Frontiers in microbiology 3:292. https://doi.org/10.3389/fmicb.2012.00292 [ Links ]
WoRMS 2018. World Register of Marine Species. (Acceso 12/06/2018) [ Links ]
Marco Violante-Huerta: marco_violante@hotmail.com
Presentado: 21/06/2018
Aceptado: 15/08/2018
Publicado online: 25/09/2018