Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.25 no.4 Lima oct. 2018
http://dx.doi.org/10.15381/rpb.v25i4.14550
NOTA CIENTÍFICA
Primer registro de Scleroderma bovista (Boletales, Sclerodermataceae) para Colombia
First record of Scleroderma bovista (Boletales, Sclerodermataceae) for Colombia
César Augusto Pinzón-Osorio 1*, Jonás Pinzón-Osorio2
1 Herbario Universidad Pedagógica Nacional UPN. Línea de Investigación Enseñanza y Aprendizaje de la Botánica. Departamento de Biología. Facultad de Ciencia y Tecnología, (UPN), sede Bogotá. Colombia. Calle 72 No. 11-86.
2 Program Human Ecology. Bachelor of Science. College of the Atlantic. COA. Maine. U.S.A. 105 Eden Street. Bar Harbor, ME 04609.
* Autor para correspondencia.
Email César A. Pinzón-Osorio: capinzono@unal.edu.co.
Email Jonás Pinzón-Osorio : jpinzonosorio@coa.edu
Resumen
Se describe e ilustra por primera vez a Scleroderma bovista para Colombia, un hongo gasteroide hallado en el campus de la Universidad Pedagógica Nacional (Bogotá), departamento de Cundinamarca. Se aporta información sobre su distribución, ecología y sustrato de crecimiento. Así, el género Scleroderma queda representado en el país por cuatro especies: S. albidum, S. areolatum, S. citrinum y S. bovista.
Palabras clave: biodiversidad urbana; Cundinamarca; micobiota; Scleroderma.
Abstract
Scleroderma bovista is described and illustrated for the first time in Colombia. Scleroderma bovista is a gasteroid fungi found on the campus of the Universidad Pedagógica Nacional (Bogotá), department of Cundinamarca. Information on distribution, ecology and growth substrate is provided. Thus, the genus Scleroderma is represented in the country by four species: S. albidum, S. areolatum, S. citrinum y S. bovista.
Keywords: Cundinamarca; mycobiota; Scleroderma; urban biodiversity.
Introducción
El género Scleroderma Pers., pertenece a la familia Sclerodermataceae Corda, suborden Sclerodermatineae Binder & Bresinsky, orden Boletales E.J. Gilbert, (Hughey et al. 2000; Binder & Bresinsky 2002; Louzan et al. 2007; Wilson et al. 2011). Este grupo de hongos gasteroides comúnmente conocido como bejines, hongos polvera o bolas de tierra (Jeffries 1999; Wright & Albertó 2006), se caracterizan por presentar basidiomas globosos, subglobosos o piriformes; sésiles, pseudostipitados o con estípite bien desarrollado; de habito epigeos a subepigeos, raramente hipogeos y microscópicamente mostrando basidiosporas globosas reticuladas o equinuladas (Guzmán 1970; Sims et al. 1995; Giachini et al. 2000; Cortez et al. 2011; Nouhra et al. 2012; Yousaf et al. 2012; Guzmán et al. 2013).
La mayoría de las especies del género Scleroderma forman ectomicorrízas (ECM), por lo que cumplen un importante rol en el mantenimiento y función de los ecosistemas forestales (Jeffries 1999). Protegen de lesiones de patógenos y de enfermedades a las raíces de los arboles con las que mantienen la asociación mutualista (Marx & Bryan 1969; Dighton 2003), además, posibilitan el desarrollo y crecimiento de algunas especies arbóreas (Jeffries 1999; Binder & Hibbett 2006; Watling 2006; Newbound et al. 2010), por lo que son utilizadas a nivel comercial como inóculo en plantaciones de Eucalyptus L'Hér., y Pinus L., (Trappe 1962; Chu-Chou 1979; Richter & Bruhn 1989; Dell et al. 1994; Lu et al. 1998; Chen et al. 2000; Rincón et al. 2001).
Scleroderma se distribuye en todo el mundo, desarrollándose en ecosistemas templados, subtropicales y tropicales (Guzmán et al. 2013; Montagner et al. 2015). Para Colombia, de acuerdo a Vasco-Palacios y Franco-Molano (2013) el género está representado por tres especies: S. albidum Pat. & Trab., reportada para el departamento de Cundinamarca (Guzmán 1970; Guzmán & Varela 1978), S. areolatum Ehrenb., hallada en los departamentos de Antioquia y Boyacá, y S. citrinum Pers., observada en el departamento del Caquetá (Vasco-Palacios & Franco-Molano 2013). A pesar de lo anterior, el conocimiento sobre la diversidad, ecológica y distribución geográfica del género sigue siendo limitado en el país. Por lo tanto, el objetivo de este estudio es reportar por primera vez a Scleroderma bovista Fr., para Colombia, un nuevo representante del grupo que se desarrolla en la zona urbana de la ciudad de Bogotá.
Material y métodos
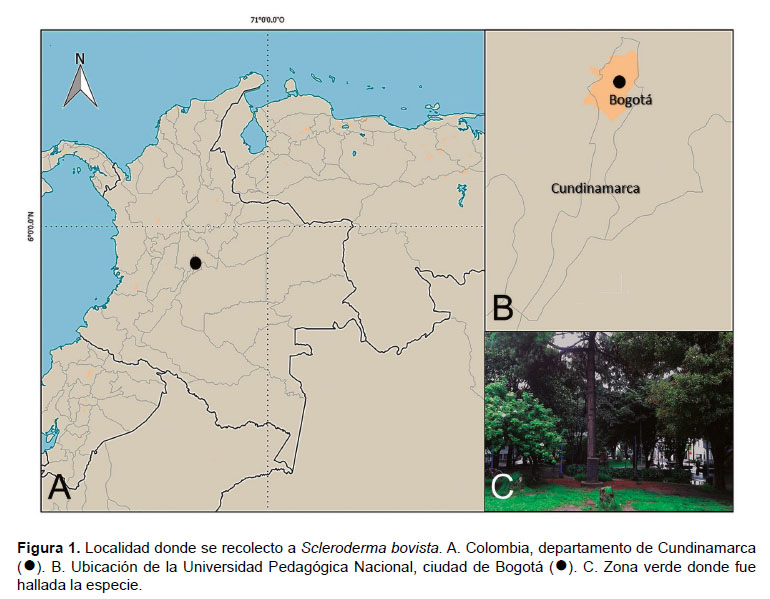
Área de estudio.- Se realizó una exploración en octubre de 2016, aplicando un muestreo ad libitum en las zonas verdes de la Universidad Pedagógica Nacional (UPN), sede Bogotá, localizada al noreste de la ciudad, a 2573 m de altitud, 04º39’30.48"N, 74º03’30.515"W, departamento de Cundinamarca (Figura 1).
La zona de vida (Holdridge et al. 1971) del lugar de estudio corresponde a un bosque húmedo montano bajo (bh-MB). La zona presenta una temperatura promedio anual de 14 °C y una precipitación promedio anual de 1200 mm, con un régimen de distribución bimodal, donde las mayores precipitaciones suceden en abril y octubre, mientras que en enero y julio se presentan las menores lluvias. Con un área de aproximadamente 23040 m2, el lugar posee una topografía plana donde el 20% corresponde a zonas verdes, cuya vegetación arbórea nativa y exótica está representada por Croton bogotanus Cuatrec., Ficus soatensis Dugand, Fraxinus chinensis Roxb., Ilex kunthiana Triana, Phoenix canariensis Hort. ex Chabaud, Pinus radiata D. Don, Prunus serótina Ehrh., Roystonea regia (Kunth) O.F.Cook, Salix humboldtiana Willd., Sambucus nigra L., Senna viarum (Little)
H.S. Irwin & Barneby y Syzygium paniculatum Banks ex Gaertn. Estas zonas son intervenidas cada 15 días por la comunidad universitaria mediante actividades de siembra, limpieza de basura y hojarasca, como parte del proyecto denominado Campaña de Recuperación de los Espacios Verdes UPN.
Recolecta y determinación.- Se recolecto, fotografió y describió macroscópicamente un basidioma de S. bovista siguiendo lo propuesto por Brundrett et al. (1996). Se utilizó el atlas de Kornerup y Wanscher (1978) para la citación de los colores. Las observaciones microscópicas se realizaron en un microscópico de luz Olympus CX31 y DMS 653 (sistema digital), montando las muestras en KOH al 5%, rojo Congo al 1% y azul de lactofenol al 1%. La medición de las basidiosporas incluyó la ornamentación y se realizó de acuerdo a la metodología de Franco-Molano et al. (2000). Para la determinación taxonómica se utilizaron los trabajos de Guzmán (1967), Guzmán (1970), Cunningham (1979), Domínguez de Toledo (1989), Sims et al. (1995), Nouhra et al. (2012) y Guzmán et al. (2013). La citación del nombre científico correspondió a la información ofrecida por el sistema de clasificación Index Fungorum (http:// www.indexfungorum.org). El espécimen fue depositado en el Herbario de la Universidad Pedagógica Nacional (HUPN), sede Bogotá, acompañado de etiquetas de referencia con datos de localidad, fecha, colector y número de colección.
Taxonomía
Scleroderma bovista Fr.
Syst. mycol. (Lundae) 3(1): 48 (1829)
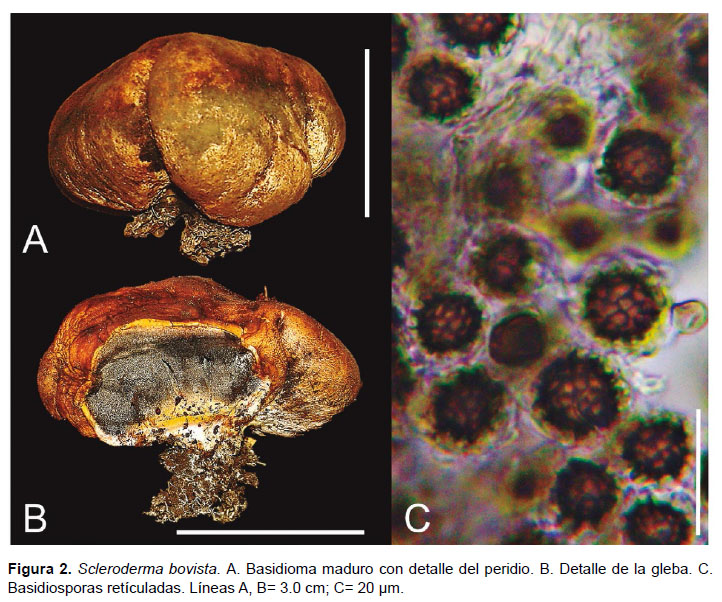
(Fig. 2)
Scleroderma verrucosum subsp. bovista (Fr.) Šebek, Sydowia 7(1-4): 177 (1953)
Scleroderma verrucosum var. bovista (Fr.) Šebek, Fl. ČSR, B-1, Gasteromycetes: 570 (1958)
Tuber fuscum Corda, Icon. fung. (Prague) 1: 25 (1837)
Scleroderma fuscum (Corda) E. Fisch., in Engler & Prantl, Nat. Pflanzenfam., Teil. I (Leipzig) 1**: 336 (1900)
Basidioma: 4.5 cm de diámetro, 3.8 cm de alto, epigeo, globoso a subgloboso, ligeramente aplanado, superficie lisa, con algunas grietas en la parte inferior, con rizomorfos agrupados en la base que se acompañan de abundante micelio compacto que asemeja un pseudoestipite corto. Peridio: hasta 0.1 cm de grosor, superficie carnosa y suave en fresco, marrón amarillento (4B8) a marrón oscuro (4D8), con algunas áreas amarillo rojizas (4C3) a naranja marrón (4C4). Dehiscencia: ruptura irregular en la parte superior del exoperidio. Gleba: carnosa, color grisáceo oliva (3E5), con algunas áreas marrón rojiza oscura, de consistencia polvorienta. Contexto: menor a 0.2 cm de grosor, ligeramente rubescente. Basidiosporas: (11.4-) 12.3−14.0 (-16.5) µm de diámetro incluyendo ornamentación, globosas, reticuladas con espinas, color marrón amarillentas a marrón oscuras en KOH, retículo de 1.0-2.0 µm de largo, grueso, irregular, fragmentado. Basidios: no observados. Peridio: dividido en dos capas, capa externa con hifas hialinas, 4.5−6.0 µm de diámetro, fibuladas, lisas; capa interna con hifas hialinas, 4.1−5.7 µm de diámetro, fibuladas, con paredes gruesas, color marrón amarillentas; hifas conductoras de hasta 4.0 µm de diámetro, asociadas con las peridiales.
Material examinado: COLOMBIA. Cundinamarca. Bogotá D.C., UPN, 04º39’30,48"N, 74º03’30.515"W, 2573 m, (22 Oct 2016), C. Pinzón-O. Pinzón-O. 233 (HUPN).
Hábito y hábitat: se desconoce cómo llegó S. bovista a las zonas verdes de la UPN. El basidioma se encontró solitario sobre tierra húmeda, sin ninguna especie arbórea próxima. Lo que indicaría un desarrollo como saprofito y no como ectomicorriza, condición infrecuente que ya ha sido propuesta por Jeffries (1999) y Wright & Albertó (2006). Sin embargo, no se descarta que esta especie sea hallada en otras zonas urbanas y naturales de Colombia formando ectomicorrizas.
Distribución: S. bovista tiene una amplia distribución. Guzmán & Ramírez-Guillén (2010) la registraron para Nepal. En Norteamérica se halló en Estados Unidos (Guzmán 1970) y México (Frutis & Guzmán 1983; Guzmán-Dávalos & Guzmán 1985; Cortés-Pérez 2011). Fries (1829) y Calonge et al. (2005) la registraron para Centroamérica, en Costa Rica. En Suramérica se ha observado en Brasil (Giachini et al. 2000; Gurgel et al. 2008; Cortez et al. 2011) y Argentina (Wright & Albertó 2006; Nouhra et al. 2012). Este trabajo reporta por primera vez a la especie en Colombia, en ambientes urbanos con alto impacto antrópico.
Observaciones taxonómicas: las descripciones macroscópicas y microscópicas concuerdan bien con las reportadas para Argentina (Wright & Albertó 2006; Nouhra et al. 2012), México (Guzmán et al. 2013) y Brasil (Cortez et al. 2011), no obstante, la dimensión del basidioma Colombiano no alcanzó el límite superior (7 cm de diámetro) registrado por NOUHRA et al. (2012). Aun así, las medidas del nuevo registro se encuentran dentro de los rangos señalados por Nouhra et al. (2012) (2.0-7 cm) y Guzmán et al. (2013) (1.0-4.5 cm).
La presencia de un peridio liso de color marrón amarillento, con algunas áreas rojizas marrón oscuro y esporas de (11-) 12-14 (-16) µm o (10-) 11-13 (-18) µm de diámetro, con un retículo bien desarrollado, delimitan a S. bovista de otras especies (Nouhra et al. 2012, Guzmán et al. 2013). Sin embargo, macroscópicamente podría confundirse con S. patagonicum Nouhra & Hern. Caff., y S. albidum Pat. & Trab., pero estas especies poseen basidiosporas equinuladas y no reticuladas (Nouhra et al. 2012). También se ha señalado su similitud con S. macrorrhizon Wallr., (Guzmán 1967; Guzmán 1970). Si bien, esta especie posee basidiosporas reticuladas y una base de micelio compacto que asemeja un pseudoestipite como S. bovista, las dimensiones de las basidiosporas de S. macrorrhizon oscilan entre 10-13 µm de diámetro, siendo mucho menores a las descritas para S. bovista, (Nouhra et al. 2012; Guzmán et al. 2013). Guzmán (1970) señaló que S. dictyosporum Pat., exhibe basidiosporas reticuladas con dimensiones de 8.8-13.6 µm de diámetro, donde la ornamentación mide 1.9 a 3.5 µm de largo, características similares a S. bovista, sin embargo, la ornamentación de esta última es más pequeña (<2 µm) y no es continua como en S. dictyosporum. Finalmente S. meridionale Demoulin & Malençon., también tiene basidiosporas reticuladas, pero estas poseen dimensiones menores a las registradas para S. bovista (Rusevska et al. 2014).
Discusión
La aparición de S. bovista en ambientes urbanos no es nuevo. Pegler et al. (1995), Nouhra et al. (2012) y Guzmán et al. (2013) señalaron que la especie se desarrolla en jardines, parques y pastizales. También se ha observado como ectomicorriza en bosques de Carya Nutt., (Powell et al. 1968; Marx & Bryan 1969; Marx 1972;), Pinus L. (Richter & Bruhn 1989; Nouhra et al. 2012; Guzmán et al. 2013), Populus L. (Jakucs & Agerer 1999), Cedrus Trew, Betula L. y Quercus L. (Nouhra et al. 2012). Por lo anterior, S. bovista ha sido usada como inoculo en explotaciones forestales comerciales (Richter & Bruhn 1989; Chen et al. 2006; Nouhra et al. 2012), ya que aumenta la capacidad de absorción del sistema radicular y protege de patógenos a los arboles con que se asocia, al producir antibióticos (Marx & Bryan 1969).
A pesar de que se ha comprobado la disminución de especies fúngicas en todo el mundo a causa de la actividad antrópica y el crecimiento urbano (Watling 2005; Newbound et al. 2010). El proceso de urbanización también ha posibilitado en muchos casos, sistemas ecológicos con interacciones complejas (Newbound et al. 2010), que a pesar de su tamaño, proporcionan hábitats capaces de albergar una diversidad fúngica considerable como lo demuestra el estudio de López-Quintero et al. (2011).
Los macromicetos poseen una gran capacidad de adaptación, proliferan en variedad de sustratos de diferentes hábitats naturales (Dix & Webster 1995), pero también en ambientes perturbados o transformados por la actividad humana, como son los bosques y jardines de las zonas urbanas (Kurup et al. 2000; Cousin et al. 2003; Dighton et al. 2004; Schmidt 2007; Gorman & Fuller 2008).
De acuerdo a López-Quintero et al. (2011) la micota que se desarrolla en estas áreas, puede ser fácilmente estudiada por el asequible acceso a los lugares. Sin embargo, en Colombia estas áreas han sido subvaloradas micológicamente y escasamente exploradas. De las 1265 especies de hongos reportadas para el país (Soto-Medina & Bolaño-Rojas 2013; Vasco-Palacios &Franco-Molano 2013; Palacio et al. 2015; Lombana-Álvarez et al. 2016), solo el 3% (38 especies) ha sido registrado en ambientes urbanos. Pulido (1983) reporto cuatro en el campus de la Universidad Nacional de Colombia, sede Bogotá, Anónimo (2000) hallo seis en zonas residenciales de la ciudad de Medellín y en el Jardín Botánico Joaquín Antonio Uribe y 28 fueron registradas en el campus de la Universidad de Antioquia (López-Quintero et al. 2011).
El campus de la UPN está conformado en su mayoría por concreto, lo que genera condiciones limitantes para el desarrollo y crecimiento de S. bovista. Sin embargo, la existencia de pequeños fragmentos de zonas verdes, con tierra abonada y especies arbóreas, ofrecen la materia orgánica suficiente para que la especie se adapte en el lugar.
Es importante señalar que zonas como jardines, parques locales y fragmentos de bosques dentro de las áreas urbanas, no solo son importantes como lugares que ofrecen espacios recreativos con estética paisajística (Re et al. 2011). Además, proveen de servicios ambientales como regulación del microclima, amortiguación del ruido, mejoramiento de la calidad del aire (Urcelay et al. 2012) y son hábitats potenciales para el mantenimiento y conservación de la biodiversidad urbana (Werner & Zahner 2009; Nilon 2011). Si la permanencia de estos ambientes no se garantiza y por el contrario se modifica el hábitat restante, los macromicetos capaces de adaptarse a las condiciones limitantes de estos lugares serán privados del sustrato y desaparecerán.
Este trabajo registra por primera vez a S. bovista para Colombia en un bh-MB con alto impacto antrópico e incrementa a cuatro los representantes del género en el país. Si bien, los ambientes urbanos hacen parte de la vida cotidiana del humano citadino, son áreas que guardan una diversidad fúngica que no debe ser subestimada. Por ello, es necesario continuar estudiando la micota urbana, más cuando estas zonas en Colombia están submuestreadas. Cualquier esfuerzo que aporte información sobre el tema, por pequeño que sea, es de gran importancia para el reconocimiento de la micota del país.
Agradecimientos
Los autores agradecen a los miembros del Herbario de la Universidad Pedagógica Nacional (UPN), sede Bogotá, por la ayuda logística y el prestado de literatura. A la licenciada Andrea Castiblanco Zerda, al herbario del Departamento de Biología de la Universidad Pedagógica Nacional y a los evaluadores por los comentarios críticos al manuscrito.
Literatura citada
Anónimo. 2000. Hongos y musgos del Valle de Aburrá. Medellín (Colombia). Medellín. Editorial Área Metropolitana del Valle de Aburrá [ Links ].
Binder M. & A. Bresinsky. 2002. Derivation of a polymorphic lineage of Gasteromycetes from boletoid ancestors. Mycologia. 94: 85-98. https://doi.org/10.1080/15572536.2003.11833251 [ Links ]
Binder M. & D.S. Hibbett. 2006. Molecular systematics and biological diversification of Boletales. Mycologia. 98 (6): 971-981. https://doi.org/10.1080/15572536.2006.11832626 [ Links ]
Brundrett M., N. Bougher, B. Dell, et al. 1996. Working with mycorrhizas in forestry and agriculture. Canberra: Australian Centre for International Agricultural Research Monographs.374pp [ Links ]
Calonge F.D., M. Mata, & J. Carranza. 2005. Contribución al catálogo de los Gasteromycetes (Basidiomycotina, Fungi) de Costa Rica. Anales del Jardín Botánico de Madrid, 62 (1): 23-45. https://doi.org/10.3989/ajbm.2005.v62.i1.26 [ Links ]
Chen Y.L., M.Q., Gong, F.Z. Wang, et al. 2000. Diversity and colonization of putative mycorrhizal fungi in Eucalyptus plantationsin Southern China. Forestry Studies in China 2 (2): 34-42. [ Links ]
Chen, Y.L., L.H., Kang, N. Malajczuk, et al. 2006. Selecting ectomycorrhizal fungi for inoculating plantations in south China: effect of Scleroderma on colonization and growth of exotic Eucalyptus globulus, E. urophylla, Pinus elliottii, and P. radiata. Mycorrhiza. 16: 251-259. https://doi:10.1007/s00572-006-0039-8. [ Links ]
Chu-Chou M. 1979. Mycorrhizal fungi of Pinus radiate in New Zealand. Soil Biology and Biochemistry 11 (6): 557-562. https://doi.org/10.1016/0038-0717(79)90021-X [ Links ]
Cortés-Pérez A. 2011. Diversidad del género Scleroderma Pers. emend. Fr. (Fungi, Basidiomycotina, Sclerodermatales) en Veracruz: Tesis, Universidad Veracruzana Facultad de Biología, Xalapa. [ Links ]
Cortez V.G., I.G. Baseia, & R.M.B. Silveira. 2011. Gasteroid mycobiota of Rio Grande do Sul, Brazil: Boletales. Journal of Yeast and Fungal Research 2 (4): 44-52. [ Links ]
Cousins J.R., D. Hope, C. Gries, et al. 2003. Preliminary assessment of arbuscular mycorrhizal fungal diversity and community structure in an urban ecosystem. Mycorrhiza. 13 (6): 319-326. https://doi.org/10.1007/s00572-003-0239-4 [ Links ]
Cunningham G.H. 1979. The Gasteromycetes of Australia and New Zealand. Serie Bibliotheca mycologica, 67. Vaduz , Germany: Ed. J. Cramer. [ Links ]
Dell B., N. Malajzuk, N.L. Bougher, et al. 1994. Development and function of Pisolithus and Scleroderma ectomycorrhizas formed in vivo with Allocasuarina, Casuarina and Eucalyptus. Mycorrhiza. 5 (2): 129-138. https://doi.org/10.1007/BF00202345 [ Links ]
Dighton J. 2003. Fungi in Ecosystem Processes. New York. Marcel Dekker Inc. [ Links ]
Dighton J., A.R. Tuininga, D.M. Gray, R.E. Huskins, T. Belton. 2004.Impacts of atmospheric deposition on New Jersey pine barrens forest soils and communities of ectomycorrhizae. Forest Ecology and Management. 201(1):131–144. doi:10.1016/j.foreco.2004.07.038. [ Links ]
Dix N.J. & J. Webster. 1995. Fungal ecology. London. Chapmanand Hall. [ Links ]
Domínguez de Toledo L.S. 1989. Gasteromycetes (Eumycota) del Centro y Oeste de la Argentina: Tesis, Universidad Nacional de Córdoba, Facultad de Ciencias Exactas, Físicas y Naturales, Córdoba. [ Links ]
Franco-Molano A.E., R. Aldana-Gómez. & R.E. Halling. 2000. Setas de Colombia (Agaricales, Boletales y otros hongos). Guía de campo. Medellín. Editorial Colciencias Universidad de Antioquia. [ Links ]
Fries E. 1952. Systema Mycologicum III. Lundae. New York. Johnson Reprint Corp. [ Links ]
Frutis I., & G. Guzmán. 1983. Contribución al conocimiento de los hongos del Estado de Hidalgo. Boletín de la Sociedad Mexicana de Micología 18: 219-265. [ Links ]
Giachini A., M. Castellano, & J. Trappe. 2000. Ectomycorrhizal fungiin Eucalyptus and Pinus plantations in southern Brazil. Mycologia. 92 (6): 1166-1177. https://doi:10.2307/3761484 [ Links ]
Gorman C.M. & H.T. Fuller. 2008. Prevalence of culturable airborne spores of selected allergenic and pathogenic fungi in outdoorair. Atmospheric Environment 42 (18): 4355-43. https://doi.org/10.1016/j.atmosenv.2008.01.009 [ Links ]
Gurgel F.E., B.D.B. Silva, & I.G. Baseia. 2008. New records of Scleroderma from Northeastern Brazil. Mycotaxon. 105: 399-405. [ Links ]
Guzmán G. 1967. Taxonomía del género Scleroderma Pers. emend. Fr. Ciencia (México). 25: 195-208. [ Links ]
Guzmán G. 1970. Monografía del género Scleroderma Pers. emend. Fr. (Fungi-Basidiomycetes). Darwiniana. 16: 233-407. [ Links ]
Guzmán G., A. Cortés-Pérez, L. Guzmán-Dávalos, et al. 2013. An emendation of Scleroderma, new records, and review of the known species in Mexico. Revista Mexicana de Biodiversidad 84: 173-191. https://doi.org/10.7550/rmb.31979 [ Links ]
Guzmán G. & F. Ramírez-Guillén. 2010. An overview on some mushrooms from Nepal. Boletín de la Sociedad Micológica de Madrid 34: 295-320. [ Links ]
Guzmán G. & L. Varela. 1978. Los hongos de Colombia III. Observaciones sobre los hongos, líquenes y mixomicetos deColombia. Caldasia. 7: 309-338. [ Links ]
Guzmán-Dávalos L. & G. Guzmán. 1985. Hongos del estado de Jalisco, V. El género Scleroderma. Revista Mexicana deMicología 1: 109-128. [ Links ]
Holdridge L.R., W. Grenke, W.H. Hatheway, et al. 1971. Forest environments in tropical life zones: A pilot study. Oxford. Pergamon Press. [ Links ]
Hughey B.D., G.C. Adams, T.D. Bruns, et al. 2000. Phylogeny of Calostoma, the gelatinous-stalked puffball, based on nuclearand mitochondrial ribosomal DNA sequences. Mycologia. 92: 94-104. https://doi:10.2307/3761453 [ Links ]
Index Fungorum. Scleroderma bovista. The Royal Botanic Gardens Kew, CAB International. 2016. [Acceso 21 Dici 2016]. Available at: http://www.indexfungorum.org/names/names.asp. [ Links ]
Jakucs E., & R. Agerer. 1999. Scleroderma bovista Fr. + Populus alba L: 121-126. (en) Agerer R., R.M. Danielson, S. Egli, K. Ingleby, D. Luoma, & R. Treu, (eds.) Descriptions of ectomycorrhizae, Vol 4. Schwäbisch Gmünd, Einhorn. [ Links ]
Jeffries P. 1999. Scleroderma: 187-200 (en) Cairney J.W.G. & S.M. Chambers, (eds.) Ectomycorrhizal Fungi Key Genera inProfile. Canterbury, Springer Berlin Heidelberg. [ Links ]
Kornerup A. & J.H. Wanscher. 1983. Methuen handbook of color. London. Eyre Methuen Ltd. [ Links ]
Kurup V.P., H.D. Shen, & B. Banerjee. 2000. Respiratory fungal allergy. Microbes and Infection 2 (9): 1101-1110. https://doi.org/10.1016/S1286-4579(00)01264-8 [ Links ]
Lombana-Álvarez, P., Monterroza-Álvarez, J.A., Chamorro-Quiroz, L.F., Franco-Molano, A.E. & Payares-Díaz, I.R., 2016. Nuevos registros de macromicetos para Colombia. Actualidades Biológicas 38 (105): 181-189. [ Links ]
López-Quintero C.A., A.M. Vasco-Palacios, & A.E. Franco-Molano. 2011. Nuevos registros de macromicetes de Colombia I. Macromicetes recolectados en zonas urbanas de Medellín (Antioquia). Actualidades Biológicas 33 (95): 261-274. [ Links ]
Louzan R., A.W. Wilson, M. Binder, et al. 2007. Phylogenetic placement of Diplocystis wrightii in the Sclerodermatineae (Boletales) based on nuclear ribosomal large subunitDNA sequences. Mycoscience. 48 (1): 66-69. https://doi.org/10.1007/S10267-006-0325-5 [ Links ]
Lu X.H., N. Malajczuk, & B. Dell. 1998. Mycorrhiza formation and growth of Eucalyptus globulus seedlings inoculated withspores of various ectomycorrhizal fungi. Mycorrhiza. 8 (2): 81-86. https://doi.org/10.1007/s005720050216 [ Links ]
Marx D.H. 1972. Ectomycorrhizae as biological deterrents 3558 to pathogenic root infections. Annual Review of Phytopathology 10: 429-454. https://doi.org/10.1146/annurev.py.10.090172.002241 [ Links ]
Marx D.H., & W.C. Bryan. 1969. Scleroderma bovista, an ectotrophic mycorrhizal fungus of pecan. Phytopathology. 59:1128-1132. [ Links ]
Montagner D.F., G. Coelho, A.O. Silveira, et al. 2015. Morphological and molecular analyses in Scleroderma (Basidiomycota) associated with exotic forests in Pampa biome, southern Brazil. Mycosphere. 6 (3): 337-344. [ Links ]
Newbound M., M.A. Mccarthy, & T. Lebe. 2010. Fungi and theurban environment: A review. Landscape and Urban Planning 96 (3): 138-145. https://doi.org/10.1016/j.landurbplan.2010.04.005 [ Links ]
Nilon CH. 2011. Urban biodiversity and the importance of management and conservation. Landscape. Landscape andEcological Engineering 7: 45-52. https://doi.org/10.1007/s11355-010-0146-8 [ Links ]
Nouhra E.R., M.L. Hernández-Caffot, N. Pastor, et al. 2012. The species of Scleroderma from Argentina, including a new speciesfrom the Nothofagus forest. Mycologia. 104 (2): 488-495. https://doi.org/10.3852/11-082 [ Links ]
Palacio M., Y. Gutiérrez, A.E. Franco-Molano, et al. 2015. Nuevos registros de macrohongos (Basidiomycota) para Colombia procedentes de un bosque seco tropical. Actualidades Biológicas 37 (102): 319-339. [ Links ]
Pegler D.N., T. Laessoe, & B.M. Spooner. 1995. British Puffballs, Earthstars and Stinkhorns: an account of the British gasteroid fungi. Kew. Royal Botanic Gardens. [ Links ]
Powell W.M., F.F. Hendrix, & D.H. Marx. 1968. Chemical control of feeder root necrosis of pecans caused by Pythium species andnematodes. Plant Disease Reporter 52: 577-578. [ Links ]
Pulido M.M. 1983. Estudios en Agaricales colombianos: Los hongos de Colombia IX. Bogotá. Instituto de Ciencias Naturales, Biblioteca José Jerónimo Triana N° 7. Universidad Nacional de Colombia. [ Links ]
Re G.E., C. Eynard, M. Martiarena, et al. 2011. Los árboles de Ciudad Universitaria: diagnóstico de estado y riesgo aparente. Córdoba. Universidad Nacional de Córdoba. [ Links ]
Richter D.L., & J.N. Bruhn. 1989. Pinus resinosa ectomycorrhizae: seven host-fungus combinations synthesized in pure culture.Symbiosis. 7: 211-228. [ Links ]
Rincón A., I.F. Alvarez, & J. Pera. 2001. Inoculation of containerized Pinus pinea L. seedlings with seven ectomycorrhizal fungi. Mycorrhiza. 11 (6): 265-271. doi: https://doi.10.1007/s005720100127. [ Links ]
Rusevska K., M. Karadelev, C. Phosri, et al. 2014. Rechecking of the genus Scleroderma (Gasteromycetes) from Macedonia usingbarcoding approach. Doga, Turkish Journal of Botany 38: 375-385. Doi:10.3906/bot-1301-36 [ Links ]
Schmidt O. 2007. Indoor wood-decay basidiomycetes: damage,causal fungi, physiology, identification and characterization,prevention and control. Mycological Progress 6: 261-279. https://doi.org/10.1007/s11557-007-0534-0 [ Links ]
Sims K.P., R. Watling, & P. Jeffries. 1995. A revised key of the genus Scleroderma. Mycotaxon. 56: 403-420. [ Links ]
Soto-Medina E., & A.C. Bolaño-Rojas. 2013. Hongos macroscópicos en un bosque de niebla intervenido, Vereda Chicoral, Valle del Cauca, Colombia. Biota Colombiana. 14 (2): 1-12. [ Links ]
Trappe J.M. 1962. Fungus associates of ectotropic mycorrhizae. Bot Rev. 28 (4): 538-606. [ Links ]
Urcelay C., G. Robledo, F. Heredia, et al. 2012. Hongos de la madera en el arbolado urbano de Córdoba. Córdoba. Instituto Multidisciplinario de Biología Vegetal. [ Links ]
Watling R. 2005. Fungal conservation: some impressions. A personal view: 881-896 (en) Dighton J., J.F. White, & P, Oudemans.(eds.) The Fungal Community: Its Organisation and Role in the Ecosystem. Boca Raton. CRC Press. [ Links ]
Watling R. 2006. The Sclerodermatoid fungi. Mycoscience. 47 (1): 18-24. https://doi.org/10.1007/s10267-005-0267-3 [ Links ]
Werner P., & R. Zahner. 2008. Biological diversity and cities: a review and bibliography. Leipzig. Bundesamt fur Naturschutz(BfN). [ Links ]
Wilson A.W., M. Binder, & D. Hibbett. 2011. Effects of gasteroid fruiting body morphology on diversification rates in three independent clades of fungi estimated using binary state speciation and extinction analysis. Evolution. 65 (5): 1305-322. Doi: 10.1111/j.1558-5646.2010.01214.x. [ Links ]
Wright J.E., & E. Albertó. 2006. Hongos de la región Pampeana II: Hongos sin laminillas. Buenos Aires. Editorial L.O.L.A. [ Links ]
Yousaf N., A.N. Khalid, & A.R. Niazi. 2012. New records of Scleroderma species (Sclerodermataceae, Agaricomycetes) from Pakistan. Mycotaxon. 122: 43-50. https://doi.org/10.5248/122.43 [ Links ]
Vasco-Palacios A.M., & A.E. Franco-Molano. 2013. Diversity of Colombian Macrofungi. (Ascomycota-Basidiomycota). Mycotaxon. 121: 1-58. [ Links ]
Información sobre los autores:
CPO tomo las fotografías y realizo la recolección del escocarpo con su respectiva descripción macro y microscópica. CPO y JPO analizaron y compararon los datos de campo y laboratorio, cotejándolos con información de la literatura especializada. JPO construyo el abstract.
Los autores no incurren en conflictos de intereses.
Presentado: 26/04/2018
Aceptado: 28/10/2018
Publicado online: 07/12/2018