Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.15381/rpb.v26i1.14628
TRABAJOS ORIGINALES
Área de vida de la especie invasora Achatina fulica (Gastropoda: Achatinidae) en un área de conservación de bosque seco ecuatoriano
Home-range of the invasive terrestrial gastropod, Achatina fulica (Gastropoda: Achatinidae), in an Ecuadorian dry forest conservation area
Jessica Cuasapaz-Sarabia y Jaime A. Salas*
*Universidad de Guayaquil, Facultad de Ciencias Naturales, Carrera de Biología. Ecuador.
Resumen
Achatina fulica es un gasterópodo terrestre invasivo, conocido como una de las 100 especies invasoras más dañinas del mundo. Achatina fulica fue reportado en Ecuador en el 2008, pero no se ha evaluado aún su impacto sobre los ecosistemas nativos. El objetivo principal fue determinar el área de vida (AV) promedio de esta especie en dos zonas con distinto grado de intervención en el Bosque Protector Cerro Blanco, un remanente de bosque seco tropical. La fase de campo consistió en la captura, marcaje, recaptura, toma de medidas morfométricas y georreferenciación de los individuos; para el análisis de datos se calculó el AV mediante el método de polígono convexo mínimo, y se lo correlacionó con variables ambientales a través de un análisis de componentes principales (ACP). El AV promedio en la zona alterada fue de 3.58 m2 (±0.93, n=30), y en el sendero ecoturístico fue 3.27 m2 (±0.48, n=40); se determinó que la humedad fue el parámetro ambiental que influyó directamente sobre el AV y la densidad poblacional en ambas zonas de estudio. El manejo de esta especie invasora no consta como un asunto clave de manejo para esta reserva privada, por lo que se recomienda ejecutar acciones de control para su erradicación.
Palabras clave: invasión biológica; caracol gigante africano, área protegida; factores ambientales; solapamiento ecológico; plaga.
Abstract
Achatina fulica is an invasive terrestrial gastropod known as one of the 100 most harmful invasive species in the world. Achatina fulica is known in Ecuador since 2008, but the impact over their native ecosystems has not evaluated. The main objective was to determine the home range (HR) of this species in two zones with different levels of intervention in the Cerro Blanco reserve. The field work consisted in the capture, marking, recapture, taking of morphometric measurements and georeferencing of the individuals; for the analysis of data, HR was calculated using the convex polygon method, and environmental variables were correlated through a principal component analysis (PCA). The average HR in the altered zone was 3.58 m2 (± 0.93, n = 30), and on the ecotourist trail was 3.27 m2 (± 0.48, n = 40); the humidity was the environmental parameter that directly influences the life area and the population density in both zones study. The management of this invasive species does not appear as a key management issue for this private reserve, so it is recommended a control actions for its eradication.
Keywords: invasive species; giant African snail; protected area; environmental factors; ecological overlap; plague.
Introducción
Achatina fulica o caracol africano fue reportado en el 2008 por Borrero et al. (2009) como especie introducida en Ecuador con fines comerciales en la industria cosmetológica, trayendo consigo problemas al sector agrícola, médico-sanitario, económico y social. Achatina fulica ha sido investigada por su importancia médicosanitario, por ser vector de parásitos como Ascaris sp., Strongyloides sp., Cryptosporidium sp., Blastocystis sp., Angiostrongylus cantonesis, Schistosoma mansoni, entre otros (Muzzio 2011, Martini 2011, Solórzano et al. 2014, Cazorla et al. 2015, Sánchez & Man Ging 2015, CuasapazSarabia 2016). Otros trabajos se han enfocado al control y erradicación del molusco como plaga (Correoso 2006, USAID Ecuador 2011), pero no se han evaluado los posibles impactos negativos de su introducción a ecosistemas nativos en este país.
Para esto, un aspecto ecológico a considerar es la estimación de su área de vida o ámbito de hogar (home range), concepto que engloba el espacio que necesita un individuo para realizar sus actividades vitales (Powell 2000); esta información ayudaría a entender cómo se dispersa esta especie invasiva, y servir como herramienta para su manejo, lo cual en áreas naturales o de conservación puede ser urgente, pues A. fulica está catalogada como una especie transformadora de hábitat (Borrero et al. 2009, Correoso & Coello 2009, Gutiérrez-Gregoric et al. 2011), y presenta ventajas sobre otras especies dado que es altamente reproductiva, generalista y adaptable a todo tipo de hábitat (Roda et al. 2016), por lo que puede ser causante de alteraciones de comunidades bióticas nativas, e incidir en la pérdida de biodiversidad de una región (Aguirre & Tabor 2008, Alonso & Castro-Diez 2015, Traveset 2015, Gutiérrez 2017).
Este es el caso del Bosque Protector Cerro Blanco, un extenso fragmento de bosques deciduos y semideciduos del Pacífico ecuatorial, conocidos genéricamente como bosques secos, que está ubicado hacia el final de la Cordillera Chongón Colonche (Cun 2012, MAE 2013), donde se ha registrado recientemente la presencia de caracol africano en varios sectores, y ante la amenaza potencial de esta especie invasiva, se propuso estimar el tamaño promedio del área de vida de A. fulica en esta localidad, correlacionándolo con variables ambientales, con miras a recomendar acciones para su control, basados en la información biológica y ecológica.
Material y métodos
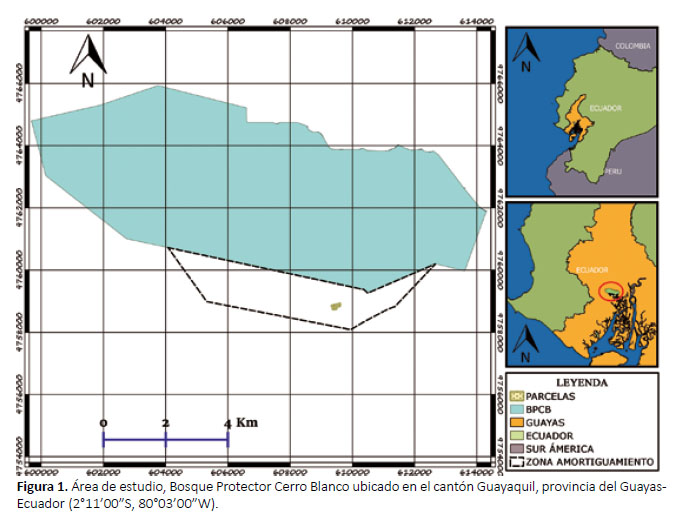
Área de estudio.- El presente estudio se desarrolló en el Bosque Protector Cerro Blanco ubicado en el cantón Guayaquil, provincia del Guayas-Ecuador (2°1100S, 80°0300W) (Fig. 1), el cual tiene una extensión de 6078 ha., y donde predomina el ecosistema de bosque seco tropical (BsT) de la Cordillera costera o Chongón Colonche, es de carácter privado, y administrada por la Fundación Pro-Bosque (Cun 2012).
Fase de campo.- Los muestreos fueron realizados en dos sitios dentro de la zona de amortiguamiento de Cerro Blanco: un área fuertemente alterada dedicada a actividades de camping, aledaña a una vía de primer orden, y otra de uso ecoturístico, con paisajes de bosque seco, denominada Sendero Buena Vista, los cuales fueron recorridos de manera aleatoria. Estos muestreos se realizaron durante la época lluviosa entre febrero a mayo del 2016, tres veces por semana entre las 17h – 20h. Los individuos fueron capturados de forma manual, para ser marcados, asignándoles un código numérico por orden de captura, utilizando esmalte de uñas, y se les tomó la medida longitud borde-ápice (mm), posteriormente fueron liberados en el mismo sitio; por cada individuo se georreferenció la ubicación al momento del marcaje, y las sucesivas recapturas. Se marcaron todos los individuos hallados dentro de un área delimitada (1 m2), encada zona.
Análisis de datos
Estimación de área de vida: Se utilizó el Polígono Mínimo Convexo (PMC) en el Programa QGIS (2016), versión 2.0, dado que este método usa un tamaño de muestra grande, y se ajusta tanto a la biología del organismo en estudio, como a los tiempos de observación; para reducir sesgos debido a la falta de independencia entre las observaciones, solo se incluyeron en el cálculo a los especímenes que cumplieron con más de tres relocalizaciones por individuo (Wone & Beauchamp 2003). Se realizó una correlación de Pearson para estimar si el tamaño del individuo mostraba influencia sobre el área de vida.
Densidad Poblacional: Para su cálculo se trabajó con el método Jolly-Seber, el cual está basado en la obtención de múltiples muestras durante un largo periodo de tiempo y dirigido a poblaciones abiertas, es decir, poblaciones en las pueden ocurrir sucesos como: natalidad, mortalidad, inmigración y emigración, los cuales cambian durante los muestreos (Franco-López 2011, Badii et al. 2012). Se estudió la tendencia de las poblaciones en ambos zonas de muestreo según los parámetros ambientales temperatura ambiental (°C), precipitación (mm) y humedad (%).
Análisis de Componentes Principales: esta técnica estadística fue empleada para explicar el grado de dependencia de los parámetros ambientales antes mencionados sobre el área de vida y densidad poblacional de A. fulica, usando el software Minitab (2008); los datos ambientales fueron solicitados y obtenidos de la estación meteorológica automática Puerto Hondo, registrada en la red de estaciones meteorológicas del Instituto Nacional de Meteorología e Hidrología - INHAMI.
Resultados
Área de vida.- Se marcaron un total de 200 individuos, 100 en cada zona, de los cuales se calculó el área de vida de 30 individuos de A. fulica en la zona alterada, mientras que en el sendero Buena Vista se obtuvo el área de vida de 40 individuos. Se determinó que el promedio del área de vida la zona alterada fue de 3.58 m2 (±0.93),mostrando un patrón de desplazamiento horizontal y vertical; en la Figura 2 se expone algunas de las áreas de vidas más representativas en la cual se observa polígonos amplios, debido probablemente a la disponibilidad de espacio, sin obstáculos naturales como árboles de gran tamaño, densa vegetación (hierbas, arbustos) o rocas.
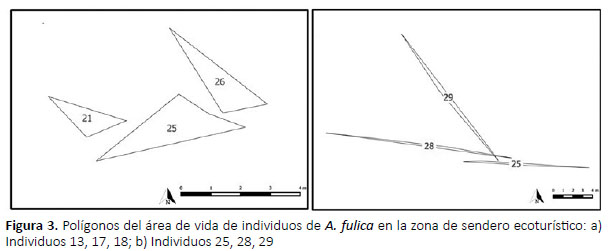
Dentro el sendero ecoturístico, el promedio de área de vida promedio de 40 individuos fue de 3.27 m2 (±0.48), mostrando un patrón de desplazamiento horizontal, formando polígonos en forma de aguja, como se observa en la Figura 3, donde todos los individuos muestran un patrón de desplazamiento similar, lo cual obedece probablemente a dos factores: el tamaño del individuo (la mayoría de los individuos median entre 4 – 7 cm), y la reducción de espacio, pues el terreno presentó obstáculos naturales e irregularidades que no permiten el libre desplazamiento del caracol africano.
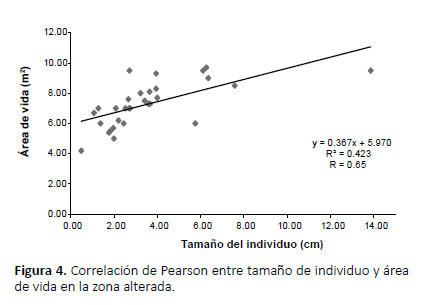
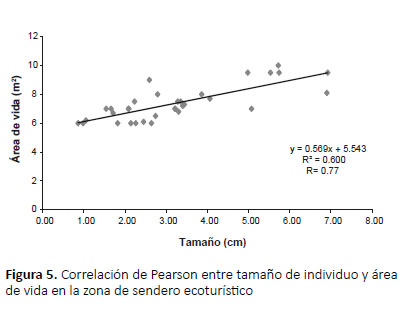
La influencia del tamaño del individuo sobre el área de vida mostró para la zona alterada una correlación moderada (r= 0.65) (Fig. 4); así mismo para la zona de sendero una correlación significativa (r= 0.77) (Fig. 5). Mediante una prueba Z se compararon los promedios de área de vida de A. fulica en ambas zonas, pero no se hallaron diferencias significativas (p= 0.29, z= 1.96, α= 0.05).
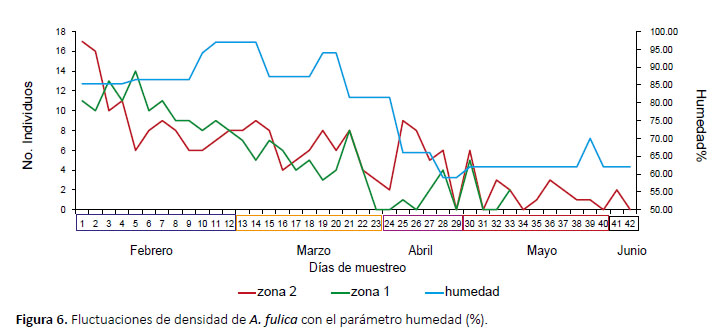
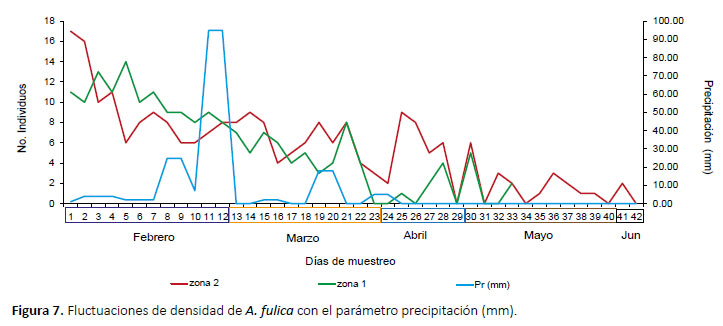
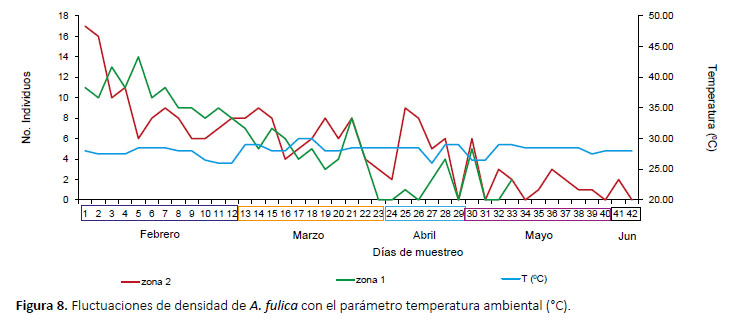
Densidad poblacional.- El seguimiento se realizó durante 42 días en las dos zonas de estudio con un promedio de 6 individuos marcados y 2 recapturas diarias, en la zona alterada se registró 6.61 ind/m2, a diferencia del sendero con 14.30 ind/m2. En ambas zonas de trabajo, el factor humedad se encuentra estrechamente relacionado, con valores mayores al 55% (Fig. 6), no se observó relación entre la disminución de la densidad poblacional de A. fulica y los factores precipitación y temperatura ambiental (Figs. 7 y 8). Mediante una prueba t se compararon los promedios de densidad poblacional en ambas zonas, observándose diferencias significativas (p=0.058, T= 1.99, α= 0.05).
Análisis de Componentes Principales (ACP)
APC: Área de vida-parámetros ambientales.- Se analizaron 3 variables ambientales: temperatura ambiental (0C), precipitación (mm) y humedad (%), para la zona alterada, dando como resultado la siguiente ecuación:
AV = – 1.2 + 0.033 Hum + 0.0497 Pr – 0.0004 Temp
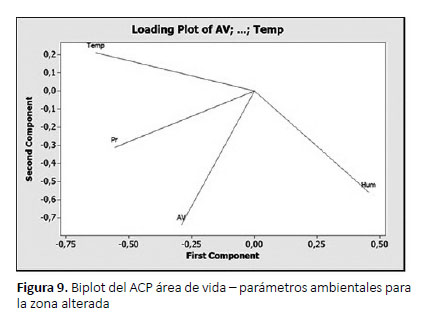
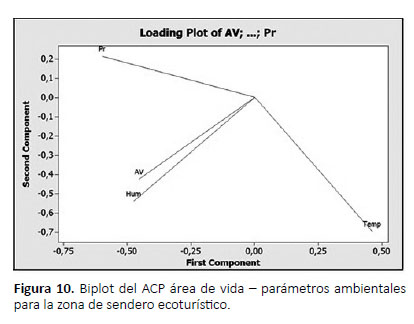
Según la ecuación de regresión múltiple, las variables humedad y precipitación influyen directamente sobre el área de vida d A. fulica en la zona alterada, y según el biplot la precipitación posee una relación cercana al área de vida (Fig. 9), mostrando una asociación fuerte entre los parámetros ambientales y el área de vida (R2= 0.93),con un error residual de 26%.
El ACP realizado para el sendero ecoturístico dio como resultado la siguiente ecuación:
AV = 4.42 – 0.130 Temp + 0.0306 Hum + 0.0128 Pr
Donde al igual que en la zona alterada, la humedad y la precipitación influyen directamente sobre el área de vida de A. fulica, mostrando una asociación fuerte entre los parámetros ambientales y el área de vida en el sendero (R2= 0,83), con un error residual de 36%. A diferencia de la zona alterada, sólo el parámetro humedad fue más cercano al área de vida (Fig. 10).
APC: Densidad – parámetros ambientales.-Se realizó un tercer análisis con las variables ambientales anteriormente mencionadas, dando como resultado la siguiente ecuación para la zona alterada:
Den = 2 + 0.43 Hum – 0.050 Pr – 0.101 Temp
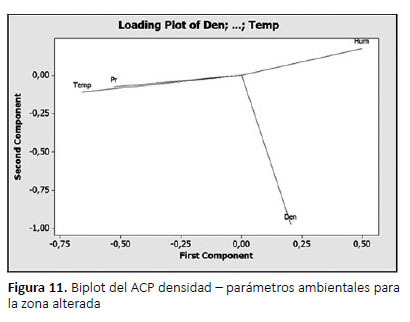
Donde la humedad es el parámetro que afecta directamente y la más cercana a la densidad poblacional de A. fulica (Fig. 11), con una asociación fuerte entre los parámetros ambientales y la densidad poblacional (R2=0.99),y un error residual de 26%.
Del ACP realizado para el sendero ecoturístico se obtuvo la siguiente ecuación:
Den = 152 – 5.54 T (0C) + 0.185 Hum (%) + 0.541 Pr (mm)
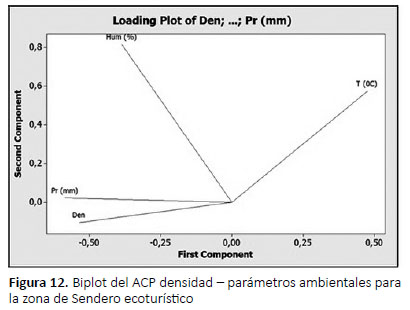
Donde la humedad y la precipitación influyen directamente sobre la densidad poblacional de A. fulica en el sendero (Fig. 12), mostrando una asociación moderada entre los parámetros ambientales y la densidad poblacional (R2=0,63), con un error residual de 36%
Discusión
Los promedios de área de vida de A. fulica entre las zonas de distinto grado de intervención no mostraron diferencias significativas, aunque los patrones de desplazamiento sí. Al respecto, Tomiyama (1992) menciona que los patrones de movimiento de esta especie dependen de la edad del individuo; individuos jóvenes tienden a desplazarse largas distancias, a diferencia de los adultos que lo hacen en cortas distancias, solo lo necesario para alimentarse y regresar a su lugar de origen o de estancia permanente, denominado homming, antes del amanecer.
Esto es consistente con lo observado con los individuos 7, 18 y 19, que mostraron polígonos estrechos (Fig. 2a), en comparación a los individuos 21, 25 y 26, quienes mostraron de polígonos más amplios (Fig. 2b). Este comportamiento estaría relacionado con el tamaño del individuo, pues el individuo 25 es un adulto (9.5 cm) que no se desplaza más que lo necesario para alimentarse y regresar a su lugar de origen, mientras que individuos jóvenes como los individuos 7 y 19, con tamaños entre 4 – 7 cm, tienden a tener mayor desplazamiento en busca de alimento, reproducción o mejores condiciones ambientales (Wone & Beauchamp 2003).
Estos patrones de dispersión muestran que A. fulica se ha adaptado a ambos escenarios indistintamente al grado de alteración en Cerro Blanco, sin embargo, dentro del sendero se pudo constatar que el caracol africano es más vulnerable a insectos (obs. personal), y a pesar que no se observó interrelación con predadores superiores (mamíferos o aves), el caracol africano representa un riesgo potencial para la fauna nativa, pues al ser ingerido, o el simple contacto de sus heces en el suelo, serviría como hospederos intermediarios de varios patógenos (Solórzano et al. 2014, Cazorla et al. 2015, Sánchez & Man Ging 2015, Cuasapaz-Sarabia 2016, Morand 2017), por lo que debe ser considerado como una amenaza emergente para la biodiversidad local de Cerro Blanco (Fischer & Colley 2004, Aguirre & Tabor 2008, Gutiérrez-Gregoric et al. 2013, Gutiérrez-Gregoric et al. 2011).
La densidad poblacional de A. fulica dentro del Bosque Protector Cerro Blanco fue alta, siendo evidente que ha alcanzado zonas boscosas, lo que muestra que su presencia no se limita solo a zonas suburbanas o rurales, sino naturales. Esto es consistente con lo reportado por Correoso (2009), quien documenta la presencia de abundantes ejemplares jóvenes y adultos de caracol africano, de gran tamaño, en la Reserva Marina-Costera Pacoche en Manabí, por lo que es necesario realizar estudios a largo plazo de esta especie invasora dentro de áreas de conservación (Gutiérrez-Gregoric et al. 2011, Peralta 2014, Pyek et al. 2017).
También, debe destacarse que existen especies nativas expuestas a esta amenaza, por ejemplo, el caracol de monte Porphyrobaphe iostoma, una especie de gasterópodo terrestre nativo, que hasta hace 40 años era una especie abundante y común dentro de esta reserva (Félix Man Ging, comm. pers), pero que durante la fase de campo del presente estudio no se observó, por lo que es recomendable documentar si existe un problema de desplazamiento de la especie nativa (Alonso & Castro–Diez 2015; Pyek et al. 2017), más aún cuando el caracol de monte está catalogado como una especie emblemática de la ciudad de Guayaquil (Cornejo 2015).
En cuanto a los parámetros ambientales precipitación, humedad y temperatura ambiental, explican en un bajo porcentaje la variación del área de vida de A. fulica (zona alterada= 6.6% y sendero= 16.6%) siendo su influencia poco relevante; el porcentaje restante de la variación (error residual: zona alterada= 26% y sendero= 36%), debe obedecer a factores no incluidos en este estudio como radiación solar, composición del suelo, fuentes de carbonato de calcio y estadío, entre otros, los cuales sería conveniente incluir en análisis posteriores.
En resumen, la humedad influye directamente sobre el área de vida del caracol africano y su densidad poblacional, lo que concuerda con varios autores (De La Ossa-Lacayo et al. 2012, Albuquerque et al. 2009), y la densidad poblacional está relacionada con el desarrollo y éxito de la invasión (Fischer & Colley 2005, Avendaño & Linares 2015, Gutiérrez-Gregoric et al. 2011).
Por lo anteriormente expuesto, en condiciones ambientales favorables, Achatina fulica representa un peligro para el equilibrio ecológico del Bosque Protector Cerro Blanco, no obstante, en la actualidad, la presencia de esta especie invasora no consta como un asunto clave de manejo (Cun 2012). Al respecto, es importante que dichas acciones se concentren en individuos jóvenes, que se dispersan más activamente que adultos, la gestión debe iniciar antes de desarrollarse altas densidades, o en épocas reproductivas (Roda et al 2016), y considerar barreras para evitar su desplazamiento, como por ejemplo zanjas.
Agradecimientos:
Esto trabajo muestra resultados parciales de la tesis de grado de Bióloga de Jéssica Cuasapaz. Ambos autores agradecen al Blgo. Marcos Morales por sus comentarios y valiosa colaboración durante los muestreos de esta investigación, al Blgo. Paúl Cun por la apertura brindada para la realización de este estudio en el Bosque Protector Cerro Blanco. Al INAMHI por su colaboración en compartir los datos meteorológicos para la realización de este trabajo.
Información sobre los autores:
JAS tuvo la idea original, JC-S realizó el levantamiento de información en campo y análisis estadísticos. Ambos autores analizaron datos, redactaron y aprobaron el manuscrito. Los autores no incurren en conflictos de intereses.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
El presente trabajo se realizó con fondos propios.
Permisos de colecta:
Este trabajo no involucró colecta o preservación de especímenes, y
no usó técnicas invasivas para su desarrollo.
Literatura citada
Aguirre A. & G. Tabo. 2008. Global factors driving emerging infectious diseases. Ann. N. Y. Acad. Sci 1149: 1-3. doi: http://dx.doi.org/10.1196/annals.1428.052 [ Links ]
Albuquerque F.S., M.C. Peso-Aguiar, M.J.T. Assunção-Albuquerque & L. Gálvez. 2009. Do climate variables and human density affect Achatina fulica (Bowditch) (Gastropoda: Pulmonata) shell length, total weight and condition factor? Braz. J. Biol. 69(3): 879-885. doi: http://dx.doi.org/10.1590/S1519-69842009000400016 [ Links ]
Avendaño J. & E. Linares. 2015. Morfometría del caracol gigante africano Achatina fulica (Gastropoda: Achatinidae) en Colombia. Cuadernos de Investigación UNED. 7(2): 287-293. [ Links ]
Badii A., J. Guillen, E. Landeros, Y. Cerna, Y. Ochoa, J. Valenzuela. 2012. Muestreo por Métodos de Captura-Recaptura. Daena 7(1): 97-131. [ Links ]
Borrero F., A. Breure, C. Christensen, M. Correoso & V. Mogollón.2009. Into the Andes: Three new introductions of Lissachatina fulica (Gastropoda, Achatinidae) and its potential distribution in South America. Tentacle 17: 6–8. [ Links ]
Alonso A. & P. Castro-Diez. 2015. Las invasiones biológicas y su impacto en los ecosistemas. Ecosistemas 24(1): 1-3. doi: http://dx.doi.org/10.7818/ECOS.2015.24-1.01 [ Links ]
Cazorla B., L. Martin, M. Erazo, F. Man- Ging, L. Solórzano. 2015. Detección del parásito Cryptosporidium sp. en caracoles Lissachatina fulica de las provincias del Guayas y Los Ríos, Ecuador. Rev. Cient. Cien. Nat y Ambien 9(1):1-4. [ Links ]
Cornejo X. 2015. Las especies emblemáticas de flora y fauna de la ciudad de Guayaquil y de la provincia del Guayas, Ecuador. Rev. Cient. Cien. Nat. Ambien. 9(2):56-71. [ Links ]
Correoso M. 2006. Estrategia preliminar para evaluar y erradicar Achatina fulica (Gastroda: Achatinaceae) en Ecuador. Bol. Téc. Ser. Zool. 6(2):45-52. [ Links ]
Correoso M. & M. Coello. 2009. Modelación y distribución del Lissachatina fulica (Gastropoda, Achatinidae) en Ecuador. Potenciales impactos ambientales y sanitarios. Rev. Geoespacial 4:79-90. [ Links ]
Cuasapaz- Sarabia, J., 2016. Endoparásitos de Achatina fulica Browdich, 1822 (Gastropoda: Achatinidae), en el Recinto Mata de Cacao, cantón Babahoyo, Provincia de Los Ríos, Ecuador. Rev Cien Nat y Ambien. 10(1):5-13. [ Links ]
Cun E.P. 2012. Evaluación de la efectividad de manejo del Bosque Protector Cerro Blanco (BPCB) como estrategia en la planificación y gestión de la reserva (provincia del Guayas- Ecuador). Tesis para optar por el grado de Maestría. Facultad de Ciencias Naturales, Universidad de Guayaquil. http://repositorio.ug.edu.ec/handle/redug/11941 [ Links ]
De la Ossa-Lacayo A., V. De la Ossa, & C. Lasso. 2012. Registro del caracol africano gigante Achatina fulica (Bowdich 1822) (Mollusca: Gastropoda- Achatinidae) en Sincelejo, costa Caribe de Colombia. Biota Colombiana 13 (2): 247-252. doi: https://doi.org/10.21068/bc.v13i2.270 [ Links ]
Fischer M.L. & E. Colley. 2004. Diagnóstico da ocorrência do caramujo gigante africano Achatina fulica Bowdich, 1822 na APA de Guaraqueçaba, Paraná, Brasil. Estudos de Biologia 26(54): 43-50. doi: http://dx.doi.org/10.7213/reb.v26i54.21289 [ Links ]
Fischer M.L. & E. Colley. 2005. Espécie invasora em reservas naturais: caracterização da população de Achatina fulica Bowdich, 1822 (Mollusca - Achatinidae) na Ilha Rasa, Guaraqueçaba, Paraná, Brasil. Biota Neotrop.5(1):127-144. doi: http://dx.doi.org/10.1590/S1676-06032005000100014 [ Links ]
Franco-López, J., 2011. Ecología y conservación: Laboratorio y campo. 1. Editorial Trillas. 342pp. [ Links ]
Gutiérrez J.L. 2017. Modification of habitat quality by non-native species, In: M. Vilà & P.E. Hulme (eds) Impact of Biological Invasions on Ecosystem services. Springer, Cham. pp 33-47. [ Links ]
Gutiérrez-Gregoric D., A.A. Beltramino, R.E. Vogler & A. Rumi. 2013. Expansión del rango de distribución de Achatina fulica Bowdich, 1822 (Gastropoda) en la Argentina y su concordancia con modelos predictivos. Amici Molluscarum 21(1): 17-21. [ Links ]
Gutiérrez-Gregoric D., V. Nuñez, R. Vogler & A. Rumi. 2011. Invasion of the Argentinean Paranense Rainforest by the Giant African Snail Achatina fulica. American Malacological Bulletin 29 (1-2):135-137. https://doi.org/10.4003/006.029.0205 [ Links ]
Martini L. 2011. Diseño de un programa de control y prevención de Angiostrongylus cantonensis en el Ecuador período 2008-2009. Tesis para optar el grado de Maestría. Facultad de Ciencias Médicas, Universidad de Guayaquil. http://repositorio.ug.edu.ec/handle/redug/1477 [ Links ]
Minitab 14 Statistical Software, 2008. [Computer software]. State College, PA: Minitab, Inc. Disponible en: www.minitab.com [ Links ]
Morand S. 2017. Infections and diseases in Wildlife by non-native organisms, In: M. Vilà & P.E. Hulme (eds) Impact of Biological Invasions on Ecosystem services. Springer, Cham. pp 177-190 [ Links ]
Muzzio J. 2011. Moluscos hospederos intermediarios de Angiostrongylus cantonensis en dos provincias de Ecuador. Tesis para optar el grado de Maestría. Instituto de Medicina Tropical Pedro Kouri. http://repositorio.educacionsuperior.gob.ec/handle/28000/777 [ Links ]
Ogbu C., A. Ani, & M. Emeh. 2014. Preferencias de alimentación y comportamiento de alimentación de dos especies de caracoles terrestres gigantes africanos. Córdoba. Arch. Zootec 63(242):337-347. [ Links ]
Peralta A.C. 2014. Registro del caracol africano en parcelas de uso agrícola de la Península de Araya, estado Sucre, Venezuela. Boletín de la Asociación Argentina de Malacología 4(2):16-18 [ Links ]
Pyek P., T.M. Blackburn, E. García-Berthou, I. Perglová & W. Rabitsch. 2017. Displacement and local extinction of native and endemic species, In: M. Vilà & P.E. Hulme (eds) Impact of biological invasions on ecosystem services. Springer. Cham. pp 157–190
Powell R.A. 2000. Animal Home Ranges and territories and Home Range Estimators, In: L. Boitani & T.K. Fuller (eds.), Research techniques in animal ecology: controversies and consequences. Columbia University Press, New York. pp. 65-110. [ Links ]
QGIS. 2016. QGIS Geographic Information System. Open Source Geospatial Foundation Project. Disponible en: http://www.qgis.org/ [ Links ]
Roda A., G. Nachman, S. Weihman, M. Yong Cong & F. Zimmerman. 2016. Reproductive Ecology of the Giant African Snail in South Florida: Implications for Eradication Programs. PLoS ONE 11(11): e0165408. https://doi.org/10.1371/journal.pone.0165408 [ Links ]
Sánchez F. & F. Man-Ging. 2015. Prevalencia del nemátodo Angiostrongylus cantonensis en el huésped intermediario caracol gigante africano (Achatina fulica), en el periodo 2012 y 2013 en varios sectores de la ciudad de Guayaquil, Ecuador. Rev Cien Nat y Ambien 9(1):12-18. [ Links ]
Solórzano L., L. Martini, H. Hernández, J. Sarracent, J. Muzzio, L. Rojas. 2014. Angiostrongylus cantonensis: un parasito emergente en Ecuador. Revista Cubana de Medicina Tropical 66(1):20-33. [ Links ]
Tomiyama K. 1992. Homing behaviour of the Giant African Snail, Achatina fulica (Ferussac) (Gastropoda; Pulmonata). J. Ethol. 10:139-147. [ Links ]
Traveset A. 2015. Impacto de las especies no nativas sobre las comunidades mediado por interacciones mutualistas. Ecosistemas 24 (1): 67-75. Doi: 10.7818/ECOS.2015.24-1.11 [ Links ]
USAID Ecuador. 2011. (en línea). Campaña informativa para el control del caracol gigante africano Achatina fulica. Proyecto USAID-Costas y Bosques Sostenibles. <http://pdf.usaid.gov/pdf_docs/PA00HW21.pdf> Acceso: 20/05/2018. [ Links ]
Wone B. & B. Beauchamp. 2003. Movement, home range and activity patterns of the horned lizard, Phynosoma callii. Journal of Herpetology 37(4): 679-686. doi: https://doi.org/10.1670/267-01A [ Links ]
Correspondencia:
*Autor de correspondencia Universidad de Guayaquil, Facultad de Ciencias Naturales, Carrera de Biología. Av. Raúl Gómez Lince s/n y Av. Juan Tanca Marengo (Campus Mapasingue)
Email J. C.-S.: jessicacuasapaz2001@gmail.com
Email J.A.S: jaime.salasz@ug.edu.ec
Presentado: 05/06/2018
Aceptado: 18/12/2018
Publicado online: 30/03/2018