Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.15381/rpb.v26i1.15918
NOTA CIENTÍFICA
Infección natural por Fasciola hepatica en cérvidos del Perú
Natural infection of Fasciola hepatica in cervids from Peru
Luis A. Gomez-Puerta* 1, José M. Angulo-Tisoc 2, Joel I. Pacheco 2, Maria T. Lopez-Urbina 3, Armando E. Gonzalez 1
1 Laboratorio de Epidemiología y Economía Veterinaria. Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos.
2 Instituto Veterinario de Investigaciones Tropicales y de Altura, Sede Maranganí. Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos.
3 Laboratorio de Microbiología y Parasitología. Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos.
Resumen
En el presente trabajo se registra la infección natural por Fasciola hepatica en un venado de cola blanca (Odocoileus virginianus) y en una taruca (Hippocamelus antisensis), ambos procedentes del departamento de Cusco. Los animales fueron remitidos al Instituto Veterinario (IVITA-Maranganí, FMV, UNMSM) por las autoridades del Servicio Nacional de Flora y Fauna (SERFOR, Sede Cusco). Durante la necropsia de los animales se colectaron seis trematodos de los conductos biliares, los cuales fueron preservados en etanol al 70%. Las observaciones morfológicas indicaron que se trataban de F. hepatica. Esto fue confirmado analizando el ADN mitocondrial de los parásitos amplificando parcialmente los genes citocromo c oxidasa subunidad 1 (cox1) y el NADH deshidrogenasa subunidad 1 (nad1). El análisis de estos genes tuvo una identidad mayor al 99% comparado con registros del banco de genes (GenBank). El presente estudio demuestra la presencia de F. hepatica en estos cérvidos, agregando así dos nuevos hospederos definitivos para el parásito.
Palabras clave: Fasciola hepatica; fasciolosis; venado de cola blanca; Odocoileus virginianus; taruca; Hippocamelus antisensis.
Abstract
Natural infection by Fasciola hepatica is recorded in a white-tailed deer (Odocoileus virginianus) and a taruca (Hippocamelus antisensis), both from the department of Cusco. Animals were remitted to the Veterinary Institute (IVITA-Maranganí, FMV, UNMSM) by the authorities of the National Service of Flora and Fauna (SERFOR, Cusco Headquarters). Six trematodes were collected from the bile ducts during the necropsy of the animals, and they were preserved in 70% ethanol. Morphological analysis indicated that they correspond to F. hepatica. This was confirmed by analyzing of the mitochondrial DNA of the parasites by partially amplifying the cytochrome c oxidase subunit 1 (cox1) and the NADH dehydrogenase subunit 1 (nad1) genes. Analysis of these genes had an identity greater than 99% compared to genes from GenBank. The present study demonstrates the occurrence of F. hepatica in these cervids, thus adding two new definitive hosts for the parasite.
Keywords: Fasciola hepatica; fasciolosis; white- tailed deer; Odocoileus virginianus; taruca; Hippo- camelus antisensis.
Introducción
Fasciola hepatica (Linnaeus, 1758) es un trematodo que está ampliamente distribuido alrededor del mundo. Este parásito es causante de millones de infecciones en humanos y animales, principalmente al ganado, en la mayoría de los países desarrollados y en vías de desarrollo (Mas-Coma et al. 2009). El parásito y sus hospederos intermediarios, caracoles de la familia Lymnaeidae, se adaptan a una amplia gama de diferentes ambientes. Asimismo, estos caracoles se han adaptado a entornos de gran altitud como los Andes de Bolivia y Perú (Mas-Coma et al. 1999, Londoñe et al. 2012). Los caracoles viven mucho tiempo y producen grandes cantidades de cercarias a mayores altitudes, lo que aumenta la transmisión. Las tierras altas de Bolivia y Perú son áreas hiperendémicas con prevalencias de hasta un 70% determinada por microscopía de heces (Mas-Coma et al. 2009).
Los ovinos y bovinos son los hospederos principales para la fasciolosis en el Perú, diversos estudios demuestran prevalencias superiores a 80% en estos rumiantes (Valderrama 2016, Carmona y Tort 2017). Prevalencias menores se han demostrado en camélidos sudamericanos domésticos, equinos, porcinos y cobayos (Espinoza et al. 2010, Flores et al. 2014). Sin embargo, los hallazgos de F. hepatica en especies silvestres son muy limitados, registrándose prevalencias de hasta 32% en vicuñas (Vicugna vicugna Molina, 1782) y 17.6% en cobayos silvestres (Cavia aperea Erxleben, 1777) (Dittmar 2002, Samamé et al. 2016). En el presente estudio se describe dos casos silvestres de infección natural por F. hepatica en el venado de cola blanca (Odocoileus virginianus Zimmermann, 1780) y en la taruca (Hippocamelus antisensis D'Orbigny, 1834) provenientes de Cusco, Perú, utilizando el diagnóstico morfológico y molecular.
Material y métodos
En junio del 2015 y octubre del 2016, un venado de cola blanca (Odocoileus virginianus Zimmermann, 1780) y una taruca (Hippocamelus antisensis D'Orbigny, 1834), respectivamente, ambas hembras adultas, fueron remitidos mediante sus respectivas actas de custodia al Instituto Veterinario IVITA-Marangani, Cusco (Institución científica nacional depositaria de material biológico) de la Universidad Nacional Mayor de San Marcos por las autoridades del Servicio Nacional de Flora y Fauna (SERFOR, sede Cusco) las que proceden de incautación de cazadores furtivos y hallazgo fortuito, respectivamente, e incluidos en la autorización de investigación RDG No 158-2015-SERFOR-DGGSPFFS. En el hallazgo de necropsia los hígados se encontraban ligeramente agrandados de tamaño, al corte del parénquima hepático se colectaron trematodos localizados en los conductos biliares.
Los trematodos fueron colectados y lavados en solución salina. Luego los parásitos fueron fijados y preservados en etanol al 70% en viales debidamente rotulados hasta su estudio morfológico y molecular. Para el estudio morfológico, los trematodos fueron teñidos con tricrómica de Gomori, deshidratados en series sucesivas hasta etanol absoluto. Luego los parásitos fueron clarificados en eugenol y montados en láminas portaobjeto usando bálsamo de Canadá. La descripción morfológica se basó en cinco trematodos colectados del venado cola blanca y uno de la taruca. Las medidas se expresan en rango con su promedio y error estándar (ES) en paréntesis, y están mencionadas en milímetros (mm) y micrómetros (µm).
El ADN fue extraído de tres ejemplares de trematodos (2 del venado cola blanca y 1 de la taruca) usando el protocolo descrito por Gomez-Puerta et al. (2016). Se realizó una reacción en cadena de la polimerasa (PCR) para amplificar parcialmente los genes mitocondriales citocromo c oxidasa subunidad 1 (cox1) y el NADH deshidrogenasa subunidad 1 (nad1). Para ellos se usaron los cebadores y protocolos descritos por Bowles y McManus (1994) y Kostadinova et al. (2003). Todos los productos positivos al PCR fueron secuenciados en un secuenciador automático ABI 3100 (Perkin-Elmer). Las secuencias de los nucleótidos obtenidas fueron comparadas con secuencias de referencias provenientes del banco de genes (GenBank). El análisis filogenético se realizó utilizando el programa MEGA7, midiendo la distancia evolutiva inferida desde la secuencia de nucleótidos. Todas las secuencias obtenidas fueron inscritas en el GenBank con los números de referencia MH681796 – MH681801.
Resultados
Los trematodos tenían una longitud total del cuerpo de 22.40 – 26.70 mm (24.73; ES = 0.65) y un ancho máximo de 9.80 – 13.20 mm (11.57; ES = 0.59). La ventosa oral media 584 – 641 µm (610; ES = 9) de largo por 910 – 988 µm (949; ES = 11). El acetábulo se localiza en el tercio anterior del cuerpo y midió 999 – 1241 µm (1079; ES = 39) de largo por 1008 – 1247 µm (1111; ES = 38) de ancho. La faringe y el esófago tuvieron una longitud de 714 – 824 µm (782; ES = 17) y 402 – 552 µm (437; ES = 24), respectivamente. Los ciegos intestinales fueron ramificados, extendiéndose hacia la parte posterior. Los testículos son muy ramificados y ocupan la parte central del cuerpo. El cirro es desarrollado. El ovario es ramificado y se localiza en el lado izquierdo por encima de los testículos. Las glándulas vitelógenas se localizan en los márgenes laterales. El útero se localiza delante de los testículos y contiene numerosos huevos los cuales median 107 – 134 µm (121; ES = 1.6) de largo por 66 – 86 µm (76; ES = 0.7) de ancho
Por otro lado, el ADN de los ejemplares fue extraído con éxito, así como la amplificación parcial de los genes mitocondriales cox1 y nad1, produciendo amplicones de ~420 y 480 pares de bases (pb), respectivamente. Las secuencias para ambos genes fueron idénticas para los tres ejemplares y fueron registradas en el banco de genes con número de acceso MH681796 – MH681798 para el gen cox1 y MH681799 – MH681801 para el gen nad1.
Discusión
El presente estudio confirma la presencia de F. hepatica en los ciervos estudiados. El análisis morfológico y molecular demostró que los parásitos correspondían a F. hepatica. Las medidas y características morfológicas de los parásitos fueron semejantes con las registradas en estudios previos (Amer et al. 2016, Ichikawa-Seki et al. 2016). Esto se confirmó con el análisis parcial de los genes mitocondriales (cox1 y nad1), llegando a obtener una identidad de más del 99% con secuencias de F. hepatica registradas en el GenBank.
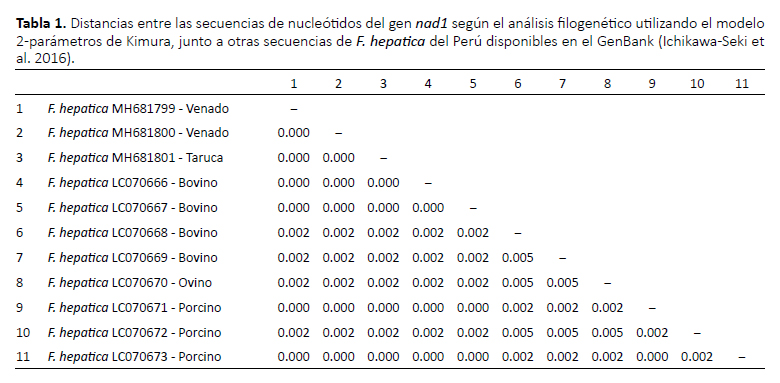
El uso de técnicas moleculares ha brindado mucha ayuda respecto al diagnóstico de los parásitos, principalmente analizando el ADN mitocondrial (Ichikawa-Seki et al. 2016, Bargues et al. 2017). Asimismo, estas herramientas han ayudado a entender mejor la epidemiologia de la enfermedad (Mas-Coma et al. 2009). Las variaciones intraespecíficas en F. hepatica se han investigado utilizando estos genes (Elliott et al. 2014). Los genes mitocondriales cox1 y nad1 han demostrado ser excelentes marcadores genéticos para las poblaciones de F. hepatica (Ichikawa-Seki et al. 2016, Bargues et al. 2017). En nuestro estudio, las secuencias del gen cox1 de los tres ejemplares tuvieron más del 99% de identidad con secuencias de referencia registradas en el GenBank para F. hepatica (GenBank No NC_002546, AF216697 y KF111602 (Fig. 1) (Le et al. 2000, Martínez-Valladares y Rojo-Vázquez 2014)). Asimismo, la alineación de las secuencias del gen nad1 mostró una identidad de 100% con secuencias de F. hepatica reportadas para el Perú (Ichikawa-Seki et al. 2016). El análisis del gen nad1 tuvo una identidad del 100% con F. hepatica colectadas de bovinos (GenBank No LC070666 y LC070667) y cerdos (GenBank No LC070671 y LC070673) del departamento de Cajamarca (Tabla 1) (Ichikawa-Seki et al. 2016). Esto indicaría que los ciervos silvestres, bovinos y cerdos pueden infectarse con el mismo linaje o genotipo del parásito.
Como se sabe, el departamento del Cusco es considerado una zona endémica a fasciolosis (Lopez et al. 2012). Estudios han demostrado prevalencias de fasciolosis de hasta 55.2% en vacunos y 10.0% en humanos (Turpo 2006, Lopez et al. 2012). Es muy probable que el aumento de la población en estos ciervos o la expansión de la ganadería andina ayude con la diseminación y contagio de F. hepatica en las especies silvestres.
En Perú, la taruca y el venado de cola blanca comparten sus hábitat con ungulados salvajes y domésticos, principalmente vicuñas, alpacas y llamas (Gazzolo y Barrio, 2016). Estudios previos han demostrado que los camélidos sudamericanos son altamente susceptibles a fasciolosis. Trabajos científicos demuestran prevalencias de fasciolosis de hasta 50% en llamas, 70% en alpacas y 32% en vicuñas de los Andes peruanos (Flores et al. 2014, Samamé et al. 2016). La convivencia de estos camélidos con los ciervos, los cuales comparten los pastizales para su alimentación, podría explicar la transmisión de F. hepatica a la taruca y al venado de cola blanca.
En lo que respecta a Sudamérica, existen reportes de infección por F. hepatica en cérvidos. Fasciola hepatica ha sido reportado en el ciervo común o europeo (Cervus elaphus Linnaeus, 1758) en Argentina, en el venado de las Pampas o guaraní (Ozotoceros bezoarticus (Linnaeus, 1758)) en Uruguay, así como en el pudú del sur (Pudu puda Molina, 1782) en Chile (Larroza y Olaechea 2010, Hernández y González 2011, Bravo 2013). El presente estudio demuestra la presencia de F. hepatica en el venado de cola blanca y en la taruca, agregando así dos nuevos hospederos definitivos para el parásito. Sin embargo, la importancia de estas especies como reservorios, así como en la epidemiología de la enfermedad aún es desconocida.
Finalmente, el hecho que ahora se cuente con especies silvestres como hospederos definitivos para F. hepatica tendría un impacto negativo para los programas de control de la enfermedad. Sin embargo, será necesario realizar futuros estudios que ayuden a determinar el papel de los ciervos silvestres en la epidemiologia de la fasciolosis en el Perú.
Agradecimientos:
Los autores agradecen a las autoridades del Servicio Nacional de Flora y Fauna (SERFOR, sede Cusco) por la donación de los animales para el estudio.
Roles de los autores:
JMA-T, JIP: colectaron las muestras; LAG-P, MTL-U, AEG: Identificaron y analizaron los parásitos; LAG-P, JMA-T, JIP, MTL-U, AEG: redactaron, revisaron y aprobaron el manuscrito.
Aspectos éticos / legales:
Este trabajo no involucró usó técnicas invasivas para su desarrollo. Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) del Ministerio de Agricultura y Riego permisos de recolección RDG N° 158-2015-SERFOR-DGGSPFFS.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
Los autores declaran no haber tenido una entidad financiadora específica.
Citación:
Gomez-Puerta L., J.M. Angulo-Tisoc, J.I. Pacheco, M.T. Lopez-Urbina, A.E. Gonzalez. 2019. Infección natural por Fasciola hepatica en cérvidos del Perú. Revista peruana de biología 26(1): 143 148 (Febrero 2019). doi: http://dx.doi.org/10.15381/rpb.v26i1.15918
Literatura citada
Amer S., A. ElKhatam, S. Zidan, Y. Feng & L. Xiao. 2016. Identity of Fasciola spp. in sheep in Egypt. Parasites & Vectors 9: 623. http://doi.org/10.1186/s13071-016-1898-2 [ Links ]
Bargues M. D., V. Gayo, J. Sanchis, P. Artigas, M. Khoubbane, S. Birriel & S. Mas-Coma. 2017. DNA multigene characterization of Fasciola hepatica and Lymnaea neotropica and its fascioliasis transmission capacity in Uruguay, with historical correlation, human report review and infection risk analysis. PLOS Neglected Tropical Diseases 11:e0005352. http://doi.org/10.1371/journal.pntd.0005352
Bowles J. & D. P. McManus. 1994. Genetic characterization of the Asian Taenia, a newly described taeniid cestode of humans. American Journal of Tropical Medicine and Hygiene 50: 33 – 44. [ Links ]
Bravo M. J. 2013. Probables causas de muerte y principales hallazgos en la necropsia de pudues (Pudu puda) examinados durante 20 años en el sur de Chile. Tesis doctoral, Universidad Austral de Chile. 28p. http://cybertesis.uach.cl/tesis/uach/2013/fvb826p/doc/fvb826p.pdf [ Links ]
Carmona C. & J. F. Tort. 2017. Fasciolosis in South America: epidemiology and control challenges. Journal of Helminthology 91: 99 – 109. http://doi.org/10.1017/S0022149X16000560 [ Links ]
Dittmar K. 2002. Arthropod and helminth parasites of the wild guinea pig, Cavia aperea, from the Andes and the Cordillera in Peru, South America. Journal of Parasitology 88: 409 – 411. http://doi.org/10.2307/3285601 [ Links ]
Elliott T., A. Muller, Y. Brockwell, N. Murphy, V. Grillo, H. M. Toet, G. Anderson, N. Sangster & T. W. Spithill. 2014. Evidence for high genetic diversity of NAD1 and COX1 mitochondrial haplotypes among triclabendazole resistant and susceptible populations and field isolates of Fasciola hepatica (liver fluke) in Australia. Veterinary Parasitology 200: 90 – 96. http://doi.org/10.1016/j.vetpar.2013.11.019 [ Links ]
Espinoza J. R., A. Terashima, P. Herrera-Velit & L. A. Marcos. 2010. Fasciolosis humana y animal en el Perú: impacto en la economía de las zonas endémicas. Revista Peruana de Medicina Experimental y Salud Pública 27: 604 – 612. http://dx.doi.org/10.17843/rpmesp.2010.274.1535 [ Links ]
Flores B., R. V. Pinedo, F. Suarez, R. Angelats & A. Chávez. 2014. Prevalencia de fasciolosis en llamas y alpacas en dos comunidades rurales de Jauja, Perú. Revista de Investigaciones Veterinarias del Perú 25: 284 – 292. http:// doi.org/10.15381/rivep.v25i2.8501 [ Links ]
Gazzolo C. & J. Barrio. 2016. Feeding ecology of taruca (Hippocamelus antisensis) populations during the rainy and dry deasons in central Peru. International Journal of Zoology 2016: 6. http://doi.org/10.1155/2016/5806472. [ Links ]
Gomez-Puerta L. A., V. Alarcon, J. Pacheco, F. Franco, M. T. LopezUrbina & A. Gonzalez. 2016. Molecular and morphological evidence of Taenia omissa in pumas (Puma concolor) in the Peruvian Highlands. Revista Brasileira de Parasitologia Veterinária 25: 368 – 73. http://doi. org/10.1590/S1984-29612016046. [ Links ]
Hernandez Z. & S. Gonzalez. 2011. Parasitological survey of the Uruguayan populations of wild Pampas deer (Ozotoceros bezoarticus L. 1758). Animal Production Science 52: 781 – 785. http://doi.org/https://doi.org/10.1071/AN11358
Ichikawa-Seki M., P. Ortiz, M. Cabrera, C. Hobán & T. Itagaki. 2016. Molecular characterization and phylogenetic analysis of Fasciola hepatica from Peru. Parasitology International 65: 171 – 174. http://doi.org/10.1016/j.parint.2015.11.010 [ Links ]
Kostadinova A., E. A. Herniou, J. Barrett & D. T. Littlewood. 2003. Phylogenetic relationships of Echinostoma Rudolphi, 1809 (Digenea: Echinostomatidae) and related genera re-assessed via DNA and morphological analysis. Systematic Parasitology 54: 159 – 176. http://doi.org/10.1023/A:1022681123340 [ Links ]
Larroza M. & F. Olaechea. 2010. Comparación de la morfología y la viabilidad de huevos de Fasciola hepatica en distintos hospedadores en Patagonia. Veterinaria Argentina 27: 1 – 5. [ Links ]
Le T. H., D. Blair, T. Agatsuma, P. F. Humair, N. J. Campbell, M. Iwagami, D. T. Littlewood, B. Peacock, D. A. Johnston, J. Bartley, D. Rollinson, E. A. Herniou, D. S. Zarlenga & D. P. McManus. 2000. Phylogenies inferred from mitochondrial gene orders-a cautionary tale from the parasitic flatworms. Molecular Biology and Evolution 17: 1123 – 1125. http://doi.org/10.1093/oxfordjournals.molbev.a026393 [ Links ]
Londoñe P., A. Chávez, O. Li, F. Suárez & D. Pezo. 2012. Presencia de caracoles Lymnaeidae con formas larvarias de Fasciola hepatica en altitudes sobre los 4000 msnm en la sierra sur del Perú. Revista de Investigaciones Veterinarias del Perú 20: 58 – 65. http://dx.doi. org/10.15381/rivep.v20i1.533. [ Links ]
Lopez M., Jr A. C. White M. M. Cabada. 2012. Burden of Fasciola hepatica infection among children from Paucartambo in Cusco, Peru. American Journal of Tropical Medicine and Hygiene 86: 481 – 485. http://doi.org/10.4269/ajtmh.2012.11-0448 [ Links ]
Martínez-Valladares M. & F. A. Rojo-Vázquez. 2014. Intraspecific mitochondrial DNA variation of Fasciola hepatica eggs from sheep with different level of anthelmintic resistance. Parasitology Research 113: 2733 – 2741. http://doi.org/10.1007/s00436-014-3934-5 [ Links ]
Mas-Coma S., M. A. Valero & M. D. Bargues. 2009. Fasciola, lymnaeids and human fasciolosis, with a global overview on disease transmission, epidemiology, evolutionary genetics, molecular epidemiology and control. Advances in Parasitology 69, 41 – 146. https://doi.org/10.1016/S0065-308X(09)69002-3 [ Links ]
Mas-Coma S., R. Anglés, J. G. Esteban, M. D. Bargues, P. Buchon, M. Franken & W. Strauss. 1999. The Northern Bolivian Altiplano: a region highly endemic for human fasciolosis. Tropical Medicine and International Health 4: 454 – 467. https://doi.org/10.1046/j.13653156.1999.00418.x [ Links ]
Samamé L. A., A. Chávez & R. Pinedo. 2016. Fasciolosis en vicuñas (Vicugna vicugna) de la sierra central del Perú. Revista de Investigaciones Veterinarias del Perú 27: 137 – 144. http://dx.doi.org/10.15381/rivep.v27i1.11459 [ Links ]
Turpo I. D. 2006. Frecuencia de fasciolosis e hidatidosis en bovinos beneficiados en el camal de Sicuani-Cusco. Tesis bachiller, Universidad Nacional del Altiplano. 40p. [ Links ]
Valderrama A. A. 2016. Prevalencia de fasciolosis en animales poligástricos de Perú, 1985-2015. Revista Medicina Veterinaria 32: 121 – 129. http://dx.doi.org/10.19052/mv.3861 [ Links ]
Correspondencia:
*Autor para correspondencia:
Email: LAG-P: lgomezp@unmsm.edu.pe, lucho92@yahoo.com
ORCID LAG-P: http://orcid.org/0000-0002-7909-979X
Email: JA-T: jose.angulo3@unmsm.edu.pe, jmangulot@gmail.com
ORCID JA-T: http://orcid.org/0000-0003-3238-5462
E-mail: Joel Pacheco: jmangulot@gmail.com
ORCID JP: https://orcid.org/0000-0001-9978-6522
Email: MTL-U: mlopezu@unmsm.edu.pe
Email: AEG: agonzalezz@unmsm.edu.pe
ORCID AEG: http://orcid.org/0000-0003-1909-1873
Presentado: 30/07/2018
Aceptado: 25/02/2019
Publicado online: 30/03/2019