Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.1 Lima ene./mar. 2019
http://dx.doi.org/10.15381/rpb.v26i1.15919
NOTA CIENTÍFICA
Algunos helmintos parásitos de la gaviota peruana (Larus belcheri)
Some parasitic helminths of the Belcher's gull (Larus belcheri)
Luis A. Gomez-Puerta* 1 ORCID: http://orcid.org/0000-0002-7909-979X, Asucena Naupay2 ORCID: https://orcid.org/0000-0002-6136-3345
1 Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Lima, Perú.
Resumen
La información sobre helmintos parásitos de aves marinas es muy limitada en el Perú. En el presente trabajo, se identificaron helmintos colectados de la gaviota peruana (Larus belcheri) provenientes de algunas playas de Lima (Pucusana, Chorrillos, Ventanilla y Ancón) en Perú. Los helmintos fueron estudiados morfológicamente e identificados como Skrjabinoclava sp. (Nematoda), Contracaecum sp. (Nematoda), Maritrema sp. (Trematoda) y Profilicollis altmani (Acanthocephala). El presente trabajo corresponde a los primeros registros de estos parásitos en la gaviota peruana.
Palabras clave: Helmintos; gaviota peruana; Larus belcheri; Nematoda; Skrjabinoclava; Contracaecum; Trematoda; Maritrema; Acanthocephala; Profilicollis altmani.
Abstract
Information on parasitic helminths of seabirds is very limited in Peru. In the present work, helminths collected from the Belcher's gull (Larus belcheri) from some beaches of Lima (Pucusana, Chorrillos, Ventanilla and Ancón) in Peru were identified. The helminths were studied morphologically and identified as Skrjabinoclava sp. (Nematoda), Contracaecum sp. (Nematoda), Maritrema sp. (Trematoda) and Profilicollis altmani (Acanthocephala). The present work corresponds to the first records of these parasites in the Peruvian gull.
Keywords: Helminths; Peruvian gull; Larus belcheri; Nematoda; Skrjabinoclava; Contracaecum; Trematoda; Maritrema; Acanthocephala; Profilicollis altmani.
Introducción
En la costa peruana habitan más de 150 especies de aves, que dependen del mar para alimentarse y reproducirse, y cuyas poblaciones sobrepasan los cientos de miles e incluso millones de individuos (Duffy 1983, Guillén 1990, Schulenberg et al. 2010). En el Perú existen 16 géneros, 29 especies y 29 subespecies de la familia Laridae (Plenge 2014). A nivel mundial existen 45 especies del género Larus que representan casi la totalidad de las 50 especies de la Familia Laridae (Harrison 1983).
Larus belcheri Vigors, 1829 llamada también "gaviota peruana", es un ave residente de la Costa Peruana, se distribuye en el área comprendida entre las islas Lobos de Tierra (Norte del Perú) y al Sur Coquimbo (Chile), ocasionalmente llega hasta Panamá (Harrison 1983). La gaviota peruana es omnívoro y carroñero, se alimenta de peces, cangrejos, moluscos y carroña. Asimismo, son predadores de huevos y pichones de aves guaneras (Guillén 1990).
En el Perú, existe muy poca información sobre la helmintofauna de las aves marinas, en especial de la familia Laridae. Una de las pocas referencias es la de Taboada et al. (1974), en la cual se menciona la ocurrencia del acantocéfalo Falsifilicollis sp. y el trematodo Mesophorodiplostomum sp. en la gaviota de Franklin (Leucophaeus pipixcan (Wagler, 1831)). Posteriormente, el trematodo fue evaluado por Tantaleán et al. (1975) y determinó que la especie correspondía a M. pricei. Por otro lado, Mateo et al. (1982) estudia acantocéfalos colectados de L. belcheri y lo identifica como Polimorphus (Profilicollis) bullocki. Asimismo, un estudio parasitológico en la gaviota de Franklin describen la ocurrencia del acantocéfalo Profilicollis altmani (Sin. P. bullocki) y los cestodos Tetrabothrius sp., Wardium paucispinosum, y Phyllobothrium sp. (Centeno y Sánchez 2015).
En el presente trabajo se describe algunos helmintos colectados de la gaviota peruana (L. belcheri), contribuyendo así con el conocimiento de la fauna helmíntica de esta gaviota.
Material y métodos
Entre octubre de 2011 y noviembre de 2014, se colectaron helmintos de 11 gaviotas peruanas (L. belcheri) halladas muertas en las playas de Pucusana, Chorrillos, Ventanilla y Ancón, en el área de Lima Metropolitana. Las aves muertas se trasladaron al Laboratorio de Parasitología Humana y Animal de la Facultad de Ciencias Biológicas, en la Universidad Nacional Mayor de San Marcos. Los helmintos fueron colectados y lavados en suero fisiológico. Luego, se fijaron y preservaron en etanol al 70% en viales debidamente rotulados. Para el estudio anatómico y morfológico de los helmintos, los nematodos fueron clarificados con lactofenol de Amann, mientras que los digeneos y acantocéfalos fueron coloreados con Carmín Acético de Semichon.
Las fotografías se realizaron usando un microscopio Carl Zeiss Axioskiop-40. Las medidas fueron obtenidas usando el programa Leica IM50 Versión, 4.0 R117. Las medidas se expresan en milímetros (mm) y micras (µm), en promedio con sus respectivos rangos.
Para la identificación de los nematodos se utilizaron las claves propuestas por Anderson et al. (2009), Barus et al. (1985) y Mozgovoy (1953). Para la identificación del digeneo se usaron las claves propuestas por Bray et al. (2008). La nomenclatura taxonómica de los nematodos sigue a Anderson et al. (2009) y la del digeneo sigue a Bray et al. (2008). Parte de las muestras examinadas se encuentran depositadas en la Colección de Parásitos del Laboratorio de Epidemiologia y Economía Veterinaria de la Facultad de Medicina Veterinaria de la Universidad Nacional Mayor de San Marcos (FMV), Lima, Perú (SERFOR RDG N° 023-2018).
Resultados
Filo: Nematoda
Orden: Spirurida
Familia: Acuariidae
Género: Skrjabinoclava Sobolev, 1943
Skrjabinoclava sp.
(FMV 1398)
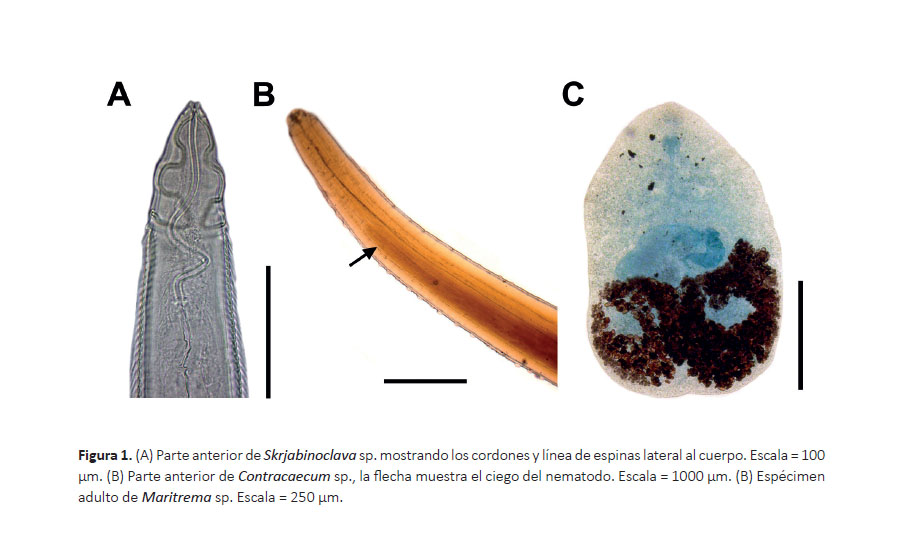
Nematodos pequeños con cordones amplios, los cuales son comprimidos lateralmente. Las espinas del cuerpo forman una línea larga detrás de cordones y se distribuye hasta la parte posterior del cuerpo (Fig. 1A). Su cutícula es gruesa con estrías transversales regulares.
Macho: Longitud máxima de 4.54 mm, con una anchura máxima de 183 µm, cerca de la mitad del cuerpo. Los cordones tienen una longitud de 298 µm y un ancho de 3.2 – 4.3 µm. La capsula bucal tiene 190 µm de longitud. El anillo nervioso y poro excretor están localizados 189 µm y 215 µm de la parte anterior del cuerpo, respectivamente. El esófago se divide en una región muscular y una glandular. La longitud del esófago muscular y glandular es 184 µm y 412 µm, respectivamente. El ancho máximo del esófago es 49 µm. La espícula izquierda tiene una longitud de 669 µm y termina en punta cónica. La espícula derecha mide 188 µm de longitud. La distancia de la cloaca a la parte posterior mide 219 µm. La cola mide 40.2 µm de longitud.
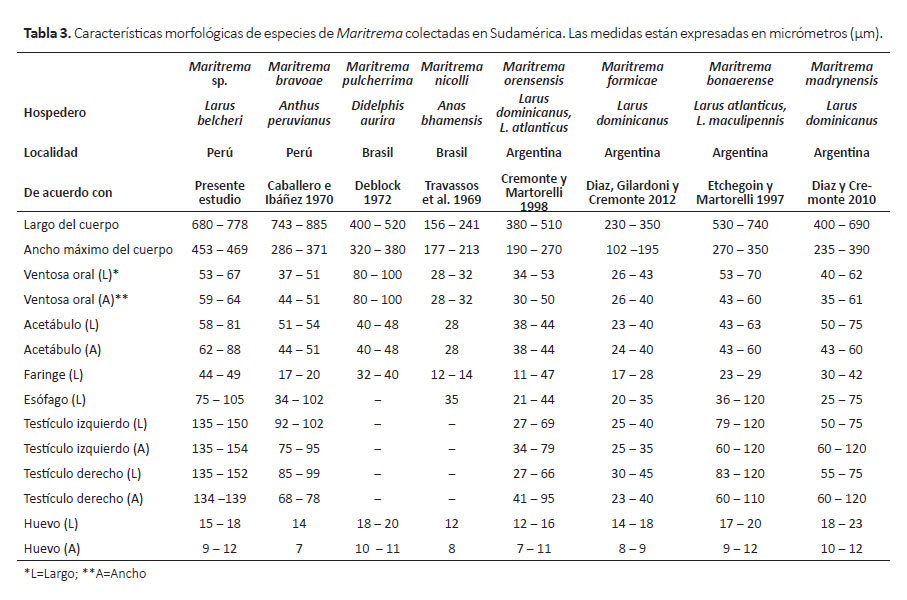
Comentarios.- El género Skrjabinoclava se encuentra conformado por aproximadamente 30 especies. En Sudamérica, los estudios parasitológicos han registrado solo seis especies de Skrjabinoclava: S. tupacincae Freitas, Vicente, Ibañez, 1970, S. bakeri Wong y Anderson, 1987, S. inornatae Wong y Anderson, 1987, S. hartwichi Wong y Anderson, 1987, S. andersoni Cremonte y Navone 1999 y S. thapari Freitas, 1953 (Freitas 1953, Freitas et al. 1970, Wong y Anderson 1987). Todas estas especies son parásitos de aves, a diferencia de S. thapari, la cual utiliza al mapache (Procyon cancrivorus (Cuvier, 1798)) como hospedero definitivo.
Actualmente, solo dos especies de Skrjabinoclava han sido registradas en láridos: S. andersoni en la gaviota dominicana (Larus dominicanus (Lichtenstein, 1823)) y en la gaviota cangrejera o gaviota de Olrog (Larus atlanticus Olrog, 1958), ambas en Argentina (Cremonte y Navone 1999); y S. horrida en la gaviota de Delaware (Larus delawarensis Ord, 1815) y en la gaviota sombría (Larus fuscus Linnaeus, 1758) de Europa (Wong y Anderson 1987). A pesar que las medidas de algunas de las partes anatómicas del espécimen estudiado difiere con especies de Skrjabinoclava registradas en el Perú y en láridos (Tabla 1), será necesario hacer el estudio morfológico de más especímenes provenientes de L. belcheri, para confirmar si el espécimen estudiado corresponde a una nueva especie de Skrjabinoclava.
Orden: Ascaridida
Familia: Anisakidae
Género: Contracaecum Railliet y Henry 1912
Contracaecum sp.
(FMV 1399)
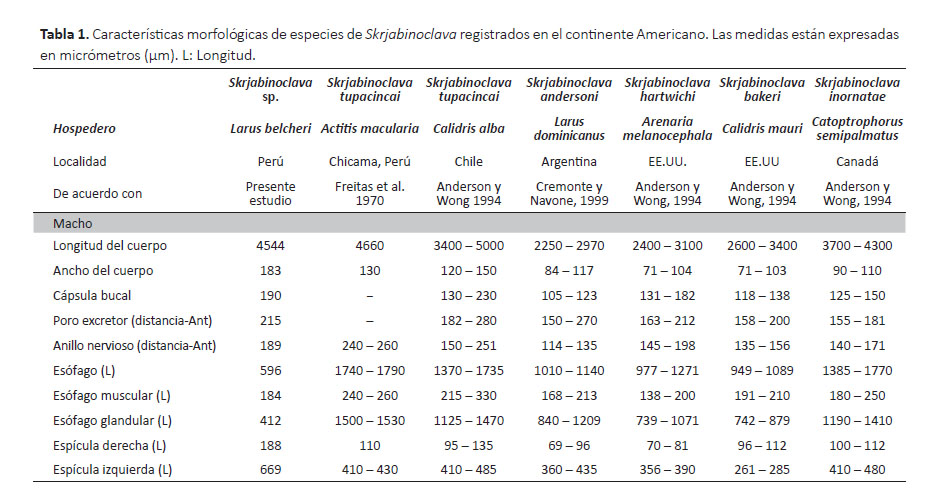
Macho: (Especie #1, medidas basadas en 3 especímenes).
Nematodos con cutícula transversalmente estriada. Labio dorsal y ventrolateral con una ligera depresión medial en el margen superior. Interlabia presente. Esófago con ventrículo globular reducido. Presencia del ciego intestinal. Poro excretor en la base de los labios. Longitud total del cuerpo 18.1 (16.7 – 22.3) mm con un ancho máximo de 600 (586 – 612) µm. Anillo nervioso situado a 432 (412 – 447) µm de la extremidad anterior. Longitud total del esófago 2037 (1998 – 2122) µm, con 167 (159 – 171) µm de ancho máximo. Apéndice ventricular 704 (697 – 710) µm de largo. Ciego intestinal 1400 (1392 – 1410) µm de largo. Espículas ligeramente iguales; la espícula derecha mide 4217 (4200 – 4225) µm de longitud; espícula izquierda mide 4230 (4217 – 4241) µm de longitud. La cloaca se encuentra a 267 (258 – 272) µm de la parte posterior del cuerpo.
Contracaecum sp.
(FMV 1400)
Macho: (Especie #2, medidas basadas en 2 especímenes).
Nematodos de cuerpo robusto con cutícula transversalmente estriada. Interlabia presente. Esófago con ventrículo globular reducido. Presencia del ciego intestinal (Fig. 1B). Longitud total del cuerpo 36.3 (34.2 – 38.4) mm con un ancho máximo de 1004 (947 – 1063) µm. Poro excretor y anillo nervioso situados a 351 (322 – 379) µm y 946 (798 – 1096) µm de la extremidad anterior, respectivamente. La longitud total del esófago mide 4924 (4846 – 5001) µm. El ciego intestinal y el apéndice ventricular miden 3575 (3480 – 3670) µm y 775 (748 – 801) µm, respectivamente. Espículas ligeramente iguales; la espícula derecha mide 5559 (5502 – 5616) µm de longitud; espícula izquierda mide 5108 (4945 – 5271) µm de longitud. La cloaca se encuentra a 270 (245 – 295) µm de la parte posterior del cuerpo.
Comentarios.- Los nematodos del género Contracaecum Railliet y Henry, 1912 (Nematoda: Anisakidae) utilizan a una variedad de especies de peces como hospederos intermediarios o paraténicos. Asimismo, las aves y mamíferos piscívoros actúan como hospederos definitivos para estos parásitos (Anderson 2000). Actualmente en el Perú se registra cuatro especies para el género Contracaecum. Contracaecum microcephalum (Rudolphi, 1809) para el huaco común (Nycticorax nycticorax (Linnaeus, 1758)) de Junín y Puno; Contracaecum osculatum Rudolphi, 1802 para los otarios Arctocephalus australis (Zimmermann, 1783) y Otaria flavescens (Shaw, 1800). Contracaecum ovale (Linstow, 1907) para el macá común (Podiceps rolland Quoy and Gaimard, 1824) y Contracaecum rudolphii sensu lato (Rudolphi, 1819) Hartwich, 1964 para la gaviota dominicana (L. dominicanus), gaviota andina (Chroicocephalus serranus (Tschudi, 1844)); el pelícano pardo (Pelecanus occidentalis Linnaeus, 1766), el cormorán guanay (Leucocarbo bougainvillii (Lesson, 1837)) y en el cormorán neotropical (Phalacrocorax brasilianus (Gmelin, 1789)) (Sarmiento et al. 1999). El presente estudio corresponde al primer hallazgo de Contracaecum sp. para la gaviota peruana.
Ambos especímenes estudiados correspondían a estadios adultos y representaban a diferentes especies, esto por diferir en el tamaño de los órganos internos, así como en el tamaño de las espículas. El tamaño del cuerpo de las especie de Contracaecum sp. descritas en el presente estudio (especie 1 y 2) fueron muy similares con C. microcephalum y C. ovale (Tabla 2). Sin embargo, las 2 especies de Contracaecum sp. se diferenciaron de C. microcephalum y C. ovale principalmente por el tamaño de las espículas, siendo más grande en los especímenes estudiados. Por otro lado, algunas medidas de las 2 especies de Contracaecum sp. estaban dentro del rango de las medidas registradas para C. rudolphii (Tabla 2). Actualmente, C. rudolphii es considerada una especie sensu lato (D'Amelio et al. 2012), por este motivo el diagnóstico de los parásitos quedó como Contracaecum sp. Será necesario realizar futuros estudios que incluyan las técnicas moleculares para identificar las especies de Contracaecum que parasitan a las aves y mamíferos marinos en el Perú.
Clase: Trematoda
Orden: Plagiorchiida
Familia: Microphallidae
Género: Maritrema Nikoll, 1907
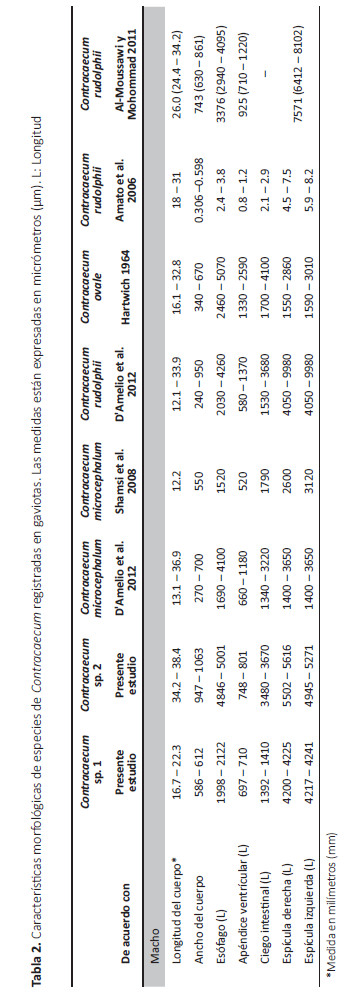
Maritrema sp.
(FMV 1401)
La descripción está basada en cinco ejemplares adultos teñidos y montados en láminas portaobjeto (Fig. 1C). Digeneos de cuerpo piriforme, miden 720 (680 – 778) µm de largo por 459 (453 – 469) µm en ancho máximo a nivel testicular. Tegumento espinoso. Ventosa oral terminal, mide 58 (53 – 67) µm de largo por 62 (59 – 64) µm de ancho. El acetábulo tenía 68 (58 – 81) µm de largo por 77 (62 – 88) µm de ancho. Faringe muscular bien desarrollada, mide 46 (44 – 49) µm de largo por 47 (45 – 50) µm de ancho. El esófago mide 88 (75 – 105) µm largo. El ciego intestinal izquierdo y derecho miden 199 (188 – 218) µm y 192 (185 – 199) de largo, respectivamente. Ambos ciegos terminan al nivel del poro genital. El testículo izquierdo mide 143 (135 – 150) µm de largo y 144 (135 – 154) µm de ancho. El testículo derecho mide 143 (135 – 152) µm de largo y 136 (134 – 139) µm de ancho. El saco del cirro mide 245 (216 – 275) µm de largo y 83 (75 – 91) µm de ancho máximo. El ovario localizado en la zona antero-lateral al acetábulo, inmediatamente anterior al testículo derecho, mide 56 (54 – 58) µm de largo por 61 (60 – 62) µm de ancho. El útero se origina en la parte distal del ootipo, ocupando la región post-testicular, terminando en un metratermo que se abre en el poro genital. Los huevos tenían 16 (15 – 18) µm de largo por 10 (9 – 12) µm de ancho.
Comentarios.- Las especies del género Maritrema parasitan principalmente las aves marinas, utilizando a gasterópodos como primeros hospederos intermediarios, y a los crustáceos como segundos hospederos intermediarios (Ching 1963, Deblock 1972). Solo siete especies de Maritrema han sido reportadas en Sudamérica. Estas incluyen dos especies en Brasil: Maritrema nicolli Travassos, 1920 en el pato gargantillo (Anas bahamensis Linnaeus, 1758 (Sin. Daphila bahamensis)) y Maritrema pulcherrima Travassos, 1929 en el tracto digestivo de la zarigüeya brasileña (Didelphis aurita (Wied-Neuwi., 1826)) (Deblock 1972). Una especie en Perú: Maritrema bravoae Caballero e Ibáñez, 1970 en el ave paseriforme Anthus peruvianus Nicholson, 1878 (Caballero e Ibáñez 1970). Cuatro especie en Argentina: Maritrema bonaerense Etchegoin y Martorelli, 1997 (Sin. M. bonaerensis (ver Diaz et al. 2012)) en el intestino de las gaviotas Larus atlanticus Olrog, 1958 y Chroicocephalus maculipennis (Lichtenstein, 1823) (Sin. Larus maculipennis) (Etchegoin y Martorelli 1997), Maritrema orensensis Cremonte y Martorelli, 1998 en las gaviotas L. dominicanus y L. atlanticus (Cremonte y Martorelli 1998); Maritrema madrynensis Diaz y Cremonte, 2010 y Maritrema formicae Diaz, Gilardoni, Cremonte 2012 en L. dominicanus (Diaz y Cremonte 2010, Diaz et al. 2012). El tamaño del cuerpo de Maritrema sp. colectada de la gaviota peruana fueron semejantes con M. bravoae y M. bonaerense. Sin embargo, Maritrema sp. se diferenció de ellas por el tamaño del acetábulo, faringe y testículos, siendo más grandes en esta (Tabla 3). El presente estudio representa el primer registro de Maritrema sp. en la gaviota peruana.
Clase: Archiacanthocephala
Orden: Polymorphida
Familia: Polymorphidae
Género: Profilicollis
Profilicollis altmani (Perry, 1942) Van Cleave, 1947
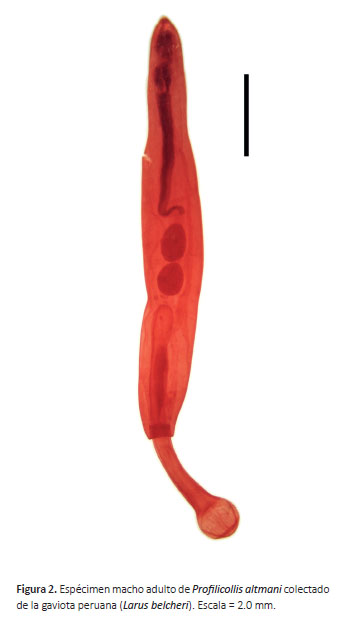
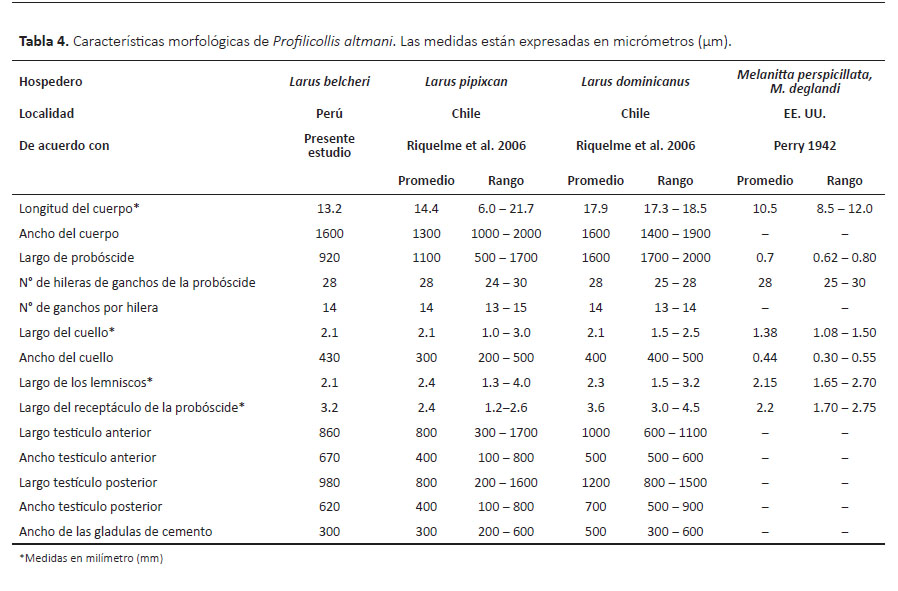
La descripción está basada en un ejemplar macho teñido y montado en lámina portaobjeto (Fig. 2). Acantocéfalos de cuerpo alargado con cuello largo y probóscide globular-esférica. El cuerpo midió 13.2 mm de largo y un ancho máximo de 1600 µm en la parte media del cuerpo. La probóscide midió 920 µm de largo y 1030 µm de ancho, y presentó 28 hileras de ganchos, cada hilera tuvo 14 ganchos. Cuello de 2.1 mm de largo con un ancho máximo de 430 µm. Lemniscos midieron 2.1 mm de largo. El receptáculo midió 3.2 mm de largo. El testículo anterior midió 860 y 670 de largo y ancho, respectivamente. El testículo posterior midió 980 de largo y 620 de ancho. Presentó cuatro glándulas de cemento con diámetro promedio de 300 µm.
Comentarios.- Las características morfológicas del acantocéfalo estudiado coincidieron con las descripciones para Profilicollis altmani (Tabla 4). Profilicollis altmani fue originalmente descrito como Filcollis altmani por Perry (1942) y posteriormente fue considerado dentro del género Profilicollis por Van Cleave (1947). Asimismo, estudios posteriores en gaviotas del Pacifico reportaron nuevas especies de acantocéfalos, tales como Polymorphus (Profilicollis) bullocki en la gaviota Peruana (L. belcheri) (Mateo et al., 1983) y Polymorphus kenti en la gaviota argéntea (Larus argentatus) (Van Cleave 1947). Posteriormente, estas especies de acantocéfalos fueron consideradas sinónimas de P. altmani (Amin 2013). Por otro lado, P. altmani es un parásito que tiene importancia en salud pública. En 1991, fueron documentados casos de parasitismo humano por Falsifilicollis sphaerocephalus (Ibáñez y Machado 1991), una especie considerada sinónima de P. altmani (Amin 2013). Como es sabido, los crustáceos Emerita analoga y E. talpoidea, están involucrados en el ciclo de vida de P. altmani, actuando como hospederos intermediarios (Tantaleán y Cárdenas 2004). Este crustáceo es utilizado en algunos platos peruanos, principalmente el ceviche, y de esta manera se podría explicar la transmisión a los humanos.
Agradecimientos:
Roles de los autores:
AN: colectó las muestras; LAG-P, AN: Identificaron los parásitos; LAG-P, AN: redactaron, revisaron y aprobaron el manuscrito.
Aspectos éticos / legales:
Este trabajo no involucró usó técnicas invasivas para su desarrollo.
Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) del Ministerio de Agricultura y Riego - permisos de recolección RDG N° 023-2018-MINAGRI-SERFOR-DGGSPFFS.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
Los autores declaran no haber tenido una entidad financiadora específica.
Literatura citada
Al-Moussawi A. A. & M. K. Mohammad. 2011. Contracaecum rudolphii Hartwich, 1964 (Nematoda: Anisakidae) in the cormorant Phalacrocorax carbo (Linnaeus, 1758) wintering in Baghdad area: a new host record in Iraq. Bulletin of Iraq Natural History Museum 11: 7 – 16. [ Links ]
Amato J. F. R., C. M. Monteiro & S. B. Amato. 2006. Contracaecum rudolphii Hartwich (Nematoda, Anisakidae) from the Neotropical Cormorant, Phalacrocorax brasilianus (Gmelin) (Aves, Phalacrocoracidae) in southern Brazil. Revista Brasileira de Zoologia 23: 1284 – 1289. https://doi.org/10.1590/S0101-81752006000400046 [ Links ]
Amin O. M. 2013. Classification of the Acanthocephala. Folia Parasitologica 60: 273 – 305. [ Links ]
Anderson R. C. 2000. Nematode parasites of vertebrates: Their development and transmission, 2nd ed. CABI Publishing, Wallingford, Oxon, UK, 650 p. [ Links ]
Anderson R. C. & P. L. Wong. 1994. New species of Skrjabinoclava (Nematoda: Acuarioidea) from the Semipalmated Sandpiper (Calidris pusilla) (Aves: Scolopacidae). Journal of the Helminthological Society of Washington 61: 64 – 66. [ Links ]
Anderson R. C., A. G. Chabaud & S. Willmott. 2009. Keys to the nematode parasites of vertebrates: archival volume. CAB International, Wallingford (UK). 463 p. [ Links ]
Barus V., T. P. Sergeeva, M. D. Sonin & K. M. Ryzhikov. 1978. Helminths of fish-eating birds of the Palearctic region I. Nematoda. Springer science, Checoslovaquia. 318 p. https://doi.org/10.1007/978-94-009-9972-5 [ Links ]
Bray R. A., D. I. Gibson & A. Jones. 2008. Keys to the Trematode. Vol. 3. London, UK. CAB International and Natural History Museum. 451 – 492 p. [ Links ]
Caballero C. E. & N. Ibañez. 1970. Estudios helmintológicos de la República del Perú. I. Dos especies de Trematoda de la familia Microphallidae Travassos, 1920 que parasitan a Aves. Anales del Instituto de Biología, Universidad Nacional Autónoma de México. Serie zoología 41: 29 – 38. [ Links ]
Centeno I. & L. Sánchez. 2015. Helmintos parásitos de la gaviota de Franklin Leucophaeus pipixcan (Wagler, 1831) de los pantano de Villa, Chorrillos, Lima. The Biologist 13, Suplemento Especial 1: 68. [ Links ]
Ching H. L. 1963. The description and life cycle of Maritrema laricola sp. n. (Trematoda: Microphallidae). Canadian Journal of Zoology 41: 881 – 888. https://doi.org/https://doi.org/10.1139/z63-058 [ Links ]
Cremonte F. & S. R. Martorelli. 1998. Description of a new species of Maritrema (Digenea: Microphallidae) from Larus dominicanus (Aves: Laridae) in Buenos Aires coast, Argentina. Folia Parasitologica 45: 230 – 232. [ Links ]
Cremonte F. & G. T. Navone. 1999. Co-occurrence of Pectinospirura argentata Wehr, 1933, Skrjabinoclava andersoni n. sp. and larvae (Nematoda: Acuariidae) in the proventriculus of Larus dominicanus Lichtenstein (Aves: Laridae), with notes on their attachment. Systematic Parasitology 42: 203 – 211. doi: https://doi.org/10.1023/A:1006054720048 [ Links ]
D'Amelio S., S. Cavallero, N. O. Dronen, N. B. Barros & L. Paggi. 2012. Two new species of Contracaecum Railliet & Henry, 1912 (Nematoda: Anisakidae), C. fagerholmi n. sp. and C. rudolphii F from the brown pelican Pelecanus occidentalis in the northern Gulf of Mexico. Systematic Parasitology 81: 1 – 16. https://doi.org/10.1007/s11230-011-9323-x [ Links ]
Deblock S. 1972. Contribution à l’étude des Microphallidae Travassos, 1920 (Trematoda) XXIII. Les espèces décrits au Brésil par L. Travassos. Annals of Parasitology 47: 77 – 89.
Diaz J. I. & F. Cremonte. 2010. Development from metacercaria to adult of a new species of Maritrema (Digenea: Microphallidae) parasitic in Kelp Gull, Larus dominicanus, from Patagonian coast, Argentina. Journal of Parasitology 96: 740 – 745. https://doi.org/10.1645/GE-2343.1. [ Links ]
Diaz J. I., C. Gilardoni & F. Cremonte. 2012. Description of Maritrema formicae sp. nov. (Digenea, Microphallidae) parasitic in the kelp gull, Larus dominicanus, from the Patagonian coast, Argentina. Acta Parasitologica 57: 149 – 153. https://doi.org/10.2478/s11686-012-0019-4. [ Links ]
Duffy D. 1983. The foraging ecology of Peruvian seabirds. Auk 100: 800 – 810. [ Links ]
Etchegoin J. A. & S. R. Martorelli. 1997. Description of a new species of Maritrema (Digenea: Microphallidae) from Mar Chiquita coastal lagoon (Buenos Aires, Argentina) with notes on its life cycle. Journal of Parasitology 83: 709 – 713. https://doi.org/10.2307/3284251. [ Links ]
Freitas J. F. T. 1953. Echinuriinae parasito de mamífero (Nematoda, Spiruroidea). En: Dayal J. & K. S. Singh. Thapar Commemoration Volume A. A collection of articles presented to Prof. G.S. Thapar on this 60th Birthday. University Lucknow, Lucknow. 51: 89 – 94. [ Links ]
Freitas J. F. T., J. J. Vicente & N. Ibañez. 1970. Fauna helmintológica do Peru: Nova especie do genero Skrjabinoclava Sobolev, 1943 (Nematoda, Spiruroidea). Atas da Sociedade de Biologia do Rio de Janeiro 12: 1 – 3. [ Links ]
Guillén V. 1990. Registro de aves marinas en el Callao. Boletín de Lima 71: 41 – 46. [ Links ]
Harrison P. 1983. Seabirds, an identificaction guide. Christopher Helm (Publishers). Ltd, London. 448 p. [ Links ]
Hartwich G. 1964. Revision Der Vogelparasitischen Nematoden Mitteleuropas. II. Die Gattung Contracaecum Railliet & Henry, 1912 (Ascaridoidea). Mitteilungen aus dem Zoologischen Museum in Berlin 40: 15 – 53. [ Links ]
Mateo E., R. Cordova & E. Guzmán. 1982. Polymorphus (Profilicollis) bullocki. Nueva especie de acantocéfalo hallado en la gaviota Larus belcheri en el Perú. Boletin de Lima 4: 73 – 78. [ Links ]
Mozgovoy A. A. 1953. Principles of nematodology II. Ascaridata of animals and man and the diseases caused by them. Part II. Moscow: Izdat. Akad. Nauk SSSR, 616 p. (En Ruso). [ Links ]
Plenge M. A. 2014. Species and subspecies of the birds of Peru. Unión de Ornitólogos del Perú. https://sites.google.com/site/boletinunop/subespecies. (Acceso 15/07/2018) [ Links ]
Riquelme C., M. George-Nascimento & L. Balboa. 2006. Morfometría y fecundidad de Profilicollis bullocki Mateo, Córdova & Guzmán 1982 (Acanthocephala: Polymorphidae) en especies simpátricas de aves costeras de Chile. Revista Chilena de Historia Natural 79: 465 – 474. [ Links ]
Sarmiento L., M. Tantaleán & A. Huiza. 1999. Nemátodos parásitos del hombre y de los animales en el Perú. Revista Peruana de Parasitología 14: 9 – 65. [ Links ]
Schulenberg T. S., D. F. Stotz, D. F. Lane, J. P. O’Neill & T. A. Parker III. 2010. Aves de Perú. Princeton University Press, Princeton, New Jersey, 660 p.
Shamsi S., R. Gasser, I. Beveridge & A. Alizadeh Shabani. 2008. Contracaecum pyripapillatum n. sp. (Nematoda: Anisakidae) and a description of C. multipapillatum (von Drasche, 1882) from the Australian pelican, Pelecanus conspicillatus. Parasitology Research 103: 1031 – 1039. https://doi.org/10.1007/s00436-008-1088-z [ Links ]
Taboada D. A., E. Zárate & M. T. Valderrama. 1974. Determinación de algunos helmintos parásitos de Larus pipixcan Wagler "gaviota de franklin". Revista Peruana de Biología 1: 194 – 195. http://dx.doi.org/10.15381/rpb.v1i2.8421 [ Links ]
Tantaleán M., R. Martínez & D. Juárez. 1975. Estudio de algunos trematodos del Perú. Revista Peruana de Medicina Tropical, Universidad Nacional Mayor de San Marcos 3-4: 46 – 56. [ Links ]
Tantaleán M. & J. Cárdenas. 2004. Consideraciones sobre Profilicollis altmani (Perry, 1942) Van Cleave, 1947 en el Perú. Revista Peruana de Biología 11: 109 – 111. http://dx.doi.org/10.15381/rpb.v11i1.2442 [ Links ]
Travassos L., J. F. T. Freitas & A. Kohn. 1969. Trematódeos do Brasil. Memórias do Instituto Oswaldo Cruz 67: 1 – 886. [ Links ]
Van Cleave H. J. 1947. Analysis of distinctions between the acanthocephalan genera Filicollis and Polymorphus, with description of a new species of Polymorphus. Transactions of the American Microscopical Society 66(3): 302 – 313. https://doi.org/10.2307/3223398 [ Links ]
Wong P. L. & R. C. Anderson. 1987. New and described species of Skrjabinoclava Sobolev, 1943 (Nematoda: Acuarioidea) of the proventriculus of nearctic waders (Aves: Charadriiformes) with a review of the genus and a key to species. Canadian Journal of Zoology 65: 2760 – 2779. https://doi.org/10.1139/z87-418 [ Links ]
Correspondencia:
1 Laboratorio de Epidemiología y Economía Veterinaria. Facultad de Medicina Veterinaria. Universidad Nacional Mayor de San Marcos. Av. Circunvalación 2800, San Borja. Lima, Perú.
2 Laboratorio de Parasitología Humana y Animal. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos. Av. Venezuela s/n cuadra 34. Lima, Perú.
*Autor para correspondencia:
Email LAG-P: lgomezp@unmsm.edu.pe, lucho92@yahoo.com
Email AN: anaupayi@unmsm.edu.pe, asucnau@yahoo.es
Presentado: 30/07/2018
Aceptado: 25/02/2019
Publicado online: 30/03/2019