Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rpb.v26i2.15337
TRABAJOS ORIGINALES
Variación ontogenética y dimorfismo sexual en Platalina genovensium (Chiroptera: Phyllostomidae)
Ontogenetic and secondary sexual dimorphism variation in Platalina genovensium (Chiroptera: Phyllostomidae)
Dennisse Ruelas* ORCID iD: 0000-0002-3793-8639
1 Universidad Nacional Mayor de San Marcos, Museo de Historia Natural, Av. Arenales 1256, Lima 11, Perú.
*Programa de Conservación de Murciélagos
Resumen
La variación por edad y el dimorfismo sexual en murciélagos son aspectos frecuentemente estudiados; sin embargo, esta información no está disponible para Platalina genovensium, una especie de murciélago amenazado que habita ecosistemas secos entre Perú y Chile. En este estudio, se presentan los primeros datos sobre su caracterización en clases de edad y un análisis de dimorfismo sexual. Se analizaron 31 especímenes entre juveniles y adultos para evaluar la ontogenia. Luego, usando solo especímenes adultos se evaluó la presencia de dimorfismo sexual mediante análisis estadísticos y multivariados usando una variable externa y 14 cráneo-dentales. Como resultado, se presenta caracterizaciones de los estadíos juvenil (clase I) y adulto (clases IV y V), además del cráneo de un feto. Con respecto al dimorfismo sexual, se encontró que la longitud del antebrazo entre hembras y machos no presenta diferencias estadísticamente soportadas mientras que, a nivel cráneo-dental, el ancho de la rama mandibular fue la principal variable dimórfica. Se sugiere que las diferencias reportadas entre especímenes juveniles y adultos y entre hembras y machos sean entendidas desde una perspectiva evolutiva y de adaptación y no solo ontogenéticamente.
Palabras clave: cráneo; edad; feto; mandíbula; morfología.
Abstract
Ontogenetic development and sexual dimorphism in bats are aspects frequently studied; however, this information is not available for Platalina genovensium, a threatened bat species that occurs in dry ecosystems between Peru and Chile. In this study, I present the first information about the ontogeny and sexual dimorphism of the species based on the review of collection specimens. I analyzed 31 specimens including juveniles and adults to assess ontogeny. Sexual dimorphism was tested by statistical and multivariate analysis using one external and 14 cranio-dental variables on adults only. Descriptions of juvenile (age class I) and adult stages (age classes IV and V) are presented, as well as the skull of a fetus. I found that the forearm length did not present statistically supported differences between sexes, whereas at the cranial-dental level, the mandibular branch width was the main dimorphic variable. I suggest that the differences reported between juvenile and adult specimens and between females and males should be understood from the perspective of evolution and adaptation and not only ontogenetically.
Keywords: age; fetus; mandible; morphology; skull; variation.
Introducción
Actualmente, uno de los objetivos de la biología integrativa es dilucidar los fundamentos evolutivos de los patrones ecológicos actuales asumiendo que la selección natural, en lugar de la competencia, favorece el desplazamiento de caracteres (Adams & Pedersen 2000). Este enfoque pretende integrar la morfología, el desarrollo, la biología evolutiva y la filogenética en una teoría unificada de la evolución (Klingenberg 1998; Adams & Pedersen 2000). En este sentido, es importante no solo comprender el nicho de un organismo, sino también la variación por edad y sexo como parte de la estructura social de una comunidad (Tchumy 1982; Polis 1984; Werner y Gilliam 1984; Shine 1989; Safi 2008; Bolnick et al. 2011).
En los vertebrados, la diferenciación de las formas adultas comienza en los primeros estadios de su desarrollo y continúa hasta la edad adulta, donde los cambios morfológicos adaptativos, como la aparición de nuevos estados de carácter, son afectados por la selección natural, la cual puede favorecer algunas morfologías novedosas que pueden ser heredables como cambios evolutivos dentro de las poblaciones (Müller & Wagner 1991; Klingenberg 1998; Adams & Pedersen 2000). Estas presiones selectivas tienen mayor efecto durante el desarrollo, por lo que el estudio de los organismos juveniles es la clave para entender los cambios morfológicos de las especies desde una perspectiva evolutiva (Raff 1996; Adams & Pedersen 2000). En cuanto al desarrollo ontogénico de los murciélagos, los estudios se han enfocado principalmente en el desarrollo embrionario relacionado a su adaptación al vuelo y ecolocación (Adams & Pedersen 2000).
Por otro lado, los estudios sobre la variación por sexo o dimorfismo sexual han contribuido sustancialmente a la comprensión de los procesos ecológicos y evolutivos, relacionados tanto a la adaptación como a la selección (Shine 1989; Andersson & Iwasa 1996; Bornholdt et al. 2008). El dimorfismo sexual en cuanto al tamaño ha sido relacionado principalmente con la competencia por recursos, la selección sexual y cuidado parental (Ralls 1977; Camargo & de Oliveira 2012). En el caso de los murciélagos se han reportado especies dimórficas donde generalmente las hembras son más grandes que los machos, y monomórficas, donde hembras y machos son similares en tamaño (Ralls 1976, 1977; Hurtado et al. 2015). Diversos autores han sugerido hipótesis que intentan explicar ambas condiciones. Williams y Findley (1979) sugirieron que el mayor tamaño de las hembras es una respuesta adaptativa a las demandas metabólicas del mantenimiento homeostático durante la preñez; mientras que, Myers (1978) sugirió que el mayor tamaño de las hembras refleja una respuesta adaptativa a los desafíos aerodinámicos del vuelo durante la preñez. Diversos estudios sugieren un dimorfismo no solo en peso y tamaño corporal, sino también en la longitud del antebrazo, envergadura alar y comportamiento (Camargo & de Oliveira 2012; O'Mara et al. 2016).
El dimorfismo sexual ha sido relativamente bien documentado en murciélagos vespertiliónidos, siendo las hembras más grandes y pesadas que los machos (Ralls 1976; Myers 1978; Schulz 1999; Bornholdt et al. 2008). Sin embargo, esta información en murciélagos filostómidos es menor a pesar de ser la familia más diversa y mejor distribuida en el Neotrópico (Gardner 2008). No obstante, aunque diversos aspectos del dimorfismo sexual y el desarrollo ontogénico han sido descritos para algunas especies de murciélagos, muchas otras aún no han sido evaluadas.
Platalina genovensium es un murciélago nectarívoro, clave en el mantenimiento de los ecosistemas secos, distribuido desde el norte de Perú hasta el norte de Chile (Ruelas & Pacheco 2018) y es, además, una especie amenazada (Pacheco & Aguirre 2016). Desde su descripción se ha generado diversa información que ha contribuido de manera significativa con el conocimiento sobre su morfología (Velazco et al. 2013), historia natural (Sahley & Baraybar 1996; Zamora et al. 2014; Malo de Molina et al. 2011; Maguiña & Amanzo 2016), filogenia (Parlos et al. 2014) y distribución (Koopman 1978; Ruelas & Pacheco 2018). Sin embargo, debido a los pocos registros y poca cantidad de especímenes en colecciones, muchos otros aspectos como el desarrollo ontogenético y el dimorfismo sexual no han sido evaluados. No obstante, Velazco et al. (2013) basados en observaciones sugirieron que la mandíbula en especímenes machos es más robusta que en hembras pero no la cuantificaron.
El objetivo de este estudio fue caracterizar la variación ontogenética por clases de edad y evaluar la presencia de dimorfismo sexual secundario en Platalina genovensium usando especímenes de museos.
Material y métodos
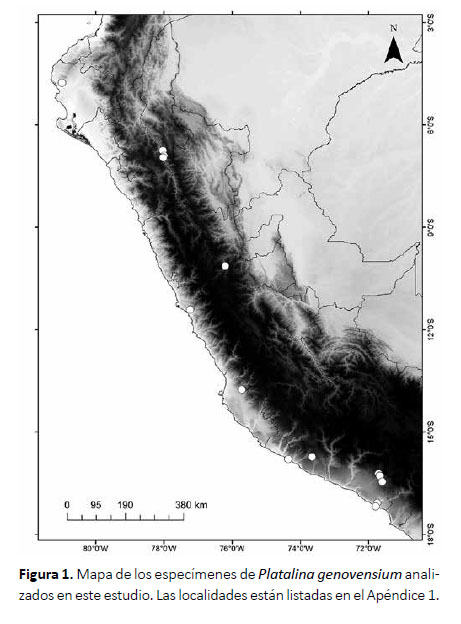
Se analizaron 31 especímenes de Platalina genovensium provenientes de siete departamentos del Perú depositados en el Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (MUSM, Perú) y en el American Museum of Natural History (AMNH, EE.UU.). En el Apéndice 1 se presenta el listado de ejemplares examinados y mapeados (Fig. 1). Para determinar la edad se siguió el criterio de Pacheco y Patterson (1992) modificado, considerando principalmente el desarrollo de la dentadura y osificación de los huesos:
-
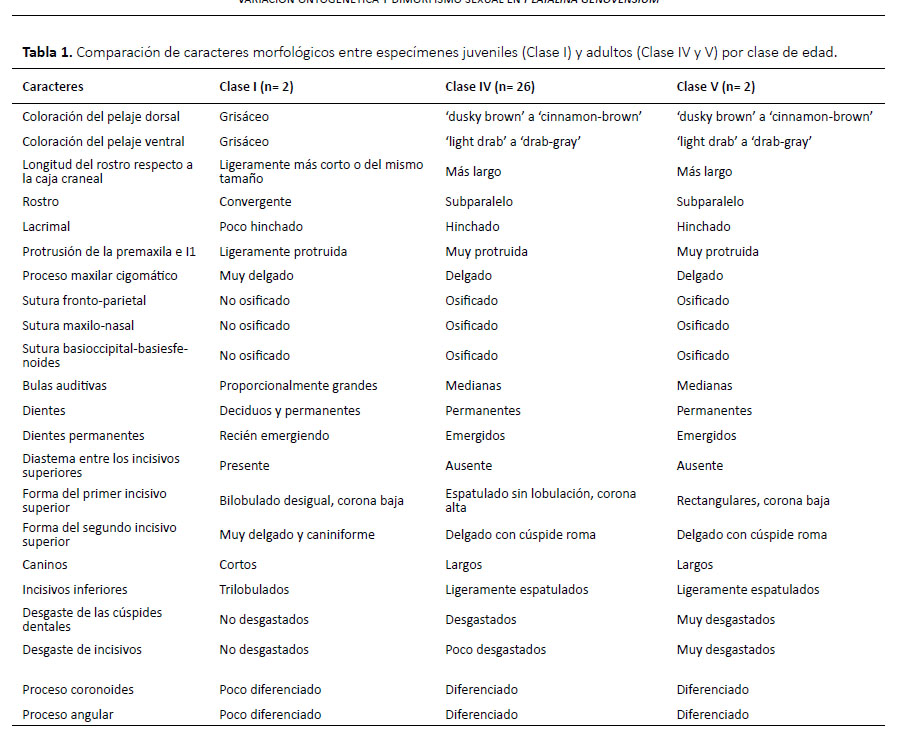
Clase I (juvenil): especímenes con huesos craneales aún no fusionados completamente, con la epífisis cartilaginosa en algunos huesos largos como el fémur o húmero, con dientes deciduos y dientes permanentes aun brotando y coloración del pelaje grisácea.
-
Clase II (juvenil): especímenes con huesos craneales osificados, sutura basiesfeoides-basioccipital casi completamente osificada, con algunos dientes deciduos sobrepuestos en los dientes permanentes, y coloración del pelaje grisácea.
-
Clase III (subadulto): cráneo completamente osificado (incluyendo suturas), incisivos superiores ligeramente pequeños y separados, molares y premolares sin desgaste y coloración del pelaje grisácea.
-
Clase IV (adulto): especímenes similares a los de clase III, pero con incisivos superiores espatulados, dentadura poco desgastada y coloración de adulto.
-
Clase V (adulto): especímenes similares a la clase IV, pero con dentadura más desgastada y más evidente en los incisivos.
Para la caracterización morfológica se siguió a Phillips (1971), Wetterer et al. (2000) y Griffiths y Gardner (2008). Para definir la coloración del pelaje se siguió la escala de colores de Smithe (1975) bajo luz natural difusa.
Para evaluar el dimorfismo sexual se analizaron variables externas y cráneo-dentales únicamente de especímenes adultos (clases IV y V). Dada la poca cantidad de muestras disponibles y considerando que la especie es potencialmente migratoria (Sahley 1995; Sahley & Baraybar 1996; Zamora et al. 2013), se analizaron los especímenes de la vertiente occidental de los Andes como una población (n= 25). Las medidas externas que se tomaron de las etiquetas fueron la longitud total (LT), longitud de la cola (LC), longitud de la pata (LP), longitud de la oreja (LO), longitud del trago (Ltr) y peso. Éstas solo se emplearon con fines descriptivos. Mientras que, la longitud del antebrazo (AB) se consideró como una variable dimórfica entre sexos, y se analizó mediante un análisis de varianza (ANOVA) de una vía. Luego, se tomaron 14 medidas cráneo-dentales: longitud máxima del cráneo (LMC), longitud cóndilo-basal (LCB); longitud cóndilo- canina (LCC), desde el borde anterior del canino superior hasta el borde posterior del cóndilo occipital; longitud palatal (PAL); constricción postorbital (CPO), ancho mínimo postorbital; ancho mastoideo (AM); ancho de la caja craneal (ACC); alto de la caja craneal (ALC), desde el basicráneo hasta la parte más alta del cráneo; longitud entre I-M3 (I-M3); longitud de la hilera dental maxilar (LHM), desde la base del primer incisivo superior hasta la parte posterior del tercer molar superior; ancho mínimo entre M3-M3 (M3M3), longitud mínima interna entre los terceros molares superiores; ancho mínimo entre los caninos (CC); longitud de la rama mandibular (LM), desde la base del primer incisivo inferior hasta el cóndilo mandibular; y alto de la rama mandibular (ARM), a nivel del ultimo molar inferior. Las medidas se tomaron usando un calibrador Fisher Scientific (error: ±0.01). Luego se realizó un análisis de componentes principales y sobre el componente con mayor varianza se aplicó la prueba t de Student para muestras independientes. Previamente probamos los supuestos de normalidad mediante la prueba de Shapiro-Wilk y homocedasticidad mediante la prueba F de Fisher. Todos los análisis se realizaron en R 3.4.4 (R Core Team 2018). El nivel de significancia estadística fue de p<0.05.
Resultados
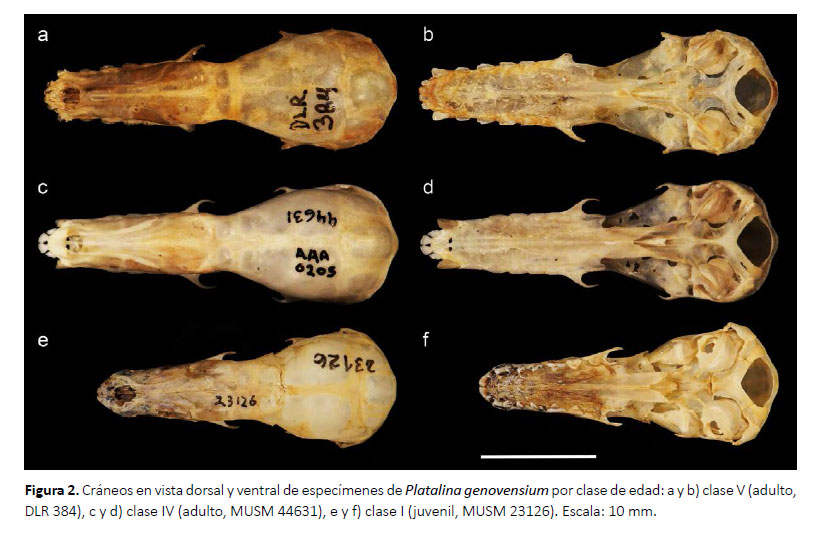
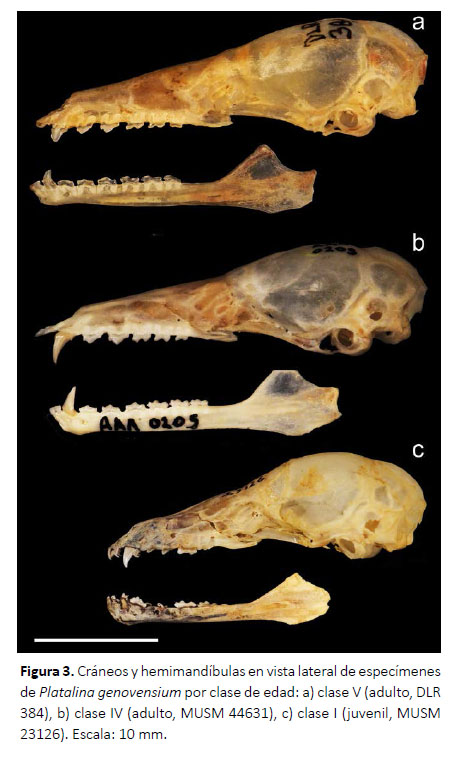
Caracterización ontogénica.Esta revisión da cuenta de dos especímenes juveniles (clase I), 28 adultos (clase IV: 26 especímenes; clase V: 2 especímenes) y 1 feto, los cuales se describen a continuación:
En los especímenes juveniles el pelaje es grisáceo, los patagios son oscuros y contrastan ligeramente con el pelaje, el rostro es convergente y ligeramente más corto o de la misma longitud que la caja craneal, el lacrimal es poco hinchado, la premaxila y primeros incisivos superiores son ligeramente protruidos, el proceso maxilar cigomático es muy delgado, la sutura fronto-parietal no está osificada, la sutura maxilo-nasal no está osificada, la sutura basioccipital-basiesfenoides no está osificada, la fosa mesopterigoidea es relativamente larga y ancha, su margen anterior tiene forma de V, las fosas del basiesfenoides son ligeramente profundas y estrechas, las bulas auditivas son proporcionalmente grandes, presentan alrededor de 22 dientes deciduos dispuestos de sobre los dientes permanentes que recién están emergiendo, los dientes deciduos tienen puntas muy delgadas y filudas y están dirigidas hacia atrás, los incisivos superiores deciduos están separados por diastemas amplios, el primer incisivo superior permanente es desigualmente bilobulado con el lóbulo interno más grande, el segundo incisivo superior es delgado y caniniforme; el canino superior es más grueso y el doble de alto que el segundo incisivo superior, los premolares superiores son muy pequeños y similares en forma y tamaño entre ellos, los molares superiores son pequeños pero con la misma estructura que presentan los molares permanentes de los adultos; los incisivos inferiores son trilobulados, el primer incisivo inferior es el doble más ancho que el segundo incisivo inferior, el canino inferior es delgado y muy pequeño, los premolares inferiores son pequeños, y los molares inferiores tienen estructura similar a los molares de adulto, la rama mandibular es muy delgada y los procesos coronoides y angular recién están diferenciándose (Figs. 2, 3; Tabla 1).
Los especímenes adultos de las clases de edad IV y V solo se diferenciaron por el desgaste dental, el cual es mucho mayor en los de clase V. Los adultos en general presentaron antebrazo mediano (47.49-52.00 mm), pelaje de mediano tamaño casi en todo el cuerpo (8 mm de largo en la espalda), el pelaje dorsal tiene un patrón tricoloreado, con el extremo distal de color dusky brown (color 19) a cinnamon-brown (color 33), la parte media y basal son de color smoke gray (color 44) a blanquecinas, y en algunos especímenes se pueden notar pelos oscuros esparcidos; mientras que el pelaje ventral presenta el extremo distal de color light drab (color 119C) a drabgray (color 119D) y la región media y el extremo basal son blanquecinos; los patagios son de color café oscuro y contrastan fuertemente con el pelaje; el cráneo es alargado, el rostro es subparalelo, la longitud del rostro excede ampliamente a la de la caja craneana, la premaxila y el primer incisivo inferior están protruidos fuertemente, el proceso maxilar cigomático es delgado, la sutura frontoparietal osificada, la sutura maxilo-nasal osificada, la sutura basioccipital-basiesfenoides osificada; el paladar es largo y estrecho, la fosa mesopterigoidea es relativamente larga y ancha, su margen anterior tiene forma de V, las fosas del basiesfenoides son ligeramente profundas, las bula auditivas son proporcionalmente medianas; fórmula dental I 2/2, C 1/1, P 2/3 y M3/3; el primer incisivo (I1) es de forma espatulada y es aproximadamente 25 % más grande y ancho que segundo incisivo (I2), mientras que I2 es alargado, delgado y con las puntas romas dirigidas hacia I1; I1 e I2 se encuentran juntos, dirigidos hacia adelante, entre I2 y el canino hay un pequeño diastema; el canino (C) es desarrollado, delgado, con la superficie interna casi plana, en la parte posterior presenta un cíngulo moderado; los premolares superiores son estrechos en sentido labio-lingual y anchos lateralmente, con coronas moderadamente bajas y no están en contacto, ambos son morfológicamente similares; sin embargo, el primer premolar (P1) es ligeramente más pequeño que el segundo premolar (P2), tienen aspecto de hoja filuda con el cíngulo anterior más desarrollado que el posterior el cual es más propenso a desgaste; los tres molares superiores normalmente no están en contacto, el tamaño es decreciente de adelante hacia atrás, pero morfológicamente son similares; los incisivos inferiores están bien desarrollados, son anchos, presentan una corona alta y son ligeramente procumbentes y forman una línea casi continua, y entre el segundo incisivo (i2) y el canino (c) existe un pequeño diastema, i2 es ligeramente más estrecho que i1, pero morfológicamente son iguales; el canino inferior es muy desarrollado, simple, ligeramente curvado, con un cíngulo posterior pequeño; los premolares inferiores son anchos, estrechos en sentido labio-lingual, no están en contacto, presentan cíngulos anterior y posterior bien desarrollados de aproximadamente el mismo tamaño, sus cúspides principales son relativamente bajas y romas; los molares inferiores también tienen aspecto de hojas filudas, son similares morfológicamente pero el tamaño es decreciente en sentido antero-posterior, m1 y m2 se encuentran ligeramente más separados que m2 y m3. La rama mandibular es ligeramente delgada, el proceso coronoides es bajo y romo, el proceso angular tiene una punta roma muy ancha (Figs. 2, 3; Tablas 1 y 2).
Los especímenes de clase V presentan los incisivos superiores bastante desgastados, notándose I1 e I2 casi del mismo tamaño; los caninos con puntas romas y muy cortas, mientras que los premolares y molares ya no presentan puntas filudas como en los de la clase de edad IV. Los únicos especímenes de edad V revisados fueron hembras (DLR 348, MNH 149).
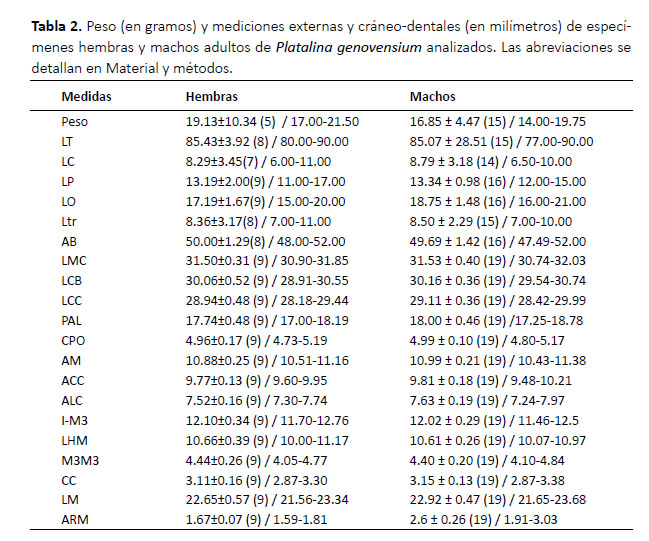
Adicionalmente, se examinó una hembra (MUSM 26153) preñada, conteniendo un embrión, el cual presenta el rostro muy corto y dirigido hacia abajo, la caja craneal muy globosa y asimétrica con el lado derecho más hinchado. Características que indican el poco desarrollo del embrión incluyen los huesos incompletamente osificados, huesos craneales aún separados, paladar muy corto, cuatro dientes superiores en proceso de erupción, bula auditiva comparativamente grande y aún en proceso de formación, mandíbula muy delgada con solo un diente probablemente emergido y las ramas mandibulares separadas (Fig. 4). No se encontraron huesos postcraneales, probablemente debido a que estos eran cartilaginosos y fueron destruidos por los derméstidos durante el proceso de limpieza.
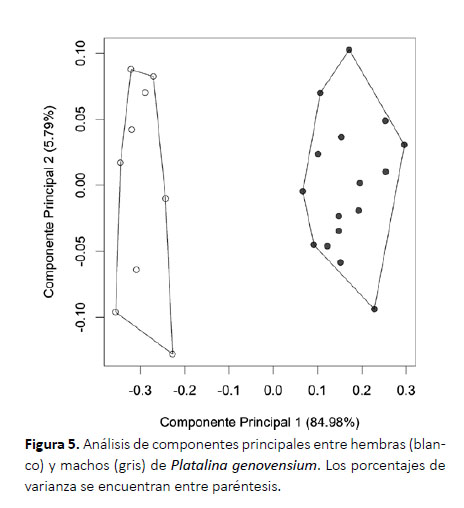
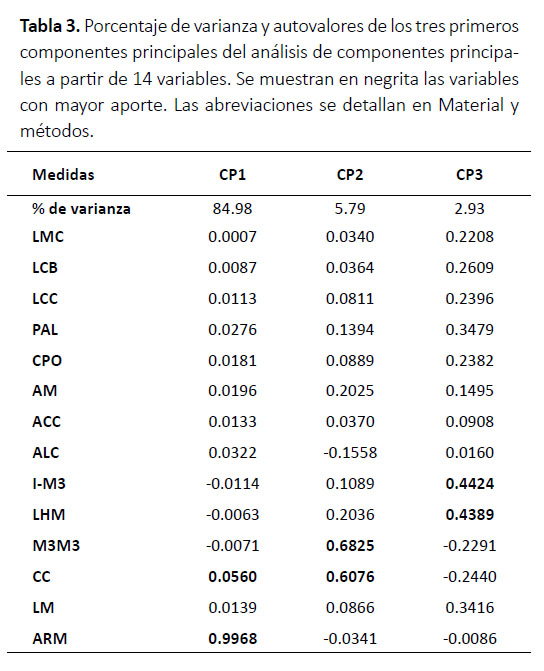
Dimorfismo sexual.La longitud del antebrazo entre hembras y machos no presentó diferencias soportadas estadísticamente (F= 0.53, p= 0.47). Mientras que, los resultados del análisis de componentes principales empleando variables craneales mostraron que los tres primeros componentes representan el 93.69% de la varianza total, donde el primer componente explicó la mayor varianza (84.98%) y las variables que más influyeron sobre el componente fueron ARM y CC, Este componente presentó valores con distribución normal (hembras: W=0.95, p=0.73; machos: W=0.96, p=0.72). Mientras que, el segundo componente explicó el 5.79% de la varianza y las variables que más influyeron fueron M3M3 y CC; y el tercer componente explicó el 2.93% de la varianza total y las variables I-M3 y LHM aportaron más al componente (Fig. 5; Tabla 3). La prueba t de Student encontró que hay diferencias estadísticamente soportadas entre hembras y machos (t= -21.24, df= 22.01, p<0.001).
Discusión
Variación ontogénica y morfológica.En este estudio encontramos diferencias en los caracteres cráneodentales entre especímenes juveniles y adultos, los cuales no solo están relacionados con la osificación de las suturas, coloración de pelaje y desgaste dentario, que son usados frecuentemente para determinar clases de edad en murciélagos (Pacheco & Patterson 1992); sino también caracteres presentes en juveniles en un diferente estado que en adultos como los incisivos superiores fuertemente bilobulados, los incisivos inferiores trilobulados, el rostro convergente o los lacrimales apenas hinchados. Con frecuencia se les da poca consideración a las diferencias entre juveniles y adultos y el papel que desempeñan estas diferencias en la dinámica de la población, así como en la evolución del ecosistema, por considerarse como un periodo efímero del ciclo de vida y, por lo tanto, difícil de medir; mientras que las formas adultas son vistas como la unidad significativa del nicho de una especie (Adams & Pedersen 2000), ya que, por lo general, son consideradas como una construcción inmutable y morfológicamente estable, mientras que los< juveniles como formas prefuncionales en lugar de ser entendidas como etapas adaptativas evolutivamente importantes que ocupan su propio nicho, el ontogenético (Werner & Gilliam 1984; Coppinger & Smith 1990; Adams & Pedersen 2000). En este sentido, diversos autores sugieren que las formas adultas deben entenderse como el resultado de la selección natural y la interacción múltiple de factores intrínsecos y extrínsecos durante su etapa juvenil (Lauder 1982; Coppinger & Smith 1990; Adams & Pedersen 2000).
En cuanto a los estudios ontogenéticos realizados en murciélagos, se han centrado principalmente en el desarrollo embrionario en diversos temas como el desarrollo morfológico, la cuantificación del crecimiento y osificación de las manos, pies y patagios los cuales a su vez están relacionados con el vuelo (Adams 2000; Adams & Thibault 2000; Wyant & Adams 2007; Adams 2008). Sin embargo, pocos son los estudios sobre el desarrollo osteológico en murciélagos (Giannini et al. 2006; ReyesAmaya & Jerez 2013; Reyes-Amaya et al. 2017), desconociéndose en gran medida los procesos de osificación de la mayoría de las especies. Este es el primer estudio en mostrar una imagen del cráneo limpio de un feto de una especie de la familia Phyllostomidae. Aunque el tiempo de gestación y desarrollo embrionario de P. genovensium son desconocidos, el poco desarrollo de las bullas timpánicas del feto sugiere que probablemente tenía alrededor de 46 días de desarrollo (estadio 15 o mayor) y debido a su posición respecto al cráneo, también es probable que la pinna y el trago aún no se hubieran diferenciado completamente (Nolte et al. 2009, Cretekos et al. 2015).
Los dientes embrionarios o deciduos en murciélagos son una interesante característica documentada por algunos autores como Phillips et al. (1977), Nolte et al. (2009) y Ventura et al. (2018). Sin embargo, los dientes en la mandíbula del feto reportado en este estudio (Fig. 4) no son como los dientes deciduos descritos por Phillips (1971), ya que no son caniniformes, sino que presentan una cúspide plana, y debido al poco desarrollo probablemente estos aún no emergieron de la encía dental. Por otro lado, se sugiere estudiar la extraña asimentrÃa craneal observada en P. genovensium y determinar si es parte del desarrollo normal o un caso individual.
A nivel morfológico se encontró en los adultos algunos caracteres discrepantes con otros autores que podrÃan considerarse variables a nivel individual. Phillips (1971) sugirió que el P2 de Platalina carecÃa de cÃngulo posterior; sin embargo, en este estudio sà se pudo notar su presencia, aunque menos desarrollado que el cÃngulo anterior y muy propenso a desgaste. En cuanto a los incisivos inferiores, Galaz et al. (1999) mencionaron que, en su espécimen reportado para Chile, estaban separados por un pequeño diastema; sin embargo, en los especÃmenes analizados los incisivos inferiores se disponen en una lÃnea continua, mientras que entre el I2 y el C sà hay un pequeño diastema. Es probable que el diastema reportado por Galaz et al. (1999) tenga relación con los diastemas presentes en especÃmenes juveniles o subadultos. A nivel individual, los especÃmenes adultos variaron en la cantidad de molares superiores e inferiores, de 3 a 2, lo cual ha sido reportado previamente por Velazco et al. (2013) y Ruelas y Pacheco (2018). Esta disminución en las piezas dentarias también ha sido reportada en otros murciélagos nectarívoros neotropicales como Glossophaga soricina (Ramírez-Pulido & Müdespacher 1987). También se observó que la coloración del pelaje en especímenes colectados en un mismo lugar (e.g. especímenes de Lomas de Granados) puede variar en tonalidades de más claras a más oscuras.
Dimorfismo sexual.Dada la limitada cantidad de muestras analizadas, los resultados presentados son preliminares, pudiendo variar al incrementar el tamaño de la muestra; sin embargo, esto no resta relevancia a los hallazgos reportados en este estudio, que a su vez soportan lo sugerido por Velazco et al. (2013). Los resultados sugieren que principalmente el alto de la rama mandibular (ARM) es una variable importante para diferenciar hembras y machos (Tabla 3; Fig. 5), donde las hembras presentan mandíbulas más delgadas (1.59 – 1.81 mm) que los machos (1.91 – 3.03 mm). No obstante, el espécimen macho adulto (MUSM 44631) reportado por Ruelas y Pacheco (2018) presenta una mandíbula tan delgada como lo reportado para las hembras, pero que en vista oclusal se muestra ligeramente más espesa. También, notamos que los caninos de este espécimen son más largos y anchos; sin embargo, este carácter resulta difícil de cuantificar ya que es susceptible al desgaste.
Si bien la mandíbula está implicada directamente con los hábitos alimenticios de las especies (Gill et al. 2014; De Esteban-Trivigno 2011), el que esta estructura sea sexualmente dimórfica, implica que probablemente las dietas entre hembras y machos sean diferentes. Sin embargo, esto aún no tiene sustento ya que no se ha reportado este patrón en otras especies de la familia Phyllostomidae. Tschapka et al. (2008) encontraron que las hembras de Musonycteris harrisoni, una especie de murciélago especialista en el consumo de néctar, presentan el rostro más corto y robusto que los machos y sugirieron que esto podría ser un efecto de la movilización de calcio de los huesos durante la preñez y lactancia, ya que el calcio sería un factor limitante en las hembras. Además, esta reducción y robustez del rostro, daría la ventaja a las hembras de consumir frutas e insectos (Tschapka et al. 2008). En el caso de P. genovensium, no se ha encontrado este mismo patrón; sin embargo, la delgadez de la mandíbula de las hembras podría también estar asociado a la movilización de calcio como un requerimiento reproductivo (Barclay 2002).
Por otro lado, algunos estudios han reportado que las hembras de P. genovensium tienen el antebrazo relativamente más largo y son más pesadas que los machos (Sahley & Baraybar 1996; Zamora et al. 2013). Sin embargo, en este estudio no encontramos estas diferencias en cuanto al antebrazo, mientras que el peso por ser una variable no medida nuevamente y susceptible a error (e.g. mayor peso de hembras en primeros estadios de preñez), no se evaluó. Aunque es probable que en cuanto al ancho y envergadura alar pueda haber diferencias significativas ya que las hembras son más pesadas que lo machos durante la preñez y al momento de cargar a la cría ya nacida. No obstante, estudios realizados en otras especies de murciélagos no han encontrado diferencias significativas entre hembras y machos en cuanto a estas variables (Camargo & de Oliveira 2012; O'Mara et al. 2016).
Agradecimientos:
Agradezco a Rufford Foundation (RSG reference 17551-1) e Idea Wild por el financiamiento y equipamiento otorgados para este estudio. También agradezco a Rob Voss por permitirme acceder a especímenes depositados en el American Museum of Natural History, y a Víctor Pacheco por su apoyo y la revisión de este manuscrito.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
El presente trabajo se realizó gracias al financiamiento de la Rufford Foundation (RSG reference 17551-1) e Idea Wild.
Aspectos éticos / legales:
Este estudio tuvo autorización del Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) mediante la Resolución de Dirección General N° 021-2016-SERFOR/DGGSPFFS.
Citación:
Ruelas D. 2019. Variación ontogenética y dimorfismo sexual en Platalina genovensium (Chiroptera: Phyllostomidae). Revista peruana de biología 26(2): 201 210 (Julio 2019). doi: http://dx.doi.org/10.15381/rpb.v26i2.15337
Literatura citada
Adams R.A. & K.M. Thibault. 2000. Ontogeny and evolution of the hindlimb and calcar: assessing phylogenetic trends. En: Adams, R. A. & S. C. Pedersen, eds. Ontogeny, Functional Ecology and Evolution of Bats. Cambridge University Press, Cambridge. Pp. 317-332 [ Links ]
Adams R.A. & S.C. Pedersen (eds). 2000. Ontogeny, Functional Ecology, and Evolution of Bats. Cambridge University Press, Cambridge. [ Links ]
Adams R.A. 2000. Wing ontogeny, shifting niche dimensions, and adaptive landscapes. En: Adams, R.A. & S.C. Pedersen, eds. Ontogeny, Functional Ecology and Evolution of Bats. Cambridge University Press, Cambridge. Pp 275-316. [ Links ]
Andersson M.B. & Y. Iwasa. 1996. Sexual Selection. Trends in Ecology & Evolution 11(2):53-58. https://doi.org/10.1016/0169-5347(96)81042-1 [ Links ]
Barclay R.M.R. 2002. Do plants pollinated by flying fox bats (Megachiroptera) provide an extra calcium reward in their nectar? Biotropica 34:168-171. doi: https://doi.org/10.1111/j.1744-7429.2002.tb00252.x [ Links ]
Bolnick D.I., P. Amarasekare, M.S. Araújo, R. Bürger, J.M. Levine, M. Novak, V.H.W. Rudolf, S.J. Schreiber, M.C. Urban & D.A. Vasseur. 2011. Why intraspecific trait variation matters in community ecology. Trends in Ecology & Evolution 26(4):183-192. doi: https://doi.org/10.1016/j.tree.2011.01.009 [ Links ]
Bornholdt R., L.R. Oliveira & M. E. Fabián. 2008. Sexual size dimorphism in Myotis nigricans (Schinz, 1821) (Chiroptera: Vespertilionidae) from south Brazil. Brazilian Journal of Biology 68:897-904. doi: https://doi.org/10.1590/s1519-69842008000400028 [ Links ]
Camargo N.F. de, H.F.M. de Oliveira. 2012. Sexual Dimorphism in Sturnira lilium (Chiroptera, Phyllostomidae): Can pregnancy and pup carrying be responsible for differences in wing shape? PLoS ONE 7(11): e49734. doi: https://doi.org/10.1371/journal.pone.0049734 [ Links ]
Coppinger R.P. & C. K. Smith. 1990. A model for understanding the evolution of mammalian behavior. En: H. H. Genoways, ed. Current Mammalogy. Plenum Press, New York. Pp. 335-374. [ Links ]
Cretekos C.J., S.D. Weatherbee, C.H. Chen, N.K. Badwaik, L. Niswander, R.R. Behringer & J.J. Rasweiler IV. 2005. Embryonic staging system for the short-tailed fruit bat, Carollia perspicillata, a model organism for the mammalian order Chiroptera, based upon timed pregnancies in captive-bred animals. Developmental Dynamics 23:721-738. doi: https://doi.org/10.1002/dvdy.20400
De Esteban-Trivigno S. 2011. Ecomorfología de xenartros extintos: análisis de la mandíbula con métodos de morfometría geométrica. Ameghiniana 48(3):78-102. [ Links ]
Galaz J., J. Torres-Mura & J. Yáñez. 1999. Platalina genovensium (Thomas, 1928), un quiróptero nuevo para la fauna de Chile (Phyllostomidae: Glossophaginae). Noticiario mensual del Museo Nacional de Historia Natural, Santiago de Chile 337:6-12. [ Links ]
Giannini N.P., J.R. Wible & N.B. Simmons. 2006. On the cranial osteology of Chiroptera. I. Pteropus (Megachiroptera: Pteropodidae). Bulletin of the American Museum of Natural History 295:1-134. doi: https://doi.org/10.1206/00030090(2006)295[0001:otcooc]2.0.co;2 [ Links ]
Gill P., M. Purnell, N. Crumpton, K. Brown, N. Gostling, M. Stampanoni & E. Rayfield, 2014. Dietary specializations and diversity in feeding ecology of the earliest stem mammals. Nature. 512:303-307. doi: https://doi.org/10.1038/nature13622 [ Links ]
Griffiths T.A. & A.L. Gardner. 2008. Subfamily Lonchophyllinae Griffiths, 1982. En: Gardner A.L., ed. Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. The University of Chicago Press, Illinois. Pp. 244-255 [ Links ]
Hurtado N., R.D. Sepulveda & V. Pacheco. 2015. Sexual size dimorphism of a sensory structure in a monomorphic bat. Acta Chiropterologica 17:75-83. doi: https://doi.org/10.3161/15081109acc2015.17.1.006 [ Links ]
Klingenberg C.P. 1998. Heterochrony and allometry: the analysis of evolutionary change in ontogeny. Biological Review 73(1):79–123. doi: https://doi.org/10.1111/j.1469-185x.1997.tb00026.x [ Links ]
Koopman K.F. 1978. Zoogeography of Peruvian bats with special emphasis on the role of the Andes. American Museum Novitates 2651:1-33. [ Links ]
Lauder G.V. 1982. Historical biology and the problem of design. Journal of Theoretical Biology 97:57-67. doi: https://doi.org/10.1016/0022-5193(82)90276-4 [ Links ]
Malo de Molina J., S. Velazco, V. Pacheco & J. Robledo. 2012. Análisis de las vocalizaciones del murciélago longirrostro peruano Platalina genovensium Thomas, 1928 (Chiroptera: Phyllostomidae). Revista Peruana de Biología 18:311-318. doi: https://doi.org/10.15381/rpb.v18i3.443. [ Links ]
Maguiña R. & J. Amanzo. 2016. Diet and pollinator role of the long-snouted bat Platalina genovensium in lomas ecosystem of Peru. Tropical conservation Science 9:18 https://doi.org/10.1177%2F1940082916674288 [ Links ]
Müller G.B. & G.P. Wagner. 1991. Novelty in evolution: Restructuring the concept. Annual Review of Ecology and Systematics 22:229-256 https://doi.org/10.1146/annurev.es.22.110191.001305 [ Links ]
Myers P. 1978. Sexual dimorphism in size of vespertilionid bats. The American Naturalist, 112:701-711. doi: https://doi.org/10.2307/2425072 [ Links ]
Nolte M.J., D. Hockman, C.J. Cretekos, R.R. Behringer & J.J. Rasweiler. 2009. Embryonic staging system for the Black Mastiff Bat, Molossus rufus (Molossidae), correlated with structure-function relationships in the adult. Anatomical record (Hoboken) 292:155-6. doi: https://doi.org/10.1002/ar.20867 [ Links ]
O'Mara M.T., K. Bauer, D. Blank, J.W. Baldwin & D.K. Dechmann, 2016. Common Noctule Bats Are Sexually Dimorphic in Migratory Behaviour and Body Size but Not Wing Shape. PloS one, 11(11), e0167027. doi: https://doi.org/10.1371/journal.pone.0167027 [ Links ]
Pacheco V. & B. Patterson. 1992. Systematics and biogeographic analysis of four species of Sturnira (Chiroptera: Phyllostomidae), with emphasis on Peruvian forms. Memorias del Museo de Historia Natural 21:5-81. [ Links ]
Pacheco V. & L. Aguirre. 2016. Platalina genovensium. The IUCN Red List of Threatened Species 2016: e.T17487A21988884. http://dx.doi.org/10.2305/IUCN.UK.2016-2.RLTS.T17487A21988884.en. Visitado el 20 de abril de 2019. [ Links ]
Parlos J.A., R.E. Tim, V.J. Swier, H. Zeballos, R.J. Baker. 2014. Evaluation of paraphyletic assemblages within Lonchophyllinae, with description of a new tribe and genus. Occasional Papers of Texas Tech University 320:1-21. [ Links ]
Phillips C. 1971. The dentition of Glossophagine bats: development, morphological characteristics, variation, pathology, and evolution. University of Kansas, Museum of Natural History, Miscellaneous publication 54:85-86. [ Links ]
Phillips C.J., G.W. Grimes & G.F. Forman. 1977. Oral Biology. Pp 121–135 en Biology of Bats of the New World Phyllostomatidae, Part II (Baker R.J., J.K. Jones Jr. & D.C. Carter, eds.). Special Publications of the Museum of Texas Tech University, Texas. [ Links ]
Polis G.A. 1984. Age structure component of niche width and intraspecific resource partitioning can agegroups function as ecological species. The American Naturalist 123(4):541–564. doi: https://doi.org/10.1086/284221 [ Links ]
R Core Team. 2018. R: A Language and Environment for Statistical Computing. R Foundation for Statistical Computing, Vienna, Austria. https://www.R-project.org/ [ Links ]
Raff R.R. 1996. The Shape of Life. University of Chicago Press, Chicago. [ Links ]
Ralls K. 1976. Mammals in which females are larger than males. The Quarterly Review of Biology 51:245-276. [ Links ]
Ralls K. 1977. Sexual dimorphism in mammals: Avian models and unanswered questions. The American Naturalist 111:917-938. doi: https://doi.org/10.1086/283223 [ Links ]
Ramírez-Pulido J. & C. Müdespacher. 1987. Formulas dentarias anormales en algunos murciélagos mexicanos. Acta Zoológica Mexicana (n.s.) 23:1-54. [ Links ]
Reyes-Amaya N. & A. Jerez. 2013. Postnatal cranial ontogeny of the common vampire bat Desmodus rotundus (Chiroptera: Phyllostomidae). Chiroptera Neotropical 19:1198-1211. https://doi.org/10.1002/ar.23646 [ Links ]
Reyes-Amaya N., A. Jerez & D. Flores. 2017. Morphology and postnatal development of lower hindlimbs in Desmodus rotundus (Chiroptera: Phyllostomidae): A comparative study. The Anatomical Record 300:2150-2165. doi: https://doi.org/10.1002/ar.23646 [ Links ]
Ruelas D. & V. Pacheco. 2018. Noteworthy records and distribution of Peruvian Long-tongued Bat Platalina genovensium Thomas, 1928 (Chiroptera: Phyllostomidae). Check List 14(5):937-944. doi: https://10.15560/14.5.937 [ Links ]
Safi K. 2008. Social bats: The males' perspective. Journal of Mammalogy 89(6):1342-1350 [ Links ]
Sahley C. 1995. Bat and hummingbird pollination of two species of columnar cacti: effects on fruit production and pollen dispersal. Ph.D. dissertation, University of Miami, Coral Gables, Florida. [ Links ]
Sahley C. & L. Baraybar. 1996. Natural history of the longsnouted bat, Platalina genovensium (Phyllostomidae: Glossophaginae) in southwestern Peru. Vida Silvestre Neotropical 5:101-109. [ Links ]
Schulz M. 1999. Relative abundance and other aspects of the natural history of the rare golden-tipped bat, Kerivoula papuensis (Chiroptera: Vespertilionidae). Acta Chiropterologica 1:165-178. [ Links ]
Shine R. 1989. Ecological causes for the evolution of sexual dimorphism: a review of the evidence. Quarterly Review of Biology 64:419-461. doi: https://doi.org/10.1086/416458 [ Links ]
Smithe F.B. 1975. Naturalist’s color guide. American Museum of Natural History, New York.
Tchumy W.O. 1982. Competition between juveniles and adults in age-structured populations. Theoretical Population Biology 21(2):225-68. doi: https://doi.org/10.1016/0040-5809(82)90017-x [ Links ]
ThomasO.1928.Anewgenusandspeciesofglossophaginae,with a subdivisión of the genus Choeronycteris. The Annals and Magazine of Natural History London 1:120-123. doi: https://doi.org/10.1080/00222932808672753 [ Links ]
Tschapka M., E.B. Sperr, L.A. Caballero-Martínez & R.A. Medellín. 2008. Diet and cranial morphology of Musonycteris harrisoni, a highly specialized nectar-feeding bat in western Mexico. Journal of Mammalogy 89:924-932 http://dx.doi.org/10.1644/07-mamm-a-038.1 [ Links ]
Velazco P.M., R. Cadenillas, O. Centty, L. Huamaní & H. Zamora. 2013. New records of Platalina genovensium (Chiroptera, Phyllostomidae) and Tomopeas ravus (Chiroptera, Molossidae). Mastozoología Neotropical 20:425434. [ Links ]
Ventura A., M.R. Nogueira, A.L. Peracchi, A.A. do Nascimento, D.A. Vieira-Lopes & N.P. Pinheiro. 2018. Comparative prenatal development and embryonic staging of neotropical fruit bats (genus Artibeus). Zoologischer Anzeiger A Journal of Comparative Zoology 274:131146. https://doi.org/10.1016/j.jcz.2018.01.008 [ Links ]
Werner E.E. & J. F. Gilliam. 1984. The ontogenetic niche and species interactions in size-structured populations. Annual Review of Ecology and Systematics 15(1):393-25. doi: https://doi.org/10.1146/annurev.es.15.110184.002141 [ Links ]
Wetterer A.L., M. V. Rockman & N.B. Simmons. 2000. Phylogeny of Phyllostomid bats (Mammalia: Chiroptera): data from diverse morphological systems, sex chromosomes, and restriction sites. Bulletin of the American Museum of Natural History 248:1-200. doi: https://doi.org/10.1206/0003-0090(2000)248<0001:popbmc>2.0.co;2 [ Links ]
Williams D.F. & J.S. Findley. 1979. Sexual size dimorphism in Vespertilionid bats. American Midland Naturalist 102:113-126. [ Links ]
Wyant K.A & R.A. Adams. 2007. Prenatal growth and development in the Angolan free-tailed bat, Mops condylurus (Chiroptera: Molossidae). Journal of Mammalogy 88:1248-1251. https://doi.org/10.1644/06-mamma-392r.1 [ Links ]
Zamora H.T., C.T. Sahley, C.E. Medina, Y.E. Arteaga, A.C. Escobar & A. Pari. 2013. El Murciélago longirostro peruano, Platalina genovensium Thomas, 1928 (Phyllostomidae, Lonchophyllinae), en el área de influencia del gasoducto de PERU LNG: Estatus poblacional y recomendaciones para su conservación. En: Alonso A., F. Dallmeier & G.P. Servat, eds. Monitoring biodiversity: lessons from a trans-Andean Megaproject. Smithsonian Institution Scholarly Press, Washington. Pp. 110– 123, 327–340 [ Links ]
Correspondencia:
E-mail:druelasp@unmsm.edu.pe
Presentado: 13/10/2018
Aceptado: 04/05/2019
Publicado online: 06/07/2019
Apéndice 1. Especímenes revisados y mapeados en este estudio. Sexo: hembra (h), macho (m), no determinado (?); f: feto
Platalina genovensium (31): PERU: Amazonas: Luya, Tuén, 1m (MUSM 38627), Chachapoyas, 7 Km SE Centro poblado de Balsas, 1m (MUSM 44631). Arequipa: Caravelí, 1m (AMNH 257108), Caravelí, Lomas de Atiquipa, 2m (MUSM 45458, 45459), Arequipa, Yura, 2h 3m (MUSM 46318, 46319, 46437, 46438, MUSM no catalogado: MNH 95), Arequipa, Tiabaya, batolito de la Caldera, 1m (MUSM 12900), Islay, Cocachacra, 1h (MUSM no catalogado: MNH 149, MNH 150), Islay, Punta de Bombón, 1h (MUSM no catalogado: DLR 384). Cajamarca: Celendín, Cantange, 1m (MUSM 44632). Huánuco: Ambo, Cueva de Jatun Uchco, 2? (MUSM 23126, 23184). Ica: Pisco, cerca de la Mina La Bolivar, 1m (MUSM 45502), Pisco, Mina Bolívar, 2h 3m 1f (MUSM 26150, 26152-26155). Lima: Huaral, Lomas de Granados, 1h 5m (MUSM 44688-44693), Lima, Cerro El Agustino, 1m (MUSM 149). Piura: Talara, La Brea, 12.9 km North of Tamarindo, 1h (AMNH 278520). Localidad desconocida: Lima, 1m (MUSM 6756).