Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.2 Lima abr./jun. 2019
http://dx.doi.org/10.15381/rpb.v26i2.15798
NOTA CIENTÍFICA
Crianza de Michaelus phoenissa (Lepidoptera: Lycaenidae) sobre Senna alata (Fabaceae) en Perú
Breeding of Michaelus phoenissa (Lepidoptera : Lycaenidae) on Senna alata (Fabaceae) in Peru
Christophe Faynel 1* ORCID Id:0000-0001-9330-4633 y Jhon Harryson González-Mercado 2 ORCID Id:0000-0002-6010-179X
1. Independent Researcher, Société entomologique Antilles Guyane.
2. Universidad Nacional San Antonio Abad del Cusco, Cusco, Perú.
Resumen
En la estación científica de Villa Carmen, situada cerca de Pillcopata, Cusco, Perú (S 12°53.687' - W 71°24.232', 533 m), encontramos orugas de Michaelus phoenissa (Hewitson, 1867) (Lycaenidae), consumiendo flores de Senna alata (L.) Roxb. (Fabaceae). La mayoría de las orugas se encontraban en el último estadio (entre 1 y 1.5 cm de longitud), no visibles a primera vista, ya que se alojaban en las flores no abiertas. La crianza permitió obtener cuatro adultos, dos hembras y dos machos y ningún parasitoide. Se compara las plantas hospederas de M. phoenissa con otras especies hospederas del genero de Michaelus Nicolay, 1979.
Palabras clave: Eumaeini; mirmecofilia; coloración criptica; Leguminosae; Bignoniaceae.
Abstract
In Villa Carmen, a scientific station near Pillcopata, Cusco, Peru (S 12°53.687' - W 71°24.232', 533 m), we found caterpillars of Michaelus phoenissa (Hewitson, 1867) (Lycaenidae) consuming flowers of Senna alata (L.) Roxb. (Fabaceae). The caterpillars were mostly last instars (between 1 and 1.5 cm in length). They were not visible at first sight because they lodged in unopened flowers. We reared two female and two male adults. None of the immature stages was parasitized. We compare the food plants of M. phoenissa with those of others species of Michaelus Nicolay, 1979.
Keywords: Eumaeini; Myrmecophily; cryptic coloration; Leguminosae; Bignoniaceae.
Introducción
El género neotropical Michaelus Nicolay, 1979 (Lycaenidae, Theclinae, Eumaeini) ocurre desde México hasta el sur de Brasil, principalmente en la selva de baja altitud, y contiene seis especies: M. phoenissa, M. jebus (Godart, [1824]), M. thordesa (Hewitson, 1867), M. hecate (Godman & Salvin, 1887), M. ira (Hewitson, 1867), y M. joseph Robbins, 2010. Todas se encuentran en Perú, excepto M. hecate. Michaelus se caracteriza por las estructuras de sus alas y las de su genitalia, estas con dos signa parecidas a espinas en el corpus bursae (Nicolay 1979).
En nuestro estudio de las mariposas del valle del río Kosñipata (RDG-122-2016-SERFOR-DGGSPFFS), también buscamos orugas, especialmente de la familia Lycaenidae. A finales de agosto 2018, en la estación científica de Villa Carmen situada cerca de Pillcopata (S 12°53.687' - W 71°24.232', 533 m), encontramos orugas de Michaelus phoenissa (Hewitson, 1867), consumiendo flores de Senna alata (L.) Roxb. (Fabaceae). La mayoría de las orugas estaban en el último estadio. La cría permitió obtener cuatro adultos: dos hembras y dos machos y ningún parasitoide.
Material y métodos
El proyecto de investigación consistió en inspeccionar las flores de diferentes especies de Fabaceae para buscar orugas de Lycaenidae. Con facilidad se encontró una oruga sobre Senna alata, la revisión sistemática de los otros arbustos cerca de la estación científica de Villa Carmen permitió encontrar 7 orugas más. Para la observación del desarrollo, se dejó en la misma planta y en la misma rama, rodeada con una malla entomológica con seis orugas. Un lazo permitía cerrar la malla e impedir la salida de las orugas y también el ingreso de las hormigas. Colocamos una oruga pequeña en un frasco con etanol para análisis posteriores de ADN en caso que la crianza no funcionase. Cuando regresamos dos semanas después, todas las orugas se habían transformado en crisálidas.
Los adultos fueron fotografiados con una cámara fotográfica digital Nikon Coolpix 5000. Las imágenes en el campo fueron tomadas con la cámara de un teléfono móvil Samsung Galaxy S6. La pupa fuera fotografiada con un Nikon D3100.
Las siguientes abreviaturas de las colecciones son usadas en el texto:
- CIBC International Institute of Biological Control, Curepe, Trinidad y Tobago.
- DZUP Museu de Entomología, Universidade Federal do Paraná, Curitiba, Paraná, Brasil.
- MIZA Museo del Instituto de Zoología Agrícola, Maracay, Aragua, Venezuela.
- MUSM Museo de Historia Natural, Universidad Nacional Mayor de San Marcos, Lima, Perú.
- USNM National Museum of Natural History, Smithsonian Institution, Washington, D.C., E.U.A.
Resultados y discusión
Senna alata es un arbusto de la familia Fabaceae, subfamilia Caesalpinioideae, usada como planta ornamental y árbol medicinal (tratamiento de afecciones de la piel). Es originaria de México, y se puede encontrar en diversos hábitats desde México hasta el sur de Brasil. En los trópicos crece hasta una altitud de 1200 metros. Son arbustos de 1 a 4 m de altura, con presencia de racimos florales densos que se alargan de 15 a 60 cm, con hojas de 30 a 70 cm de longitud. Los arbustos de S. alata son frecuentes en los alrededores del estanque de la estación de Villa Carmen y cerca del río Kosñipata. Casi cada flor o tallo floral inspeccionados presentaba una oruga, solo hubo un caso de dos orugas en una misma flor, una por encima de la otra (Figura 1D). Se encontraron muy rápidamente cinco orugas en un mismo arbusto. Dos especies de hormigas también se encontraban sobre la planta: Camponotus integellus Forel, 1899 (Formicinae) y Pheidole huacana Wilson, 2003 (Myrmicinae). La identificación de estas hormigas fue realizada por Jacques Delabie (Lab. de Mirmecologia, UESCCEPLAC, Itabuna, Brasil, donde se encuentran muestras en la colección con el número de referencia 5839).
Inicialmente, no observamos contacto entre las hormigas al exterior y las orugas que estaban dentro de los botones florales. Sin embargo, cuando separamos los pétalos para buscar larvas, las orugas salieron de las flores y las hormigas rojizas Pheidole huacana, que se encuentran frecuentemente en lo alto del tallo floral, mostraron un comportamiento de alarma y procedieron a palpar las orugas con sus antenas, para proteger a las larvas molestadas. No observamos contacto entre las hormigas negras, Camponotus integellus, presentes en menor número, y las orugas. Durante nuestras manipulaciones, las dos especies de hormigas no fueron agresivas. Sobre otro arbusto, encontramos una oruga que dejaba su planta hospedera para hacer su crisálida, y fue escoltada por la hormiga más pequeña, P. huacana (Figura 1C).
La oruga (Figuras 1B, C, D) es amarilla pues toma la pigmentación de la flor (Faynel et al., 2015) y presenta en cada segmento un punto negro, cerca a la cabeza con pelos blancos, y dos marcas triangulares negras sobre la parte dorsal de la cabeza y el primer segmento. Los excrementos son amarillos (igual a la flor). Se observa que se deposita dentro de la flor donde la oruga vive, luego que ésta se llena de excremento la oruga se desplaza a otra flor más grande, dentro del mismo tallo floral, y coloca un poco de seda blanca alrededor del hoyo de la flor. Este hoyo se presenta en la cara interna siendo protegido y cubierto por un pétalo. La oruga tiene la cabeza dentro de la flor, dejando la parte posterior del cuerpo al exterior, donde se encuentra la glándula nectarífera que las hormigas estimulan para tomar el néctar producido por la oruga. Cuando se retira o disturba las flores cercanas, la oruga sale para posiblemente buscar otro escondite. La pupa (Figura 1E) se parece mucho a la de M. jebus (Faynel et al., 2015), y tiene una duración media de catorce días. Las cuatro crisálidas eclosionaron a partir del 13 de setiembre, produciendo dos hembras y dos machos y ningún parásito. Los meses de agosto y septiembre coinciden con la época seca en el valle de Kosñipata, con habitualmente muchas más eclosiones de Lycaenidae.
Michaelus phoenissa (Figura 1) es una especie con una gran área de distribución. La encontramos casi en todos los países de América Central y de América del Sur. A pesar de eso, es una especie que no es muy frecuente en colecciones en Perú: solo hay una hembra en la colección de Arequipa, 5 machos y 6 hembras en MUSM y ningún ejemplar en la Universidad de Cusco antes de este estudio. Tampoco se encuentra en la lista de mariposas diurnas de Villa Carmen de Michael L. McInnis (informe de campo, no publicado). Pero se encuentra en la lista de las mariposas del valle del río Kosñipata del Dr. Gerardo Lamas y su equipo, entre 300-500 m (5 machos y 3 hembras, 75% de ellos atraídos por trampas cebadas con pescado podrido o mezcla de pescado/orina, informe de campo, no publicado).
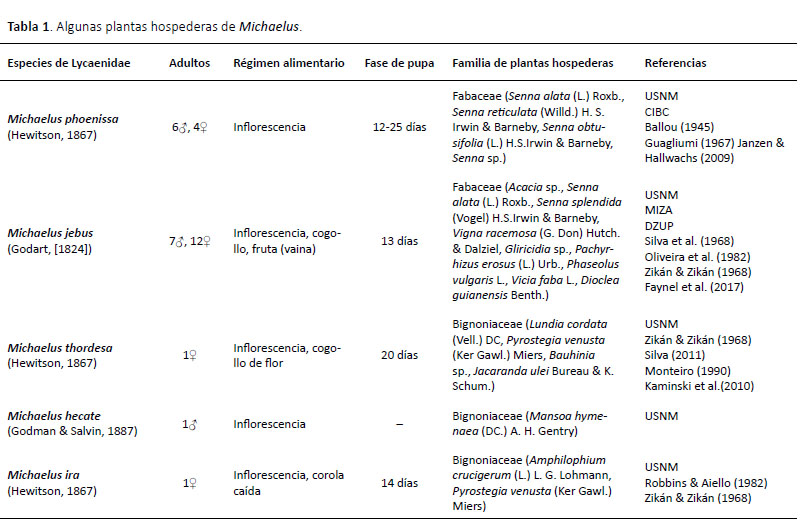
La oruga de Michaelus phoenissa se ha registrado en Costa Rica en 2007 (provincia Alajuela, Área de Conservación Guanacaste, 527 m), donde se ha criado en Senna obtusifolia (L.) H.S. Irwin & Barneby (Janzen & Hallwachs 2009). La oruga, de 15 mm de longitud, de color "amarillo con pelos blancos pequeños y puntos negros" consume las flores amarillas de la planta (Janzen 07-SRNP-1293). Es idéntica a aquellas que encontramos (imágenes en Janzen & Hallwachs 2009). Robbins (2010) señala que individuos de M. ira han sido criados sobre flores de Pithecoctenium y Pyrostegia (Bignoniaceae) en el sur de Brasil y en Panamá (según Zikán & Zikán 1968 ; Robbins & Aiello 1982). Robbins (comunicación personal) también nos transmitió una treintena de datos de cría de Michaelus (Tabla 1). Los nombres de las plantas citadas fueron verificados en http://www.theplantlist.org (Accedido el 20 de enero de 2019).
Silva (2011) ha criado M. thordesa sobre Bauhinia sp. (Fabaceae) en el Distrito Federal, Brasil. Encontró huevos dejados juntos en el tallo de una inflorescencia. El período larval duró aproximadamente 20 días. La larva presentó una coloración amarillenta con una línea longitudinal oscura. La coloración se hizo críptica para los botones y el tallo de la inflorescencia. La crisálida es marrón-beige con marcas más sombrías, similar a la de M. phoenissa. Silva (2011) señala que M. thordesa se ha criado sobre Jacaranda ulei Bureau & K. Schum. (Bignoniaceae) (según Zikán & Zikán 1968 ; Monteiro 1990 ; Kaminski et al. 2010).
Faynel et al. (2017) han criado M. jebus en Guyana Francesa sobre flores rosas de Dioclea guianensis Benth. (Fabaceae). La oruga es rosa con un surco dorsal marcado con una estría más oscura. La crisálida es beige moteada de castaño, similar a la de M. phoenissa (Figura 1E y Faynel et al. 2017: fig. 17, p. 139) y está rodeada por un hilo de seda. La duración de la crisálida fue 13 días.
En conclusión, la mariposa Michaelus phoenissa fue criada en la estación científica de Villa Carmen sobre Senna alata donde se encuentra frecuentemente en el estado de larvas que consumen las yemas de las flores, en asociación simbiótica con la hormiga Pheidole huacana. Sin ser una especie rara, las adultas de este taxón son poco comunes en el campo. Con los datos actuales, es interesante anotar, que una parte de las especies del género se alimenta de Fabaceae (M. phoenissa, M. jebus), y la otra de Bignoniaceae (M. thordesa, M. hecate, M. ira).
Iconografía para las mariposas o las plantas
Faynel C. 2018. Lycaenidae. SEAG (vouchers CF-LYC-573; CFLYC- 642). <http://insectafgseag.myspecies.info/fr/ content/lycaenidae> (Accedido el 20 de enero de 2019).
Janzen D.H. & W. Hallwachs 2009. Dynamic database for an inventory of the macrocaterpillar fauna, and its food plants and parasitoids, of Area de Conservacion Guanacaste (ACG), northwestern Costa Rica (07-SRNP- 1293 voucher codes) <http://janzen.sas.upenn.edu> (Accedido el 20 de enero de 2019).
The Plant List. 2010. Version 1. < http://www.theplantlist.org/ > (Accedido el 20 de enero de 2019).
Agradecimientos:
Por su ayuda en el campo, agradecemos a Maëva Leroy y Gloria Jilahuanco. Por sus consejos y correcciones al texto, agradecemos a Jacques Delabie (para su identificación de las hormigas), Gerardo Lamas, Robert K. Robbins, José Cerdeña, y Michael L. McInnis. También manifestamos nuestra gratitud a los responsables de la estación biológica de Villa Carmen (especialmente el administrador David Guevara) por su acogida y cooperación y al Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) por el permiso de investigación (N° RDG-122-2016-SERFOR-DGGSPFFS).
Fuentes de financiamiento: El presente trabajo se realizó gracias al financiamiento de la Agencia de los Estados Unidos para el Desarrollo Internacional (USAID) Nº MTO 069018.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Rol de los autores:
CF y JHC-M: realizaron los muestreos, analizaron los datos, redactaron el manuscrito; revisaron y aprobaron el manuscrito.
Aspectos éticos / legales:
Servicio Nacional Forestal y de Fauna Silvestre (SERFOR) permiso de investigación N° RDG-122-2016-SERFOR-DGGSPFFS.
Citación:
Faynel C. y J.H. González-Mercado. 2019. Crianza de Michaelus phoenissa (Lepidoptera: Lycaenidae) sobre Senna alata (Fabaceae) en Perú. Revista peruana de biología 26(2): 265 - 270 (Mayo 2019). doi: http://dx.doi.org/10.15381/rpb.v26i2.15798
Literatura citada
Ballou C.H. 1945. Notas sobre insectos dañinos observados en Venezuela 1938-1943. Datos tomados en la época en que causaron daños de consideración. 3a. Conferencia interamericana de Agricultura (Caracas) 34: 1-151, 6 figs. [ Links ]
Faynel C., F. Bénéluz, S. Brûlé & S. Fernandez 2017. Dioclea guianensis et Dioclea virgata (Fabaceae) : planteshôtes de nombreux Lycaenidae et Riodinidae en Guyane. Exemples de polychromatisme larvaire cryptique (Lepidoptera). Revue de l’Association Roussillonnaise d’Entomologie 26(3) : 135 – 143.
Guagliumi P. 1967. Insetti e aracnidi dele piante comuni del Venezuela segnalati nel periodo 1938-1963. Relazioni e Monografie agrarie subtropicale e tropicale (N.S.) 86: xiv + 391 pp. [ Links ]
Janzen D.H. & W. Hallwachs 2009. Dynamic database for an inventory of the macrocaterpillar fauna, and its food plants and parasitoids, of Area de Conservacion Guanacaste (ACG), northwestern Costa Rica (07-SRNP1293 voucher codes) <http://janzen.sas.upenn.edu> (Accedido el 20 de enero de 2019). [ Links ]
Kaminski L.A., S.C. Thiele, C.A. Iserhard, H.P. Romanowski & A. Moser 2010. Natural history, new records, and notes on the conservation status of Cyanophrys bertha (Jones) (Lepidoptera: Lycaenidae). Proceedings of the Entomological Society of Washington 112(1): 54-60. [ Links ]
Monteiro R.F. 1990. Aspectos ecológicos de teclíneos (Lepidoptera: Lycaenidae) com especial referência à coloração críptica de duas espécies de Rekoa Kaye. Doutorado em Ecologia, Universidade Estadual de Campinas, Campinas, SP, Brasil. [ Links ]
Nicolay S.S. 1979. Studies in the genera of American Hairstreaks. 5. A review of the Hubnerian genus Parrhasius and description of a new genus Michaelus (Lycaenidae: Eumaeini). Bulletin of the Allyn Museum 56: 1–52. [ Links ]
Oliveira, A.M. de, R.G. Coelho, S. Sudo, N.R. Leal & M.T. Liberal 1982. Incidência de Thecla jebus Godart, 1819 (Lepidoptera: Lycaenidae) em cultivares de feijão-de-vagem, no município de Itaguaí, Estado do Rio de Janeiro. Anais da Sociedade entomológica do Brasil 11(1): 163-166. [ Links ]
Robbins R.K. 2010. Four commonly confused hairstreaks (Lycaenidae, Theclinae, Eumaeini): three need names, one does not. Journal of the Lepidopterists' Society 64(1):1-13. [ Links ]
Robbins, R.K. & A. Aiello 1982. Foodplant and oviposition records for Panamanian Lycaenidae and Riodinidae. Journal of the Lepidopterists' Society 36: 65–75. [ Links ]
Silva A.G. d'A. e., C.R. Gonçalves, D.M. Galvão, A.J.L. Gonçalves, J. Gomes, M. do N. Silva & L. Simoni 1968. Quarto catálogo dos insetos que vivem nas plantas do Brasil seus parasitos e predadores. Edição ampliada do "3° catálogo dos insetos que vivem nas plantas do Brasil" de autoria do Prof. A. M. da Costa Lima. Parte II. Insetos, hospedeiros e inimigos naturais. Indice de insetos e índice de plantas. Rio de Janeiro, Ministério da Agricultura. 1: xxvii + 622 pp.; 2: [viii] + 265 pp. [ Links ]
Silva, N.A.P. 2011. Biologia de lagartas de Lycaenidae em inflorescências de plantas no cerrado do Brasil Central. 116 f., il. Dissertação (Mestrado em Ecologia) – Universidade de Brasília. [ Links ]
Zikán, J.F. & W. Zikán 1968. Inseto-fauna do Itatiaia e da Mantiqueira. III. Lepidoptera. Pesquisa Agropecuária Brasileira 3:45–109. [ Links ]
Correspondencia:
*Autor para correspondencia
Christophe Faynel: christophe.faynel@wanadoo.fr
1 Address: 16, rue des Aspres, 34160 Montaud, Francia. Jhon H. Gonzalez-M.: jharrysongm@gmail.com
2 Dirección postal: Uvima7 h – 14, San Sebastián, Cusco, Perú.
Otros datos de los autores / biografía:
ORCID Christophe Faynel: 0000-0001-9330-4633
ORCID Jhon H.Gonzalez-M.: 0000-0002-6010-179X
Presentado: 30/01/2019
Aceptado: 20/02/2019
Publicado online: 06/07/2019