Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.3 Lima ago. 2019
http://dx.doi.org/10.15381/rpb.v26i3.16772
TRABAJOS ORIGINALES
Incremento de la viabilidad, producción de especies reactivas de oxígeno, IL-1 y TNF-α en células mononucleares de sangre periférica humana tratadas con fucoidan de Lessonia trabeculata
Increase in viability, production of reactive oxygen species, IL-1 and TNF-α in human peripheral blood mononuclear cells treated with fucoidan from Lessonia trabeculata
Erasmo H. Colona‐Vallejos*1 ORCID iD: 0000-0001-9759-288X, Libertad Alzamora-Gonzales1 ORCID iD: 0000-0002-7425-7453, Jorge Chávez Pérez2 ORCID iD: 0000-0003-1728-9886, Eder V. Apumayta Suárez2 ORCID iD: 0000-0001-5829-8805, Iliana Chang Avila3 ORCID iD: 0000-0001-8346-6735
1 Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Biologicas, Lima, Perú.
2 Universidad Nacional Agraria La Molina, Instituto de Investigación de Bioquímica y Biología Molecular, Lima, Perú.
3. Empresa PSW S.A., Perú
Resumen
Las algas pardas constituyen una fuente de alto contenido de polisacáridos como los fucoidanos que poseen importantes propiedades inmunomoduladoras. El objetivo fue determinar la viabilidad de células mononucleares de sangre periférica humana (CMSPh), producción de óxido nítrico (NO), especies reactivas de oxígeno (ROS) y de las citoquinas proinflamatorias IL-1α, IL-6, TNF-α e IFN-γ en cultivos tratados con fucoidan de Lessonia trabeculata. Se empleó fucoidan de Lessonia trabeculata proveniente de la bahía San Nicolás de Marcona-Ica. Las CMSPh se aislaron empleando Ficoll-Hypaque, se distribuyeron a una concentración de 1x105 células/pocillo en medio RPMI-1640 completo y se trataron con diferentes concentraciones de fucoidan durante 24 y 48 h. La actividad citotóxica se determinó por la reducción de MTT, la producción de NO por la reacción de Griess y las ROS por la reducción del NBT. La producción de citoquinas se cuantificó por ELISA. El fucoidan de L. trabeculata estimuló la proliferación de CMSPh y produjo el incremento de ROS a concentraciones de 100-2000 μg/mL respecto al control (p<0.001), la reacción para nitritos resultó negativa. El fucoidan incrementó la producción de IL-1α y TNF-α a concentraciones de 100 y 10 μg/mL respectivamente, mientras que la producción de IL-6 e IFN-γ no mostró diferencias significativas. Se concluye que el fucoidan de L. trabeculata estimula la proliferación de CMSPh, producción de especies reactivas de oxígeno y las citoquinas proinflamatorias IL-1α y TNF-α que poseen importantes propiedades inmunomoduladoras.
Palabras clave: Lessonia trabeculata; fucoidan; especies reactivas de oxígeno; citoquinas proinflamatorias; células mononucleares de sangre periférica.
Abstract
Brown algae are a source of high content of polysaccharides such as fucoidans that have important immunomodulatory properties. The aim was to determine the viability of human peripheral blood mononuclear cells (hPBMC), production of nitric oxide (NO), reactive oxygen species (ROS) and the proinflammatory cytokines IL-1α, IL-6, TNF-α and IFN -γ in cultures treated with fucoidan from Lessonia trabeculata. Fucoidan from Lessonia trabeculata from San Nicolás de Marcona-Ica Bay was used. The hPBMC were isolated using Ficoll-Hypaque, distributed at a concentration of 1x105 cells/well in complete RPMI-1640 medium and treated with different concentrations of fucoidan for 24 and 48 h. The cytotoxic activity was determined by the reduction of MTT, NO production by the Griess reaction and ROS by the reduction of NBT. The production of cytokines was quantified by ELISA. The fucoidan of L. trabeculata stimulated the proliferation of hPBMC and produced the increase of ROS at concentrations of 100-2000 μg/mL with respect to the control (p <0.001), the reaction for nitrites was negative. Fucoidan increased the production of IL-1α and TNF-α at concentrations of 100 and 10 μg/mL respectively, while the production of IL-6 and IFN-γ did not show significant differences. It is concluded that the fucoidan of L. trabeculata stimulates the proliferation of hPBMC, production of reactive oxygen species and the proinflammatory cytokines IL-1α and TNF-α that possess important immunomodulatory properties.
Keywords: Lessonia trabeculata; fucoidan; reactive oxygen species; proinflammatory cytokines; peripheral blood mononuclear cells.
Introducción
Las algas pardas presentan alto contenido de polisacáridos con actividad biológica, destacando la presencia de ácido algínico, laminarinas y fucoidanos. Estos compuestos presentan un amplio espectro de propiedades farmacológicas y baja toxicidad in vivo (Thinh et al. 2013).
Desde el descubrimiento de la estructura molecular del fucoidan por Kylin en 1913, otras estructuras de fucanos de diferentes algas pardas han sido investigadas considerando su distribución en el tejido algal y la divergencia estructural (Morya et al. 2012). Se ha estudiado el contenido de fucoidanos en las algas pardas Adenocystis utricularis, Analipus japonicus, Ascophyllum nodosum, Bifurcaria bifurcate, Chorda filum, Cladosiphon okamuranus, Cystoseira indica, Dictyota menstrualis, Ecklonia kurome, Fucus distichus, Fucus evanescens, Fucus serratus, Fucus vesiculosus, Himanthalia lorea, Hizikia fusiforme, Kjellmaniella crassifolia, Laminaria saccharina, Laminaria digitata, Fucus spiralis, Laminaria cichorioides, Laminaria religiosa, Laminaria japonica, Laminaria angustata, Lessonia vadosa, Lobophora variegate, Macrocytis pyrifera, Padina pavonia, Padina gymnospora, Pelvetia canaliculata, Pelvetia wrightii, Saccharina latissima, Sargassum linfolium, Sargassum sp., Sargassum stenophyllum, Spatoglossum schroederi, Stichopus japonicas, Stoechospermum marginatum, Undaria pinnatifida entre otras (Ale et al. 2011, Morya et al. 2012, Rani et al. 2017, Baba et al. 2018).
En los últimos 20 años, se han reportado diversas actividades biológicas de los fucoidanos de algas pardas; principalmente en la estimulación del sistema inmune, la actividad citotóxica sobre líneas celulares tumorales y efecto antitumoral in vivo. La actividad biológica de los fucoidanos varía con la especie, peso molecular, composición, estructura, método de extracción y ruta de administración. La bioactividad de polisacáridos como el fucoidan se atribuye al número y posición de los grupos sulfato (Li et al. 2008; Rioux et al. 2010; Cho et al. 2010; Fitton 2013; Zhao et al. 2018). Actualmente se ha demostrado que los fucoidanos desempeñan un papel vital como alimento funcional en la salud humana debido a sus actividades biológicas y beneficios para la salud (Zhao et al. 2018).
En general, se ha señalado que los fucoidanos producen diversos efectos inmunomoduladores como, el incremento de la actividad de células NK y LT citotóxicos, título de anticuerpos neutralizantes y la fagocitosis por macrófagos (Ramberg et al. 2010). La supervivencia de ratones con tumor P-388 tratados con fucoidan de U. pinnatifida se asoció con el incremento de aproximadamente dos veces del IFN-γ producido por las células T y NK (Maruyama et al. 2003). La incubación de linfocitos de bazo y macrófagos con fucoidan de Fucus vesiculosus produjeron su activación y efecto antitumoral sobre las líneas celulares de YAC-1 (linfoma murino) y B16 (melanoma murino) mediante la producción de radicales libres (óxido nítrico y peróxido de hidrógeno) y citoquinas (TNF-α e IL-6) (Choi et al. 2005). Se ha determinado que el fucoidan de Lessonia vadosa induce la maduración de células dendríticas (Barahona et al. 2014). Los fucoidanos extraídos de Sargassum crassifolium y Padina australis estimularon la actividad en las células de las placas de Peyer (Yuguchi et al. 2016). El fucoidan del esporofito coreano de U. pinnatifida mostró ser menos citotóxico para las células inmunes y poseer actividad inmunomoduladora para producir citoquinas y quimiocinas a partir de macrófagos y esplenocitos en comparación con un fucoidan comercial obtenido de Fucus vesiculosus, considerándose U. pinnatifida como un potente agente inmunomodulador (Yoo et al. 2007). Estudiando mezclas comerciales, Vetvicka y Vetvickova (2017) determinaron el elevado potencial inmunoestimulante de fucoidanos, encontrando un significativo incremento de la actividad fagocítica por monocitos de sangre periférica, la producción de citoquinas, y la formación de anticuerpos contra ovoalbúmina. Por otro lado, estudios realizados en México con harina de Lessonia trabeculata mostraron actividad anticoagulante, antihipertensiva y antioxidante (Resendiz et al. 2010, Ramírez et al. 2013). Qu et al. (2014) aislaron y caracterizaron el fucoidan de L. trabeculata procedente de Perú, determinando su elevada actividad antioxidante.
En el Perú, las algas marinas son exportadas y utilizadas como materia prima en la industria de alginatos, carragenanos y agar siendo limitado su consumo como alimento en humanos. El alginato procede principalmente de dos especies: Lessonia nigrescens y Lessonia trabeculata, durante los últimos años, se ha incrementado la extracción de Lessonia spp. o aracanto, debido a la creciente demanda de los productos comerciales derivados como abonos, también se emplean en nutrición animal, como nutracéuticos, cosmecéuticos y consumo humano. Los pobladores dedicados a la pesca artesanal aprovechan el recurso para mejorar su situación socio-económica (IMARPE 2012).
El objetivo fue determinar la producción de óxido nítrico (NO), especies reactivas de oxígeno (ROS) y citoquinas proinflamatorias IL-1α, IL-6, TNF-α e IFN-γ en cultivos de células mononucleares de sangre periférica humana (CMSPh) tratadas con fucoidan de L. trabeculata, para contribuir con la validación del biorecurso como inmunomodulador y así ampliar su aprovechamiento en la alimentación humana.
Material y métodos
Lessonia trabeculata Villouta & Santelices 1986 se colectó de la Bahía de San Nicolás (15°15’21.0"S, 75°14’31.0"W), Marcona, Nazca, Ica. La identificación taxonómica se realizó en el Herbario A. Weberbauer del Departamento de Biología de la Universidad Nacional Agraria La Molina (UNALM). Los especímenes fueron procesados por la empresa PSW S.A. hasta la obtención del producto (FLt). La identificación de fucoidan y metabolitos secundarios como polifenoles, taninos, cardenólidos y terpenos se realizó en el Laboratorio de Fitoquímica y Bioquímica Vegetal del Instituto de Investigación de Bioquímica y Biología Molecular de la UNALM. Como control positivo en los ensayos realizados se empleó el fucoidan de F. vesiculosus (FFv) (Sigma, F8190). Las diferentes concentraciones de fucoidan se hicieron a partir de una solución de 15 mg/mL en medio RPMI-1640 sin suero bovino fetal (medio incompleto) y se almacenó a 4 °C hasta su utilización.
Separación de células mononucleares de sangre periférica (CMSPh).Previo consentimiento informado se obtuvo en tubos heparinizados la sangre venosa de personas voluntarias saludables del personal de nuestro laboratorio. La sangre se diluyó con buffer fosfato salino (PBS) 0.15 M en la proporción 1:2, se depositó sobre una columna de Ficoll-Hypaque 1.077 g/mL (LSM Lymphocyte Separation Medium) y se centrifugó a 2000 rpm durante 25 minutos a temperatura ambiente. Se recuperó el anillo de CMSPh, las células se lavaron una vez con PBS 0.15 M y dos veces con RPMI-1640 completo (10% de suero ternera fetal (STF) inactivado al calor, 2 mM 2 FFv, y se incubaron a 37°C, 5% CO durante 24 y 48 h. glutamina, hepes 10 mM, 23 mM bicarbonato de sodio, aminoácidos no esenciales, 100 UI/mL penicilina y 100 μg/mL estreptomicina). El conteo de células diferencial se realizó en cámara de Neubauer mediante microscopía óptica con azul de tripán al 0.4%. En cada pocillo se colocaron 100 μL de 1x106 células/mL. El número de CMSPh a emplearse en los ensayos se determinó mediante el rango de linealidad por el ensayo de reducción metabólica del bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5-difeniltetrazol (MTT) (Mosmann 1983).
Evaluación de la viabilidad celular.- La viabilidad celular y la capacidad citotóxica de los agentes estudiados son interpretadas como un indicador de potencial anticancerígeno in vivo. La citotoxicidad dependerá de la concentración y tiempo de exposición, cuya intensidad originará una perturbación metabólica o integridad estructural causando la muerte o inhibición de la división celular (Escobar et al. 2010, Kumar et al. 2018). Para evaluar la viabilidad celular se realizó el ensayo de reducción metabólica del bromuro de 3-(4,5-dimetiltiazol-2-ilo)-2,5- difeniltetrazol (MTT) (Mosmann 1983; Alley et al. 1988). Las CMSPh se sembraron en medio RPMI 1640 completo a una concentración de 1x105 células/pocillo en placas de cultivo de 96 pocillos. El FLt se añadió en concentraciones de 2000, 1000, 500, 200, 100, 50, 25, 10 y 1 µg/mL. Como controles se emplearon cultivos de CMSPh con FFv y sin fucoidan bajo las condiciones descritas. Las placas se incubaron durante 48 h a 37 °C en atmósfera de 5% CO . Luego se agregó a cada pocillo 20 µL de MTT (5 mg/mL disuelto en PBS 0.15M) y se incubó durante 4 h a 37 °C en atmósfera de 5% CO2en oscuridad. Posteriormente se añadió 100 µL de dimetilsulfóxido (DMSO), se agitó suavemente a 60 rpm durante 30 min y se determinó la absorbancia a 492/630 nm. Las pruebas de citotoxicidad in vitro se realizaron por triplicado. El porcentaje de viabilidad se calculó mediante la siguiente formula:
% Viabilidad= D.O células tratadas/D.O células control X100
Producción de óxido nítrico (NO).- Se evaluó la determinación de nitritos que son metabolitos estables de la síntesis del NO, mediante la reacción de Griess (Moshage et al. 1995). Se colocaron 200 µL de 1X105 de células mononucleares/pocillo en microplacas de 96 pocillos a concentraciones de 2000, 1000, 500, 50 y 10 µg/mL de FLt Luego 50 µL del sobrenadante se mezclaron con 50 µL del reactivo A y 50 µL del reactivo B de Griess (Promega), se incubó por 10 min a temperatura ambiente y en oscuridad, y se realizó la lectura de las absorbancias a 492/630 nm. Como controles positivo y negativo se utilizaron CMSPh tratadas con 10 µg/mL de lipopolisacárido de Escherichia coli 055:B5 (LPS, Sigma) y no tratadas respectivamente.
Determinación de especies reactivas de oxigeno (ROS).- El ensayo de nitroazul de tetrazolio (NBT) se utilizó para medir la cantidad de especies reactivas de oxígeno intracelular producido por las células fagocíticas al reducir las sales de nitroazul de tetrazolio (Choi et al. 2006). Se colocaron 200 µL de 1X105 de células mononucleares/pocillo en microplacas de 96 pocillos a concentraciones de 2000, 1000, 500, 50 y 10 µg/mL de FLt y FFv, y se incubaron a 37 °C, 5% CO2 durante 24 y 48 h. Posteriormente se descartaron las células no adherentes
Posteriormente se descartaron las células no adherentes lavando con PBS y se agregó 15 µL de NBT (5 mg/mL, disuelto en solución de sales balanceadas de Hanks). Las microplacas se incubaron durante 3 h a 37 °C, 5% CO , posteriormente se lavaron dos veces con PBS 0.15M y se fijaron con metanol absoluto. Para medir la reducción NBT espontánea, las células se incubaron en medio de cultivo. Para disolver el formazán producto de la reducción del NBT se agregó 120 μL de hidróxido de potasio 2M y 140 μL de DMSO. La lectura se realizó a 630 nm. Como control positivo se utilizó 10 µg/mL LPS (Sigma).
Cuantificación de IL-1α, IL-6, TNF-α e IFN-γ.Se emplearon kits de ELISA sándwich para IL-1α, IL-6, TNF-α e IFN-γ (Sigma, RAB0269, RAB0306, RAB0476 y RAB0222 respectivamente) y se procedió de acuerdo a las instrucciones de manufactura. Las citoquinas se determinaron en los sobrenadantes de los cultivo de CMSPh tratados con las distintas concentraciones de FLt y< FFv e incubados a 37 °C, 5% CO durante 48 h.
Análisis estadístico.- Los datos se analizaron mediante el programa GraphPad Prisma 5.0. Las diferencias entre los tratamientos y el grupo control se establecieron empleando análisis de la varianza (ANOVA). Las diferencias se consideraron significativas en valores de p<0.05.
Resultados
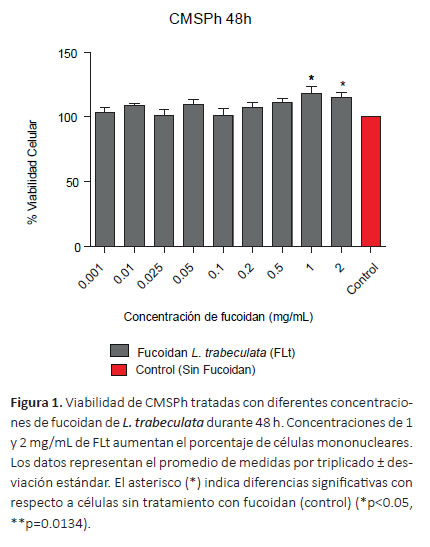
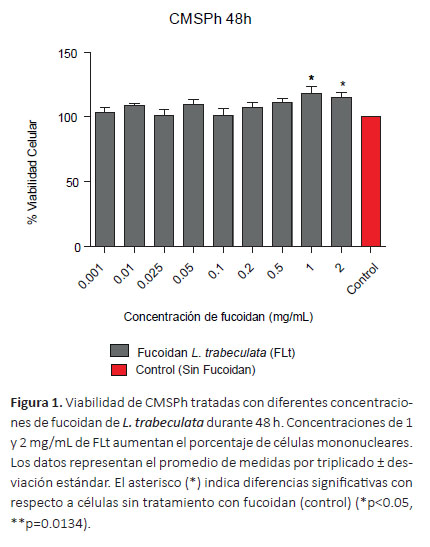
Determinación de la viabilidad celular en células mononucleares sanguíneas. En la Figura 1 se muestra que el tratamiento de 48 h con concentraciones de FLt hasta 2 mg/mL no tuvo efecto citotóxico sobre las CM- SPh (p>0.05). Sin embargo, se evidenció el incremento del porcentaje de la viabilidad celular respecto al control (p= 0.0134). Del mismo modo, el tratamiento con FFv durante 48 h incrementó el porcentaje de células mononucleares con relación al control (p< 0.0001) (Fig. 2).
Efecto del fucoidan de Lessonia trabeculata sobre la producción de óxido nítrico.- Las CMSPh tratadas con las concentraciones de fucoidan de L. trabeculata y F. vesiculosus no estimularon la producción de óxido nítrico (NO) luego de 24 y 48 h de cultivo, se observó que el reactivo de Griess provocó la precipitación del fucoidan a concentraciones mayores de 1 mg/mL.
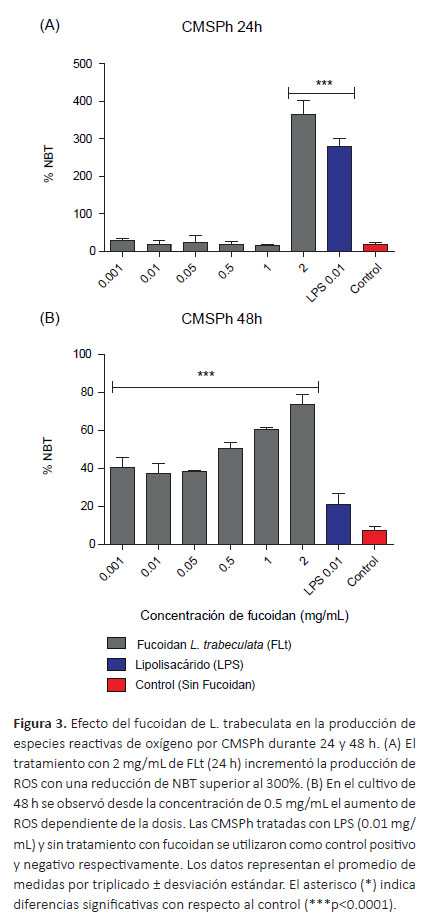
Determinación de especies reactivas de oxígeno por reducción del NBT.A las 24 h del cultivo, la actividad oxidativa de los monocitos a partir de las CMSPh tratadas con 2 mg/mL de FLt se incrementó significativamente respecto al control (p< 0.0001) y LPS (p< 0.05), mientras que el tratamiento a concentraciones de 0.01, 0.05, 0.5 y 1 mg/ mL de FLt no produjo diferencias significativas con relación al control (p> 0.05) (Fig. 3A). En las CMSPh tratadas durante 48 h a concentraciones de 0.001, 0.01, 0.05, 0.5, 1 y 2 mg/mL de FLt se incrementó significativamente la producción de ROS con porcentajes de reducción de NBT de 40.37, 37.4, 38.2, 50.7, 60.4 y 73.7 % respectivamente frente al control (p<0.0001). El FLt a las concentraciones de 0.5, 1 y 2 mg/mL produjo mayor incremento de ROS respecto al LPS (p<0.0001) (Fig. 3B).
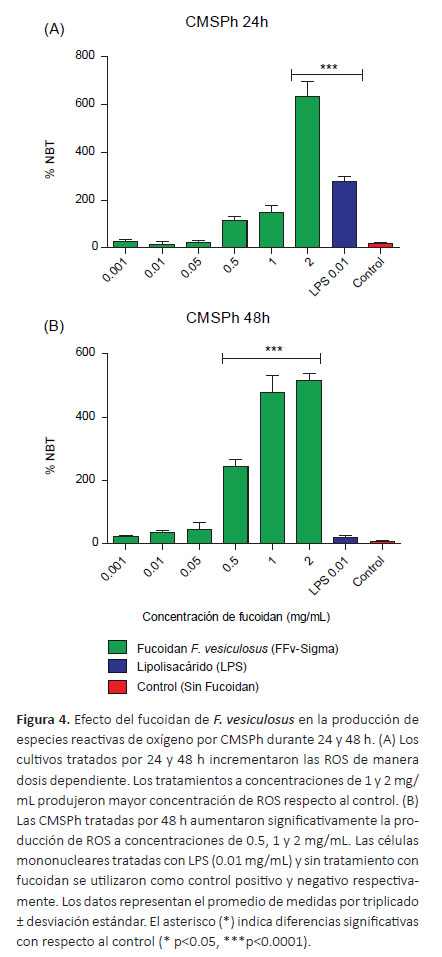
En el caso del tratamiento con FFv (24 h) se observó el aumento de ROS a la concentración de 1 mg/mL (p<0.05) y 2 mg/mL (p<0.0001) respecto al control (Figura 4A), mientras que a las 48 h de tratamiento se observaron diferencias desde las concentraciones de 0.5, 1 y 2 mg/mL con relación al control (p<0.0001) (Figura 4B). Cabe notar que el FFv a la concentración de 2 mg/ mL duplicó el porcentaje de reducción del NBT cuando se comparó con el FLt a la misma concentración (Figuras 3A y 4A), mientras que el FFv (48 h) evidenció porcentajes de reducción del NBT superiores al 100% respecto al FLt (Figs. 3B y 4B). El tratamiento con el fucoidan parece modular la producción de ROS dependiente de la dosis.
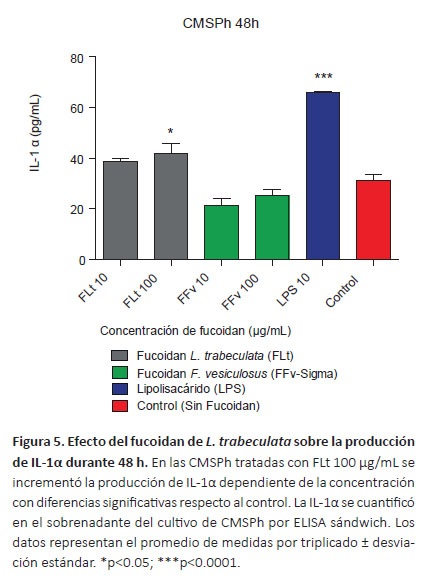
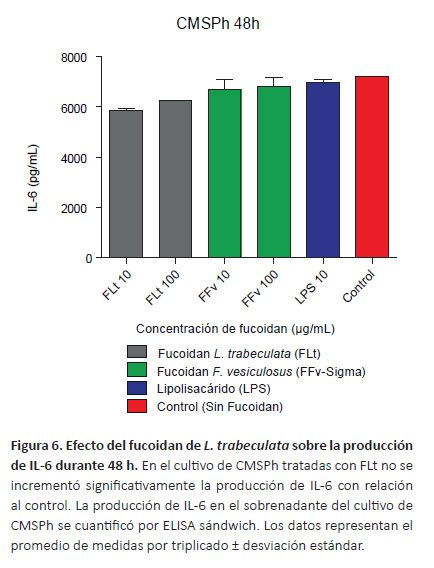
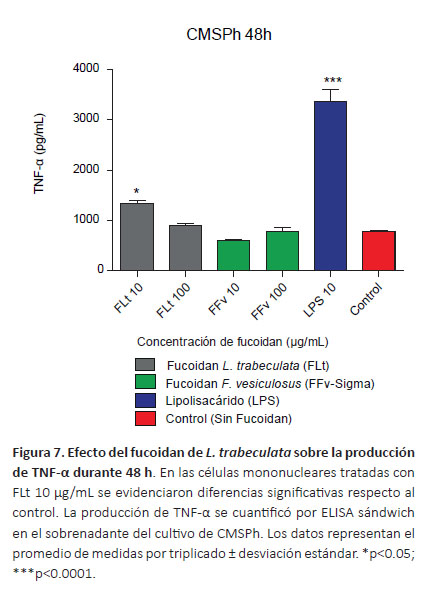
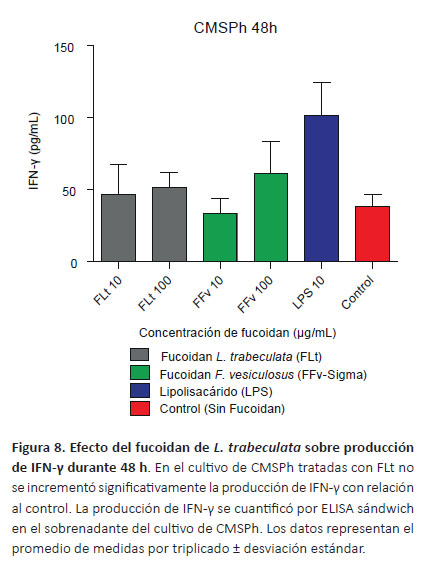
Cuantificación de citoquinas por ELISA sándwich.Con la finalidad de determinar el efecto inmunomodulador del fucoidan sobre la síntesis de la IL-1α, IL-6, TNF-α e IFN-γ se cuantificó la producción de citoquinas en el sobrenadante de los cultivos de CMSPh tratados con diferentes concentraciones mediante la prueba de ELISA. En la Figura 5 se observa el incremento de IL-1α dependiente de la concentración del fucoidan, en el tratamiento de las CMSPh con FLt 100 μg/mL produjo diferencias respecto al FFv (p<0.0001) y control (p<0.05). Se determinó una mayor producción de IL-6 a las concentraciones de FLt 10 y 100 μg/mL, sin embargo no se observaron diferencias significativas con relación al control (p>0.05) (Fig. 6). Con respecto al TNF-α a la concentración de FLt 10 μg/mL se evidenció diferencias respecto al control (p<0.05) (Fig. 7). Además, se encontraron diferencias significativas cuando se comparó el FLt 10 μg/mL respecto a las concentraciones del FFv 10 μg/mL (p<0.01) y FFv 100 μg/mL respectivamente (p<0.05). En los cultivos de CMSPh tratados con FLt no se observaron diferencias significativas en la producción IFN-γ respecto al control. Sin embargo, la síntesis de IFN-γ se incrementó con relación al FFv 10 μg/mL (p<0.05) (Fig. 8). En las CMSPh tratadas con LPS 10 μg/ mL se incrementó la producción de IL-1α, TNF-α respecto al control (p<0.0001) (Figs. 5 y 7).
Discusión
Los fucoidanos son heteropolisacáridos de L-fucosa sulfatada que se encuentra en la pared celular o matriz extracelular de algas pardas y constituye aproximadamente el 40% de peso seco del alga (Holdt & Kraan, 2011).
Las concentraciones comprendidas entre 1-2000 μg/ mL (48h) de fucoidan de L. trabeculata (FLt) no produjeron efectos tóxicos sobre las CMSPh (Figura 1). Estos resultados concuerdan con los obtenidos por Vásquez y Ramos (2012) quienes demostraron que el tratamiento de CMSPh con el extracto de S. siliquosum a concentraciones entre 25-175 μg/mL (72 h), no afectó la viabilidad celular. Yoo et al. (2007) determinaron que el fucoidan de U. pinnatifida (FUp) a concentraciones superiores a 500 μg/mL no mostró actividad citotóxica en esplenocitos y macrófagos peritoneales de ratón. Asimismo, el tratamiento a concentraciones de 0 a 500 μg/mL de fucoidan de F. vesiculosus (FFv) sobre cultivos primarios de hígado humano no evidenció efectos citotóxicos (Min et al. 2014), sin embargo, el FUp y FFv produjeron toxicidad sobre el crecimiento de la línea celular de macrófagos leucémicos de ratón (RAW 264.7), mientras que el FFv inhibió el crecimiento de esplenocitos murinos de manera dosis dependiente (Yoo et al. 2007). Las diferencias en los efectos citotóxicos señaladas por los referidos autores están relacionadas con las estructuras heterogéneas y complejas de los fucoidanos, y las especies de las que proceden (Nakano et al. 2012).
En relación al incremento en el porcentaje de la viabilidad en CMSPh tratadas con fucoidan, se observó diferencias a las concentraciones de 1000 y 2000 μg/mL de FLt con relación al control (p<0.0001) (Figura 1). Estos resultados concuerdan con los obtenidos por Vásquez & Ramos (2012) quienes demostraron que el fucoidan de S. siliquosum a concentraciones entre 25-175 μg/mL estimuló la actividad proliferativa sobre CMSPh. Se ha reportado el efecto mitogénico del FFv (10-100 μg/mL), FUp (100 μg/mL) y productos comerciales a base de fucoidan (10 μg/mL) sobre esplenocitos murinos estimulados con Concanavalina A y LPS (Choi et al. 2005, Hayashi et al. 2008, Vetvicka & Vetvickova, 2017). Estos resultados contrastan con los de Yuvaraj & Arul (2014), quienes empleando concentraciones entre 0-100 μg/mL del extracto de Sargassum wightii observaron la inhibición de la proliferación de CMSPh, por lo cual se puede inferir que el incremento de CMSPh obtenido en el presente estudio para el fucoidan de L. trabeculata es similar a los reportes presentados por los referidos autores.
Las concentraciones de FLt y FFv no indujeron la producción de NO en cultivos de CMSPh, resultados que concuerdan con los de Yang et al. (2006) y Hwang et al. (2011) quienes determinaron que el fucoidan de Laminaria japónica y el extracto de polisacáridos sulfatados de Sargassum hemiphyllum disminuyen la producción de NO en células RAW 264.7 estimuladas con LPS. Así mismo, nuestros resultados difieren de los hallados por Choi et al. (2005) quienes determinaron que macrófagos peritoneales de ratón tratados con fucoidan de F. vesiculosus (48 h) producen altas concentraciones de NO. Otros autores han reportado que el tratamiento de células RAW 264.7 con fucoidanos de Laminaria angustata var. longissima, Ascophyllum nodosum y Fucus vesiculosus inducen la producción de NO de manera dosis dependiente (Teruya et al. 2010, Jiang et al. 2011, Nishiguchi et al. 2014). La presencia de NO se ha determinado principalmente en macrófagos empleando LPS y/o citoquinas, sin embargo, investigadores como Weinberg et al. (1995) encontraron en monocitos humanos activados la producción disminuida de la enzima sintasa óxido nítrico inducible (iNOS) y NO. Es probable que la reacción de ROS (anión superóxido, peróxido de hidrógeno, radical hidroxilo y algunas veces ácido hipocloroso) ocasione la inactivación del NO o la consiguiente conversión en peroxinitrito (ONOO-), una molécula con potente bioactividad (MacMicking et al. 1997).
La determinación de la actividad oxidativa se realizó mediante la técnica de reducción del NBT. El tratamiento de CMSPh con FLt y FFv (24 h) a la concentración de 2 mg/mL produjo el incremento de ROS respecto al control (p<0.0001) (Figuras 3A y 4A). Cuando se trataron las CMSPh (48 h) se observaron diferencias a concentraciones de FLt de 0.001, 0.01, 0.05, 0.5, 1 y 2 mg/mL con relación al control (p<0.0001) (Figura 3B), mientras que el tratamiento con el FFv presentó diferencias a las concentraciones de 0.5, 1 y 2 mg/mL (p<0.0001) (Figura 4B). Los resultados coinciden con los encontrados por Jiang et al. (2013) quienes trabajaron con polisacáridos sulfatados de Ascophyllum nodosum y demostraron la producción de especies reactivas de oxígeno en células RAW 264.7. La inhibición en la producción de anión superóxido implica una fuerte actividad antioxidante de los fucoidanos sobre ROS (So et al. 2007), en ese sentido otros autores han demostrado que empleando el extracto de Eisenia bicyclis y nanopartículas constituidas por quitosano y FFv se inhibe la producción de anión superóxido y la actividad fagocítica en macrófagos aislados de ratas y células RAW 264.7 respectivamente (Namkoong et al. 2011, Huang & Li 2014).
La IL-1α es una potente citoquina proinflamatoria y pleiotrópica que es secretada por monocitos, macrófagos, células dendríticas, células B, fibroblastos, neutrófilos, células epiteliales entre otras. Esta citoquina estimula la expresión de genes de otras citoquinas inflamatorias, factores de crecimiento de linfocitos, factores estimuladores de colonias y mesenquimales (Velez et al. 2004; Fettelschoss et al. 2011). Con respecto a la IL-1α se evidenció que la mayor producción fue con 100 µg/mL de FLt respecto al control (p<0.05) y al FFv (p<0.01) (Figura 5), si bien no existen referencias respecto a la producción de esta citoquina en modelos similares, Vásquez et al. (2014) demostraron que CMSPh estimuladas con LPS 10 µg/mL y coincubadas con extracto de fucoidan de S. siliquosum a concentraciones comprendidas entre 25-175 μg/mL durante 48 h, inhibieron la producción de IL-1, IL-6 y TNF-α de manera dosis dependiente. Sin embargo, en el presente estudio se determinó que cultivos tratados con 100 µg/mL de FLt y FFv incrementan la producción de IL-1α respecto a 10 µg/mL (Figura 5).
La IL-6 es una citoquina bifuncional que media actividades pro y antiinflamatorias. Esta citoquina es expresada por neutrófilos y eosinófilos no estimulados, linfocitos B y T, monocitos y células endoteliales estimuladas (Garbuzova-Davis et al. 2018). En los cultivos tratados con FLt y FFv se evidenció la producción de IL-6 (p>0.05). Además, se observó que a FLt 10 y 100 µg/ mL se disminuye la producción de IL-6 frente al control (p<0.05) (Figura 6); resultados que evidencian la acción inmunomoduladora del fucoidan de L. trabeculata en la producción de esta citoquina.
El TNF-α es una citoquina pluripotencial proinflamatoria que regula una diversidad de respuestas celulares y es producida en primer lugar por monocitos y macrófagos (Esposito & Cuzzocrea 2009). En el cultivo de CMSPh tratadas con FLt 10 µg/mL se incrementó la producción de TNF-α respecto al FFv 10 µg/mL (p<0.01), FFv 100
µg/mL (p<0.05) y el control (p<0.05) (Figura 7). Los referidos resultados son similares a los reportados por Halling et al. (2015) quienes determinaron que en cultivos de CMSPh tratadas con elevadas concentraciones de fucoidan ultrapurificado (10 mg/mL) de Laminaria hyperborea durante 24 h, se incrementó la producción de TNF-α, aunque la producción de IL-6 no mostró diferencias significativas. Este comportamiento es distinto cuando se emplean cultivos de otros tipos de células como macrófagos J774A.1 que tratados con fucoidanos puros y mezclas comerciales (10 μg/mL), produjeron IL-10 y TNF-α, mientras que en macrófagos THP-1 tratados a la concentración de 10 y 100 μg/mL de fucoidan de Laminaria digitata y Laminaria hyperborea se incrementaron los niveles de TNF-α, IL-6 e IL-10 (Vetvicka & Vetvickova 2017, Stefaniak-Vidarsson et al. 2017).
El IFN-γ es sintetizado por linfocitos Th1CD4+, linfocitos citotóxicos CD8+, células NK y células NKT. La secreción de IFN-γ por células NK es importante en estadios iniciales de la infección, mientras que la producción por linfocitos T es importante en la respuesta inmune adaptativa (Razaghia et al. 2017). Respecto a la producción de IFN-γ no se evidenciaron diferencias significativas entre el FLt y FFv con relación al control (p>0.05) (Figura 8); resultados similares obtuvieron Iwamoto et al. (2011) al comprobar en cultivos de CMSPh de personas tratadas y no tratadas con 100 μg/mL de fucoidan durante 12 días. Sin embargo, se ha confirmado que en el cultivo de esplenocitos de ratón estimulados con fucoidan de Fucus evanescens se incrementan el nivel de citoquinas séricas proinflamatorias TNF-α, IFN-γ e IL-2 (Kuznetsova et al. 2017). En ratones tratados con FUp, Mathew et al. (2017) determinaron el incremento de IL-6 e IFN-γ sin diferencias significativas.
Respecto a la síntesis de citoquinas en cultivos de CMSPh (48 h) se observó que el FLt provoca el aumento de IL-1α y TNF-α (Figuras 5 y 7), mientras que la IL-6 e IFN-γ no se produjeron de manera significativa respecto al control (Figuras 6 y 8). En los cultivos con FFv se evidenció la producción de las cuatro citoquinas ensayadas (p>0.05).
Los efectos del fucoidan en la producción de citoquinas permanecen controversiales debido a que existen reportes que han demostrado su inducción o inhibición, esta contradicción se sustentaría en las características estructurales, composición y diversas actividades biológicas del fucoidan según la especie del alga (Ale et al. 2011, Li et al. 2017).
Se concluye que el fucoidan de L. trabeculata induce la proliferación de células mononucleares humanas, la producción de especies reactivas de oxígeno y citoquinas proinflamatorias IL-1α y TNF-α con importantes propiedades inmunomoduladoras.
Agradecimientos:
Al Mg. Ing. Paul Kradolfer Zamora y al Ing. Gunter Villena Sarmiento por promover el nexo entre la empresa PSW S.A y la Universidad Nacional Mayor de San Marcos y a la actual Gerencia PSW S.A por mantener el vínculo para futuras investigaciones.
Rol de los autores:
LAG, ECV: diseñaron el estudio; ECV: desarrollo de los experimentos; JCHP, EAS, ICA: colectaron el alga, procesaron y determinaron el contenido de fucoidan; ECV, LAG: analizaron e interpretaron los datos; ECV, LAG: redactaron el manuscrito; ECV, LAG: revisaron y aprobaron el manuscrito.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
INNOVATE (Contrato 143-PNICP-PIAP-2015) y el Vicerrectorado de Investigación y Posgrado-UNMSM (Código: B17100461-RR N° 04274-R-17).
Aspectos éticos / legales:
Los autores declaran que los procedimientos realizados se basan en los principios éticos estipulados en la Declaración de Helsinki 2000, para la investigación médica en seres humanos.
Citación:
Colona-Vallejos E.H. , L. Alzamora-Gonzales, J.A. Chávez Pérez, E.V. Apumayta Suárez, I. Chang Avila. 2019. Incremento de la viabilidad y producción de especies reactivas de oxígeno en células mononu- cleares de sangre periférica humana tratadas con fucoidan de Lessonia trabeculata. Revista peruana de biología 26(3): 291 300 (Septiembre 2019). doi: http://dx.doi.org/10.15381/rpb.v26i3.16772
Literatura citada
Ale M.T., J.D. Mikkelsen & A.S. Meyer. 2011. Important Determinants for Fucoidan Bioactivity: A Critical Review of Structure-Function Relations and Extraction Methods for Fucose-Containing Sulfated Polysaccharides from Brown Seaweeds. Marine Drugs 9: 2106-2130. https://doi.org/10.3390/md9102106 [ Links ]
Alley M.C., D.A. Scudiere, A. Monks, M.L. Hursey, M.J. Czerwinski, D. Fine, B.J. Abbott, J.G. Mayo, R.H. Shoemaker & M.R Boyd. 1988. Feasebility of drug screening with panels of human tumor cell lines using a microculture tetrazolium assay. Cancer Research 48: 589-601. [ Links ]
Baba B.M., W.Wan Mustapha & S. J. Lim. 2018. Effect of extraction methods on the yield, fucose content and purity of fucoidan from Sargassum sp. Obtained from Pulau langkawi, Malaysia. Malaysian Journal of Analytical Sciences. 22: 87-94. doi: 10.17576/mjas-2018-2201-11. [ Links ] https://doi.org/10.17576/mjas-2018-2201-11
Barahona T., M.V. Encinas, M. Imarai, M. Mansilla, B. Matsuhiro, R. Torres & B. Valenzuela. 2014. Bioactive polysaccharides from marine algae, Bioactive Carbohydrates and Dietary Fibre 4(2): 125-138. https://doi.org/10.1016/j.bcdf.2014.09.002 [ Links ]
Bryan N. S., & M. B. Grisham. 2007. Methods to Detect Nitric Oxide and its Metabolites in Biological Samples. Free Radical Biology & Medicine, 43(5): 645-657. https://doi.org/10.1016/j.freeradbiomed.2007.04.026 [ Links ]
Cho M.L., B.Y. Lee & S.G. You. 2010. Relationship between oversulfation and conformation of low and high molecular weight fucoidans and evaluation of their in vitro anticancer activity. Molecules 16(1):291-7. https://doi.org/10.3390/molecules16010291 [ Links ]
Choi E.M., A.J. Kim, Y.O. Kim & J.K. Hwang. 2005. Immunomodulating activity of arabinogalactan and fucoidan in vitro. Journal of Medicinal Food, 8(4):446-53. https://doi.org/10.1089/jmf.2005.8.446 [ Links ]
Choi H.S., J.W. Kim, Y-N. Cha & C. Kim. 2006. A quantitative nitroblue tetrazolium assay for determining intracellular superoxide anion production in phagocytic cells. Journal of Immunoassay and Immunochemistry 27: 31-34. https://doi.org/10.1080/15321810500403722 [ Links ]
Escobar L., A. Rivera & F. Aristizábal. 2010. Estudio comparativo de los métodos de resazurina y MTT en estudios de citotoxicidad en líneas celulares tumorales humanas. Vitae, 17(1), 67-74. [ Links ]
Esposito E., & S. Cuzzocrea. 2009. TNF-alpha as a therapeutic target in inflammatory diseases, ischemia-reperfusion injury and trauma. Current Medical Chemistry, 16(24):3152-67. https://doi.org/10.2174/092986709788803024 [ Links ]
Fettelschoss A., M. Kistowska, S. LeibundGut-Landmann, H.D. Beer, P. Johansen, G. Senti, E. Contassot, M.F. Bachmann, L.E. French, A. Oxenius, & T.M. Kündig. 2011. Inflammasome activation and IL-1β target IL-1α for secretion as opposed to surface expression. Proceedings of the National Academy of Sciences of the United States of America. 108(44):18055-60. https://doi.org/10.1073/pnas.1109176108 [ Links ]
Fitton J. 2011. Therapies from Fucoidan; Multifunctional Marine Polymers. Marine Drugs 9: 1731-1760. https://doi.org/10.3390/md9101731 [ Links ]
Garbuzova-Davis S., J. Ehrhart, P. R. Sanberg, & C. V. Borlongan. 2018. Potential Role of Humoral IL-6 Cytokine in Mediating Pro-Inflammatory Endothelial Cell Response in Amyotrophic Lateral Sclerosis. International Journal of Molecular Sciences, 19(2), 423. http://doi.org/10.3390/ijms19020423 [ Links ]
Halling B.P., V. Vetvicka, W.R. Blakemore. 2015. Evaluation of The Immunomodulatory In Vivo Activity of Laminaria hyperborea Fucoidan Relative to Commercial (1,3/1,6)-Β-D-Glucans from Yeast and Mushrooms. Journal of Nutrition and Health Sciences 2(2), 205. https://doi.org/10.15744/2393-9060.2.205 [ Links ]
Hayashi K., T. Nakano, M. Hashimoto, K. Kanekiyo & T.Hayashi. 2008. Defensive effects of a fucoidan from brown alga Undaria pinnatifida against herpes simplex virus infection. International Immunopharmacology 8(1):10916. https://doi.org/10.1016/j.intimp.2007.10.017 [ Links ]
Holdt S. L. & S. Kraan. 2011. Bioactive compounds in seaweed: Functional food applications and legislation. Journal of Applied Phycology, 23(3): 543-597. https://doi.org/10.1007/s10811-010-9632-5 [ Links ]
Huang Y.Ch. & Li R.Y. (2014). Preparation and Characterization of Antioxidant Nanoparticles Composed of Chitosan and Fucoidan for Antibiotics Delivery. Marine Drugs 12: 4379-4398. https://doi.org/10.3390/md12084379 [ Links ]
Hwang P.A., S.Y. Chien, Y.L. Chan, M.K. Lu, C.H. Wu, Z.L. Kong & C.J. Wu. 2011. Inhibition of Lipopolysaccharide (LPS)-induced inflammatory responses by Sargassum hemiphyllum sulfated polysaccharide extract in RAW 264.7 macrophage cells. Journal of Agricultural and Food Chemistry. 59(5):2062-8. https://doi.org/10.1021/jf1043647 [ Links ]
Instituto del Mar del Perú (IMARPE). 2012. Estudio sobre macroalgas pardas en el Sur del Perú 2011-2015. Setiembre, Callao, Perú. pp. 31. [ Links ]
Iwamoto K., T. Hiragun, S. Takahagi, Y. Yanase, S. Morioke, S. Mihara, Y. Kameyoshi & M. Hide. 2011. Fucoidan suppresses IgE production in peripheral blood mononuclear cells from patients with atopic dermatitis. Archives of Dermatological Research. 303(6): 425-31. https://doi.org/10.1007/s00403-010-1115-7 [ Links ]
Jiang Z., T. Okimura, K. Yamaguchi & T. Oda. 2011. The potent activity of sulfated polysaccharide, ascophyllan, isolated from Ascophyllum nodosum to induce nitric oxide and cytokine production from mouse macrophage RAW264.7 cells: Comparison between ascophyllan and fucoidan. Nitric Oxide. 25(4):407-15. https://doi.org/10.1016/j.niox.2011.10.001 [ Links ]
Jiang Z., M. Ueno, T. Nishiguchi, R. Abu, S. Isaka, T. Okimura, K. Yamaguchi & T. Oda. 2013. Importance of sulfate groups for the macrophage-stimulating activities of ascophyllan isolated from the brown alga Ascophyllum nodosum. Carbohydrate Research 380(18):1249. https://doi.org/10.1016/j.carres.2013.05.018 [ Links ]
Kumar P., A. Nagarajan & P.D. Uchil. 2018. Analysis of Cell Viability by the MTT Assay. Cold Spring Harbor Protocols, 2018(6):pdb.prot095505. https://doi.org/10.1101/pdb.prot095505 [ Links ]
Kuznetsova T.A., L.A. Ivanushko, E.V. Persiyanova, A.L. Shutikova, S.P. Ermakova, M.Yu Khotimchenko. & N.N. Besednova. 2017. Evaluation of adjuvant effects of fucoidane from brown seaweed Fucus evanescens and its structural analogues for the strengthening vaccines effectiveness. Biomeditsinskaya khimiya, 63(6), 553-558. https://doi.org/10.18097/pbmc20176306553 [ Links ]
Li B., F. Lu, X. Wei & R. Zhao. 2008. Fucoidan: Structure and bioactivity. Molecules 13 (8): 1671-1695. https://doi.org/10.3390/molecules13081671 [ Links ]
Li P., H. Wang, Q. Shao, B. Kong & X. Qu. 2017. Fucoidan modulates cytokine production and migration of THP-1-derived macrophages via colony-stimulating factor-1. Molecular Medicine Reports, 15, 2325-2332. https://doi.org/10.3892/mmr.2017.6228 [ Links ]
MacMicking J., Q.W. Xie & C. Nathan. 1997. Nitric oxide and macrophage function. Annual Review Immunology 15:323-50. https://doi.org/10.1146/annurev.immunol.15.1.323 [ Links ]
Maruyama H., H. Tamauchi, M. Hashimoto & T. Nakano (2003). Antitumor activity and immune response of Mekabu fucoidan extracted from Sporophyll of Undaria pinnatifida. In Vivo 17(3):245-9. [ Links ]
Mathew L., M. Burney, A.Gaikwad, P. Nyshadham, E. K. Nugent, A.Gonzalez & J. A. Smith. 2017. Preclinical Evaluation of Safety of Fucoidan Extracts From Undaria pinnatifida and Fucus vesiculosus for Use in Cancer Treatment. Integrative Cancer Therapies, 16(4), 572-584. https://doi.org/10.1177/1534735416680744 [ Links ]
Min E.Y., I.H. Kim, J. Lee, E.Y. Kim, Y.H Choi., T.J. Nam. 2014. The effects of fucodian on senescence are controlled by the p16INK4a-pRb and p14Arf-p53 pathways in hepatocellular carcinoma and hepatic cell lines. International Journal Oncology 45(1):47-56. https://doi.org/10.3892/ijo.2014.2426 [ Links ]
Morya V. K., J. Kim & E-K. Kim. 2012. Algal fucoidan: structural and size-dependent bioactivities and their perspectives. Applied Microbiology and Biotechnology 93:7182. https://doi.org/10.1007/s00253-011-3666-8 [ Links ]
Moshage H., B. Kok, J.R. Huizenga & P.L. Jansen. 1995. Nitrite and nitrate determinations in plasma: a critical evaluation. Clinical Chemical. 41(6 Pt 1):892-6. [ Links ]
Mosmann T. 1983. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal Immunology Methods 65: 55-63. https://doi.org/10.1016/0022-1759(83)90303-4 [ Links ]
Namkoong S., S-Ch Kang, H. Do, K-H. Jang, S-A Jang., M-G Choung & E-H. Sohn. 2011. Immunomodulatory Effects of Supplementation with Extracts from the Marine Brown Alga Eisenia bicyclis on Macrophages. Korean Journal Plant Research 24(3): 298-303. https://doi.org/10.7732/kjpr.2011.24.3.298 [ Links ]
Nakano K., D. Kim, Z. Jiang, M. Ueno., T. Okimura., K. Yamaguchi & T. Oda. 2012. Immunostimulatory Activities of the Sulfated Polysaccharide Ascophyllan from Ascophyllum nodosum in in vivo and in vitro. Systems, Bioscience, Biotechnology, and Biochemistry, 76:8, 1573- 1576. https://doi.org/10.1271/bbb.120232 [ Links ]
Nishiguchi T., Z.J. iang, M. Ueno, S. Takeshita, K. Cho, R. S. Woon, K-H. Kang, K. Yamaguchi, D. Kim & T. Oda. 2014. Reevaluation of bactericidal, cytotoxic, and macrophagestimulating activities of commercially available Fucus vesiculosus fucoidan. Algae 29(3): 237-247. https://doi.org/10.4490/algae.2014.29.3.237 [ Links ]
Qu G., X. Liu, D. Wang, Y. Yuan, & L. Han. 2014. Isolation and characterization of fucoidans from five brown algae and evaluation of their antioxidant activity. Journal of Ocean University of China. 13(5), 851-856. https://doi.org/10.1007/s11802-014-2260-y [ Links ]
Ramberg J.E., E. D. Nelson, & R. A. Sinnott. 2010. Immunomodulatory dietary polysaccharides: a systematic review of the literature. Nutrition Journal 9: 54. https://doi.org/10.1186/1475-2891-9-54 [ Links ]
Ramírez A., L. Quevedo, N. Paniagua, G. Chamorro, A. Milliar, , M. Jaramillo. 2014. Antioxidant enzymes gene expression and antihypertensive effects of seaweeds Ulva linza and Lessonia trabeculata in rats fed a high-fat and high-sucrose diet. Journal Applied Phycology 26:597605. https://doi.org/10.1007/s10811-013-0134-0 [ Links ]
Rani V., R.J. Shakila, P.Jawahar & A. Srinivasan. 2017. Influence of Species, Geographic Location, Seasonal Variation and Extraction Method on the Fucoidan Yield of the Brown Seaweeds of Gulf of Mannar, India. Indian Journal of Pharmaceutical Sciences 79(1): 65-71. https://doi.org/10.4172/pharmaceutical-sciences.1000202 [ Links ]
Razaghi A., C. Villacrés, V. Jung, N. Mashkour, M. Butler, L. Owens, & K. Heimann. 2017. Improved therapeutic efficacy of mammalian expressed-recombinant interferon gamma against ovarian cancer cells. Experimental Cell Research. 359(1): 20-29. https://doi.org/10.1016/j.yexcr.2017.08.014 [ Links ]
Resendiz G., G. Hernández, M. Muñoz, J. Murillo-Álvarez & E. Hernández. 2010. Extraction, partial characterization and Anticoagulant activity of fucoidan from four species of brown seaweed. En: XX International Seaweed Symposium (Ensenada, Baja California, México). Pp. 92. [ Links ]
Rioux L., S. L. Turgeon, & M. Beaulieu. 2010. Structural characterization of laminaran and galactofucan extracted from the brown seaweed Saccharina longicruris. Phytochemistry 71(13): 1586-1595. https://doi.org/10.1016/j.phytochem.2010.05.021 [ Links ]
So M.J., B.K. Kim, M.J. Choi, K.Y. Park, S.H. Rhee & E.J. Cho. 2007.Protective Activity of Fucoidan and Alginic Acid against Free Radical-Induced Oxidative Stress under in Vitro and Cellular System. Preventive Nutrition and Food Science 12(4):191-196. https://doi.org/10.3746/jfn.2007.12.4.191 [ Links ]
Stefaniak-Vidarsson M., M. Gudjónsdóttir, G. Marteinsdottir, O.E. Sigurjonsson & K. Kristbergsson. 2017. Evaluation of bioactivity of fucoidan from laminaria with in vitro human cell cultures (THP-1). Functional Foods in Health and Disease. 7: 688-701. https://doi.org/10.31989/ffhd.v7i9.373 [ Links ]
Teruya T., S. Takeda, Y. Tamaki, & M. Tako. 2010. Fucoidan isolated from Laminaria angustata var. longissima induced macrophage activation. Bioscience Biotechnology Biochemical 74(9):1960-2. https://doi.org/10.1271/bbb.100294 [ Links ]
Thinh P.D., R.V. Menshova, S.P. Ermakova, S.D. Anastyuk, B.M Ly & T.N. Zvyagintseva. 2013. Structural Characteristics and Anticancer Activity of Fucoidan from the Brown Alga Sargassum mcclurei. Marine Drugs 11: 14561476. https://doi.org/10.3390/md11051456 [ Links ]
Vasquez R.D. & J. Ramos. 2012. Immunomodulatory effects of sulfated polysaccharides from Sargassum siliquosum J.G Agardh on peripheral blood mononuclear cells. International Journal of Research in Pharmacology and Phytochemistry 2(1): 55-63. [ Links ]
Vasquez R.D., R. Garcia-Meim & J. Ramos. 2014. Polysaccharide Extracts From Sargassum siliquosum J.G. Agardh Modulates Production Of Pro-Inflammatory Cytokines In LPS-Induced PBMC and Delays Coagulation Time InVitro. Journal of Harmonized Research in Pharmacy 3(3): 101-112. [ Links ]
Vélez S., J. Camargo, P. Correa & J. Anaya. 2004. Bases moleculares de la familia de la interleuquina-1. Revista Colombiana de Reumatología, 11 (1): 11-39. [ Links ]
Vetvicka V. & J. Vetvickova. 2017. Fucoidans Stimulate Immune Reaction and Suppress Cancer Growth. Anticancer Research 37(11):6041-6046. https://doi.org/10.21873/anticanres.12051 [ Links ]
Weinberg J., M. Misukonis, P. Shami, S. Mason, D. Sauls, W. Dittman, E. Wood, G. Smith, B. McDonald, & K. Bachus. 1995. Human mononuclear phagocyte inducible nitric oxide synthase (iNOS): analysis of iNOS mRNA, iNOS protein, biopterin, and nitric oxide production by blood monocytes and peritoneal macrophages. Blood, 86(3): 1184-1195. Accessed October 06, 2018. Retrieved from http://www.bloodjournal.org/content/86/3/1184 [ Links ]
Yang J.W., S.Y. Yoon, S.J. Oh, S.K. Kim, K.W. Kang. 2006. Bifunctional effects of fucoidan on the expression of inducible nitric oxide synthase. Biochemical and Biophysical Research Communications Journal, 346(1):345-50. https://doi.org/10.1016/j.bbrc.2006.05.135 [ Links ]
Yoo Y., W. Kim, S. Kim, S Kim., M. Chung, J. Park, H. Suh, K. Lee & Y. Park. 2007. Immunomodulating Activity of a Fucoidan Isolated from Korean Undaria pinnatifida Sporophyll Algae, 22(4): 333-338. https://doi.org/10.4490/ALGAE.2007.22.4.333 [ Links ]
Yuguchi Y., V. T. T. Tran, L. M. Bui, S.Takebe, S. Suzuki, N. Nakajima,, ... T. T. T.Thanh. 2016. Primary structure, conformation in aqueous solution, and intestinal immunomodulating activity of fucoidan from two brown seaweed species Sargassum crassifolium and Padina australis. Carbohydrate Polymers, 147: 69-78. https://doi.org/10.1016/j.carbpol.2016.03.101 [ Links ]
Yuvaraj N. & V. Arul. 2014. In vitro Anti-Tumor, Anti-Inflammatory, Antioxidant and Antibacterial Activities of Marine Brown Alga Sargassum wightii Collected from Gulf of Mannar. Global Journal of Pharmacology 8 (4): 566- 577. [ Links ]
Zhao Y., Y. Zheng, J. Wang, S. Ma, Y. Yu, W. L. White, J. Lu. 2018. Fucoidan Extracted from Undaria pinnatifida: Source for Nutraceuticals/Functional Foods. Marine Drugs, 16(9): 321. https://doi.org/10.3390/md16090321 [ Links ]
Correspondencia:
* Autor para correspondencia
EHC-V: ecolonav@unmsm.edu.pe
LA-G: lalzamorag@unmsm.edu.pe
JACP: jchavezp@lamolina.edu.pe
EVAS: 20101090@lamolina.edu.pe
Otros datos de los autores / biografía:
1 Grupo de Investigación Inmunomoduladores y antitumorales de origen natural y sintético (MO- DULANS).
Presentado: 21/11/2018
Aceptado: 12/07/2019
Publicado online: 30/09/2019