Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. vol.26 no.3 Lima ago. 2019
http://dx.doi.org/10.15381/rpb.v26i3.16778
TRABAJOS ORIGINALES
Dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae) in the El Zapotal reserve, Chiapas, Mexico
M. Edivaldo Rodríguez-López ORCID: 0000-0003-3192-5287, Gibrán Sánchez-Hernández* ORCID: 0000-0002-0152-1380, Benigno Gómez ORCID: 0000-0002-7260-6744
El Colegio de la Frontera Sur, San Cristóbal de Las Casas, México
Resumen
El Centro Ecológico y Recreativo El Zapotal (CEREZ) se caracteriza por presentar uno de los últimos remanentes de selva mediana en la región central de Chiapas, México. Sin embargo, el conocimiento de algunos grupos taxonómicos de la reserva no es del todo adecuado. En este trabajo se analiza la composición y estructura, así como la distribución temporal de los escarabajos coprófagos que habitan en el CEREZ. Se realizaron muestreos mensuales entre febrero de 2013 y enero de 2014 utilizando trampas de caída cebadas con estiércol de seis especies de mamíferos que se mantienen en cautiverio al interior del Zoológico Miguel Álvarez del Toro (ZooMAT). Se presenta una lista anotada de 22 especies agrupadas en 12 géneros y seis tribus de Scarabaeinae. Onthophagus anthracinus, Canthon femoralis, Onthophagus landolti y Copris laeviceps aportan el 89.7% de la abundancia total. La curva de rarefacción muestra una tendencia asintótica, con un 92% de completitud. La fauna capturada muestra una marcada distribución temporal (p < 0.01), observando los valores más altos de riqueza y abundancia durante los meses de la temporada lluviosa. Los registros representan el 7.53% de la diversidad conocida en México y el 18.2% de las especies reportadas en el estado de Chiapas. A pesar de representar un pequeño remanente de selva tropical y de la constante presión antrópica generada por la zona urbana, El Zapotal conserva una fauna de escarabajos coprófagos representativa a nivel regional, resaltando la importancia de la reserva como refugio de especies.
Palabras clave: Lista anotada; Distribución temporal; Selva mediana subperennifolia; Remanente; Presión antrópica.
Abstract
El Zapotal Recreational Ecological Preserve (CEREZ) is characterized by presenting one of the last remnants of tropical forest in the central region of Chiapas, Mexico. However, the knowledge of some taxa of the reserve is not entirely adequate. In this work the composition and structure, as well as the temporal distribution of the dung beetles that reside in CEREZ, are analyzed. Monthly samplings were carried out between February 2013 and January 2014 using pitfall traps baited with dung of six mammal species that are kept in captivity inside the Miguel Álvarez del Toro Zoo (ZooMAT). An annotated checklist of 22 species grouped into 12 genera and six tribes of Scarabaeinae is presented. Onthophagus anthracinus, Canthon femoralis, Onthophagus landolti, and Copris laeviceps provide 89.7% of the total abundance. The rarefaction curve shows an asymptotic tendency, with 92% completeness. The captured fauna showed a marked temporal distribution (p < 0.01), observing the highest values of richness and abundance during the months of the rainy season. The records represent 7.53% of the species diversity known in Mexico and 18.2% of the reported in the Chiapas state. Despite representing a small remnant of tropical forest and the constant anthropic pressure generated by the urban area, El Zapotal conserves a representative fauna of dung beetles at the regional level, Highlighting the importance of the reserve as a refuge for species.
Keywords: Annotated checklist; Temporal distribution; Tropical forest; Remnant; Anthropic pressure.
Introducción
Las actuales transformaciones, de los paisajes naturales a zonas de urbanización, son un claro ejemplo del impacto negativo de las actividades humanas sobre la biodiversidad y que a nivel mundial se considera un importante impulsor del cambio ambiental (Melliger et al. 2018). La pérdida de biodiversidad en las áreas urbanas es causada principalmente por la reducción de hábitats, aislamiento y baja conectividad de las áreas verdes, escasez de alimentos y otros factores como la contaminación química y acústica. No obstante, en dichas zonas aún se pueden encontrar refugios de biodiversidad donde los hábitats y suelos están menos perturbados, los cuales por lo general se encuentran en zonas periféricas, parques, terrenos abandonados, entre otros (Taboada-Verona et al. 2019). Los estudios faunísticos son importantes para documentar la ocurrencia de especies en estas áreas de interés (Hernández & Navarrete-Heredia 2018) y realizar evaluaciones posteriores ante posibles cambios en los ensambles de especies como resultado de la interacción con variables climáticas o impactos antrópicos (Navarrete & Halffter 2008a, Sánchez-de-Jesús et al. 2016).
Los escarabajos coprófagos de la subfamilia Scarabaeinae (Coleoptera: Scarabaeidae) juegan un papel crucial en el entierro y degradación del estiércol de vertebrados y como resultado, realizan una serie de servicios ecológicos que son esenciales para el funcionamiento del ecosistema (Nichols et al. 2008). Además, son sensibles a las alteraciones antrópicas y naturales (Nichols et al. 2007), por lo que se les considera un grupo indicador altamente informativo (Spector 2006).
La respuesta general de los escarabajos coprófagos a distintos impactos antrópicos es similar, pero existe poco conocimiento sobre las especies que habitan en zonas urbanas y periurbanas y el efecto que estas zonas ejercen sobre su riqueza y composición. Su presencia en estas áreas implica superar una serie de restricciones funcionales que son básicas en la ecología de este grupo de insectos: superficies impermeables, baja disponibilidad de recursos y la presencia de olores derivados principalmente de la combustión de combustibles fósiles (Ramírez-Restrepo et al. 2016).
Los Scarabaeinae son un grupo de insectos de amplia distribución geográfica que pueden llegar a colonizar una gran variedad de hábitats, principalmente en regiones tropicales, pero su diversidad decrece con el incremento de la altitud hasta estar ausente en regiones frías con altitudes extremas (Halffter 1991, Hanski & Cambefort 1991). A nivel mundial, se han descrito alrededor de 6500 especies y 279 géneros (Schoolmeesters 2019). En la región Neotropical la subfamilia está representada por alrededor de 2000 especies y 91 géneros (Vaz-de-Mello et al. 2011). Los Scarabaeinae en México se estiman en un aproximado de 292 especies registradas (Darling & Génier 2018, Gasca-Álvarez et al. 2018, Mora-Aguilar & Delgado 2018, Sánchez-Hernández & Gómez 2018, Sánchez-Huerta et al. 2018, Halffter et al. 2019, Joaqui et al. 2019, Moctezuma et al. 2019a, b), de las cuales 121 especies (41.44%) han sido reportadas en Chiapas, siendo considerado uno de los estados con mayor número de registros a nivel nacional (Sánchez-Hernández & Gómez 2018).
Los estudios sobre los Scarabaeinae en el estado de Chiapas han incrementado de forma considerable durante los últimos 15 años, situación que ha permitido tener un conocimiento más adecuado de la fauna de escarabajos que habita en la región. La mayoría de los trabajos analizan la composición y estructura de los ensambles en áreas naturales protegidas federales y sus zonas de influencia, principalmente de la región selva Lacandona (Navarrete & Halffter 2008a, Sánchez-de-Jesús et al. 2016, Santos-Heredia et al. 2018) y de la región selva Zoque (Arellano et al. 2008, 2013, Blas-López & Gómez 2009, Gómez et al. 2017, Sánchez-Hernández et al. 2018); mientras que otros proporcionan nuevos datos de distribución geográfica o descripción de nuevas especies (Gómez & Chamé-Vázquez 2003, Morales et al. 2004, Chamé-Vázquez & Gómez 2005, Navarrete & Halffter 2008b, Halffter & Halffter 2009, Sánchez-Hernández et al. 2017, Sánchez-Hernández & Gómez 2018). No obstante, todavía existen extensas zonas del territorio chiapaneco poco exploradas, entre las cuales destacan la mayoría de las áreas naturales protegidas de carácter estatal, cuyo conocimiento faunístico es nulo.
El Centro Ecológico y Recreativo El Zapotal (CEREZ) es un área natural protegida estatal que se caracteriza por albergar uno de los últimos remanentes de selva mediana subperennifolia del valle central del estado de Chiapas (Palacios-Espinosa et al. 2016), este fragmento de selva se encuentra amenazado debido al constante avance de la mancha urbana de la ciudad de Tuxtla Gutiérrez. Pese a su relevancia, el conocimiento de la flora y fauna presentes en la reserva se limita a los animales que se mantienen en cautiverio (mamíferos medianos y aves, principalmente) dentro del Zoológico Regional Miguel Álvarez del Toro (ZooMAT) el cual abarca 27 ha de la reserva; y a un estudio preliminar de la vegetación del área (Palacios- Espinosa et al. 2016), sin que exista conocimiento de otros grupos taxonómicos, incluidos los insectos. Por lo tanto, el presente estudio tiene como finalidad describir la composición y estructura de la fauna de escarabajos coprófagos de la subfamilia Scarabaeinae que habita en el Centro Ecológico y Recreativo El Zapotal, así como analizar la distribución temporal de sus especies.
Material y métodos
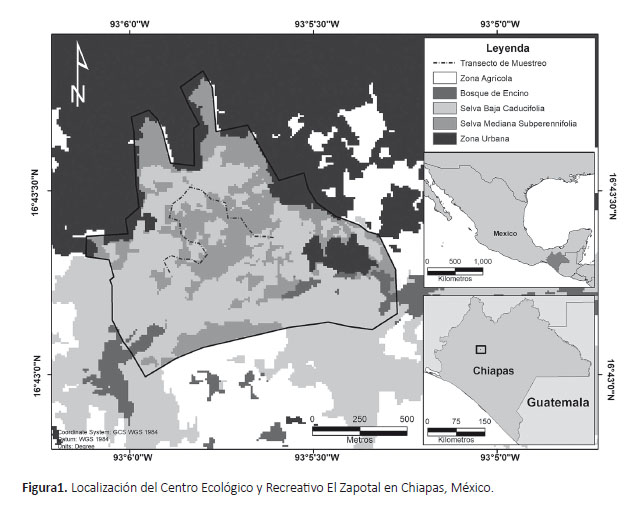
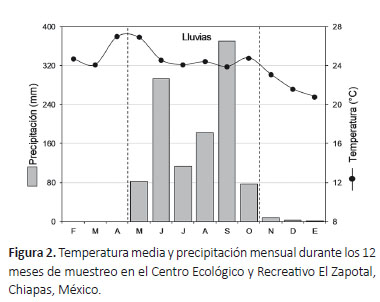
Área de estudio. El Centro Ecológico y Recreativo El Zapotal es una reserva que forma parte de la elevación conocida como Meseta de Copoya, incluida en la región fisiográfica Depresión Central de Chiapas. Se ubica al sureste de la zona urbana del municipio de Tuxtla Gutiérrez, entre los 16°43’0’’ y 16°43’ 40’’ N y los 93°05’33" y 93°06’08" W, con una extensión de 127.4 ha y una zona de influencia de 95.7 ha (Fig. 1). Su rango altitudinal va desde los 600 hasta los 850 m. Los tipos de vegetación predominantes son selva baja caducifolia y selva mediana subperennifolia dentro de los cuales se han reportado un total de 501 especies de plantas vasculares, agrupadas en 357 géneros y 101 familias (Palacios-Espinosa et al. 2016). Presenta un clima cálido subhúmedo con lluvias en verano y una marcada estación seca. De acuerdo con la estación meteorológica ZooMAT (SMN 2018), la temperatura media anual es de 24.5 °C con un máximo promedio de 29.5 °C y mínima de 18.6 °C; la precipitación promedio anual es de 975.4 mm. Durante el periodo de muestreo la temperatura mensual osciló entre los 20.8 y 27 °C; con una precipitación promedio de 1129.1 mm, concentrada principalmente de mayo a octubre (Fig. 2).
Muestreo de escarabajos. Se realizaron 12 muestreos sistemáticos mensuales de febrero de 2013 a enero de 2014 dentro de la reserva. Durante cada evento de muestreo se instalaron 24 trampas de caída establecidos a lo largo de un trayecto de aproximadamente 1.5 km. Las trampas se establecieron con una separación mínima de 50 m con el fin de disminuir la posibilidad de interferencia entre los olores de cada atrayente (Larsen & Forsyth 2005). Las trampas consistían en recipientes de 11 cm de diámetro, 18 cm de profundidad y 1 L de capacidad enterrados a nivel del suelo, dentro de los cuales se vertieron ~250 mL de etilenglicol como liquido conservador. Debido a que el ZooMAT se ubica dentro de los límites del polígono de El Zapotal, se utilizó como atrayente para los escarabajos, estiércol (~30 g) de seis especies de mamíferos nativos, los cuales se mantienen en cautiverio dentro de este zoológico: jaguar (Panthera onca), coyote (Canis latrans), tapir centroamericano (Tapirus bairdii), venado cola blanca (Odocoileus virginianus), mapache (Procyon lotor) y coatí (Nasua narica). Las trampas tuvieron un periodo de actividad de 48 h efectivas y fueron cubiertas con una lámina de aluminio para evitar su inundación durante la temporada de lluvias y evitar la desecación de los cebos por la irradiación solar. Los individuos recolectados se transfirieron a frascos de plástico con etanol al 70% para su posterior revisión en el laboratorio.
Trabajo taxonómico. Los individuos recuperados se determinaron taxonómicamente con ayuda de un estereoscopio Carl Zeiss Discovery v12, siguiendo literatura especializada en el grupo (Kohlmann 1997, Rivera-Cervantes & Halffter 1999, Génier & Kohlmann 2003, López-Guerrero 2005, Kohlmann & Solís 2002, 2006, Delgado & Kohlmann 2007, Edmonds & Zidek 2010, 2012, Génier 2012, González-Alvarado & Vaz-de-Mello 2014). La clasificación supragenérica de las especies se realizó siguiendo la propuesta de Bouchard et al. (2011). El material recolectado se encuentra depositado en la Colección Entomológica de El Colegio de la Frontera Sur, Unidad San Cristóbal (ECO-SC-E).
Análisis de datos. Para evaluar la integridad del inventario se realizó una curva de rarefacción/extrapolación de especies basado en el total de individuos capturados durante todos los eventos de muestreo (Chao et al. 2014). Este análisis se basó en la diversidad de orden 0D o número efectivo de especies, cuyo valor equivale simplemente a la riqueza de especies (0D = S) (Jost 2006), utilizando un método de remuestreo Bootstrap con 1000 repeticiones en el software en línea iNEXT (https://chao. shinyapps.io/iNEXTOnline/) (Chao et al. 2016). Se realizó un análisis de correlación de Pearson para establecer la relación entre los niveles de precipitación (variable independiente) con los patrones mensuales de riqueza y abundancia (variables dependientes). Se utilizó un escalamiento multidimensional no métrico (NMDS) para representar los patrones de agrupación en la composición de especies entre las temporadas de muestreo. Para verificar las diferencias en la composición de especies entre épocas de climáticas estudiadas representadas en el NMDS se realizó un análisis de similitud (ANOSIM). Para ambos análisis se usaron los datos de abundancia aplicando el índice Bray-Curtis en el software PAST v.3.21 (Hammer et al. 2001).
Los datos que se indican en la lista anotada de especies son: 1) la distribución mensual de las abundancias durante el presente estudio; 2) tipos de vegetación donde se distribuyen a nivel regional y; 3) distribución en México por estados, basado en la información de la literatura mencionada en la lista.
Resultados y discusión
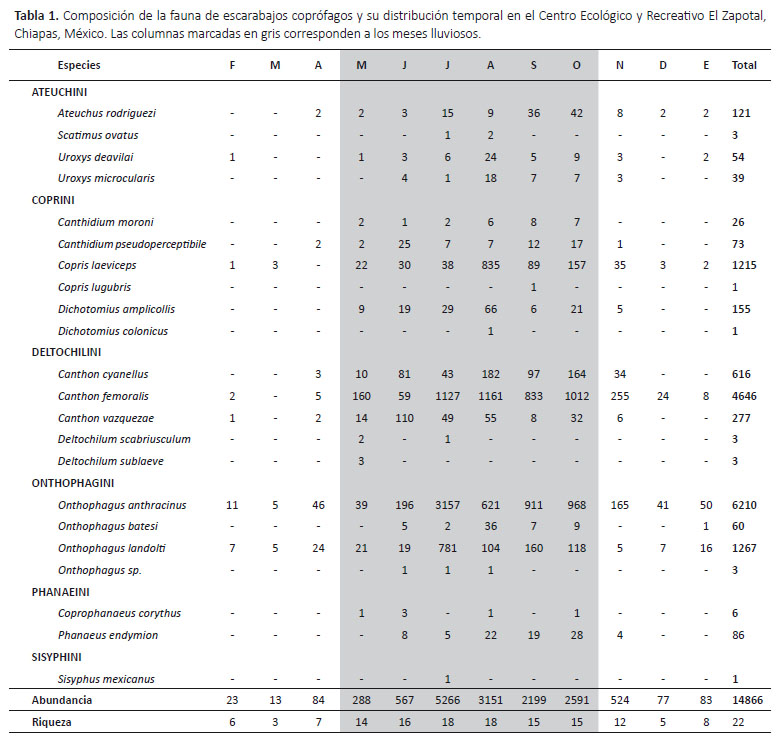
Se capturaron en total 14866 individuos que representan a 22 especies distribuidas entre 12 géneros y seis tribus de la subfamilia Scarabaeinae (Tabla 1). Los géneros Onthophagus y Canthon presentaron la mayor riqueza de especies, con cuatro y tres especies, respectivamente. Onthophagus anthracinus (n = 6210), Canthon femoralis (n = 4646), Onthophagus landolti (n = 1267) y Copris laeviceps (n = 1215) fueron las especies dominantes en la comunidad, aportando en conjunto el 89.7% de las abundancias totales. Por el contrario, Dichotomius colonicus, Copris lugubris y Sisyphus mexicanus están representados por un individuo.
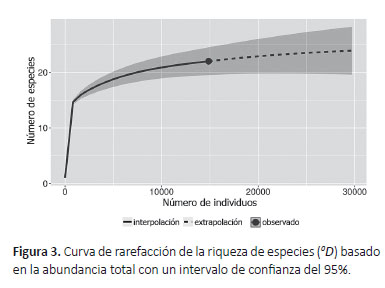
La curva de rarefacción de especies manifestó una tendencia asintótica. El valor de la extrapolación para la riqueza estimada fue 23.9 ± 4.1 de especies efectivas (Fig. 3). Esto indica que el esfuerzo de muestreo fue adecuado, con un 92% de completitud, lo que equivale al 7.53% de las especies registradas o descritas en México (Darling & Génier 2018, Gasca-Álvarez et al. 2018, Mora-Aguilar & Delgado 2018, Sánchez-Hernández & Gómez 2018, Sánchez-Huerta et al. 2018, Halffter et al. 2019, Joaqui et al. 2019, Moctezuma et al. 2019a, b) y al 18.2% de las especies de Scarabaeinae que se distribuyen en el estado de Chiapas (Sánchez-Hernández & Gómez 2018).
Aunque El Zapotal representa solo un pequeño remanente de vegetación primaria debido a la perturbación causada por el avance de los límites de la mancha urbana (Palacios-Espinoza et al. 2016), este estudio ofrece una riqueza de especies de Scarabaeinae similar a otros trabajos que se han realizado en Chiapas, tal es el caso del Parque Educativo Laguna Bélgica y la Zona Arqueológica Yaxchilán de donde se reportan 19 (Blas-López & Gómez 2009) y 20 especies (Palacios-Ríos et al. 1990), respectivamente.
Si bien a nivel regional existen otros trabajos con listados de Scarabaeinae mejor representados, como las de Arellano et al. (2008, 2013) y Sánchez-Hernández et al. (2018), nuestros resultados representan entre 59.5 y 78.6% de las especies que estos estudios reportan, lo que indica que el remanente que abarca El Zapotal, mantiene una buena representación de Scarabaeinae a nivel regional. Además, los trabajos mencionados se realizaron en zonas con mayor grado de conservación, incluyeron áreas de muestreo más extensas, un mayor esfuerzo de muestreo y también utilizaron carroña para las recolectas, un atrayente considerado eficiente para la captura de especies necrófagas especialistas y generalistas o copronecrófagas, aumentando potencialmente la eficiencia en la determinación del número de especies capturadas (Navarrete & Halffter 2008, Chamé-Vázquez et al. 2012, Sánchez-Hernández et al. 2018).
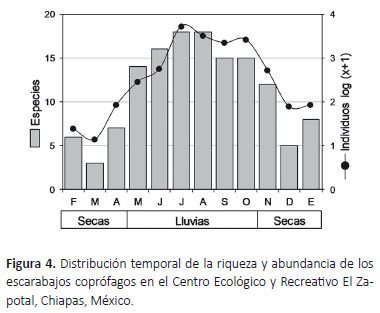
Respecto a la distribución temporal, se capturaron escarabajos durante el ciclo anual completo pero los valores observados fueron superiores en los meses de la temporada lluviosa, observando una correlación positiva entre los niveles de precipitación mensual con la riqueza (R = 0.57, p = 0.0001) y abundancia (R = 0.55, p = 0.0001) de especies. El mes de julio presentó las abundancias más altas (n = 5262, 35.4%) y el mayor número de especies se obtuvo durante julio y agosto, ambos meses con 18 especies. Por el contrario, marzo registró la riqueza y abundancia más bajos (S = 3; n = 13) (Tabla 1, Fig. 4).
De las cuatro especies dominantes, únicamente O. landolti y O. anthracinus fueron capturadas en todos los meses de muestreo. Diez especies fueron recolectadas exclusivamente durante los meses lluviosos, de las cuales, Ca. moroni, O. batesi y Cp. corythus presentan abundancias relativamente altas y están presentes durante la mayoría de los meses de la temporada. En cambio, no se capturaron especies exclusivas en ninguno de los meses de la temporada de secas (Tabla 1).
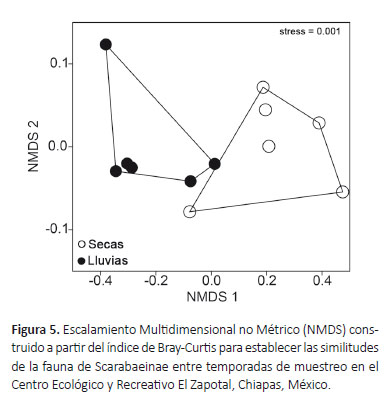
Los patrones de agrupación formados por el NMDS exponen una clara separación entre ambas temporadas de muestreo (Fig. 5), encontrando diferencias en la estructura y composición de especies (ANOSIM: R = 0.64;p = 0.005). Por lo tanto, a pesar de la baja representatividad de especies durante la temporada de secas, estos resultados sugieren que es necesario realizar muestreos anuales completos para obtener una representación faunística de escarabajos coprófagos adecuada.
La precipitación es una variable ambiental importante que permite explicar la distribución y los cambios en los patrones de riqueza, abundancia y composición de especies en los ensambles de los escarabajos de la subfamilia Scarabaeinae (Halffter & Edmonds 1982). En diversas zonas de la región Neotropical la estacionalidad marcada por los niveles de precipitación desempeña un papel determinante en la distribución de los escarabajos coprófagos, encontrándose la mayor diversidad de especies durante la estación lluviosa (Andresen 2005, Navarrete & Halffter 2008, Sánchez-de-Jesús et al. 2016). Esto se debe a que las condiciones de humedad y temperatura son trascendentales en el aprovechamiento del recurso alimenticio y la reproducción de estos escarabajos (Halffter & Edmonds 1982). Mientras que factores relacionados con ambientes secos pueden inducir alteraciones en la estructura de la comunidad, principalmente, en la reducción de la riqueza y cambios en la composición de especies (Andresen 2005).
Sin embargo, los ritmos estacionales no influyen en la presencia o ausencia de algunas especies de la subfamilia, sobre todo en aquellas que presentan hábitos generalistas, ya que pueden hacer uso de una mayor oferta de recursos (Halffter & Favila 1993), como ocurre con las cuatro especies dominantes en el presente trabajo, las cuales se distribuyen ampliamente en la región y se han recolectado con distintos tipos de atrayentes (Navarrete & Halffter 2008, Sánchez-de-Jesús et al. 2016, Sánchez-Hernández et al. 2018, Santos-Heredia et al. 2018).
En conclusión, a pesar de mantener solo un remanente aislado de vegetación primaria y la constante presión antrópica de la urbanización y sus efectos indeseados, el Centro Ecológico y Recreativo El Zapotal alberga una buena representación faunística de Scarabaeinae a nivel regional. En gran medida esto es posible gracias a la presencia de los mamíferos nativos de la región chiapaneca que se mantienen en cautiverio dentro del ZooMAT, principalmente especies de talla mediana a grande como el ocelote (Leopardus pardalis), jaguar (Panthera onca),tapir centroamericano (Tapirus bairdii), mono aullador(Alouatta palliata), venado cola blanca (Odocoileus virginianus) y pecarí (Pecari tajacu), entre otros, ya que su presencia en el ecosistema está correlacionada con estos escarabajos y son impulsores sustanciales de la estructura de los ensambles de los Scarabaeinae (Bogoni et al. 2016), de modo que estas especies proveen los recursos para la alimentación y nidificación de forma constante, permitiendo que la comunidad de escarabajos coprófagos de la subfamilia Scarabaeinae mantenga poblaciones estables en la mayoría de los meses del año.
Por lo tanto, es importante proponer estrategias quepermitan conservar los remanentes de vegetación primaria como El Zapotal, ya que tienen la capacidad de albergar una alta diversidad de especies, principalmente por laconstante presión antrópica ejercida por su cercanía conla zona urbana, pues a medida que estas áreas se expanden en el territorio, la biodiversidad urbana y periurbanase vuelve más susceptible a desaparecer (Ramírez-Restrepo & Halffter 2016; Taboada-Verona et al. 2019).
Lista anotada de las especies de Scarabaeinae de la Reserva El Zapotal, Chiapas
TRIBU ATEUCHINI PERTY, 1830
1. Ateuchus rodriguezi (De Borre, 1886)
Distribución mensual: Se recolectaron 121 individuos (0.81%) durante abril (2), mayo (2), junio (3), julio (15), agosto (9), septiembre (36), octubre (42), noviembre (8), diciembre (2) y enero (2). Tipos de vegetación:selva mediana subperennifolia, selva alta perennifolia, bosque de pino, vegetación secundaria, pastizal, cultivos de frutales y de café (Thomas 1993, Kohlmann 1984, 1997, Arellano et al. 2008, 2013, Cancino-López et al. 2014). Distribución estatal: Chiapas, Colima, Durango, Guerrero, México, Michoacán, Morelos, Nayarit, Oaxaca, Sinaloa (Kohlmann 1984, 1997).
2. Scatimus ovatus Harold, 1862
Distribución mensual: Se capturaron solo tres individuos (0.02%) durante julio (1) y agosto (2). Tipos de vegetación: selva mediana subperennifolia, selva alta perennifolia, bosque de pino-encino, bosque mesófilo de montaña y pastizal (Thomas 1993, Génier & Kohlmann 2003, Navarrete & Halffter 2008a, Arellano et al. 2008, 2013). Distribución estatal: Chiapas, Colima, Durango, Guerrero, Jalisco, Michoacán, Morelos, Oaxaca, Veracruz (Génier & Kohlmann 2003).
3. Uroxys deavilai Delgado & Kohlmann, 2007
Distribución mensual: Se capturaron 54 individuos (0.36%) durante febrero (1), mayo (1), junio (3), julio (6), agosto (24), septiembre (5), octubre (9) y noviembre (3) y enero (2). Tipos de vegetación: selva baja caducifolia y acahual (Delgado & Kohlmann 2007, Arellano et al. 2008, 2013). Distribución estatal: Chiapas, Guerrero, Jalisco, Quintana Roo, Tamaulipas, Veracruz, Yucatán (Delgado & Kohlmann 2007).
4. Uroxys microcularis Howden & Young, 1981
Distribución mensual: Se obtuvieron 39 individuos (0.26%) durante junio (4), julio (1), agosto (18), septiembre (7), octubre (6) y noviembre (3). Tipos de vegetación: selva mediana subperennifolia, selva alta perennifolia, acahual y cultivo de café (Delgado & Kohlmann 2007, Navarrete & Halffter 2008a). Distribución estatal: Chiapas, Veracruz, Yucatán (Delgado & Kohlmann 2007).
TRIBU COPRINI LEACH, 1815
5. Canthidium moroni Kohlmann & Solís, 2006
Distribución mensual: Se capturaron 26 individuos (0.17%) durante mayo (2), junio (1), julio (2), agosto (6), septiembre (8) y octubre (7). Tipos de vegetación: Bosque de pino y pino-encino (Kohlmann & Solís 2006). Distribución estatal: Chiapas y Quintana Roo (Kohlmann & Solís 2006).
6. Canthidium pseudoperceptibile Kohlmann & Solís, 2006
Distribución mensual: Se obtuvieron en total 73 individuos (0.49%) durante los meses de abril (2), mayo (2), junio (25), julio (7), agosto (7), septiembre (12), octubre (17) y noviembre (1). Tipos de vegetación: selva baja caducifolia, selva alta perennifolia, bosque mesófilo de montaña y acahual (Kohlmann & Solís 2006). Distribución estatal: Chiapas y Veracruz (Kohlmann & Solís 2006).
7. Copris laeviceps Harold, 1862
Distribución mensual: Se capturaron 1215 individuos (8.17%) durante febrero (1), marzo (3), mayo (22),junio (30), julio (38), agosto (835), septiembre (89), octubre (157), noviembre (35), diciembre (3) y enero (2). Tipos de vegetación: selva baja caducifolia, selva medianasubperennifolia, selva alta perennifolia, pastizal, acahual,cultivos de café y de cacao (Morón et al. 1985, Palacios-Ríos et al. 1990, Thomas 1993, Arellano et al. 2008, Navarrete & Halffter 2008a, Arellano et al. 2013). Distribución estatal: Campeche, Chiapas, México, Oaxaca, Puebla,Quintana Roo, San Luis Potosí, Veracruz (Matthews 1961,Morón-Ríos & Morón 2016, Darling & Génier 2018).
8. Copris lugubris Boheman, 1858
Distribución mensual: Se capturó un solo individuo (0.007%) durante septiembre. Tipos de vegetación: selva baja caducifolia, selva mediana subperennifolia, selva alta perennifolia, bosque mesófilo de montaña y pastizal inducido (Morón et al. 1985, Palacios-Ríos et al. 1990, Thomas, 1993; Navarrete & Halffter 2008a, Are-llano et al. 2008, 2013, Blas-López & Gómez 2009). Distribución estatal: Campeche, Chiapas, Coahuila, Colima, Durango, Guerrero, Guanajuato, Hidalgo, Jalisco, México, Michoacán, Morelos, Nayarit, Oaxaca, Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Tabasco, Tamaulipas, Vera-cruz, Yucatán (Darling & Génier 2018, Matthews 1961, Morón-Ríos & Morón 2016).
9. Dichotomius amplicollis Harold, 1869
Distribución mensual: Se capturaron 155 individuos (1.04%) durante los meses de mayo (9), junio (19), julio (29), agosto (66), septiembre (6), octubre (21) y noviembre (5). Tipos de vegetación: selva mediana subperennifolia, selva alta perennifolia, bosque mesó-filo de montaña, pastizal, acahual, cultivos de café y de cacao (Morón et al. 1985, Halffter et al. 1992, Thomas 1993, López-Guerrero 2005; Arellano et al. 2008, 2013, Navarrete & Halffter 2008a, Blas-López & Gómez 2009). Distribución estatal: Campeche, Chiapas, Chihuahua, Guerrero, Hidalgo, Jalisco, Michoacán, Morelos, Nayarit, Oaxaca, Puebla, Sinaloa, Veracruz (López-Guerrero 2005, Morón-Ríos & Morón 2016).
10. Dichotomius colonicus Say, 1835
Distribución mensual: Se obtuvo un solo individuo (0.007%) durante el mes de agosto. Tipos de vegetación: bosque mesófilo de montaña, pastizal y zonas hortícolas (Castro-Ramírez et al. 2003, Arellano et al. 2008, 2013, Delgado et al. 2012). Distribución estatal: Aguas-calientes, Baja California Sur, Campeche, Coahuila, Colima, Chiapas, Chihuahua, Distrito Federal, Durango, Guanajuato, Guerrero, Hidalgo, Jalisco, México, Michoacán, Morelos, Nayarit, Nuevo León, Oaxaca, Puebla, Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Tabasco, Tamaulipas, Tlaxcala, Veracruz, Yucatán, Zacatecas (Kohlmann 2003, López-Guerrero 2005).
TRIBU DELTOCHILINI LACORDAIRE, 1856
11. Canthon cyanellus LeConte, 1859
Distribución mensual: Se capturaron 616 individuos (4.14%) durante abril (3), mayo (10), junio (81), julio (43), agosto (82), septiembre (97), octubre (164), noviembre (34) y enero (2). Tipos de vegetación: selva baja caducifolia, selva mediana subperennifolia, selva alta perennifolia, bosque mesófilo de montaña, acahual, pastizal, cultivos de café y de cacao (Morón et al. 1985, Palacios-Ríos et al. 1990, Halffter et al. 1992, Thomas 1993, Navarrete & Halffter 2008a, Arellano et al. 2008, 2013, Blas-López & Gómez 2009). Distribución estatal: Campeche, Chiapas, Guerrero, Nuevo León, Tamaulipas, Veracruz (Solís & Kohlmann 2002, Halffter 2003, Morón-Ríos & Morón 2016).
12. Canthon femoralis Chevrolat, 1834 TRIBU ONTHOPHAGINI BURMEISTER, 1846
Distribución mensual: Se recolectaron 4646 individuos (31.25%) durante febrero (2), abril (5), mayo (160),junio (59), julio (1127), agosto (1161), septiembre (833),octubre (1012), noviembre (255), diciembre (24) y enero (8). Tipos de vegetación: selva baja caducifolia, selvamediana subperennifolia, selva alta perennifolia, acahual,pastizal y cultivos de café (Rivera-Cervantes & Halffter1999, Morón et al. 1985, Palacios-Ríos et al. 1990, Thomas1993, Navarrete & Halffter 2008a; Arellano et al. 2013). Distribución estatal: Campeche, Chiapas, Colima, Guerrero, Jalisco, México, Nayarit, Oaxaca, Puebla, San LuisPotosí, Sinaloa, Tabasco, Tamaulipas, Veracruz (Rivera-Cervantes & Halffter 1999, Morón-Ríos & Morón 2016).
13. Canthon vazquezae (Martínez, Halffter & Halffter, 1964)
Distribución mensual: Se registraron 277 individuos (1.86%) durante febrero (1), abril (2), mayo (14), junio (110), julio (49), agosto (55), septiembre (8), octubre (32) y noviembre (6). Tipos de vegetación: selva mediana subperennifolia, bosque mesófilo de montaña, acahual y cultivo de café (Palacios-Ríos et al. 1990, Rivera-Cervantes & Halffter 1999, Arellano et al. 2008, Blas-López & Gómez 2009). Distribución estatal: Campeche,Chiapas, Veracruz (Rivera-Cervantes & Halffter 1999, Morón-Ríos & Morón 2016).
14. Deltochilum scabriusculum Bates, 1887
Distribución mensual: Se capturaron tres individuos
(0.02) durante mayo (2) y julio (1). Tipos de vegetación:selva baja caducifolia, selva mediana subperennifolia, selva alta perennifolia y bosque de pino-encino (Morón et al.1985, Palacios-Ríos et al. 1990, Halffter et al. 1992, Thomas 1993, Halffter 2003, Arellano et al. 2008, 2013, Navarrete & Halffter 2008a). Distribución estatal: Campeche, Chiapas, Colima, Durango, Guerrero, Hidalgo, México,Morelos, Nayarit, Nuevo León, Oaxaca, Puebla, Querétaro,Quintana Roo, San Luis Potosí, Sinaloa, Sonora, Veracruz,Yucatán (Morón & Márquez 2012, Génier 2012).
15. Deltochilum sublaeve Bates, 1887
Distribución mensual: Solo se registraron seis individuos (0.04%) durante mayo (1), junio (3), agosto (1) y septiembre (1). Tipos de vegetación: selva baja caducifolia, selva mediana subperennifolia, selva alta perennifolia, bosque mesófilo de montaña, acahual, pastizal, cultivos de café y cacao (Morón et al. 1985, Morón 1987, Halffter et al. 1992, Palacios-Ríos et al. 1990, Navarrete & Halffter 2008a, Blas-López & Gómez 2009, Arellano et al. 2013, Cancino-López et al. 2014). Distribución estatal: Campeche, Chiapas, Colima, Durango, Guerrero, Hidalgo, Jalisco, Morelos, Nayarit, Puebla, Quintana Roo, Sinaloa, San Luis Potosí, Sonora, Tamaulipas, Veracruz, Yucatán (González-Alvarado & Vaz-de-Mello 2014, Halffter 2003, Morón-Ríos & Morón 2016).
TRIBU ONTHOPHAGINI BURMEISTER, 1846
16. Onthophagus anthracinus Harold, 1873
Distribución mensual: Se obtuvieron 6210 individuos (41.77%) durante febrero (11), marzo (5), abril (46), mayo (39), junio (196), julio (3157), agosto (621), septiembre (911), octubre (968), noviembre (165), diciembre (41) y enero (50). Tipos de vegetación: bosque mesófilo de montaña, bosque de pino-encino y cultivo de maíz (Thomas 1993, Coutiño-Ramos et al. 2005, Cancino-López et al. 2014). Distribución estatal: Chiapas, Guanajuato, Oaxaca, Puebla, Veracruz (Zunino 2003, Pulido-Herrera & Zunino 2007).
17. Onthophagus batesi Howden & Cartwright, 1963
Distribución mensual: Se capturaron 60 individuos (0.4%) durante junio (5), julio (2), agosto (36), septiembre (7), octubre (9) y enero (1). Tipos de vegetación:selva baja caducifolia, selva mediana subperennifolia, selva alta perennifolia, bosque de pino-encino-liquidámbar y pastizal (Howden & Cartwright 1963, Palacios-Ríos et al. 1990, Halffter et al. 1992, Thomas 1993, Arellano et al. 2008, 2013, Navarrete & Halffter 2008a, Delgado et al. 2012). Distribución estatal: Chiapas, Colima, Guerrero, Hidalgo, Jalisco, Morelos, Oaxaca, Puebla, San Luis Potosí, Tabasco, Tamaulipas, Veracruz, Yucatán (Zunino 2003, Pulido-Herrera & Zunino 2007).
18. Onthophagus landolti Harold, 1880
Distribución mensual: Representado por 1267 individuos (8.52%) durante febrero (7), marzo (5), abril (24), mayo (21), junio (19), julio (781), agosto (104), septiembre (160), octubre (118), noviembre (5), diciembre (7) y enero (16). Tipos de vegetación: selva mediana subperennifolia, selva alta perennifolia, bosque mesófilo de montaña, acahual y pastizal (Halffter et al. 1992, Thomas 1993; Arellano et al. 2013). Distribución estatal: Chiapas, Guanajuato, Oaxaca, Puebla, Veracruz (Zunino 2003, Pulido-Herrera & Zunino 2007).
19. Onthophagus sp.
Distribución mensual: Únicamente se obtuvieron tres individuos (0.02%) durante junio (1), julio (1) y agosto (1). Por la poca representatividad de la especie, no fue posible la revisión de caracteres que permitieran determinar la identidad precisa.
Con los caracteres revisados, se asume una afinidad a O. tapirus, especie distribuida en Costa Rica y Nicaragua (Kohlmann & Solís 2001).
TRIBU PHANAEINI HOPE, 1838
20. Coprophanaeus corythus Harold, 1863
Distribución mensual: se capturaron únicamente seis individuos (0.04%) durante los meses de mayo (1),junio (3), agosto (1) y octubre (1). Tipos de vegetación: selva mediana subperennifolia, selva alta perennifolia, bosque mesófilo de montaña, acahual, pastizal, cultivos de café y de cacao (Morón et al. 1985, Morón1987, Palacios-Ríos et al. 1990, Halffter et al. 1992;Coutiño-Ramos et al. 2005; Arellano et al. 2008, 2013,Navarrete & Halffter 2008a, Blas-López & Gómez 2009,Cancino-López et al. 2014). Distribución estatal: Campeche, Chiapas, Hidalgo, Oaxaca, Puebla, Tabasco,Veracruz (Edmonds & Zidek 2010, Lizardo et al. 2017,Morón-Ríos & Morón 2016).
21. Phanaeus endymion Harold, 1863
Distribución mensual: Se obtuvieron 86 individuos (0.58%) durante junio (8), julio (5), agosto (22),septiembre (19), octubre (28) y noviembre (4). Tipos de vegetación: selva mediana subperennifolia, selvaalta perennifolia, bosque mesófilo de montaña, bosquede pino, bosque de pino-encino-liquidámbar, acahual,pastizal, cultivos de café y cacao (Morón et al. 1985, Morón 1987, Palacios-Ríos et al. 1990, Halffter et al. 1992,Thomas 1993, Navarrete & Halffter 2008a, Blas-López& Gómez 2009, Delgado et al. 2012, Arellano et al. 2013,Cancino-López et al. 2014). Distribución estatal: Campeche, Chiapas, Jalisco, Michoacán, Nayarit, Oaxaca,Puebla, Quintana Roo, Tabasco, Veracruz, Yucatán (Edmonds & Zidek 2012, Morón-Ríos & Morón 2016, Lizardo et al. 2017).
TRIBU SISYPHINI MULSANT, 1842
22. Sisyphus mexicanus Harold, 1863
Distribución mensual: Especie representada por un solo individuo (0.007%) capturado durante el mes de agosto. Tipos de vegetación: selva alta perennifolia, selva mediana subperennifolia, vegetación secundaria, pastizal inducido (Morón 2003, Gómez & Chamé-Vázquez 2003). Distribución estatal: Chiapas, Oaxaca, Quintana Roo, Tamaulipas, Veracruz (Morón & Márquez 2012).
Agradecimientos:
Agradecemos al personal técnico de la curaduría de mamíferos del ZooMAT por todas las facilidades que permitieron el desarrollo del trabajo, en especial a Epigmenio Cruz Aldán, por el apoyo logístico durante cada evento de muestreo. A Rolando Dávila Sánchez por su ayuda en la elaboración del mapa del área de estudio.
Rol de los autores:
MER-L: Organizó la logística, realizó el trabajo de campo, la determinación taxonómica y la base de datos. GS-H: determinación taxonómica, analizó los datos y redactó el manuscrito. BG: Realizó la determinación taxonómica, conceptualización y diseño del trabajo de campo. MER-L, GS-H, BG: revisaron y aprobaron el manuscrito.
Conflicto de intereses:
Los autores no incurren en conflictos de intereses.
Fuentes de financiamiento:
El presente trabajo se realizó gracias al Financiamiento de El Colegio de la Frontera Sur.
Aspectos éticos / legales:
La dirección del Parque Ecológico y Recreativo El Zapotal proporcionó los permisos necesarios para los muestreos del presente trabajo.
Citación:
Rodríguez-López M.E., G. Sánchez-Hernández, B. Gómez. 2019. Escarabajos coprófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en la reserva El Zapo- tal, Chiapas, México. Revista peruana de biología 26(3): 339 -350 (Septiembre 2019). doi: http://dx.doi.org/10.15381/rpb.v26i3.16778
Literatura citada
Arellano L., J.L. León-Cortes & G. Halffter. 2008. Response of dung beetle assemblages to landscape structure in remnant natural and modified habitats in southern Mexico. Insect Conservation and Diversity 1:253–262. doi: https://doi.org/10.1111/j.1752-4598.2008.00033.x [ Links ]
Arellano L., J.L. León-Cortes, G. Halffter & J. Montero. 2013. Acacia woodlots, cattle and dung beetles (Coleoptera: Scarabaeinae) in a Mexican silvopastoral landscape. Revista Mexicana de Biodiversidad 84:650–660. doi: https://doi.org/10.7550/rmb.32911 [ Links ]
Andresen E. 2005. Effects of season and vegetation type on community organization of dug beetles in a tropical dry forest. Biotropica 37(2): 291–300. doi: https://doi.org/10.1111/j.1744-7429.2005.00039.x [ Links ]
Bogoni J.A., M.E. Graipel, P.V. De Castilho, F.M. Fantacini, V.V. Kuhnen, M.R. Luiz, T.B. Maccarini, C.B. Marcon, C.S.P. Teixeira, M.A. Tortato, F.Z. Vaz-de-Mello & M.I.M. Hernández. 2016. Contributions of the mammal community, habitat structure, and spatial distance to dung beetle community structure. Biodiversity and Conservation 25(9):1661–1675. doi: https://doi.org/10.1007/s10531-016-1147-1 [ Links ]
Bouchard P., Y. Bousquet, A.E. Davies, M.A. Alonso-Zarazaga, J.F. Lawrence, C.H.C.A. Lyal, F. Newton, C.A.M. Reid, M. Schmitt, S.A. Ślipiński & A.B.T. Smith. 2011. Family-group names in Coleoptera (Insecta). ZooKeys 88:1–972. doi: https://doi.org/10.3897/zookeys.88.807 [ Links ]
Blas-López M. & B. Gómez. 2009. Escarabajos (Coleoptera: Scarabaeidae). En: A. Riechers, J.E. Morales & E. Hernández, eds. Laguna Bélgica: Patrimonio Natural e Interpretación Ambiental. Instituto de Historia Natural, Chiapas, pp. 75–87. [ Links ]
Cancino-López R.J., E.R. Chamé-Vázquez & B. Gómez. 2014. Escarabajos necrófilos (Coleoptera: Scarabaeidae: Scarabaeinae) en tres hábitats del Volcán Tacaná Chiapas, México. Dugesiana 21(2):135–142. http://dx.doi.org/10.32870/dugesiana.v21i2.4152 [ Links ]
Castro-Ramírez A.E., J.A. Cruz-López, C. Ramírez-Salinas, H. Perales & J.A. Gómez. 2003. Manejo de la "gallina ciega" (Coleoptera: Melolonthidae) con trampas de luz en Chiapas, México. En: G. Onore, P. Reyes-Castillo & M. Zunino, coords. Escarabeidos de Latinoamérica: Estado del Conocimiento Vol. 3. Sociedad Entomológica Aragonesa, Zaragoza, pp. 81–86. [ Links ]
Chamé-Vázquez E.R. & B. Gómez. 2005. Primer registro de Canthon angustatus Harold 1867 en México (Coleoptera: Scarabaeoidea). Acta Zoológica Mexicana (n.s.) 21(3):159–160. [ Links ]
Chamé-Vázquez E.R., B. Gómez & R.J. Cancino-López. 2012. Eficiencia de dos cebos para el muestreo de coleópteros necrófagos (Scarabaeidae: Scarabaeinae) ¿calamar o pescado? Lacandonia 6(1): 85–91. [ Links ]
Chao A., K.H. Ma & T.C. Hsieh. 2016. iNEXT (iNterpolation and EXTrapolation) online: Software for interpolation and extrapolation of species diversity. Program and user's guide. <https://chao.shinyapps.io/iNEXTOnline/>. (Acceso 28/12/2018). [ Links ]
Chao A., N.J. Gotelli, T.C. Hsieh, E.L. Sander, K.H. Ma, R.K. Colwell & A.M. Ellison. 2014. Rarefaction and extrapolation with Hill numbers: a framework for sampling and estimation in species diversity studies. Ecological Monograph 84(1):45–67. doi: https://doi.org/10.1890/13-0133.1 [ Links ]
Coutiño T.A., B. Gómez & J. López-Rojas. 2005. Lista preliminar de escarabajos copronecrófagos (Coleoptera: Scarabaeinae) en el municipio de Unión Juárez, Chiapas, México. En: A. Morales, A. Mendoza, M.P. Ibarra & S. Stanford, eds. Entomología Mexicana vol. 4. Sociedad Mexicana de Entomología, México. Pp. 897–901. [ Links ]
Darling J.D.G. & F. Génier. 2018. Revision of the taxonomy and distribution of the Neotropical Copris incertus species complex (Coleoptera: Scarabaeidae: Scarabaeinae). The Canadian Entomologist 150:539–577. doi: https://doi.org/10.4039/tce.2018.32 [ Links ]
Delgado J.M., A.E. Castro-Ramírez, M.A. Morón & L. Ruiz-Montoya. 2012. Diversidad de Scarabaeoidea (Coleoptera) en las principales condiciones de hábitat de Montebello, Chiapas, México. Acta Zoológica Mexicana (n.s.) 28(1):185–210. [ Links ]
Delgado L. & B. Kohlmann. 2007. Revisión de las especies del género Uroxys Westwood de México y Guatemala (Coleoptera: Scarabaeidae: Scarabaeinae). Folia Entomológica Mexicana 46(1):1–36. [ Links ]
Edmonds W.D. & J. Zidek. 2010. A taxonomic review of the neotropical genus Coprophanaeus Olsoufieff, 1924 (Coleoptera: Scarabaeidae, Scarabaeinae). Insecta Mundi 0129:1–111. [ Links ]
Edmonds W.D. & J. Zidek. 2012. Taxonomy of Phanaeus revisited: Revised keys to and comments on species of the New World dung beetle genus Phanaeus MacLeay, 1819 (Coleoptera: Scarabaeidae: Scarabaeinae: Phanaeini). Insecta Mundi 0274:1–108. [ Links ]
Gasca-Álvarez H.J., M. Zunino & C. Deloya. 2018. The ninth brachypterous Onthophagus Latreille (Coleoptera: Scarabaeidae: Scarabaeinae) of the world: a new species from Mexico. Journal of Natural History 52(33- 34):2121–2132. doi: https://doi.org/10.1080/00222933.2018.1515382 [ Links ]
Génier F. 2012. A new species and notes on the subgenus Deltochilum (Deltochilum) Eschscholtz, 1822 (Coleoptera: Scarabaeidae: Scarabaeinae: Deltochilini). Zootaxa 3357:25–36. doi: https://doi.org/10.5281/ zenodo.213648 [ Links ]
Génier F. & B. Kohlmann. 2003. Revision of the Neotropical dung beetle genera Scatimus Erichson and Scatrichus gen. nov. (Coleoptera: Scarabaeidae: Scarabaeinae). Fabreries 28(2):57–111. [ Links ]
Gómez B. & E.R. Chamé-Vázquez. 2003. Primeros registros de Goniophileurus femoratus y Sisyphus mexicanus para Chiapas, México (Coleoptera: Scarabaeoidea). Folia Entomológica Mexicana, 42(1):103–104. [ Links ]
Gómez B., C. Pozo, L.F. de la Mora-Estrada, M.R. Domínguez, M.E. Rodríguez-López & L. Ruiz-Montoya. 2017. Diversidad de insectos colectados en cuatro localidades de la Reserva de la Biosfera Selva El Ocote. En: L. Ruiz- Montoya, G. Álvarez-Gordillo, N. Ramírez-Marcial & B. Cruz-Salazar, eds. Vulnerabilidad social y biológica ante el cambio climático en la Reserva de la Biosfera Selva El Ocote. El Colegio de la Frontera Sur, Chiapas, pp. 171–254. [ Links ]
González-Alvarado A. & F.Z. Vaz-de-Mello. 2014. Taxonomic review of the subgenus Hybomidium Shipp 1897 (Coleoptera: Scarabaeidae: Scarabaeinae: Deltochilum). Annales de la Société Entomologique de France (N.S.) 50(3-4):431–476. doi: https://doi.org/10.1080/00379271.2014.989178 [ Links ]
Halffter G. 1991. Historical and ecological factors determining the geographical distribution of beetles (Coleoptera. Scarabaeidae. Scarabaeinae). Folia Entomológica Mexicana, 82:195–238. [ Links ]
Halffter G. 2003. Tribu Scarabaeini. En: M.A. Morón, ed. Atlas de los escarabajos de México, Coleoptera: Lamellicornia. Volumen II. Familias Scarabaeidae, Trogidae, Passalidae y Lucanidae. Argania Editio, Barcelona, pp. 20–42. [ Links ]
Halffter G, M.E. Favila & V. Halffter. 1992. A comparative study of the structure of the scarab guild in Mexican tropical rain forests and derived ecosystems. Folia Entomológica Mexicana 84:131–156. [ Links ]
Halffter G. & M.E. Favila. 1993. The Scarabaeinae (Insecta: Coleoptera) an animal group for analyzing, inventorying and monitoring biodiversity in tropical rainforest and modified landscapes. Biology International 27:15–21. [ Links ]
Halffter G., M. Zunino, V. Moctezuma & J.L. Sánchez-Huerta. 2019. The integration processes of the distributional patterns in the Mexican Transition Zone: Phyletic, paleogeographic and ecological factors of a case study. Zootaxa 4586(1):001–034. http://dx.doi.org/10.11646/zootaxa.4586.1.1 [ Links ]
Halffter V. & G. Halffter. 2009. Nuevos datos sobre Canthon (Coleoptera: Scarabaeinae) de Chiapas, México. Acta Zoológica Mexicana (n.s.) 25(2):397–407. [ Links ]
Hammer O., D.A.T. Harper & P.D. Ryan. 2001. PAST: Paleontological statistics software package for education and data analysis. Paleontologia Electronica 4:1–9. https://palaeo-electronica.org/2001_1/past/past.pdf [ Links ]
Hanski I. & Y. Cambefort. 1991. Dung Beetles Ecology. Princeton University Press New Jersey. 481 p. [ Links ]
Hernández B. & J.L. Navarrete-Heredia. 2018. Annotated checklist and biogeographical affinities of Scarabaeinae beetles from Los Altos de Jalisco region, Mexico. Southwestern Entomologist 43(1):131–149. doi: https://doi.org/10.3958/059.043.0130 [ Links ]
Howden H.F. & O.L. Cartwright. 1963. Scarab beetles of the genus Onthophagus Latreille north of Mexico (Coleoptera: Scarabaeidae). Proceedings of the United States National Museum 114:1–143. [ Links ]
Joaqui T., V. Moctezuma, J.L. Sánchez-Huerta & F. Escobar. 2019. The Onthophagus fuscus (Coleoptera: Scarabaeidae) species complex: an update and the description of a new species. Zootaxa 4555(2):151–186. http://dx.doi.org/10.11646/zootaxa.4555.2.1 [ Links ]
Jost L. 2006. Entropy and diversity. Oikos 113(2):363–375. doi: https://doi.org/10.1111/j.2006.0030-1299.14714.x [ Links ]
Kohlmann B. & A. Solís. 2001. El género Onthophagus (Coleoptera: Scarabaeidae) en Costa Rica. Giornale Italiano di Entomologia 49(9):159–261. [ Links ]
Kohlmann B. & A. Solís. 2006. El género Canthidium (Coleoptera: Scarabaeidae) en Norteamérica. Giornale Italiano di Entomologia 11:235–295. [ Links ]
Kohlmann B. 1984. Biosistemática de las especies norteamericanas del género Ateuchus (Coleoptera: Scarabaeidae: Scarabaeinae). Folia Entomológica Mexicana 60:3–81. [ Links ]
Kohlmann B. 1997. The Costa Rican species of Ateuchus (Coleoptera: Scarabaeidae). Revista de Biología Tropical, 44(3) 45(1):177–192. [ Links ]
Larsen T.H. & A. Forsyth. 2005. Trap spacing and transect design for dung beetle biodiversity studies. Biotropica 37(2):322–325. doi:doi: https://doi.org/10.1111/j.1744-7429.2005.00042.x
Lizardo V., F. Escobar & O. Rojas-Soto. 2017. Diversity and distribution of Phanaeini (Coleoptera: Scarabaeidae: Scarabaeinae) in Mexico. Zootaxa 4358(2):271–294. doi: https://doi.org/10.11646/zootaxa.4358.2.3 [ Links ]
López-Guerrero I. 2005. Los Dichotomius (Coleoptera: Scarabaeinae, Dichotomiini) de la fauna de México. Boletín de la Sociedad Entomológica Aragonesa 36:195–209. [ Links ]
Matthews E.G. 1961. A revision of the genus Copris of the western hemisphere. Entomologica Americana 41:1–139. [ Links ]
Melliger, R.L., B. Braschler, H.P. Rusterholz & B. Baur. 2018. Diverse effects of degree of urbanisation and forest size on species richness and functional diversity of plants, and ground surface-active ants and spiders. PLoS ONE 13(6): e0199245. doi: https://doi.org/10.1371/journal.pone.0199245 [ Links ]
Moctezuma V., C. Deloya, J.L. Sánchez-Huerta & G. Halffter. 2019a. A new species of the Phanaeus endymion species group (Coleoptera: Scarabaeidae: Scarabaeinae), with comments on ecology and distribution. Annales de la Societé entomologique de France (N.S.) 55(3):249–254. doi: https://doi.org/10.1080/00379271.2019.1577170 [ Links ]
Moctezuma V., J.L. Sánchez-Huerta & G. Halffter. 2019b. New species of Canthidium (Coleoptera: Scarabaeidae: Scarabaeinae) from Mexico. The Canadian Entomologists 151(4):432–441 doi: https://doi.org/10.4039/tce.2019.25 [ Links ]
Morales C.J., R. Ruiz & L. Delgado. 2004. Primer registro de Euoniticellus intermedius (Reiche, 1849) y datos nuevos de distribución de Digitonthophagus gazella (Fabricius, 1787) (Coleoptera: Scarabaeidae) e Hybosorus illigeri Reiche, 1853 (Coleoptera: Hybosoridae) para el estado de Chiapas. Dugesiana 11(2):21–23. http://dx.doi.org/10.32870/dugesiana.v11i2.3803 [ Links ]
Morón M.A. 1987. The necrophagous Scarabaeinae beetles from a coffee plantation in Chiapas, Mexico: habits and phenology. The Coleopterists Bulletin 41(3):225–232. [ Links ]
Morón M.A. 2003. Subtribu Sisyphini. En: M.A. Morón, ed. Atlas de los escarabajos de México, Coleoptera: Lamellicornia. Volumen II. Familias Scarabaeidae, Trogidae, Passalidae y Lucanidae. Argania Editio, Barcelona, pp. 43–44. [ Links ]
Morón M.A., F.J. Villalobos & C. Deloya. 1985. Fauna de coleópteros lamelicornios de Boca del Chajul, Chiapas, México. Folia Entomológica Mexicana 66:57–118. [ Links ]
Morón-Ríos A. & M.A. Morón. 2016. Evaluación de la fauna de Coleoptera Scarabaeoidea en la Reserva de la Biósfera de Calakmul, Campeche, México. Southwestern Entomologist 41(2):468–484. doi: https://doi.org/10.3958/059.041.0217 [ Links ]
Morón M.A. & J. Márquez. 2012. Nuevos registros estatales y nacionales de escarabajos (Coleoptera: Scarabaeoidea) y comentarios sobre su distribución. Revista Mexicana de Biodiversidad 83:698–711. http://dx.doi.org/10.7550/rmb.28386 [ Links ]
Navarrete D.A. & G. Halffter. 2008a. Dung beetle (Coleoptera: Scarabaeidae: Scarabaeinae) diversity in continuous forest, forest fragments and cattle pastures in a landscape of Chiapas, Mexico: the effects of anthropogenic changes. Biodiversity and Conservation 17: 2869–2898. doi: https://doi.org/10.1007/s10531-008-9402-8 [ Links ]
Navarrete D.A. & G. Halffter. 2008b. Nuevos registros de escarabajos copro-necrófagos (Coleoptera: Scarabaeidae: Scarabaeinae) para México y Chiapas. Acta Zoológica Mexicana (n.s.) 24(1):247–250. [ Links ]
Nichols E., S. Spector, J. Louzada, T. Larsen, S. Amezquita & M.E. Favila. 2008. Ecological functions and ecosystem services provided by Scarabaeinae dung beetles. Biological Conservation, 141:1461–1474. doi: https://doi.org/10.1016/j.biocon.2008.04.011 [ Links ]
Nichols, E., T. Larsen, S. Spector, A.L.V. Davis, F. Escobar, M. Favila & K. Vulenic. 2007. Global dung beetle response to tropical forest modification and fragmentation: A quantitative literature review and meta-analysis. Biological Conservation, 137:1–19. doi: https://doi.org/10.1016/j.biocon.2007.01.023 [ Links ]
Palacios-Espinosa E., C.R. Beutelspacher & O. Sarmiento-Cortez. 2016. Vegetación y flora del Parque Ecológico y Recreativo El Zapotal, Tuxtla Gutiérrez, Chiapas, México. Lacandonia 10(1):37–86. [ Links ]
Palacios-Ríos M., V. Rico-Gray & E. Fuentes. 1990. Inventario preliminar de los Coleoptera Lamellicornia de la zona de Yaxchilán, Chiapas, México. Folia Entomológica Mexicana 78:49–60. [ Links ]
Pulido-Herrera L.A. & M. Zunino. 2007. Catálogo preliminar de los Onthophagini de América (Coleoptera: Scarabaeinae). En: M. Zunino y A. Melic, eds. Escarabajos, diversidad y conservación biológica. Ensayos en homenaje a Gonzalo Halffter. Monografías Tercer Milenio vol. 7. Sociedad Entomológica Aragonesa, Zaragoza, pp. 93–129. [ Links ]
Ramírez-Restrepo L. & G. Halffter. 2016. Copro-necrophagous beetles (Coleoptera: Scarabaeinae) in urban areas: A global review. Urban Ecosystems 19(3):1179–1195. doi: https://doi.org/10.1007/s11252-016-0536-2 [ Links ]
Rivera-Cervantes L.E. & G. Halffter. 1999. Monografía de las especies mexicanas de Canthon del subgénero Glaphyrocanthon (Coleoptera: Scarabaeidae: Scarabaeinae). Acta Zoológica Mexicana (n.s.) 77:23–150. [ Links ]
Sánchez-de-Jesús H., V. Arroyo-Rodríguez, E. Andresen & F. Escobar. 2016. Forest loss and matrix composition are the major drivers shaping dung beetle assemblages in a fragmented rainforest. Landscape Ecology 31:843–854. doi: https://doi.org/10.1007/s10980-015-0293-2 [ Links ]
Sánchez-Hernández G., B. Gómez, L. Delgado & M.E. Rodríguez- López. 2017. Primer registro de Onthophagus longimanus Bates, 1887 (Coleoptera: Scarabaeidae: Scarabaeinae) en Chiapas, México. Dugesiana 24(1):57–59. http://dx.doi.org/10.32870/dugesiana.v24i1.6236 [ Links ]
Sánchez-Hernández G., B. Gómez, L. Delgado, M.E. Rodríguez- López & E.R. Chamé-Vázquez. 2018. Diversidad de escarabajos copronecrófagos (Coleoptera: Scarabaeidae: Scarabaeinae) en la Reserva de la Biosfera Selva El Ocote, Chiapas, México. Caldasia 40(1):144–160. doi: https://doi.org/10.15446/caldasia.v40n1.68602 [ Links ]
Sánchez-Hernández G. & B. Gómez. 2018. First precise locality data for Onthophagus atriglabrus Howden and Gill and new state record for Onthophagus anewtoni Howden and Génier (Coleoptera: Scarabaeidae: Scarabaeinae) in Mexico. The Coleopterists Bulletin 72(4):873–876. doi: https://doi.org/10.1649/0010-065X-72.4.873 [ Links ]
Sánchez-Huerta J.L., M. Zunino & G. Halffter. 2018. A new species of American Onthophagus Latreille (Coleoptera: Scarabaeidae: Scarabaeinae) associated with rodent (Geomyidae) burrows. The Coleopterists Bulletin 72(3):407–416. doi: https://doi.org/10.1649/0010-065X-72.3.407 [ Links ]
Santos-Heredia C., E. Andresen, D.A. Zárate & F. Escobar. 2018. Dung beetle and their ecological functions in three agroforestry systems in the Lacandona rainforest of Mexico. Biodiversity and Conservation 27(9):2379– 2394. doi: https://doi.org/10.1007/s10531-018-1542-x [ Links ]
Schoolmeesters P. 2019. Scarabs: World Scarabaeidae Database (version 2018-11-01). In: Y. Roskov, G. Ower, T. Orrell, D. Nicolson, N. Bailly, P.M. Kirk, T. Bourgoin, R.E. DeWalt, W. Decock, E. van Nieukerken, J. Zarucchi, L. Penev, eds. Species 2000 & ITIS Catalogue of Life, 2019 annual checklist. Netherlands. <www.catalogueoflife.org/col> (Acceso 28/06/2019). [ Links ]
SMN (Servicio Meteorológico Nacional). 2018. (en línea). Proyecto de base de datos Climatológicos. Comisión Nacional del Agua. <http://smn.cna.gob.mx/tools/RESOURCES/Mensuales/chis/00007392.TXT> (Acceso 28/12/2018). [ Links ]
Solís A & B Kohlmann. 2002. El género Canthon (Coleoptera: Scarabaeidae) en Costa Rica. Giornale Italiano di Entomologia 10:1–68. [ Links ]
Spector, S. 2006. Scarabaeine dung beetles (Coleoptera: Scarabaeidae: Scarabaeinae): an invertebrate focal taxon for biodiversity research and conservation. The Coleopterists Bulletin, 60:71–83. doi: https://doi.org/10.1649/0010-065X(2006)60[71:SDBCSS]2.0.CO;2 [ Links ]
Taboada-Verona C., C. Sermeño-Correa, O. Sierra-Serrano & J.A. Noriega. 2019. Checklist of the superfamily Scarabaeoidea (Insecta, Coleoptera) in an urban area of the Caribbean Colombia. Check List 15(4): 579–594. doi: https://doi.org/10.15560/15.4.579 [ Links ]
Thomas D.B. 1993. Scarabaeidae (Coleoptera) of the chiapanecan forests: a faunal survey and chorographic analysis. The Coleopterists Bulletin 47(4):363–408. [ Links ]
Vaz-de-Mello F.Z., W.D. Edmonds, F.C. Ocampo & P. Schoolmeesters. 2011. A multilingual key to the genera and subgenera of the subfamily Scarabaeinae of the new world (Coleoptera: Scarabaeidae). Zootaxa 2854:1–73. http://dx.doi.org/10.11646/zootaxa.2854.1.1 [ Links ]
Zunino M. 2003. Tribu Onthophagini. En: M.A. Morón, ed. Atlas de los escarabajos de México, Coleoptera: Lamellicornia. Volumen II. Familias Scarabaeidae, Trogidae, Passalidae y Lucanidae. Argania Editio, Barcelona, pp. 66–74. [ Links ]
Otros datos de los autores / biografía:
ORCID Edivaldo Rodríguez-López:
0000-0003-3192-5287
ORCID Gibrán Sánchez-Hernández:
0000-0002-0152-1380
ORCID Benigno Gómez:
0000-0002-7260-6744
Correspondencia:
*Autor para correspondencia
M. E. Rodríguez-López: edivaldo.rguez@gmail.com
G. Sánchez-Hernández: gisah16@gmail.com
B. Gómez: bgomez@ecosur.mx
Presentado: 24/01/2019
Aceptado: 17/07/2019
Publicado online: 30/09/2019