Introducción
De las catorce especies del género Telmatobius presentes en Argentina, solamente tres se distribuyen en la provincia de Salta, entre las cuales Telmatobius atacamensisGallardo, 1962 constituye un microendemismo de la región puneña (Acosta et al. 2014, Lavilla & Barrionuevo 2005, Frost 2019). Este anuro raro, tanto geográfica como demográficamente, actualmente se encuentra en declinación (Vaira et al. 2012). Su localidad tipo está restringida a San Antonio de Los Cobres (24°12’15.63”S, 66°21’15.63”W, 3994 m de altitud). Aunque se ha sugerido que está probablemente extinta en esta localidad (Lavilla & Cei 2001, IUCN 2019), recientemente se han registrado poblaciones en cercanías de San Antonio de los Cobres (Acosta obs. pers.) y en el río Los Patos (Barrionuevo & Mangione 2006, Acosta obs. pers.), tributario del río San Antonio.
Telmatobius atacamensis ha sido registrado en localidades de la ecorregión de Puna - complejo Puna Árida, caracterizada por un clima seco y frío, con una gran amplitud térmica diaria, una media anual de 9 ºC y precipitaciones que no superan los 100 a 250 mm anuales concentradas en los meses de diciembre a marzo (Morello et al. 2012). La Puna se caracteriza por presentar salares, vegas y redes fluviales poco desarrolladas y principalmente endorreicas, entre las cuales se destaca el río San Antonio cuyo principal tributario es el río Los Patos (Paoli 2002).
En ambientes áridos, las poblaciones de anuros se distribuyen de manera discontinua, asociados a cuerpos de agua, constituyéndose en una matriz inhóspita. Esto es muy importante ya que, tanto la reproducción como la fase larvaria están estrictamente ligadas a hábitats acuáticos que se presentan a manera de parches (Nicieza et al. 2010). Por otra parte, además de las restricciones fisiológicas y la alta filopatría, se suman aquellas que pueden imponer las barreras geográficas, la distancia entre los núcleos de reproducción, o la dureza de la matriz de hábitat al movimiento de los individuos entre poblaciones (Arens et al. 2007, Nicieza et al. 2010). Estas características los convierten en buenos bioindicadores, reflejando el estrés ambiental que impacta sobre parámetros poblacionales y que se vinculan con la disminución en la calidad de los ecosistemas y de esa manera los anuros serian bioindicadores de la salud ambiental (Whittaker et al. 2013, Loza del Carpio & Mendoza Quispe 2017).
Telmatobius atacamensis, como las demás especies argentinas del género, se caracterizan por su distribución geográfica restringida y por sus hábitos marcadamente acuáticos (Lavilla & Barrionuevo 2005), lo que los vincula obligadamente a los cuerpos de agua dulce permanentes. Estos ambientes son escasos en la región. Si bien, Vaira et al. (2012) categorizó a T. atacamensis como "Amenazada" es de notar que, el cambio de estatus, anteriormente "En peligro ", debiera nuevamente de revisarse por las amenazas del pasivo minero, el vertido de aguas servidas, los residuos sólidos y el avance de la urbanización. A todo esto se debe sumar la construcción de obras civiles como el acueducto Santa Rosa que discurre por el sector del río Los Patos y que modificaría de manera permanente tanto el paisaje como el caudal del cuerpo de agua (Acosta obs. pers.).
En este contexto, además de que el modelo general básico de los anfibios impone un alto grado de estructuración espacial de sus poblaciones (Wells 2007), se debe sumar los hábitos exclusivamente acuáticos de esta especie en particular. Asimismo, la acción antrópica negativa en los ambientes que habita y la presencia del hongo quítrido, Batrachochytrium dendrobatidis (Barrionuevo & Mangione 2006) conducen a considerar a este taxón como un grupo de especial interés en los procesos de planificación de áreas protegidas. Más aún, cuando el sector donde se distribuye la especie está incluido en la Reserva Provincial Los Andes (decreto 308/80 gobierno de la Provincia de Salta).
Teniendo en cuenta que los taxones endémicos están restringidos a un área específica, y podrían definirse como la diversidad biológica exclusiva de una región (Cowling & Hilton-Taylor 1994) resulta prioritario caracterizar las poblaciones de Telmatobius atacamensis a lo largo de su rango restringido de distribución, aspecto que por otra parte no fue abordado hasta el momento a pesar de su situación desde el punto de vista de la conservación.
Material y métodos
Área de estudio.- El área de estudio se inserta en la cuenca de Salinas Grandes (Subcuenca: "Salinas Grandes - Guayatayoc”, Cuenca “Cerrada de la Puna”), en ella discurre el río San Antonio. Además, la microcuenca del río San Antonio cuya forma es elongada y se desarrolla en dirección sur - norte con una amplitud máxima de 80 km, incluye microcuencas cerradas de dimensiones reducidas (Paoli et al. 2010). Una de ellas, la de Los Patos Superior se incluyó en el área de estudio por haberse detectado poblaciones de T. atacamensis (Fig. 1).
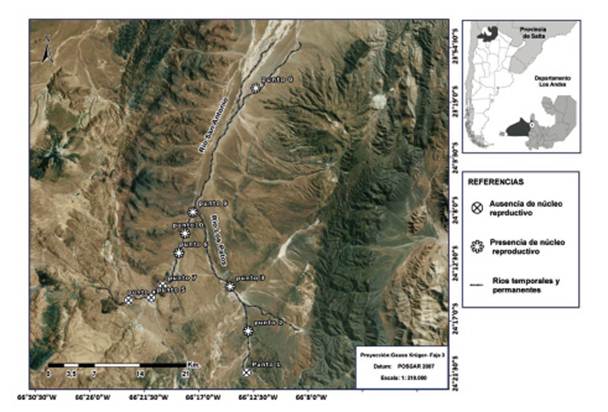
Figura 1 Sitios de muestreo en la subcuenca San Antonio indicando presencia y ausencia de núcleos reproductivos en río Los Patos y río San Antonio.
Detección de núcleos reproductivos.- En ambos ríos, durante un ciclo anual 2017 (pre-muestreo) y 2018 (enero, febrero, abril, mayo, junio, agosto, septiembre, octubre y noviembre) se establecieron un total de diez estaciones de muestreo definidas a partir de la confluencia con un tributario que conecta con otras subcuencas (Tabla 1).
Tabla 1 Ubicación de las estaciones de muestreo.
| Puntos | Coordenadas | |
|---|---|---|
| 1 | 24° 21´ S | 66° 13´W |
| 2 | 24° 17´S | 66 °12´W |
| 3 | 24° 14´S | 66° 14´W |
| 4 | 24° 15´ S | 66° 22´W |
| 5 | 24° 15´S | 66° 20´W |
| 6 | 24° 11´S | 66° 18´W |
| 7 | 24° 14´S | 66° 19´W |
| 8 | 23° 57´ S | 66° 12´W |
| 9 | 24° 08´S | 66° 17´W |
| 10 | 24° 09´S | 66° 18´W |
En cada estación se realizó una búsqueda exhaustiva de ejemplares mensualmente mediante la técnica de encuentro visual (TEV) utilizando para ello redes de malla fina (Heyer et al. 1994). Además, se registraron in situ los parámetros físico-químicos de los cuerpos de agua, pH, temperatura y conductividad eléctrica. Los registros se realizaron con medidor digital pH55/ºC y EC60 Milwoukee, entre las 9:00 - 17:00 horas.
Para la identificación de los núcleos reproductivos, se consideraron aquellos microhábitats donde se registró simultáneamente la presencia de adultos en estado reproductivo, juveniles y larvas en diferentes grupos de desarrollo (Nicieza et al. 2010) (Fig. 2).

Figura 2 Individuos en etapa larval (A), metamórfico (B), adulto(C) y microhábitat característico de Telmatobius atacamensis en núcleos reproductivos detectados en la Puna salteña.
Siguiendo a Lajmanovich (2000), se establecieron tres categorías de desarrollo larval, donde G1 incluía los estadios de 23 a 26 (Gosner 1960) correspondiendo al segmento de individuos prometamórfico, G2 (estadios 27 a 41) premetamórfico y G3 (42 a 46) clímax metamórfico. Para los individuos en etapa larval se registró el estadio (Gosner 1960), longitud hocico cloaca LHC (mm), longitud total del cuerpo LTC (mm) y peso (g).
Para cada individuo adulto detectado se registró la longitud hocico-cloaca (LHC) utilizando calibre digital, el peso (g) y el sexo determinado por caracteres sexuales externos. Todos los datos fueron tomados in situ en cada una de las estaciones de muestreo. Considerando el estatus de conservación de la especie, los individuos fueron devueltos al sitio luego de la toma de datos. Los análisis estadísticos se realizaron en INFOSTAT (2008).
Resultados
Se detectaron seis núcleos reproductivos en la cuenca del río San Antonio y río Los Patos, cuatro en el primero y dos en el segundo (Fig. 1). Los núcleos reproductivos están asociados en todos los casos a la presencia de vegetación ribereña particular compuesta por cojines de plantas que al adentrarse en el cuerpo de agua, forman pequeños remansos y generan refugios subacuáticos donde siempre se localizaron a los individuos (Tabla 2).
Tabla 2 Lista de especies de plantas asociadas a los núcleos reproductivos en la Puna salteña.
| Familia | Especie |
| Asteraceae | Parastrephia quadrangularis (Meyen) Cabrera. |
| Apiaceae | Lilaeopsis macloviana (Gand.) A. W. Hill. |
| Haloragaceae | Myriophyllum quitense Kunth. |
| Poaceae | Distichlis humilis Phil. |
| Haloragaceae | Myriophyllum quitense Kunth. |
| Zannichelliaceae | Zannichellia palustris L. |
| Ranunculaceae | Halerpestes exilis (Phil.) Tamura. |
| Cyperaceae | Zameioscirpus atacamensis (Phil.) Dhooge & Goetghebeur. |
| Campanulaceae | Lobelia oligophylla (Wedd.) Lammers. |
Los valores promedio de las variables físico-químicas de temperatura y conductividad eléctrica del agua constituyen un conjunto de datos heterogéneos (CV > 40%) mientras que los valores de pH son homogéneos (CV< 40%) para ambos ríos (Tabla 3).
Tabla 3 Parámetros Físico-Químicos tomados durante el ciclo de muestreo en río Los Patos y río San Antonio.
| Variables físico-químicas del agua in situ | ||||||
| Sitios | Temperatura (°C) | Cond (mS/cm) | pH | |||
| Río Los Patos | Media±SD | 14.61±1.92 | 1.37±0.13 | 8.63±0.13 | ||
| CV (%) | 58 | 42 | 10 | |||
| Min-Máx | 2-28.3 | 0.54-2.51 | 7.5-10.3 | |||
| Río San Antonio | Media±SD | 14.71±1.43 | 1.48±0.13 | 8.32±0.43 | ||
| CV (%) | 43 | 40 | 23 | |||
| Min-Máx | 2.4-24.1 | 0.4-0.93 | 2.6-10.1 | |||
Tanto en río San Antonio como en río Los Patos, se detectó la presencia de larvas en la categoría de desarrollo G1 (23-26) a lo largo del año. Sin embargo, la mayor abundancia se registró en el mes de octubre para el río Los Patos mientras que en el río San Antonio fue en el mes de abril. Se destaca que la abundancia siempre fue superior en el primero (Fig.3).
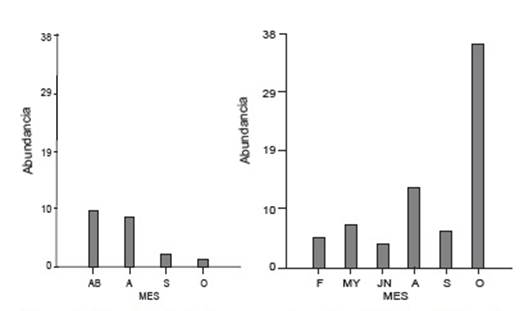
Figura 3 Abundancia de larvas para la categoría G1 en río San Antonio (izquierda) y río Los Patos (derecha) en el ciclo de muestro: F: febrero; AB: abril; MY: mayo; JN: junio; A: agosto; S: septiembre; O: octubre.
Para la categoría G2 premetamórfico (27 - 41) ambos ríos presentan un comportamiento diferente ya que, a pesar de que en ambos ríos el mes de octubre registra una abundancia mayor, se observa otro pico para el río Los Patos durante el mes de febrero (Fig. 4). Asimismo, se destaca la diferencia significativa en la abundancia entre ambos ríos, siendo Los Patos el que presentó la mayor presencia de larvas en ese estadio siempre y en todas las estaciones.
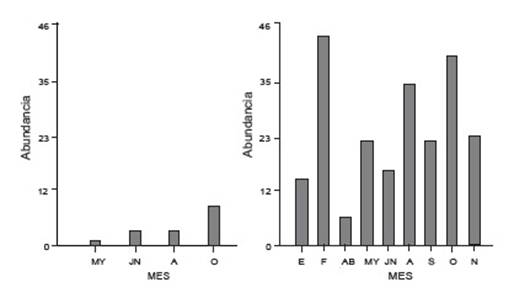
Figura 4 Abundancia de larvas para la categoría G2 en río San Antonio (izquierda) y río Los Patos (derecha) durante el ciclo de muestro: E: enero; F: Febrero; AB: abril; MY: mayo; JN: junio; A: agosto; S: septiembre, O: octubre y N: noviembre.
Las larvas en clímax metamórfico (G3= 42 - 46) fueron registradas durante casi todo el ciclo en el río Los Patos con un máximo de abundancia en el mes de noviembre en oposición al río San Antonio que solo presentó un único registro. Se destaca que mientras en el río Los Patos la presencia de esta categoría es continua, en el río San Antonio está restringida al mes de octubre.
Ambos ríos mostraron diferencias en cuanto a la frecuencia relativa de categorías de estadio. Mientras en el río Los Patos se registraron una mayor frecuencia de G2, en el río San Antonio G1 y G2 se encuentran similarmente representadas. Asimismo, se observó que la presencia de larvas en clímax metamórfico fue superior en el río Los Patos (Fig. 5).
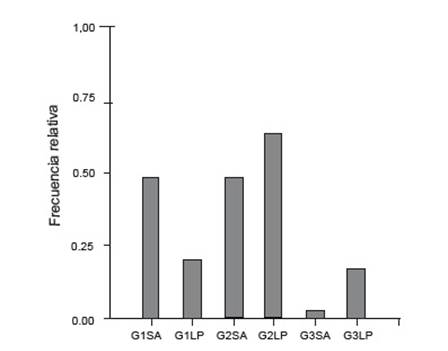
Figura 5 Frecuencia relativa de las categorías de desarrollo G1, G2 y G3 en río San Antonio (SA) y río Los Patos (LP).
La abundancia de la etapa larval fue significativamente diferente entre ambos ríos (ANOVA F= 109.41 p<0.000) siendo mayor para el río Los Patos. Cuando se compararon las variables morfológicas de las larvas entre ambos ríos, mediante T-test, dado que los datos cumplieron con los supuestos de normalidad, se observaron diferencias significativas en el promedio de la longitud del cuerpo (T= 2.13, p= 0.0410), siendo superior en el río Los Patos (3.26±0.37) con respecto al río San Antonio (3.06±0.49). Sin embargo, no se registraron diferencias significativas entre los pesos de las larvas correspondientes a las poblaciones de ambos ríos (T = 1.41, p = 0.167), aun cuando se registró una media mayor (8.27 g) en el río Los Patos.
Es interesante destacar la variación morfológica presente cuando se compararon los parámetros de longitud total y peso de los individuos, detectándose correlación entre dichas variables, considerando al total de datos (R=0.74, p=0.0001) y en un análisis en río Los Patos (R=0.73, p=0.0001) y río San Antonio (R=0.82, p= 0.0001). Por otro lado, entre el peso y la longitud del cuerpo (R: 0.05, p= 0.0001; R=0.62, p=0.0001; R= 0.82, p=0.0001) se registró un mismo comportamiento. En ese marco, las larvas del río San Antonio resultaron con pesos mayores y un cuerpo más robusto a diferencia de las del río Los Patos con una forma más longilínea.
Los individuos adultos fueron registrados para ambos ríos durante todo el ciclo. Se registraron diferencias significativas en la abundancia entre ambos (T= 19.83, p<0.0001), resultando el río Los Patos el más abundante (Fig. 6). Asimismo, para el río San Antonio la mayor abundancia (n= 16) se registró en el mes de octubre mientras que para el río Los Patos (n= 17) correspondió al mes de septiembre. A pesar de este desplazamiento temporal en las abundancias, el peso promedio máximo detectado correspondió, para ambos sitios, al mes de abril (22.036 g y 17.27 g, respectivamente).
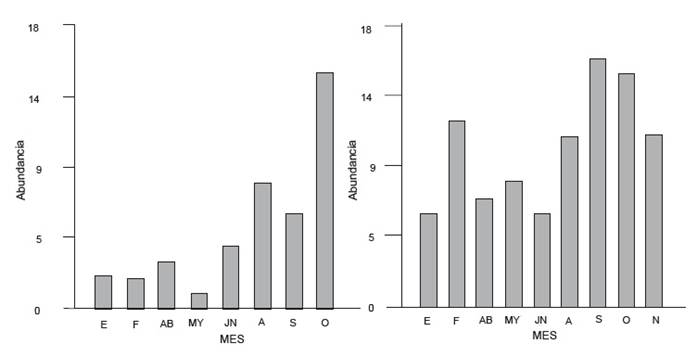
Figura 6 Abundancia de adultos durante el ciclo de muestreo en río San Antonio (izquierda) y río Los Patos (derecha).
Para ambos ríos no se registraron diferencias significativas en la proporción sexual pero si en el tamaño del cuerpo resultando los machos de mayor tamaño en el río Los Patos. Se observaron diferencias significativas en el peso de los adultos (ANOVA F=3.09 p= 0.0493) y en la longitud corporal (ANOVA F= 2.97, p=0.0175) entre los diferentes meses del año. Un patrón similar se registró en el río San Antonio aunque este no fue significativamente diferente.
Discusión
Las especies del género Telmatobius se caracterizan por desarrollar su ciclo de vida en cuerpos de agua en valles andinos y puna de la cadena montañosa de los Andes desde Ecuador hasta el norte de Argentina y Chile (Lavilla & Barrionuevo 2005, Lavilla 1997). A pesar de su amplia distribución conforman un género con numerosos endemismos, por lo que son sensibles a las disminuciones poblacionales, a pesar de sus capacidades adaptativas (Angulo 2008). En Argentina la mayoría de los estudios sobre el género están restringidos a características anatómicas, morfológicas y de desarrollo (Lavilla & Barrionuevo 2005). Dado que algunos autores proponen que T. atacamensis se encuentra extinta en la localidad tipo y sus proximidades (Lavilla & Cei 2001) el registro de núcleos reproductivos en el río San Antonio es relevante. En este marco, la detección y caracterización de núcleos de reproducción de T. atacamensis realizada, se configuraría como la primera descripción sistemática de la amplitud de la distribución de este anuro endémico.
A partir de estos resultados, se puede sostener que los individuos se encuentran asociados exclusivamente a refugios sumergidos, en sitios restringidos y definidos por zonas meandrosas de los arroyos. El hábitat adecuado para el desarrollo de la especie se caracteriza por un reducido rango de conductividad eléctrica, uno amplio de temperatura del agua y un pH alcalino. El tipo de hábitat registrado es congruente con lo documentado en especies del género (Lobos et al. 2016, 2018); el comportamiento de estas variables se podrían explicar por las características geológicas de la zona (Hongn et al. 2018), manteniendo los niveles altos de pH en todos los sitios. Sin embargo, es importante la evaluación a escala temporal de los efectos de las condiciones físico-químicas del medio sobre la distribución y abundancia de las poblaciones, dado que, la conductividad eléctrica del agua es a menudo un predictor importante de la ocupación de ranas (Lobos et al. 2018).
Considerando la abundancia de larvas a lo largo del ciclo de muestreo y el número de individuos por categoría de desarrollo, es posible caracterizar el patrón de actividad reproductiva de T. atacamensis como continua, ya que se registraron todas las clases etarias durante el año (Lajmanovich 2000). Sin embargo, se ha documentado para algunos anfibios altoandinos la presencia de larvas en etapas avanzadas de desarrollo en invierno con superposición de etapas de desarrollo tempranas y tardías en otras estaciones del año (Corbalán et al. 2014). Esta idea podría indicar que las larvas requieren de un tiempo prolongado para alcanzar la metamorfosis con pesos relativamente altos, en una posible respuesta plástica a las presiones ambientales (Acosta 2015).
Los resultados en la abundancia relativa de las categorías de desarrollo permiten evidenciar una reducción en el número de individuos en clímax metamórfico para el río San Antonio, con mayor abundancia en las primeras fases del ciclo de vida (G1 y G2). Además, el comportamiento de los valores en un marco de análisis espacial indicarían que el río Los Patos concentra la mayor abundancia de las categorías de desarrollo y probablemente existiría un reclutamiento continuo de metamórficos en comparación a lo observado en el comportamiento de la población del río San Antonio (Corbalán et al. 2014, Lobos et al. 2018).
Las variables morfológicas como peso y longitud indicarían poblaciones significativamente de mayor talla y peso promedios en río Los Patos. Sin embargo, el análisis de la variación morfológica entre ambas poblaciones establece los máximos valores en río San Antonio, este comportamiento podría estar dado por los efectos de la baja abundancia de individuos sobre el total de datos. En un análisis inicial a escala local, las variaciones significativas observadas en los descriptores morfométricos entre los momentos de muestreo en río Los Patos podrían deberse a un efecto estacional. Pero sería recomendable una evaluación temporal más amplia para establecer los efectos de la estacionalidad en la dinámica de las poblaciones de la especie.
Los datos analizados indican una población constituida por individuos diferenciados sexualmente en toda la subcuenca, a diferencia de lo informado por Lobos et al. (2018) para Telmatobius cf. philippii. Asimismo, se destaca que la mayor abundancia para la clase adulta se registró en el río Los Patos y con tendencia a que las machos sean de mayor tamaño a pesar de que en el río San Antonio se detectaron un número mayor de núcleos reproductivos. Esto podría deberse a la reducida capacidad de dispersión de la especie para explorar nuevos hábitats o a la especificidad de los mismos. Sin embargo, las observaciones de campo realizadas en los muestreos evidenciarían que los individuos, por lo general tienden a permanecer en los refugios condicionando la exploración del espacio disponible.
En ese marco, la construcción de un acueducto en el río Los Patos, donde reportamos las poblaciones más abundantes establecidas, constituye un riesgo importante que alteraría el hábitat de T. atacamensis, reconocido como un microendemismo (Angulo 2002, Acosta et al. 2014, Portelli & Díaz-Gómez 2017). Además, el bajo número de individuos adultos podría afectar potencialmente el tamaño efectivo de la población, sumando un riesgo más para la conservación de la especie.
En conclusión, los datos obtenidos en el presente estudio sobre el tipo de microhábitat, distribución y abundancia local de las poblaciones detectadas de T. atacamensis aportarían información ecológica relevante para la evaluación del estado actual de conservación, la elaboración objetiva de estrategias para el diseño de monitores efectivos, comparaciones poblacionales futuras y protección de la especie.












 uBio
uBio 


