Introducción
La actividad bioinsecticida de especies de Annonaceae ha sido ampliamente conocida desde el descubrimiento de acetogeninas y alcaloides isoquinolínicos, principios activos mayoritariamente causantes de toxicidad en artrópodos de interés agrícola y salud pública (Isman 2006, Hincapié et al. 2008; Álvarez et al. 2007; Isman & Seffrin 2014). Annona muricata, una de las especies clave investigadas por sus aplicaciones insecticidas, es capaz de controlar etapas inmaduras de Aedes aegypti principal vector de arbovirus como dengue, zika y chikungunya (Ravaomanarivo et al. 2014; Rodrigues et al. 2019).
De otro lado, la bioactividad de principios activos vegetales se correlaciona con el poder de extracción y disolutivo del solvente. Mientras que el empleo aislado de metanol, acetona, éter o cloroformo no garantizan eficientes procesos de extracción de metabolitos, la combinación de ellos encarece costos de extracción, son de difícil accesibilidad comunitaria y en muchos casos, no sinergiza la acción de interés (Palma et al. 2013, Petigny et al. 2015; Dhanani et al. 2017; Caesar & Cech, 2019). Por ende, se requiere de solventes adecuados que permitan la extracción de un amplio rango de principios activos, polares y no polares, de vasta acción plaguicida, siendo además potenciadores del efecto insecticida base. Tal es el caso del dimetilsulfóxido (DMSO; C2H6OS), molécula orgánica anfipática que tiende a solubilizar variados compuestos orgánicos e inorgánicos (Capriotti & Capriotti, 2013). En la naturaleza el DMSO surge por oxidación biológica del dimetilsulfuro producido en alimentos, suelo, aguas naturales, vegetación y fitoplancton (Pearson et al. 1991). Su relativa baja toxicidad, ha dado lugar a ser extensivamente usado en formulaciones farmacoterapéuticas y biomédicas al acelerar la permeabilidad de antibióticos, barbitúricos y anestésicos (Tunçer et al. 2018), además de agentes disolutivos en plaguicidas con extractos botánicos frente a A. aegypti (Nour et al. 2012; Stratton 1985).
La demostrada penetrabilidad tegumentaria de biomoléculas activas que ejerce el DMSO al interior celular, favorecerían la bioactividad en órganos blanco (Jacob and Herschler 1986, Notman et al. 2006; Madruga et al. 2017) lo que podría ser replicada en etapas inmaduras de mosquitos vectores. Sin embargo, estudios que revelen el incremento de la acción insecticida de metabolitos activos de A. muricata en sinergia con DMSO no han sido reportados. Por lo tanto, el presente trabajo evaluó el efecto potenciador del DMSO en extractos de semillas de A. muricata “guanábana” sobre larvas y pupas de A. aegypti in vitro y campo simulado.
Material y métodos
Fase pre-experimental
Obtención de poblaciones silvestres de A. aegypti.- El área cubierta para la captura del vector constituye el 2.33% de zonas urbano-marginales (41.36 km2) de la provincia de Trujillo. Se seleccionaron seis viviendas distribuidas entre los distritos de Trujillo (08°05’19”S, 79°00’54”W; 08°06’20”S, 79°01’00”W; 08°06’09”S, 79°00’58”W) y Florencia de Mora (08°05’16”S, 79°01’32”W; 08°04’40”S, 79°00’55”W; 08°04’51”S, 79°01’41”W), con dos años consecutivos de Índice Aédico superior a 2%. Dichos antecedentes también indicaron que los recipientes de mayor probabilidad de obtención de larvas correspondieron a baldes de plástico de 4 litros y cilindros de almacenamiento de 200 litros de capacidad de acuerdo con el Índice de Recipiente. Luego de 10 días de vigilancia entre los meses de febrero a marzo, ambos recipientes confirmaron ser las unidades muestrales positivas de larvas, procediendo a la captura con pipetas de plástico en envases herméticos rotulados (MINSA 2017, DIGESA 2011 ).
Crianza y mantenimiento de larvas y pupas.- La crianza masal de A. aegypti se desarrolló en la Unidad de Salud Ambiental, Vigilancia y Control de Vectores del Hospital Distrital El Esfuerzo, Florencia de Mora. La crianza se desarrolló por siete generaciones en términos de alcanzar mínima variabilidad en la respuesta al tóxico vegetal. Las larvas se colocaron en fuentes de plástico de 40 x 28 x 5 cm. con 300 mL de agua potable declorinada. Se tuvo en cuenta condiciones de alta esterilidad del criadero aplicando hipoclorito de sodio (NaClO 2.5%) y mezcla sulfocrómica (H2CrO4) para evitar enfermedades fúngicas o bacterianas. El aporte base de 500 mg/día de alimento consistió en pellets para peces suplementado con hígado de pollo seco (en proporción 1:1), esterilizado en estufa a 80 °C por 1 hora y almacenado en bolsas de papel de aluminio. El suministro de alimento aumentaba progresivamente en proporción a la densidad larvaria y el avance al estadio larval superior, mientras que el recambio de agua se realizó entre las 48 y 96 horas, teniendo en cuenta la ausencia de turbidez y olor por descomposición orgánica (Consoli e Lourenço de Oliveira, 1994). Cerca de 2000 pupas se acondicionaron en recipientes de plástico con 400 mL de agua potable declorada, repartidos en 5 insectarios de tul de 80 x 80 x 60 cm similar al modelo de insectario de Barraud en el mantenimiento de adultos (Gerberg et al. 1994).
Crianza y mantenimiento de adultos. - Diariamente, la alimentación de zancudos machos consistió en colocar frascos de vidrio estéril con 10 mL de jugo de frutas embebidos en algodón y en contacto con tiras de papel filtro. Así también, la alimentación de las hembras por exposición cutánea del dorso de un cobayo, se realizó en horas de la mañana durante 20 minutos (Consoli e Lourenço de Oliveira 1994).
Obtención de huevos.- El desove se produjo sobre discos de papel filtro en frascos de oviposición con agua. Luego, los huevos se trasfirieron a recipientes de plástico estériles (13 x 10 cm) con 200 mL de agua potable declorada para eclosión larvaria y continuidad de la crianza. Todas las etapas de desarrollo de A. aegypti se realizaron bajo condiciones controladas de temperatura en un rango de 25 ± 3 °C, humedad relativa de 70 ± 10% y fotoperiodo de 16 horas luz y 8 horas de oscuridad (Consoli e Lourenço de Oliveira 1994).
Selección de frutos y semillas de A. muricata.- Frutos maduros de A. muricata se obtuvieron del Mercado Central del distrito de Virú, La Libertad, en los meses de producción (febrero a julio). Las semillas se lavaron profusamente con agua potable y secaron bajo sombra por una semana.
Preparación de extractos bioinsecticidas.- Dos kilogramos de semillas secas trituradas en molino casero, se maceraron en tres litros de agua destilada, etanol 96% y una combinación de etanol 96% y DMSO (1:1) por 3 días en frascos de vidrio ámbar, con periodos de remoción entre 6 a 8 horas a temperatura y humedad ambientales. Luego de filtrar con papel Whatman N° 1, se procedió a evaporar cada extracto en baño maría a 45 °C. El extracto acuoso (EA) se concentró a 200 mL, en tanto que los extractos etanólicos (EE) y etanol-DMSO (EE-DMSO) se redujeron a sequedad para diluirlos a la misma temperatura en 200 mL de agua destilada y 200 mL de DMSO, respectivamente, constituyendo las tres soluciones madre. Con propósitos de preservación, las soluciones se refrigeraron a 4 °C por un máximo de 30 días (Vidal et al. 2009).
Fase experimental in vitro
Bioensayos estándar larvicida y pupicida.- Se realizó un bioensayo rápido de toxicidad aguda con ocho concentraciones (0.005, 0.01, 0.05, 0.1, 0.5, 1.0, 5.0, 10.0 mg/L) previo al ensayo estándar. El criterio de elección de las concentraciones fue aquel rango que produjo entre 10 y 95% de mortalidad larvaria en 24 horas, estableciéndose a 0.5, 1.0, 5.0, 10.0 mg/L ser incluidas en el bioensayo estándar. Los ensayos independientes larvicidas y pupicidas se conformaron de acuerdo con los solventes de extracción en EA, EE, EE-DMSO (DMSO 1.5%) más el control, C, (250 mL de agua potable declorada con DMSO 1.5%), en en vasos de poliestireno expandido Tecnopor® con 250 mL de solución conteniendo 25 larvas del IV estadio y pupas, sometidas a cuatro repeticiones por concentración. Las lecturas de mortalidad se llevaron a cabo a la 6, 12, 24 y 48 horas que incluyó el retiro de aquellos individuos muertos. Las larvas se consideraron muertas cuando no reaccionaban al punzarlas levemente en la región cervical, mientras que las pupas, al mostrar detención corporal en la superficie de la solución o no reaccionar ante ligeras punciones en el cefalotórax. Todos los grupos se mantuvieron bajo condiciones controladas de iluminación por luz fría, temperatura entre 25±2 °C y humedad relativa entre 75 a 80%. La mortalidad de ambos estadios se registraron en hojas técnicas estandarizadas (McLaughlin et al. 1998; WHO 2005).
Fase experimental en campo simulado
Elección de unidades experimentales.- Referenciándonos en los índices de recipiente positivos, las unidades experimentales seleccionadas fueron baldes de plástico de 4 litros de capacidad. A los recipientes de experimentación y control se les asignó un código de tal manera que su elección se fundamente en muestreos sin reposición, donde un código solo puede ser elegido por única vez. En esta asignación el primer código (letras del alfabeto) fue el indicado para el recipiente control y el resto para los experimentales (Ventosilla et al. 2001).
Bioensayos estándar larvicida y pupicida.- Las pruebas larvicidas y pupicidas se realizaron en baldes de 4 litros capacidad con agua potable declorada y 50 larvas del IV estadio y pupas, respectivamente, por tres repeticiones más el grupo control (agua con DMSO al 1.5%). Se emplearon las concentraciones provenientes de las CL50 y CL90 del bioensayo in vitro, en cantidades proporcionales que demandaron añadir a los 4 litros de solución de prueba. Los baldes fueron cubiertos con doble pliegue de malla de tul, sujetados con ligas gruesas de caucho para evitar el ingreso y salida de organismos. La exposición de los sistemas a luz solar continua en el mes de marzo, se llevó a cabo en un jardín engramado de interior desde la 6:00 am. con evaluaciones de la mortalidad a las 6, 12 y 24 horas, registrados en hojas técnicas estándar y bajo los mismos criterios de mortalidad por estadio empleados en los bioensayos in vitro. Los rangos aproximados naturales de 12 horas luz y 12 horas de oscuridad, alcanzaron temperaturas atmosféricas entre 21 a 27 °C y humedad relativa de 75 a 82% (WHO 2005).
Análisis estadístico.- Se empleó el software R ver. 3.5.2 for Windows (R Project for Statistical Computing) para el cálculo de las CL50, CL90, y ANOVA de medidas repetidas con diferencias significativas (p<0.05) entre concentraciones y tiempos de exposición. Además, se estableció la prueba de bondad de ajuste, chi cuadrado (X 2 gof ), para un valor P mayor que 0.05 aceptándose el modelo. Así también se determinó el Coeficiente de Determinación (R2) como ajuste del modelo para la relación de variables X e Y.
Resultados y discusión
La Tabla 1, muestra el efecto tóxico agudo en porcentaje de mortalidad de larvas y pupas. Los extractos confieren mínima mortalidad entre 2 a 10% (5 mg.L-1/EE-EA/larvas) desde las 6 horas de exposición y una máxima de 100% (10 mg. L-1/EE y EE-DMSO/larvas y pupas) hasta las 48 horas en ambos estadios, a excepción de EA con 73% de muerte larvaria. En general, el porcentaje de mortalidad es gradual a 0.5 y 1 mg.L-1en todos los extractos, a diferencia de las concentraciones 5 y 10 mg.L-1 cuyas respuestas parecen tener efecto tóxico muy potente en EE y EE-DMSO superior a 75% desde las 12 horas. En contraste, la alta sensibilidad de las pupas reveló intensa respuesta tóxica en todos los extractos entre las 6 y 12 horas, superior a 67% en EE y EE-DMSO, en comparación al grupo larvario y control.
Tabla 1 Porcentaje de mortalidad in vitro de larvas del IV estadio y pupas de A. aegypti por exposición de extractos de A. muricata. TE: Tipo de extracto; EA: Extracto acuoso; EE: Extracto etanólico; EE-DMSO: Extracto etanol-dimetilsulfóxido; C: Control; T: Tiempos de exposición en horas; L: Larvas del IV estadio; P: Pupas.
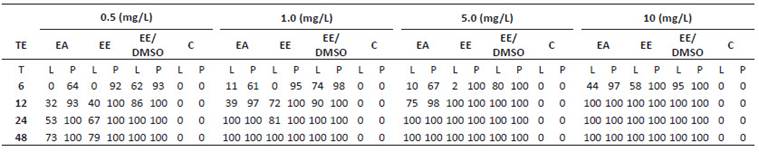
La Tabla 2 evidencia que las respuestas tóxicas, serían dependientes del estadio y tipo de extracto. Además, el análisis probit demostró que los datos se ajustaron mayoritariamente al modelo de respuesta dicotómica (sobrevivencia/mortalidad) de los organismos, cuya sensibilidad estimó las CL50 y CL90 (Stenersen 2004; Finney 1978). No obstante, los datos referidos a la acción de EE-DMSO no se ajustaron convenientemente debido al estrecho margen de mortalidad cercano al 100% desde las 12 horas impidiendo la estimación de la CL50, CL90 y parámetros estadísticos adicionales. En perspectiva, la sensibilidad larvaria al estímulo químico fue constante a las 6 horas en los tres extractos. A partir de las 12 horas, EA y EE exhiben un progresivo patrón de letalidad que se extiende a las 48 horas (R2: 0.52 - 0.96, b: 28.03 - 37.18, X2: 12.91 - 26.42, P: 0.48 - 0.77), a excepción de EE-DMSO que supera el 95% de mortalidad a larvas y pupas desde las 12 horas. El ajuste óptimo de las variables (b: 4.81, X2: 27.94, P: 0.37) y elevada interdependencia (R2 entre 0.77 - 0.98) se consiguió a las 6 horas, reflejando potencia letal del extracto. Por lo tanto, la toxicidad de los extractos sugieren conferir bioactividad en larvas y pupas, siendo las últimas más sensibles.
Tabla 2 Análisis probit de los extractos de semillas de A. muricata sobre larvas IV y pupas de A. aegypti in vitro. TE: Tiempo de exposición; Es.: Estadio; CL: Concentración Letal; L: Larva del IV estadio; P: Pupa; LC: Límite de Confianza; R2: Coeficiente de determinación; b(±ES): pendiente (±error estándar); Χ2: Chi cuadrado; P: Valor de probabilidad (0.05). -a Parámetros no calculados.
La Tabla 3 resume las CL50 y CL90 extraídas de la Tabla 2. Dichas concentraciones, ejecutadas para los experimentos de campo simulado, tuvieron en cuenta que los tiempos de exposición muestren un X2 mayor a 2 y R2 entre el 61 y 98% de asociación de variables a fin de respaldar el ajuste del modelo (Robertson et al. 2017). En el ensayo larvicida, el efecto de una misma concentración produce respuestas nulas o tardías de toxicidad mayormente en EA y EE con relación a EE-DMSO hasta las 12 horas de exposición. Por ejemplo, la mínima CL50, 16.91 mg/L, no evidencia mortalidad larvaria entre 6 y 12 horas, en contraste con la inmediata superior, 21.21 mg/L, que repunta a 85% en EA a las 12 horas y 100% en EE y EE-DMSO. Además, este último es superior en efectividad al aplicar la CL90, 41.6 mg/L, con 94% las 6 horas e incrementando a 100% a las 12 horas (Tabla 4). En contraste, la acción pupicida es temprana, 78% en EA a 23.03 mg/L desde las 6 horas, y total en todas las concentraciones de los extractos a partir de las 12 horas, salvo en la CL90, 53.18 mg/L que, en contra de lo esperado, genera mortalidad a las 24 horas en EE-DMSO. De igual manera, la CL50, 23.03 mg/L, en EA y EE ejercen 78% y 63% de mortalidad a las 6 horas y 100% a las 12 horas (Tabla 5).
Tabla 3 Resumen de las CL50 y CL90 in vitro de semillas de A. muricata. Las concentraciones subrayadas se emplearon en los ensayos de campo simulado. CL: Concentración Letal; EA: Extracto acuoso; EE: Extracto etanólico; EE-DMSO: Extracto etanol-dimetilsulfóxido; ND: Concentraciones letales no determinadas.
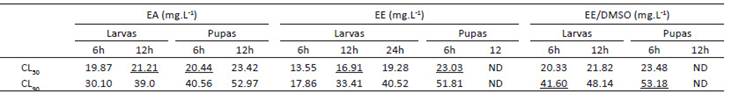
Tabla 4 Porcentaje de mortalidad de larvas IV de A. aegypti en campo simulado. TE: Tiempo de exposición; CL: Concentración Letal; EA: Extracto acuoso; EE: Extracto etanólico; EE-DMSO: Extracto etanol-dimetilsulfóxido.
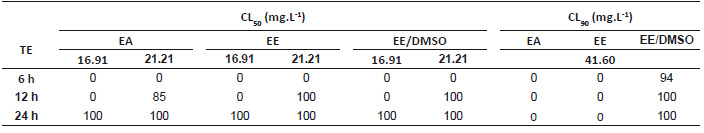
Tabla 5 Porcentaje de mortalidad de pupas de A. aegypti en campo simulado. TE: Tiempo de exposición; CL: Concentración Letal; EA: Extracto acuoso; EE: Extracto etanólico; EE-DMSO: Extracto etanol-dimetilsulfóxido.
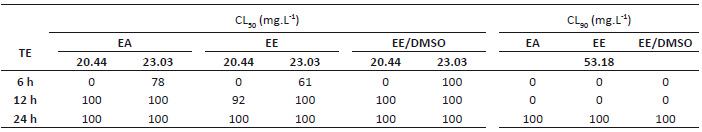
Los tres extractos ejercen 100% de mortalidad a las 24 horas evidenciando mayor sensibilidad a pupas con relación a las CL50 de larvas (16.91 y 21.21 mg/L) a pesar de no representar marcadas diferencias cuantitativas.
La fase de laboratorio es el primera de cuatro fases recomendadas por la WHO (2005) tendientes a comprobar el desempeño de un insecticida. La segunda fase de campo simulado a escala reducida, intentó preliminarmente abordar la durabilidad por exposición solar de los metabolitos de A. muricata mediada por extractos aislados y en combinación con DMSO al tener por referente la variación de los porcentajes de mortalidad. Aunque los tiempos de evaluación pudieron ampliarse, la potencia de los extractos determinó que el 100% de mortalidad ocurra dentro de las 24 horas sugiriendo que los metabolitos sean aún activos. Adicionalmente, esta fase ratifica los hallazgos de mortalidad en laboratorio sobre la mayor bioactividad de EE-DMSO, que también fueron dependientes del estadio larva o pupa.
Las Tablas de la 6 a 11 indican diferencias significativas (p<0.05) entre los tiempos, concentraciones e interacción de ambos factores sobre larvas y pupas respondiendo diferencialmente al efecto creciente de los estímulos químicos.
Tabla 6 ANOVA de extracto acuoso de semillas de A. muricata en larvas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados Medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 55.22 | 3 | 18.40 | 1125.68 | 1.84x10-44** | 2.79 |
| Tiempos de exposición | 170.68 | 3 | 56.89 | 3479.13 | 4.01x10-56** | 2.79 |
| Interacción | 12.0 | 9 | 1.33 | 81.56 | 5.24x10-26** | 2.08 |
| Dentro del grupo | 0.78 | 48 | 0.02 | |||
| Total | 238.69 | 63 |
Tabla 7 ANOVA de extracto etanólico de semillas de A. muricata en larvas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados Medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 81.64 | 3 | 27.21 | 622.37 | 2.09x10-38** | 2.79 |
| Tiempos de exposición | 209.22 | 3 | 69.74 | 1594.99 | 4.74x10-48** | 2.79 |
| Interacción | 23.07 | 9 | 2.56 | 58.64 | 7.52x10-23** | 2.08 |
| Dentro del grupo | 2.09 | 48 | 0.04 | |||
| Total | 316.04 | 63 |
Tabla 8 ANOVA de extracto etanólico-Dimetilsulfóxido de semillas de A. muricata en larvas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 8.16 | 3 | 2.72 | 558.48 | 2.62x10-37** | 2.79 |
| Tiempos de exposición | 50.64 | 3 | 16.88 | 3463.03 | 4.48x10-56** | 2.79 |
| Interacción | 10.53 | 9 | 1.17 | 240.13 | 9.04x10-37** | 2.08 |
| Dentro del grupo | 0.23 | 48 | 0.01 | |||
| Total | 69.58 | 63 |
Tabla 9 ANOVA de extracto acuoso de semillas de A. muricata en pupas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 6.38 | 3 | 2.12 | 10.99 | 1.29x10-5** | 2.79 |
| Tiempos de exposición | 53.50 | 3 | 17.83 | 92.08 | 6.36x10-20** | 2.79 |
| Interacción | 9.08 | 9 | 1.09 | 5.209 | 6.158x10-5** | 2.08 |
| Dentro del grupo | 9.29 | 48 | 0.19 | |||
| Total | 78.27 | 63 |
Tabla 10 ANOVA de extracto etanólico de semillas de A. muricata en pupas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 2.12 | 3 | 0.70 | 16.18 | 2.098x10-7** | 2.79 |
| Tiempos de exposición | 6.02 | 3 | 2.08 | 45.94 | 3.783x10-14** | 2.79 |
| Interacción | 6.36 | 9 | 0.70 | 16.18 | 8.826x10-12** | 2.08 |
| Dentro del grupo | 2.09 | 48 | 0.04 | |||
| Total | 16.60 | 63 |
Tabla 11 ANOVA de extracto etanólico-Dimetilsulfóxido de semillas de A. muricata en pupas de A. aegypti in vitro.
| Fuente de variación | Suma de cuadrados | Grados de libertad | Cuadrados medios | F | Valor P | Valor F |
|---|---|---|---|---|---|---|
| Concentraciones | 1.71 | 3 | 0.57 | 14.59 | 6.956x10-7** | 2.79 |
| Tiempos de exposición | 3.85 | 3 | 1.28 | 32.77 | 1.117x10-11** | 2.79 |
| Interacción | 5.15 | 9 | 0.57 | 14.59 | 5.151x10-11** | 2.08 |
| Dentro del grupo | 1.88 | 48 | 0.039 | |||
| Total | 12.61 | 63 |
*p>0.05 no hay diferencias significativas
**p<0.05 hay diferencias significativas
Las respuestas de la población por exposición a los tóxicos revelaron patrones de sensibilidad y tolerancia (Figura 1, A-H), lo cual se correlaciona con las pendientes superior a 2 en condiciones acuáticas (Vonesh & Chinichilli 1997; Carr 1998; Yu 2008). Aunque las pendientes suelen ser mínimas en EE-DMSO, los valores de R2 con un máximo de 95%, indicarían alta toxicidad larvicida y pupicida hasta por 48 horas, de acuerdo con el tiempo máximo de duración del bioensayo. Además, dado que los trazados de las rectas probit-logarítmicas mantienen tendencias de control larvicida relativamente exponencial (Figuras 1A, C, D, G), contrariamente, la actividad pupicida de los tres extractos fue fulminante al observar la configuración de rectas planas (Figuras 1D, F y H), sugiriendo elevada potencia tóxica (Kacew & Byung-Mu 2013). En esencia, la respuesta a los tratamientos con rectas iguales (planas) (Figuras 1F, H), paralelas (Figuras 1A, B) y no paralelas (Figuras 1C, D, E, G), revelarían distintos modos de detoxificación de los individuos de prueba frente a la absorción cuticular, intestinal, sensibilidad al órgano blanco y excreción del tóxico por el organismo (Robertson et al. 2017). No obstante, futuros análisis bioquímicos son necesarios para confirma dichas hipótesis.
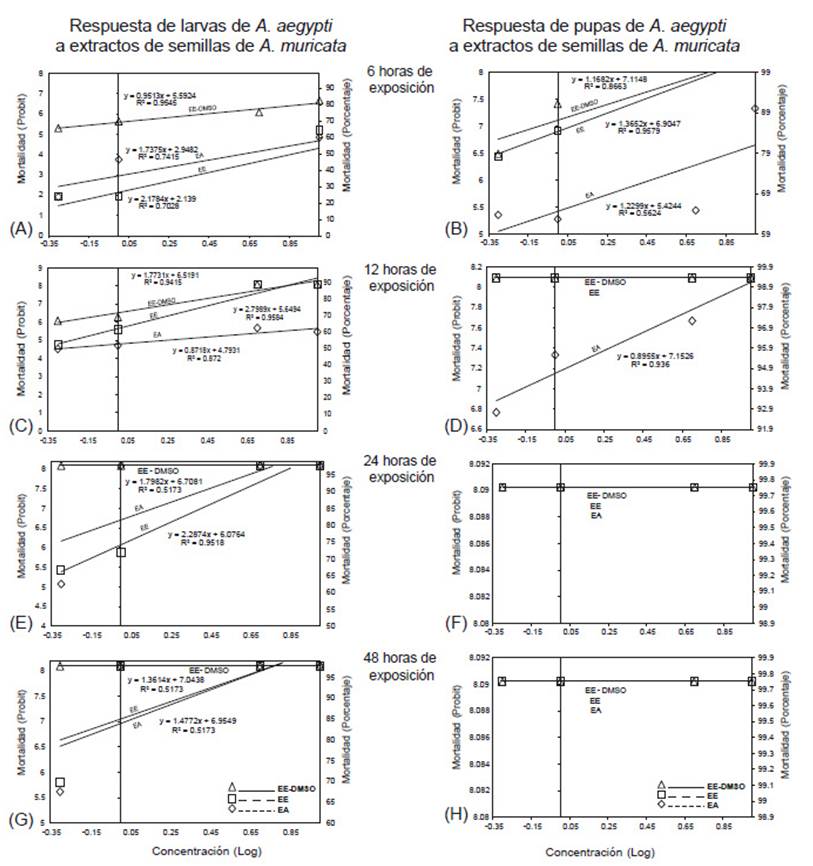
Figura 1 Respuesta de larvas (A, C, E, G) y pupas (B, D, F, H) de A. aegypti a extractos de semillas de A. muricata a las 6, 12, 24 y 48 horas de exposición. EA: Extracto acuoso, EE: Extracto etanólico, EE-DMSO: Extracto etanólico-Dimetilsulfóxido.
La eficacia insecticida de extractos vegetales es altamente dependiente del tipo o polaridad del solvente empleado (Ghosh et al 2012). Además, la actividad larvicida y pupicida sobre A. aegypti, suele variar respecto al órgano vegetal de A. muricata, siendo la extracción etanólica de semillas las que confieren mayor mortalidad (Bobadilla et al 2005), a pesar de la extracción alternativa y eficiente con solventes de distinta polaridad (agua, cloroformo y hexano) en el biocontrol de otros insectos (Bobadilla 1998; Bobadilla et al. 2003).
En nuestro propósito por evaluar el incremento de la respuesta larvicida y pupicida con la inclusión del potenciador DMSO en etanol como solvente referencial, nuestros hallazgos revelaron que dichas bioactividades aumentan significativamente in vitro manteniéndose en campo simulado. Una explicación se fundamentaría en el fácil mecanismo de solubilización, penetrabilidad y partición de sustancias bioactivas fomentadas por el DMSO (Dragicevic et al. 2015), por lo que la doble función solvente-potenciador, podría habilitar cuticularmente el traslado tegumentario de acetogeninas (He et al. 1997), alcaloides triptamínicos (Moghadamtousi et al. 2015) y ciclopéptidos (Coria et al. 2018), principios activos de semillas, que eventualmente podrían ser potenciados por el DMSO en alusión a su carácter aprótico dipolar característico de potenciadores por penetración (Barbosa, et al 2003; Marren 2011).
Evidencias que respalden nuestro planteamiento potenciador del DMSO es revelado por aumento de la penetración de principios activos de extractos herbáceos al integumento del ácaro Rhipicephalus annulatus por remoción de la capa sérica epicuticular (Ravindran et al. 2011). Asimismo, la asociación de principios insecticidas con DMSO y metanol en medio acuoso fueron muy efectivos en larvas de Culex (Bowman et al. 1981). En ensayos de aplicación oral de acetogeninas anonáceas en larvas de Spodoptera frugiperda e inyección hemolínfica en Leptinotarsa decemlineata con DMSO (Guadaño et al. 2000), demuestran potencia insecticida con escaso efecto en organismos controles (Gonçalves et al. 2007). Por lo tanto, desde el punto de vista de la solubilización y procesamiento de extractos bioinsecticidas, EE y la combinación EE-DMSO, ejercerían mayor amplitud de solubilidad y potencia tóxica al basarnos en los porcentajes de mortalidad y en virtud a que los potenciadores por penetración suelen ser fácilmente solubles por solventes orgánicos como el etanol (Magnusson et al. 2001), sin desmerecer la solubilidad ejercida por EA que evidenció actividad larvicida y pupicida en menor intensidad.
Las probables vías de control en larvas de A. aegypti, han determinado por incluir modos de acción por contacto e ingesta (Gusmão et al. 2002; Costa et al, 2018). Así también, dado que la mayoría de los insecticidas controladores de mosquitos ejercen actividad por ingestión (Antonio-Nkondjio et al. 2018), la ausencia de alimentación en pupas conllevaría a que las sustancias sólo ejerzan acción por contacto (Pereira et al. 2013). En contexto con nuestros resultados, la bioactividad pupicida desencadenó movimientos de distensión y retracción de la pupa de 2 segundos de duración a intervalos de 15 a 20 segundos, previos a la anulación del desplazamiento y flotabilidad característicos de la exposición a insecticidas por contacto, así como inmovilidad y muerte que revelarían toxicidad neuromuscular (Tomé et al. 2014). La respuesta tóxica probablemente haya iniciado por penetrabilidad de la cubierta proteica del conjunto laminar del exoesqueleto de la pupa (Liu et al. 2017), cuya toxicidad sugeriría acción knockdown o de aniquilación inmediata, tal como señala la WHO (2016). Es decir que la condición knockdown partiría por la emisión vía cuticular de los principios activos para rápida penetrabilidad y respuesta inmediata (Stocky et al. 2001), lo cual se produjo desde los 15 minutos (resultados no mostrados), tal como lo realizan los piretroides al asociarlos con el sinergista Butóxido de Piperonilo (BPO) (Giddings et al. 2016). No obstante, bajo los propósitos de determinar la mortalidad acorde a los tiempos del bioensayo, probablemente la disminución de la concentración del tóxico estime la precisión de las CL50 y CL90 a fin de observar respuestas susceptibles graduales y ajustables.
Conclusiones
- Los extractos acuosos, etanólicos y combinación etanol-DMSO de las semillas de A. muricata ejercen acción larvicida y pupicida in vitro y campo simulado. La toxicidad se incrementa en relación directa a las concentraciones, tipos de extracto y estadio de desarrollo. Los altos porcentajes de mortalidad de la combinación etanol-DMSO evidenciaron mayor potencia tóxica que los extractos acuoso y etanólico. La potencia es superior en pupas que en larvas sugiriendo alta sensibilidad vinculada a posibles mecanismos de penetración por contacto presuntivamente relacionadas a respuestas neuromusculares. Estos alcances primarios promoverán investigaciones de control vectorial, operatividad, factibilidad y aplicabilidad comunitaria de extractos de A. muricata potenciados.












 uBio
uBio 


