Introducción
Los cachalotes (Physeteroidea) son un grupo de cetáceos altamente autapomórficos representados en la actualidad por tres especies, agrupadas en dos clados: Physeteridae con el cachalote Physeter macrocephalus como único representante y Kogiidae, incluyendo al cachalote enano Kogia breviceps y el cachalote pigmeo K. sima. Estos animales se diferencian del resto de cetáceos dentados debido a la presencia de una cuenca supracraneal excavada en la región dorsal del cráneo y una fuerte asimetría de las narinas óseas externas, ambas condiciones derivadas de la hipertrofia del complejo nasal (Huggenberger et al. 2016). Los modernos cachalotes son el ultimo remanente de un grupo que se origino en algún punto del Oligoceno temprano (Mchedlidze 1970) y alcanzó su máxima diversidad durante el Mioceno medio-tardío (Fordyce & Muizon 2001). Esta hiperdiversificación del grupo es atribuida a las condiciones marinas estables que se mantuvieron a lo largo del Optimo Climático del Mioceno medio-tardío (Marx & Uhen 2010), el cual beneficio no solo a este grupo, sino a otros cetáceos (Marx et al. 2016). Restos fósiles de cachalotes han sido hallados a lo largo de todo el mundo por más de 200 años; sin embargo, el registro fósil se ha limitado a dientes aislados o fragmentos craneales que no poseen caracteres diagnósticos. Esta situación se ha revertido durante los últimos 30 años con la descripción de varias especies en base a restos bien conservados, incluyendo seis especies de la Formación Pisco (Ica-Arequipa, Perú): Livyatan melvillei (Lambert et al. 2010), Acrophyseter deinodon Lambert et al. 2008, Acrophyseter robustus Lambert et al. 2017, Koristocetus pesceiCollareta et al. 2017, Scaphokogia cochlearis Muizon 1988 y Scaphokogia totajpeBenites-Palomino et al. 2020.
La Formación Pisco es una unidad geológica que se extiende por más de 300 km entre Ica y el norte de Arequipa (Fig. 1), con zonas que corresponden a transgresiones marinas de hasta 100 km tierra adentro (DeVries 1988). Los sedimentos de dicha formación oscilan entre los 13 y 4 millones de años (Fig. 1 A; DeVries 1998). Debido a la gran cantidad de fósiles conservados y buena preservación es considerada uno de los yacimientos fosilíferos cenozoicos mas importantes del planeta (Esperante et al. 2008). A lo largo de sus diversos afloramientos se han encontrado una gran cantidad de vertebrados e invertebrados que incluyen: cetáceos (Lambert & Muizon 2013), pinnípedos (Muizon & DeVries 1985), tiburones (Ehret et al. 2012), aves marinas (Stucchi 2007), cocodrilos (Kraus 1998), peces (Collareta et al. 2015), perezosos nadadores (Muizon et al. 2004) y moluscos (DeVries 1998).
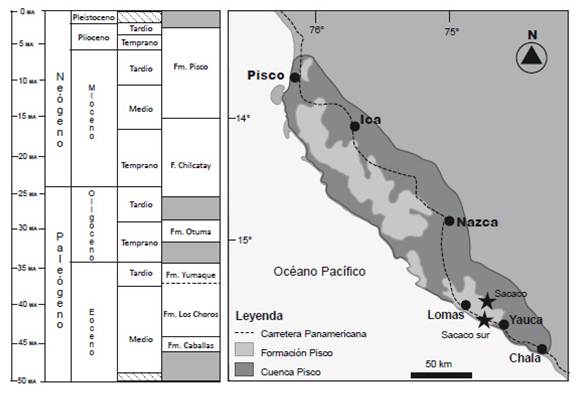
Figura 1 La Cuenca Pisco. Geología de las formaciones geológicas presentes en la Cuenca Pisco (izquierda) modificado de DeVries 1998. Mapa mostrando la extensión de la Formación Pisco dentro de la cuenca del mismo nombre, las estrellas indican las localidades del presente estudio (derecha).
Los análisis filogenéticos sugieren que durante el Mioceno los cachalotes divergieron en tres grandes linajes (Paolucci et al. 2020), que coexistieron hasta inicios del Plioceno. La mayoría de las especies de la Fm. Pisco pertenecen al grupo parafilético de los “cachalotes macroraptoriales” (e.g. Livyatan melvillei, Acrophyseter deinodon, A. robustus) caracterizados por poseer una gran fosa temporal además de dientes funcionales con esmalte en la mandíbula y el maxilar (Lambert et al. 2017). El segundo grupo presente son los Kogiidae, que incluyen a Scaphokogia cochlearis y Koristocetus pescei; reconocidos por la reducción del complejo nasal, presencia de una cresta facial sagital en la región dorsal del cráneo y su tamaño reducido (Velez-Juarbe et al. 2015, Collareta et al. 2017, Benites-Palomino et al. 2020). Hasta la actualidad no existen registros fósiles en el Perú del tercer grupo de cachalotes: los Physeteridae.
El registro fósil de Physeteridae es escaso y se encuentra predominantemente restringido al hemisferio norte; debido a esto, la composición de esta familia ha variado a lo largo de los últimos análisis filogenéticos (Velez-Juarbe et al. 2015, Lambert et al. 2017, Paolucci et al. 2020). Estos animales se distinguen del resto de physeteroideos debido a que poseen una cuenca supracraneal gigante, dientes reducidos de forma cónica sin esmalte, una fosa temporal reducida y una sínfisis mandibular larga no anquilosada. Aparte del moderno Physeter macrocephalus, se conocen en el registro fósil a Idiophyseter merriami y Aulophyseter morricei, del Mioceno de California. Otros taxones como Physeterula dubusi, Idiophorus patagonicus y Orycterocetus crocodilinus también caen dentro de Physeteridae; sin embargo, su posición ha variado siendo reconocidos como un clado aparte o grupos basales a los otro physetéridos. Esta variación en su posición filogenética se debe a que muchos de estos taxones se conocen en base a restos craneales fragmentarios, y a la ausencia de formas basales del Mioceno temprano o del Oligoceno tardío. El presente trabajo representa el primer registro de Physeteridae para la Formación Pisco, en base a dos dientes aislados provenientes del nivel Sacaco (SAO) del área de Sacaco (Fig. 1 B), Arequipa, Perú.
Material y métodos
Los restos hallados corresponden a dos dientes aislados provienen del área de Sacaco, Arequipa, Perú (Fig. 1). MUSM 2629 fue colectado en 1994 y MUSM 3905 fue colectado en el 2001, ambos por Carlos Martin. Los materiales motivo de estudio se encuentran depositados permanentemente en la colección del Departamento de Paleontología de Vertebrados del Museo de Historia Natural UNMSM.
Abreviaturas institucionales: MUSM: Departamento de Paleontología de Vertebrados, Museo de Historia Natural UNMSM, Lima, Perú.
Sistemática Paleontológica
Cetacea Brisson, 1762
Odontoceti Flower, 1867
Pan-physeteroidea Velez-Juarbe, Wood, de Gracia y Hendy, 2015
Physeteroidea Gray, 1821
Physeteridae Gill, 1879
Physeteridae indet.
(Figura 2)
Material referido: Horizonte y edad: MUSM 3905 (Fig. 2 A) proviene de la localidad de Sacaco, nivel de vertebrados Sacaco (SAO) con una edad estimada entre 5.75-5.89 Ma. MUSM 2629 (Fig. 2 B) proviene de Sacaco-sur, nivel de vertebrados Sud-Sacaco (SAS) con una edad estimada entre 5.93-6.59 Ma.
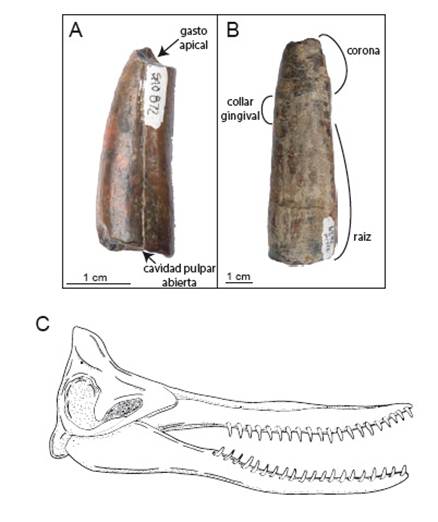
Figura 2 Physeteridae indet. SAO 872 (A) y MUSM 2629 (B), dientes en vista bucal, mostrando la ausencia de esmalte y desgaste apical. Reconstrucción del Physeteridae Orycterocetus crocodilinus, cercanamente emparentado a la forma presente en Sacaco.
Descripción: Ambos dientes presentan la morfología típica de la familia Physeteridae: forma cónica con una ligera curvatura medial, pérdida de esmalte, una ligera compresión lateromedial y raíz abierta. Dientes con características similares han sido asociados al género Orycterocetus del Atlántico norte (Kellogg 1965, Bianucci et al. 2004) o a Aulophyseter de California (Kellogg 1927); sin embargo, la morfología dentaria en Physeteroidea no permite identificación a nivel de género o especie. Es difícil determinar si los dientes pertenecen a individuos adultos debido a que en physeteroideos la raíz se mantiene abierta después de alcanzada la madurez (Fig. 2A, B), manteniéndose así hasta la senectud, y el patrón de desgaste de la corona puede ser variable en un mismo individuo (Evans et al. 2002). MUSM 3905 (Fig. 2A) alcanza una longitud máxima de 45.8 mm, 15.8 mm de diámetro labiolingual máximo y 17.4 mm de diámetro anteroposterior máximo. MUSM 2629 (Fig. 2B) alcanza una longitud máxima de 82.2 mm, 20.5 mm de diámetro labiolingual máximo y 25.3 mm de diámetro anteroposterior máximo. Este diente presenta una incisión lateral, que lo escinde longitudinalmente, revelando las capas estructurales de dentina con líneas de crecimiento, daño que podría haberse debido al uso del diente como en physeteroideos raptoriales (Lambert & Bianucci 2019), o a causas tafonómicas post mortem. Estas líneas de crecimiento se acumulan a manera de bisectriz, entre el ángulo formado por el eje longitudinal del diente y el plano horizontal del cráneo, condición también observada en el moderno Physeter (Ohsumi et al. 1963).
Discusión
Los registros de Physeteridae han estado predominantemente restringidos al hemisferio norte. Numerosos especímenes de Aulophyseter han sido colectados en la Formación Temblor de California (Mioceno medio 16-13 Ma.). Este también es el caso del genero Orycterocetus, con una alta cantidad de individuos encontrados en la Formación Calvert entre Maryland y Virginia. Ambas especies presentan un rostro largo y dientes cónicos afinados en el maxilar y la mandíbula, y evidencian una ligera variación intraespecifica. Idiophyseter merriami es otro physetérido poco conocido de California, cuyo rostro no se preservó. En base a la forma del premaxilar y el maxilar en la base del rostro, esta especie es reconstruida con el rostro corto, evidenciado que existieron morfologías de rostro corto, fuera de las típicas morfologías longirostras (Kellogg 1925). En Europa, se conoce a Physeterula dubusi descrito en base a fragmentos craneales del Mioceno superior (Lambert 2008). A diferencia de otros physetéridos, Physeterula posee una cuenca supracraneal moderadamente reducida y retiene dientes funcionales en el maxilar; sin embargo, estos dientes tampoco poseen esmalte y presentan el perfil cónico de Aulophyseter, Orycterocetus y los dientes reportados en este trabajo. Los pocos registros atribuibles a physetéridos en el hemisferio sur incluyen a Chile (Pyenson et al. 2014), Argentina (Pérez et al. 2011) y Micronesia (Fitzgerald 2011); sin embargo, estos registros corresponderían al grupo parafilético de los cachalotes macroraptoriales por la presencia de esmalte y el perfil engrosado del diente. La única especie de physetérido descrita en Sudamérica es Idiorophus patagonicus, del Mioceno inferior de Argentina, conocido por un cráneo parcial con mandíbula. A diferencia del resto de physetéridos esta especie retiene una pequeña lamina de esmalte en la corona (Lambert 2008), debido a esto los análisis filogenéticos la recuperan como miembro basal de la familia (Paolucci et al. 2020).
En el área de Sacaco, se habían atribuido anteriormente restos fragmentarios a la familia Physeteridae (Muizon & DeVries 1985, Muizon 1988). Sin embargo, dichos restos correspondían a fragmentos rostrales, mandíbulas y dientes aislados que no poseían ninguna de las sinapomorfias propias de la familia. Estos restos actualmente son referidos como Physeteroidea indet., debido a que los dientes poseían una corona con presencia de esmalte y a que los fragmentos mandibulares y rostrales retenían dientes funcionales bastante desarrollados. Contrariamente, los modernos Physeter macrocephalus basan su dieta en la captura de calamares por succión a grandes profundidades (Evans & Hindell 2004), debido a esto carecen de dientes funcionales en el maxilar. Los dientes mandibulares en Physeter carecen de función activa en la alimentación, e incluso en situaciones en que la mandíbula se encuentra dañada o deformada estos animales pueden alimentarse sin problemas (Spaul 1964). Adicionalmente, en Physeter la erupción de dientes ocurre a distintas edades y es parte de un marcado sistema de dimorfismo sexual: incluyendo casos en que los dientes pueden erupcionar muy tardíamente en las hembras (Whitehead 2009).
La retención de dientes funcionales de tamaño reducido en el maxilar y la mandíbula podría indicar una mayor capacidad raptora relacionada con una dieta piscívora (Lambert 2008, Lambert et al. 2014), en especies como Orycterocetus o Aulophyseter. En estos animales los dientes poseen una forma cónica-afinada con una ligera curvatura medial, muy similar a la reportada en este trabajo.
Durante el Mioceno tardío los ambientes de baja profundidad (e.g. bahías, archipiélagos, puntas y lagunas marinas) del antiguo litoral peruano creaban una serie de ambientes protegidos idóneos para el desarrollo de la fauna marina (Marocco & Muizon 1988). La presencia de physeteroideos en la Formación Pisco es conocida desde los trabajos pioneros de Muizon y DeVries (1985).
Se han descrito hasta la fecha cuatro especies de cachalotes provenientes del área de Sacaco, fuera de otras especies presentes en la región norte (Ocucaje) de la Formacion Pisco: Koristocetus pescei, Scaphokogia cochlearis, Scaphokogia totajpe y Acrophyseter deinodon (Benites-Palomino et al. 2020). La morfología craneana de estas especies indica que los nichos ecológicos no se superponían (Fig. 3), ocupando los cachalotes hipercarnívoros el pico de la cadena trófica (Lambert et al. 2014) y los kógidos restringidos a la succión (Collareta et al. 2017). Este nuevo registro de Physeteridae para el área indicaría que también existían cachalotes piscívoros en el área, que no competían con otras especies contemporáneas. La adición de estos nuevos restos al contexto de cetáceos de Sacaco indicaría que el área en el pasado era una región idónea para el desarrollo de estos animales, como anteriormente se había propuesto (Lambert & Muizon 2013).
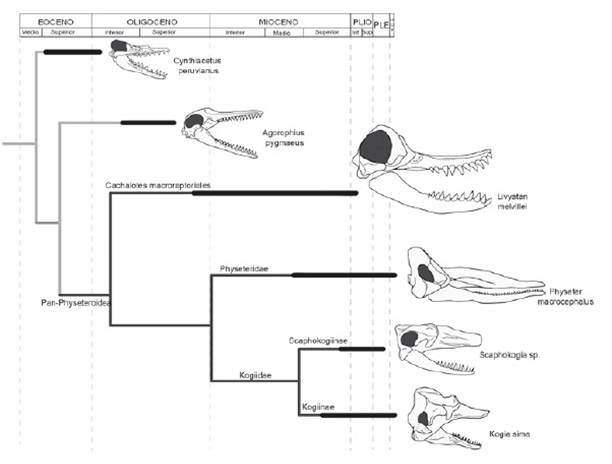
Figura 3 Árbol filogenético calibrado en el tiempo modificado de Lambert et al. (2017) mostrando las relaciones existentes entre los grupos de Physeteroidea, todos presentes en la Fm. Pisco. Las barras negras indican el rango temporal de los grupos y las reconstrucciones craneales (derecha) resaltan la variación de la fosa temporal entre las distintas morfologías.












 uBio
uBio 


