Introducción
La temperatura corporal es quizás la variable ecofisiológica más importante que afecta el rendimiento de los ectotermos (Angilletta et al. 2002). Cuando las poblaciones naturales están expuestos a estrés térmico, los individuos responden a través del movimiento, comportamiento o cambios fisiológicos (Narum et al. 2013). En particular, se conoce que las respuestas de los organismos acuáticos a la temperatura son la tolerancia, resistencia y preferencia (Jobling 1981). Por otro lado, la preferencia termal es el rango de temperatura donde los organismos se congregan por mayor tiempo o se adaptan al entorno térmico (Reynolds & Casterlin 1979, Hernández & Bückle 1997) y es el indicador del requerimiento termal donde las especies son fisiológicamente estables (Díaz et al. 2002, González et al. 2010, García-Guerrero et al. 2013).
La preferencia termal final se puede determinar tanto por el método gravitacional, en el que los animales se dejan en un gradiente durante un período prolongado, o por el método agudo el cual es el más utilizado, y consiste en una estimación gráfica o matemática a partir de los resultados de experimentos a corto plazo; en ambos casos los animales son aclimatados a diferentes temperaturas (Lagerspetz & Vainio 2006, Reiser et al. 2014).
La preferencia termal final determinada por el método agudo es alta en crustáceos de climas tropicales; por ejemplo, en postlarvas y juveniles de Macrobrachium rosenbergii es de 29 °C y 31 °C respectivamente (DíazHerrera et al. 1993), en juveniles de M. acanthurus es 29.5 °C (Díaz et al. 2002), en M. occidentale de 27.2 °C (Hernández 2008) y en M. tenellum de 32.25 °C (Rodríguez et al. 2012). En cambio, en crustáceos de climas templados, la preferencia termal final es menor, como en Cherax quadricarinatus que es de 24.1 °C (Hernández 2008), en Orconectes rusticus de 22.1 °C (Mundahj & Benton 1990) y en Procambarus clarkii de 23.4 °C (Espina et al. 1993, Bückle et al. 1996).
Los camarones anfídromos realizan migraciones estacionales a lo largo del río para reproducción y crecimiento (Bauer 2013), en ellas experimentan diferentes condiciones ambientales y nutricionales. En el de Cryphiops caementarius (Molina 1782), solo los machos migran hasta los 1400 m de altitud, donde la temperatura del agua es cercana a los 16 °C (Amaya & Guerra 1976, Méndez 1981, Wasiw & Yépez 2015), y en algunos ríos las hembras llegan hasta los 1000 m (Zacarías & Yépez 2015, Wasiw & Yépez 2017). Además, esta especie habita en casi todos los ríos de la costa del Perú, donde la temperatura varía estacionalmente entre 16 y 29 °C (Wasiw & Yépez 2015, Zacarías & Yépez 2015), aunque también se distribuye hasta el río Maipo en Chile cuya temperatura varía entre 10.5 y 24.5 °C (Bahamonde & Vila 1971, Jara 1997).
La amplia distribución latitudinal y altitudinal de C. caementarius ya es indicador de que los camarones están capacitados para soportar variaciones de temperatura del agua. De acuerdo con Morris y Airriess (1998), los crustáceos de hábitats térmicamente variables deben tener un conjunto integrado de respuestas compensatorias a la fluctuación de temperatura. El único estudio termal con C. caementarius fue realizado sin aclimatación previa, y se observó que los adultos toleraban temperaturas entre 10 y 32 °C durante 5 h (Viacava et al. 1978). Esta información no es suficiente para establecer la ecología termal de la especie, toda vez que la aclimatación es importante para borrar algún efecto del origen geográfico (Nielsen & McGraw 2016). Por consiguiente, no se conoce el efecto de las temperaturas de aclimatación en la preferencia termal de ejemplares machos adultos, los cuales tienen migraciones de mayores distancias altitudinales, crecen más que las hembras (Viacava et al. 1978) y tienen potencial para cultivo comercial (Brack 2000). Por otra parte, el conocimiento de la ecología termal permitirá evaluar en un futuro cercano, si el cambio climático afectará la preferencia termal, como sucede en M. tenellum (Rodríguez et al. 2012). Por estos motivos, en este trabajo se determina la preferencia termal de machos adultos de C. caementarius previamente aclimatados a diferentes temperaturas.
Material y métodos
Material biológico.Los camarones se colectaron en el río Pativilca cerca del centro poblado Huayto (10°39’50"S, 77°40’02"W), Lima, Perú, en mayo de 2018, y en dicho lugar, la temperatura del agua fue de 19.2 °C. En el Laboratorio de Acuicultura Ornamental de la Universidad Nacional del Santa, C. caementarius fue reconocido siguiendo la clave taxonómica de Méndez (1981) y los ejemplares machos se verificaron por la presencia de gonóporos en los coxopoditos del quinto par de periópodos. Los camarones seleccionados (n = 90) de tamaños y pesos uniformes (p>0.05) (54.57 ± 2.57 mm de longitud total y 5.61 ± 0.44 g de peso total), tuvieron apéndices cefalotorácicos completos y no mostraron signos de laceraciones en el cuerpo.
Aclimatación termal.Los camarones se aclimataron en un sistema de cultivo individual (Reyes 2012) que evita la interacción y el canibalismo. Este sistema consistió de nueve acuarios de vidrio (55 L), cada uno con 10 recipientes de plástico (13 cm de diámetro, 5.5 cm de altura). Las paredes de los recipientes tuvieron orificios (3 cm de largo por 0.5 cm de ancho) para permitir el flujo de agua y, en cada recipiente, se adhirió un tubo de PVC (½" Ø) que sobresalió del nivel del agua y por donde se alimentaba a los individuos. En cada recipiente se sembró un camarón (10 camarones por acuario). En estas condiciones, los camarones se mantuvieron durante 30 días a temperatura de laboratorio (19.4 ± 0.6 °C) para borrar algún efecto del origen geográfico y para que tuvieran similar historia termal (Nielsen & McGraw 2016).
Las temperaturas del agua para aclimatación se establecieron de acuerdo con la temperatura del agua de los ríos donde abunda C. caementarius (Zacarías & Yépez 2015) y fueron de 19.4 ± 0.5 °C (control), 24 °C y 28 °C. En estas condiciones, los camarones se mantuvieron durante 30 días en aclimatación termal. La temperatura del agua deseada se mantuvo con termorreguladores sumergibles de 100 W (Sebo®, ± 0.5 °C), excepto el control que tuvo variación ambiental. Los camarones se alimentaron con alimento balanceado (28% proteína cruda) y el nivel de alimentación fue del 6% de su peso húmedo. La ración diaria (08:00 y 19:00 h) fue dividida en iguales proporciones. El fotoperiodo fue natural (11:30 horas luz) entre julio y agosto de 2018.
Gradiente termal.El sistema de gradiente horizontal termal fue similar al empleado por García-Guerrero et al. (2013) y consistió de una canaleta de PVC (3 m de longitud y 10 cm de profundidad). Dentro de la canaleta se colocaron divisiones con láminas de poliestireno expandido con una abertura en la parte inferior (4 cm de largo por 4 cm de alto) para permitir la circulación del agua y el libre desplazamiento de los camarones. Las divisiones fueron separadas cada 20 cm de longitud, con lo cual se formaron 18 compartimentos. Para lograr el gradiente térmico (12°C a 33°C), la canaleta se llenó con agua (8 cm de altura) y en un extremo se colocaron termorreguladores sumergibles de 100 W (Sebo®) y en el otro extremo se colocaron bolsas con hidrogel congelado. En cada compartimento se colocó un difusor de aire (0.5 L min-1) para evitar estratificación térmica. La temperatura del agua de cada compartimento se registró con termómetro digital (± 0.1°C). La concentración de oxígeno disuelto se registró con Oxímetro HI 9146 (± 0.01 mg L-1) y varió entre 5.75 a 9.50 mg L-1. La relación de la temperatura (T) con el oxígeno disuelto (OD) se expresó mediante la siguiente ecuación OD = −0.1578 T + 11.205, con un R2 = 0.9337. El sistema se probó una semana antes de iniciar el experimento y la ecuación resultante entre la temperatura (T) de cada compartimento (C) fue T = 1.3073 C + 8.7137, con un R2 = 0.9961.
Preferencia termal.La preferencia termal se determinó por el método agudo descrito por Reynolds y Casterlin (1979), el cual consistió en introducir un camarón en el compartimento de la canaleta cuya temperatura del agua fue más cercana a la temperatura de aclimatación. Luego, se esperó 30 min para que el camarón se oriente en el sistema. La primera observación se realizó después de 10 min del período de orientación y las siguientes cada 10 min hasta completar 15 observaciones. Este procedimiento se aplicó a los demás camarones. Durante las pruebas, se evitó acercarse al sistema de gradiente termal para no perturbar a los camarones, excepto, cuando se registró la ubicación de ellos en los compartimentos, lo cual se hizo con cuidado. En cada observación se verificó la temperatura del agua del compartimento donde se ubicó el camarón. Para cada prueba se empleó un camarón, para evitar alteración de la distribución de la especie dentro del gradiente termal, debido a la interacción agresiva entre congéneres. Las pruebas se realizaron entre las 08:00 a 14:00 h durante agosto de 2018. No hubo muertes de camarones durante los 15 días posteriores a la prueba termal.
El movimiento de los camarones en el sistema de gradiente termal fue expresado por dos métodos: (1) movimiento según cambios de temperatura: como resultado del cambio de temperatura cada 50 min según la ubicación de los camarones en el sistema de gradiente termal (Lewis & Ayers 2014), y (2) movimiento según temperatura promedio: obtenida por la ubicación de los camarones a lo largo del gradiente termal durante el periodo de prueba. La preferencia termal final se determinó gráficamente por la intersección de la preferencia termal y la temperatura de aclimatación, con la línea de equilibrio termal (Reynolds & Casterlin 1979). El intervalo de confianza de la preferencia termal para cada temperatura de aclimatación fue considerado como zona óptima termal (Cumillaf et al. 2016). La desviación estándar de la media de cada preferencia termal fue considerada como zona de dispersión termal.
Análisis de datos.Los datos se procesaron como media ± desviación estándar. La normalidad de los datos se determinó con la prueba de Kolmogorov-Smirnov. La diferencia entre las medias de los tratamientos se determinó por análisis de varianza de una vía y con la prueba de Tukey. En todos los análisis se empleó significancia del 5%. Los datos se procesaron con el programa estadístico SPSS versión 23 para Windows.
Resultados
Movimiento de camarones según cambios de temperatura.Durante los tres periodos de cambios de temperatura el movimiento de los camarones fue diferente entre tratamientos (p<0.05). Los camarones aclimatados a 19 °C redujeron sus movimientos abruptamente (de ∆T 6 °C hasta ∆T 1.2 °C) en el gradiente termal a partir de 100 - 150 min. Los camarones aclimatados a 24 °C tuvieron lento movimiento en los primeros 0 - 50 min (∆T 0.3 °C) pero hubo ligero incremento hasta los 50 - 100 min (∆T 1.2 °C) para luego incrementar abruptamente hasta a los 100 - 150 min (∆T 5.6 °C). El movimiento de los camarones aclimatados a 28 °C fue mayor al comienzo (∆T 10.6 °C), luego disminuyó (∆T 3.2 °C) hasta los 50 - 100 min, para luego incrementar hasta los 100 - 150 min (∆T 6 °C) (Fig. 1).
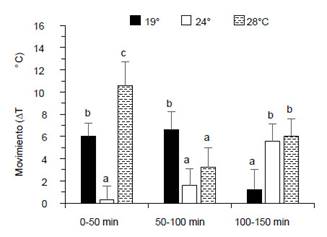
Figura 1 Movimiento de machos de C. caementarius aclimatados a diferentes temperaturas, según cambio de temperatura (∆T °C) durante tres periodos de observaciones a lo largo del gradiente termal. Letras diferentes sobre las columnas en un mismo período de observación indica diferencia significativa (p<0.05).
Movimiento de camarones según temperatura promedio.Los camarones aclimatados a 19 °C tuvieron mayor desplazamiento a compartimentos con temperaturas más altas que su temperatura de aclimatación (Fig. 2A), y aquellos aclimatados a 28 °C se desplazaron a compartimentos con temperaturas más bajas que aquella de aclimatación (Fig. 2C). En cambio, en los camarones aclimatados a 24 °C el mayor desplazamiento fue alrededor de su temperatura de aclimatación (Fig. 2B). La especie evitó temperaturas >31 y <12 °C.
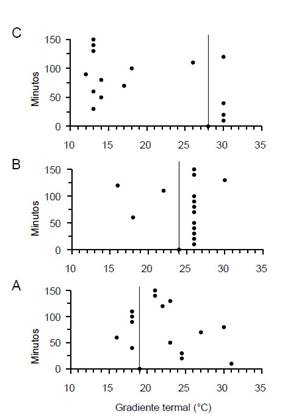
Figura 2 Movimiento de machos de C. caementarius a lo largo del gradiente termal. A) Camarones aclimatados a 19 °C. B) Camarones aclimatados a 24 °C. C) Camarones aclimatados a 28 °C. La línea vertical indica la temperatura de aclimatación.
Preferencia termal.De acuerdo a los resultados de los métodos de medir el movimiento de los camarones dentro del sistema de gradiente termal, la preferencia termal se calculó con el segundo método; es decir, con la temperatura promedio obtenida durante el periodo de prueba. El incremento de la temperatura de aclimatación de 19 °C a 24 °C ocasionó incremento de la preferencia termal de 22.7 ± 3.8 °C a 24.8 ± 2.6 °C, respectivamente, aunque sin diferencias significativas (p>0.05). La temperatura de aclimatación de 28 °C ocasionó disminución de la preferencia termal a 21.1 ± 4.9 °C, la cual solo fue diferente (p<0.05) con los aclimatados a 24°C. La zona óptima calculada mediante el intervalo de confianza de la preferencia termal fue entre 19.3 y 25.7 °C. La zona de dispersión termal fue entre 16.2 y 27.4 °C. La preferencia termal final fue de 24.5 °C (Fig. 3).
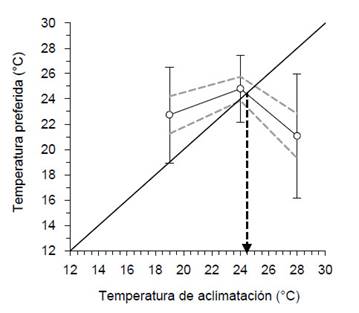
Figura 3 Preferencia termal de machos de C. caementarius aclimatados a diferentes temperaturas. Los círculos blancos representan las medias, las líneas verticales la desviación estándar y las líneas punteadas el intervalo de confianza al 95% para la media. La línea de 45° representa la línea de equilibrio termal. La flecha vertical indica la preferencia termal final.
Discusión
En el presente estudio se determinó que la temperatura de aclimatación afectó la preferencia termal de los machos adultos de C. caementarius, considerando las condiciones de un sistema tubular de gradiente termal. En experimentos con gradientes termales, un posible error es el uso de aparatos en forma de cajas o tubos donde los individuos se acumulan en las esquinas de la caja o en los extremos del tubo (Lagerspetz & Vainio 2006). En nuestra investigación, se empleó un individuo por cada prueba y el desplazamiento de los animales no tuvo obstáculos, lo que demostró que la canaleta de gradiente termal empleada no afectó el comportamiento termal de los machos de C. caementarius.
Además, la evaluación del movimiento de los camarones en el sistema de gradiente termal para determinar la preferencia termal fue diferente entre los métodos empleados. En adultos de Cancer borealis aclimatados a diferentes temperaturas, el movimiento dentro del gradiente termal se redujo hasta un cambio de 1 °C después de 40 min, y fue utilizado para determinar la preferencia termal aguda de dicha especie (Lewis & Ayers 2014). Este comportamiento no fue observado en machos de C. caementarius, pues el movimiento en relación al cambio de temperatura fue errático. Por consiguiente, el método de Lewis y Ayers (2014), utilizado en un crustáceo marino, no es confiable para determinar la preferencia termal de machos de C. caementarius, probablemente por habitar diferentes ambientes acuáticos, por lo que se optó por utilizar los datos del movimiento del camarón según la temperatura promedio.
Los machos de C. caementarius aclimatados a 19 °C se desplazaron a compartimentos con temperaturas más altas que su temperatura de aclimatación y los aclimatados a 28 °C buscaron temperaturas más bajas. En cambio, los camarones aclimatados a 24 °C se desplazaron a compartimentos cuya temperatura fue alrededor de su temperatura de aclimatación. Estos resultados están de acuerdo con Lagerspetz y Vainio (2006) quienes consideraron que los crustáceos muestran una baja actividad locomotora en la temperatura preferida, y altas respuestas también son posibles. Además, el movimiento de los camarones en el sistema de gradiente termal demostró la gran capacidad que tuvieron para la exploración de ambientes en busca de temperaturas que se ajusten a sus requerimientos fisiológicos. Aun cuando no se conocen termorreceptores en C. caementarius, ellos percibieron la temperatura del agua porque ocasionó desplazamiento en el sistema de gradiente termal. En la langosta Homarus americanus tampoco se conocen termorreceptores, pero puede sentir aumentos y disminuciones en la temperatura del agua de más de 1 °C y tan pequeñas como 0.15 °C (Jury & Watson 2000) y en Uca panacea y U. pugilator, el quelípodo mayor del macho está involucrado en la termorregulación (Windsor et al. 2005, Darnell & Munguia 2011).
En el ambiente natural, los adultos de C. caementarius son inactivos en el día y permanecen escondidos debajo de piedras y de la vegetación acuática (Bahamonde & Vila 1971), pero en las pruebas de laboratorio, los desplazamientos que realizaron dentro del sistema de gradiente termal fueron durante el día, lo que sugiere que la hora o la luz del día no fueron obstáculos para que ellos busquen condiciones termales adecuadas para su confort, de ahí que evitaron temperaturas >31 °C y <12 °C que probablemente sean temperaturas críticas que es necesario investigar. Similares resultados de exploración general del ambiente se obtuvieron en C. borealis, que demuestra capacidad termotáctica para alejarse de temperaturas demasiado altas o bajas (Lewis & Ayers 2014).
Los machos adultos de C. caementarius aclimatados en alta temperatura (28 °C) tuvieron una preferencia termal de 21.1 °C, similar (p>0.05) a los aclimatados a 19°C que fue de 22.7 °C, pero diferente con los de 24 °C que fue de 24.8 °C. Esta disminución de la preferencia termal cuando la temperatura de aclimatación fue alta, también sucede en M. rosenbergii (Díaz-Herrera et al. 1993) y M. acanthurus (Díaz et al. 2002), aunque ninguna explicación es dada para dichos resultados. Sin embargo, de acuerdo con el amplio movimiento de C. caementarius aclimatados en alta temperatura, que se interpreta como exploración del ambiente, indicaría que ellos evitan el estrés termal. Este comportamiento está de acuerdo con Narum et al. (2013), quienes consideraron que cuando hay estrés térmico, los individuos pueden intentar evitarlo a través del movimiento, el comportamiento o los cambios fisiológicos. Además, este amplio movimiento que realizaron los camarones indicaría que en caso que haya incremento de temperatura en el ambiente natural ellos serían vulnerables a la predación. Es conveniente estudiar la tolerancia termal de la especie sobre los 28 °C para dilucidar algunos detalles del comportamiento termal.
Además, los resultados de preferencia termal sugieren que los machos adultos de C. caementarius evitan altas temperaturas probablemente para que no afecte su condición reproductiva y su actividad metabólica. En los machos de Penaeus setiferus, la alta temperatura (30 °C) del agua ocasiona degeneración del tracto reproductivo y melanización de espermatóforos y es preferible mantenerlos entre 25 y 27 °C (Pascual et al. 1998). En machos de Litopenaeus vannamei, las altas temperaturas (29 y 32 °C) del agua afectan la viabilidad de espermatozoides, y por ello se mantienen en su temperatura preferida (26 °C) y óptima para reproducción (Pérez-Velásquez et al. 2001, González et al. 2010). En adultos de M. tenellum, la mayor temperatura de aclimatación (32 °C) posiblemente afecte la salud de los gametos por malformaciones de los espermatozoides (Hernández-Sandoval et al. 2018). Aunado a todo esto, en M. rosenbergii, la exposición a alta temperatura (35 °C) afecta el tejido branquial y puede sufrir estrés respiratorio debido a la alta tasa metabólica (Manush et al. 2007).
La zona termal óptima del agua para machos de C. caementarius, calculada con el intervalo de confianza de la preferencia termal, fue entre 19.3 y 25.7 °C, pero, por ser el primer registro termal que se obtiene para la especie, se requiere de un estudio de confirmación, que podría estar relacionado con su crecimiento en dichas condiciones termales. En cambio, la zona de dispersión termal de los camarones fue más amplia (de 16.2 a 27.4°C), y está de acuerdo con la variabilidad estacional de la temperatura del agua que se registra en la distribución latitudinal de la especie, principalmente donde hay mayor densidad poblacional (Viacava et al. 1978, Méndez 1981, Wasiw & Yépez 2015). De acuerdo con Giomi et al. (2016), la variabilidad de las respuestas térmicas dentro de la población es el reflejo de diferentes historias térmicas individuales, incluida la aclimatación a corto plazo en las variaciones ambientales. En este sentido, el rango de temperatura de la zona de dispersión termal, indicaría que la especie respondió de acuerdo con las condiciones termales del origen geográfico, pues los camarones procedieron del río Pativilca (10° S) donde la temperatura varía entre 19 y 22 °C (Llanos 1980), pero en los ríos de Arequipa donde hay mayor densidad poblacional varía entre 16 y 29 °C (Wasiw & Yépez 2015, Zacarías & Yépez 2015); y en el río Maipo en Chile (33° S), que es el límite de distribución sur, la temperatura fluctúa entre 10.5 y 24.5 °C (Bahamonde & Vila 1971; Jara 1997).
La preferencia termal final de 24.5 °C determinado por primera vez en machos adultos de C. caementarius, indica ser la temperatura en la cual, el organismo se encuentra con sus funciones vitales normales (González et al. 2010, García-Guerrero et al. 2013) y está de acuerdo con la preferencia termal final de especies de climas templados, como en juveniles, preadultos y adultos de P. clarkii que es de 23.4 °C (Espina et al. 1993, Bückle et al. 1996), en juveniles de C. quadricarinatus de 24.1 °C (Hernández 2008) y en postlarvas de P. monodon de 23.2°C (Chen & Chen 1999). Aunque no se conoce si otros estados ontogenéticos de C. caementarius tienen similar preferencia termal que los adultos, la preferencia establecida para machos adultos será de utilidad para ubicar lugares como: donde mantener reproductores, donde realizar el engorde de camarones; así como también, conocer si el cambio climático afectaría la preferencia termal del adulto de C. caementarius.












 uBio
uBio 


