Introducción
Los humedales son extensiones de pantanos, marismas, turberas o superficies cubiertas de agua, de régimen natural o artificial, permanentes o temporales, estancadas o corrientes, dulces, salobres o saladas, incluyendo las extensiones de agua marina cuya profundidad en marea baja no excede los seis metros según la Convención Ramsar (Troya 1989). En regiones áridas como la costa del Perú, los humedales se forman por el afloramiento de la capa freática en zonas de baja altitud y cercanas al mar (Arana & Salinas 2003). Presentan una biota particular caracterizada por tener plantas enraizadas con adaptaciones al hábitat inundado, generando un refugio para la fauna silvestre pues aportan agua y una alta productividad primaria (Keddy 2010).
Según ProNaturaleza (2010), en el litoral peruano se conocen 95 humedales, de los cuales la laguna Medio Mundo, Paraíso, Pantanos de Villa, Puerto Viejo y Caucato están entre los más importantes del centro del Perú. Estos humedales albergan una gran diversidad de flora (Ramírez & Cano 2010, Aponte & Cano 2013) y fauna; siendo los más estudiados los protozoarios (Guillén et al. 2003, Paredes et al. 2007), nemátodos (Guillén et al. 2003, Paredes et al. 2007), moluscos (Vivar et al. 1998), insectos acuáticos y semiacuáticos (Blancas 1976, 1978, Iannacone & Alvariño 2007), arácnidos (Duárez 1998, Paredes 2010), peces (Castro et al. 1998), anfibios y reptiles (Icochea 1998) y poblaciones de aves residentes y migratorias (Torres et al. 2006, Pisconte 2010, Iannacone et al. 2010, Pulido 2018). Sin embargo, la diversidad y el estado de conservación de los mamíferos de los humedales de la costa ha sido poco explorada, conociéndose únicamente dos estudios. Tovar (1977) reportó para la laguna Medio Mundo a la rata Rattus rattus Linnaeus y al zorro Lycalopex sechurae (Thomas) (reportado como Dusicyon sechurae). Posteriormente, Pacheco et al. (2015) reportaron ocho especies de mamíferos para los Pantanos de Villa entre ellos el cuy silvestre Cavia tschudii y una posible especie nueva de Akodon.
Por ello, el presente estudio pretende: 1) documentar la diversidad de los mamíferos pequeños en cuatro humedales de la costa central del Perú, en un rango de 3 grados de latitud y con una elevación 0 50 m de altitud, 2) determinar la abundancia relativa de mamíferos no voladores y la actividad relativa de los murciélagos, 3) analizar la diversidad β entre los cuatro humedales, y 4) discutir el estado de conservación de los humedales de la costa peruana.
Material y métodos
Se realizaron tres evaluaciones en la albufera de Medio Mundo (2013, 2014 y 2015), dos en Caucato (2011 y 2012), cinco en Pantanos de Villa (del 2004 al 2015) y dos en la ensenada San Antonio (2013 y 2015) (Fig. 1). En este último lugar solo se evaluó el componente de murciélagos mediante registros acústicos.
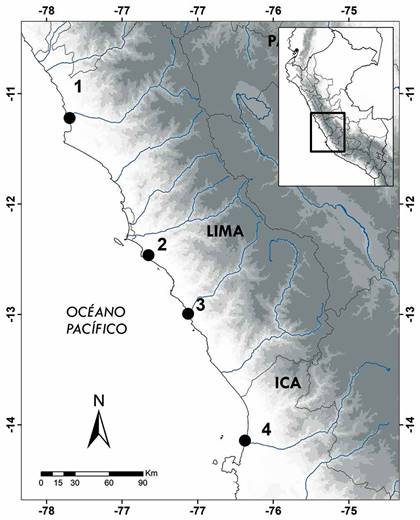
Figura 1 Mapa de los humedales muestreados en el centro del Perú. 1= Albufera Medio Mundo, 2= Refugio de vida silvestre Pantanos de Villa, 3= Ensenada San Antonio y 4= Humedal de Caucato.
Humedal de Albufera de Medio Mundo.Ubicado en el kilometro 175 de la Panamericana Norte en el distrito de Végueta, provincia de Huaura, Lima (11°6'24"S,77°36'18"W) a una elevación que va desde el nivel del mar hasta 50 m de altitud. Tiene un área aproximada de 271.60 ha en la que destacan 4 comunidades de vegetación según Aponte y Ramírez (2011): la comunidad de plantas anfibias de borde de laguna, dominada por Cyperus laevigatus Linnaeus y Chenopodium petiolare Kunth; la comunidad de gramadal dominada por Distichlis spicata (Linnaeus) Greene y Sarcocornia neei (Lagasca) Alonso y Crespo; la comunidad dominada por Lippia nodiflora Michx, que se encuentra muy cerca al gramadal del lado este del humedal; y la comunidad de juncal donde predomina Schoenoplectus americanus (Persoon) Schinz y Séller y especies de borde de laguna como Typha domingensis Persoon, Schoenoplectus californicus (Meyer) Steudel y Bolboschoenus maritimus (Linnaeus) Palla. La "verdolaga de puerco" Bacopa monnieri (Linnaeus) Pennell fue registrada indistintamente en diferentes comunidades (Aponte & Ramírez 2011). Creada como Área de Conservación Regional en el 2007 (D.S. Nº 006-2007-AG).
Refugio de vida silvestre Pantanos de Villa.Ubicado en el distrito de Chorrillos, provincia de Lima (12°11'42"S, 76°58'42"W) a una elevación de 0 5 m de altitud y un área aproximada de 263.27 ha. Entre los tipos de vegetación presentes encontramos asociaciones de gramadal en suelos arenosos cuya especie predominante es Distichlis spicata "grama salada", vegas de ciperáceas (Schoenoplectus americanus) en suelo saturado con hierbas de 0.5 a 1 m de alto, gramíneas como Paspalum vaginatum Swartz y totorales con Typha domin-gensis al borde de los espejos de agua (Cano et al. 1993). Creada como área de conservación en el 2006 (D.S. Nº 055-2006-AG).
Ensenada San Antonio.Se encuentra al sur del departamento de Lima, en el distrito de San Antonio, provincia de Cañete, cercano al límite con la provincia de Lima a dos kilómetros al sur de la playa León Dormido (12°39'40"S, 76°39'51"W). La característica más resaltante de este último humedal es la escasa cobertura de totora y zonas arbustivas en los bordes del cuerpo de agua, encontrando el perímetro cubierto por densas matas de gramíneas, ciperáceas y una franja de grama salada que cubre gran parte del suelo arenoso alejado del borde del humedal. Su flora y fauna aún no se ha caracterizado. Según ProNaturaleza (2010) corresponde a un humedal de origen artificial conocido también por el nombre "Las Hienas."
Humedal de Caucato.Se ubica en el distrito de San Clemente, Pisco, Ica (13°40'02"S, 76°12'43"W), con un área aproximada de 250 ha y una elevación de 0 30 m de altitud. Caucato está rodeado de un grupo de colinas no muy altas, que no sobrepasan los 113 m, y tiene los siguientes tipos de vegetación: el totoral que está conformado por Typha angustifolia Linnaeus, se localiza sobre suelo inundado, es fangoso y con grandes cantidades de detritus orgánico; el juncal conformado por diferentes especies de plantas asociadas, pero con predominio por Schoenoplectus americanus, cubriendo una gran superficie del humedal; el gramadal, asociación vegetal en la que predomina la grama salada Distichlis spicata y Sporobolus virginicus (Linnaeus) Kunth; y campos de cultivo de maíz, algodón y productos de pan (ProNaturaleza 2010). No está en ninguna categoría de conservación.
Métodos de captura convencional.Se empleó una evaluación convencional con trampas de captura y redes de neblina (Voss & Emmons 1996, Pacheco et al. 2007, Lim & Pacheco 2016). Para los mamíferos pequeños terrestres se emplearon trampas de golpe (Museum Special y Victor rat trap) que sacrifican a los animales al capturarlos y trampas de captura viva (Sherman y Tomahawk). Las trampas en transectos fueron dispuestas en estaciones separadas por aproximadamente 10 m, cada estación con una trampa de golpe y otra de captura viva, y dispuestas en un hábitat relativamente homogéneo. El cebo consistió en una mezcla de avena, mantequilla de maní, vainilla, miel de abeja, pasas y semillas para canarios (10:3:1:1:1). Las trampas fueron armadas en la tarde, revisadas en las primeras horas de la mañana y cebadas en la tarde.
Para los mamíferos pequeños voladores se utilizaron redes de niebla (12 m o 6 m de largo por 2.5 m de ancho) en sitios óptimos como totorales y sitios abiertos a las lagunas. Las redes se abrieron a las 17:00 horas y fueron revisadas cada hora hasta las 24:00 h.
El esfuerzo de captura se expresó como trampas noche (TN) para el caso de los pequeños mamíferos terrestres y como redes noche (RN) para los mamíferos voladores.
Método acústico.Para el registro acústico se siguió el procedimiento de "monitoreo activo en transectos acústicos" (Kingston 2016) empleando el detector de ultrasonido Pettersson D240x (Pettersson Electronik AB, Uppsala, Suecia) en modo heterodino y tiempo expandido para detectar y transformar los pulsos ultrasónicos de los murciélagos en secuencias audibles para el oído humano de hasta 34 segundos de duración. Además, el detector se conectó a grabadoras digitales Marantz PMD 661 y Tascam DR-100 configuradas para generar archivos de sonido en formato PCM wav con una resolución virtual de 16 bits a una frecuencia de muestreo de 44.1 kHz (Malo de Molina et al. 2011).
El registro acústico se llevó a cabo en un recorrido lineal por el borde de los humedales con estaciones separadas por 40 m, considerando un radio funcional de detección de 20 m, donde se realizaron grabaciones por 15 minutos. Se evaluaron 8 horas por noche en dos períodos, de 18:00 a 22:00 y de 02:00 y 06:00. Los registros acústicos se analizaron en busca de llamadas o pases de murciélagos mediante la visualización de espectrogramas en el programa Avisoft SAS-Lab Pro 5.2 con una frecuencia de muestreo de 44.1 kHz, FFT (Fast Fourier Transform) de 256 puntos de longitud, superposición de 75% entre ventanas de Hamming y factor de expansión temporal de 1:10. De cada llamada se seleccionaron pulsos en fase de búsqueda de buena calidad para medir seis parámetros acústicos adaptados de la evaluación acústica de Pacheco et al. (2015): Frecuencia de máxima amplitud (Fmax), frecuencia inicial (FI), frecuencia final (FF), ancho de banda (BW) equivalente a la diferencia entre FI y FF, duración del pulso (DP) e intervalo entre pulsos consecutivos (IP). Adicionalmente, se registró el número de armónicos en cada pulso, armónico de mayor intensidad (AMI) y se asignó una secuencia de componentes; frecuencia modulada (FM) o cuasiconstante (QCF) siguiendo a Jung et al. (2007) y se clasificó la orientación como ascendente o descendente.
La lectura de los parámetros acústicos y la comparación con grabaciones referenciales obtenidas de individuos capturados, bibliotecas acústicas y bibliografía de estudios bioacústicos (Arias-Aguilar et al. 2018, Collen 2012, Jung et al. 2014, Jung & Kalko 2011, Ossa 2010, Ossa et al. 2018, Pacheco et al. 2015, Rivera-Parra & Burneo 2013) permitieron una identificación a priori de las especies. Se validó el porcentaje de asignaciones correctas mediante un análisis de función discriminante y se calcularon la media y desviación estándar para cada parámetro acústico de cada especie. El esfuerzo de muestreo se obtuvo multiplicando el número de horas evaluadas, noches y detectores de ultrasonido empleados.
Procesamiento de muestras.Los especímenes capturados fueron fijados en formol al 10% y preservados en alcohol al 70% para su conservación definitiva, con o sin el cráneo removido. Algunos especímenes se prepararon como piel, cráneo y carcasa para mantener características externas como coloración de piel y textura. Seguimos los protocolos para la eutanasia de los animales de la American Society of Mammalogists (Sikes et al. 2016). Los especímenes y los archivos de sonido obtenidos durante las sesiones de grabación se encuentran depositados en la colección científica del Departamento de Mastozoología del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos, Lima, Perú (MUSM). Los especímenes fueron identificados mediante comparación con especímenes de la colección. La nomenclatura se basó en Pacheco et al. (2009) y tentativamente se sigue la propuesta de Myotis bakeri en lugar de M. atacamensis para la región de Lima (Moratelli et al. 2019).
Se registraron los datos del lugar de muestreo y tipo de hábitat. Se tomaron las medidas estándar (longitud total, de la cola, del pie y oreja; y del antebrazo y el trago para los murciélagos); además del peso, sexo, edad y la condición reproductiva de cada espécimen colectado. Adicionalmente se preservaron en alcohol de 95°, fecas, ectoparásitos y endoparásitos y tejidos (músculo) para estudios posteriores.
Análisis de la comunidad.Para determinar el número de especies esperadas de mamíferos pequeños no voladores y voladores respecto al esfuerzo de muestreo se calcularon curvas de acumulación de especies para cada comunidad mediante la ecuación de Clench usando los programas EstimateS versión 6 (Colwell 2000) y Statistica (StatSoft Inc. 2003), considerando que una representación adecuada de la comunidad es alcanzada cuando se registra más del 70% de especies esperadas (Jiménez-Valverde & Hortal 2003).
La abundancia relativa (AR) fue determinada en relación con el esfuerzo de captura empleado. En mamíferos no voladores la AR es el número de individuos capturados (incluyendo los liberados) por cada 100 TN, y en el caso de los murciélagos es el número de individuos capturados por cada 10 RN (Pacheco et al. 2007, 2015). En esta evaluación se obtuvo un total de 4651 trampas noche (TN) y 27 redes noche (RN). Los esfuerzos por cada humedal se presentan en la Tabla 1. Debido a que el registro acústico no permite estimar abundancias porque no se garantiza que todas las grabaciones procedan de individuos diferentes, se determinó la actividad relativa en cada humedal, la cual fue representada por la proporción de pases de murciélagos pertenecientes a cada especie del total de registros en cada humedal siguiendo a Abarca (2016).
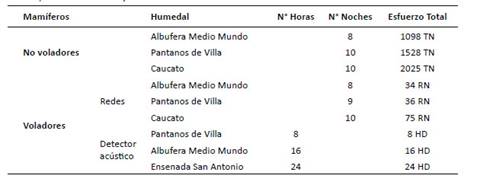
Tabla 1 Esfuerzo de captura (EC) para mamíferos menores no voladores y voladores evaluados en este estudio en la albufera de Medio Mundo, Pantanos de Villa, Caucato y la ensenada San Antonio. TN = Trampas Noche, RN = Redes Noche y HD = Horas detector.
La diversidad α para cada humedal, en función a la abundancia por capturas o actividad acústica, fue estimada con los índices de diversidad de Simpson (1 D = 1 ∑p 2) que varía entre 0 y [1 1/S], donde S equivale al número de especies de la muestra, el índice de Shannon (H’ = -∑p ln p ) que varía de 0 al logaritmo natural del número de especies, la diversidad máxima (H = lnS) alcanzable cuando todas las especies están presentes en igual proporción y el índice de equidad de Pielou (J’= H´/ H ). Para hallar los valores se emplearon las fórmulas propuestas por Krebs (1999).
La diversidad β entre los cuatro humedales fue estimada en función a los registros de captura y acústicos con el coeficiente de similitud de Jaccard (I ) y el análisis Coddington (1994). En este último, C va de 0 (cuando las listas comparadas son idénticas) a 1 (cuando las listas son completamente distintas). En caso una especie no tuviera registro de presencia en un humedal se asumió su presencia si es que la especie estuvo presente tanto al norte y al sur de dicho humedal.
Resultados
Composición de especies.Registramos 21 especies de mamíferos que incluyen ocho roedores, 12 murciélagos y un marsupial. Entre los roedores, cinco especies son nativas, cuatro de la familia Cricetidae: Aegialomys ica, Akodon mollis, Akodon sp. y Oligoryzomys arenalis y una de la familia Caviidae, el cuy Cavia tschudii; y tres son roedores introducidos de la familia Muridae: Rattus rattus, R. norvegicus y Mus musculus. Entre los murciélagos, tres son de la familia Phyllostomidae: Artibeus fraterculus, Desmodus rotundus y Glossophaga soricina valens; dos de la familia Vespertilionidae: Lasiurus blossevillii y Myotis bakeri; y siete de la familia Molossidae: Eumops perotis, Mormopterus kalinowskii, Nyctinomops aurispinosus, N. laticaudatus, N. macrotis, Promops davisoni y Tadarida brasiliensis. El único marsupial registrado fue Didelphis pernigra (Figs. 2, 3, 6; Tabla 2).

Figura 2 Mamíferos terrestres capturados mediante registros directos. a) Oligoryzomys arenalis, b) Akodon sp., c) Rattus norvegicus, d) Mus musculus, e) Aegialomys ica, f) Cavia tschudii, g) Rattus rattus, h) Didelphis pernigra.
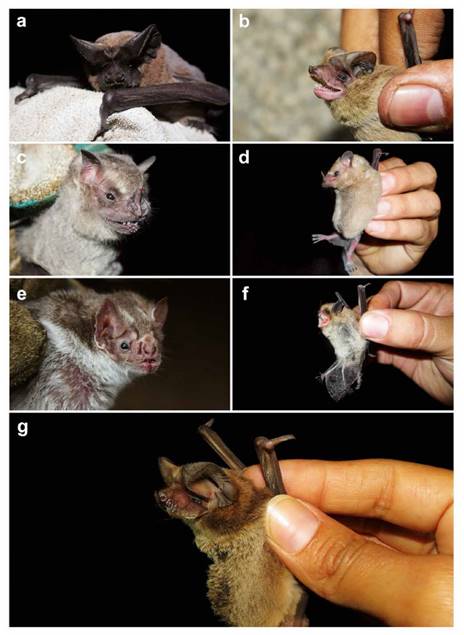
Figura 3 Murciélagos registrados en la ensenada San Antonio (a-f) y en Pantanos de Villa (g). Especies: a) Nyctinomops aurispinosus, b) Mormopterus kalinowskii, c) Artibeus fraterculus, d) Glossophaga soricina valens, e) Desmodus rotundus, f) Myotis bakeri y g) Tadarida brasiliensis.
Tabla 2 Listado de especies de mamíferos pequeños registradas en los humedales de la costa central del Perú. C = Registro por captura, sean trampas o redes de neblina, A = Registro acústico. El cero indica que no hubo captura a pesar del trampeo mientras que "-" indica que no hubo trampeo.
Las especies de roedores introducidas, Mus musculus y Rattus rattus estuvieron presentes en la Albufera de Medio Mundo, Pantanos de Villa y Caucato; mientras que R. norvegicus se registró solo en los Pantanos de Villa y Caucato.
El muestreo acústico compiló 173 pases o llamadas de ecolocación en 159 grabaciones. La determinación taxonómica respaldada por llamadas referenciales procedentes de individuos capturados fue posible para los insectívoros Myotis bakeri, Mormopterus kalinowskii, Mundo estimó que las especies observadas (S obs= 5) Nyctinomops aurispinosus y Tadarida brasiliensis, el esp significaron el 89 % de las especies esperadas (S = hematófago Desmodus rotundus, el frugívoro Artibeus obs 5.59), las observadas en los Pantanos de Villa (S = 5) fraterculus y el nectarívoro Glossophaga soricina valens.
Las otras especies fueron determinadas haciéndose uso de las referencias bibliográficas mencionadas. Las determinaciones fueron respaldadas por el análisis de función discriminante (en base a 243 pulsos) el cual obtuvo 95.69% de asignaciones correctas. Además, MANOVA mostró que las combinaciones de parámetros acústicos por especie fueron significativamente diferentes (Lambda de Wilks = 6.73 x 10-5, F = 87.91; p < 0.001). Los dos ejes discriminantes explicaron el 97.6% de la variación (Fig. 4, Tabla 3).

Figura 4 Llamadas de ecolocación de las 12 especies de murciélagos registradas por grabaciones acústicas. Artibeus fraterculus (Afr), Glossophaga soricina valens (Gso), Desmodus rotundus (Dro), Myotis bakeri (Mba), Lasiurus blossevillii (Lbl), Mormopterus kalinowskii (Mka), Promops davisoni (Pda), Tadarida brasiliensis (Tbr), Nyctinomops laticaudatus (Nla), Nyctinomops aurispinosus (Nau), Nyctinomops macrotis (Nma) y Eumops perotis (Epe).
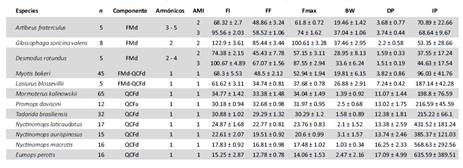
Tabla 3 Resumen estadístico de los parámetros acústicos obtenidos de pulsos de ecolocación para las 12 especies de murciélagos registradas en humedales de la costa central peruana. n: Número de pulsos, FM: Frecuencia Modulada, QCF: Frecuencia Cuasiconstante, a: ascendente, d: descendente. AMI: armónico de mayor intensidad, FI: Frecuencia Inicial, FF: Frecuencia Final, Fmax: Frecuencia de Máxima Amplitud, BW: Ancho de banda, DP: Duración de pulso e IP: Intervalo de pulso.

Curva de acumulación, abundancia y actividad relativa.La curva de acumulación de especies de Clench para los roedores registrados en la Albufera de Medio Mundo estimó que las especies observadas (Sobs = 5) significaron el 89 % de las especies esperadas (Sesp = 5.59), las observadas en los Pantanos de Villa (Sobs = 5) representaron el 85 % de las esperadas (Sesp = 5.85) y las observadas en Caucato (Sobs = 6) fueron el 94% de las esperadas (Sesp = 6.38); lo cual, al ser mayor a 70%, sugieren un muestreo bastante completo con los métodos de captura empleados (Fig. 5).
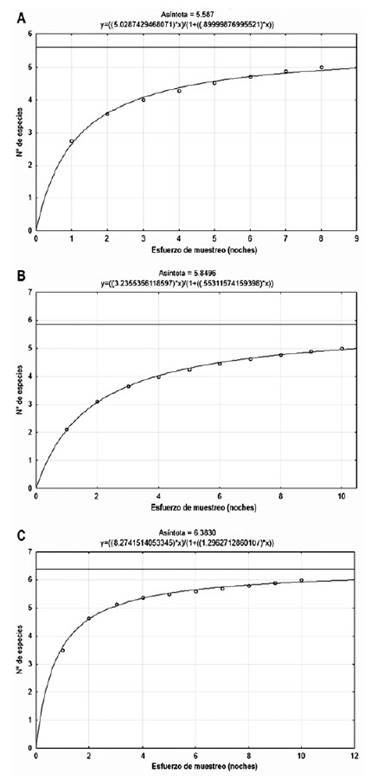
Figura 5 Curva acumulativa de especies de roedores de: A) Albufera de Medio Mundo, B) Pantanos de Villa y C) Caucato.
La curva de acumulación de especies de Clench para los murciélagos mostró una mayor representatividad a mayor esfuerzo de muestreo, encontrándose que las especies observadas en Pantanos de Villa (Sobs = 5) representaron el 46% de especies esperadas (Sesp = 10.98), en la albufera de Medio Mundo (Sobs = 8) significaron el 65% de las especies esperadas (Sesp = 12.23) y en la Ensenada San Antonio (Sobs = 11) fueron el 71% de las especies esperadas. En esta última localidad la representatividad, obtenida con un esfuerzo de muestreo de 24 horas detector (3 tres noches), es considerada adecuada (Fig. 6, Tabla 1). Dado que los registros de captura de murciélagos con redes de niebla fueron escasos (un ejemplar por cada especie) no se intentó realizar un análisis de acumulación de especies y abundancia (Tabla 2).
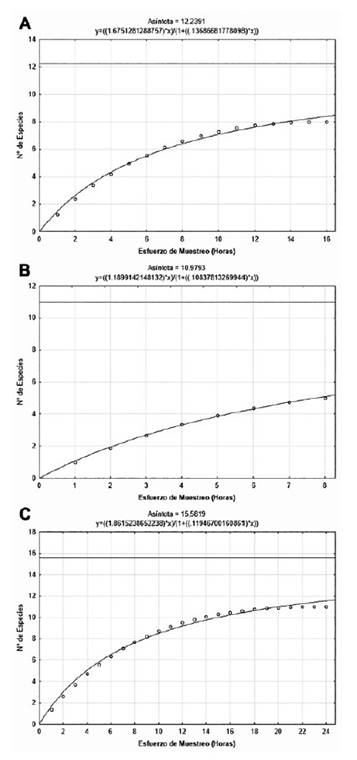
Figura 6 Curva acumulativa de especies de murciélagos de: A) Albufera de Medio Mundo, B) Pantanos de Villa y C) Ensenada San Antonio.
En Caucato, Mus musculus fue la especie más abundante, casi diez veces más que las otras especies; en la albufera de Medio Mundo lo fue Akodon mollis; mientras que en los Pantanos de Villa lo fueron Mus musculus y Akodon sp. El marsupial Didelphis pernigra fue uno de los más raros, con AR muy baja (0.18), encontrado solo en albufera de Medio Mundo (Tabla 4).
Tabla 4 Abundancia relativa (en base a 100 trampas noche) de pequeños mamíferos por humedal evaluado de la costa central del Perú.
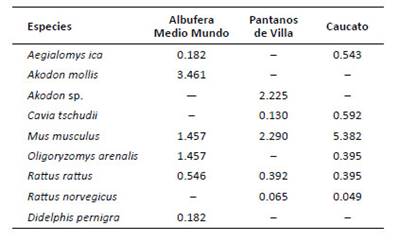
Akodon sp. El marsupial Didelphis pernigra fue uno de los más raros, con AR muy baja (0.18), encontrado solo en albufera de Medio Mundo (Tabla 4).
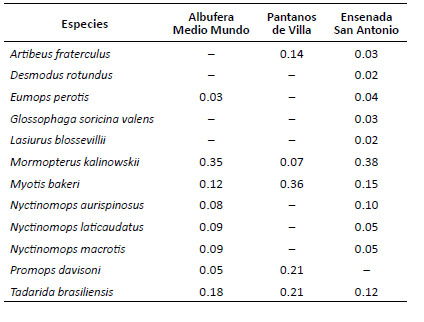
El murciélago Mormopterus kalinowskii presentó la mayor actividad relativa en la Ensenada San Antonio (0.38) y la albufera de Medio Mundo (0.35), duplicando la actividad relativa de otras especies comunes en los humedales referidos respectivamente tales como Tadarida brasiliensis y Myotis bakeri. En cambio, en los Pantanos de Villa la mayor actividad relativa la obtuvo M. bakeri (0.36), seguida de T. brasiliensis y Promops davisoni (0.21) y M. kalinowskii con la actividad más baja. Las especies Artibeus fraterculus, Desmodus rotundus, Eumops perotis, Glossophaga soricina y Lasiurus blossevillii obtuvieron una actividad relativa menor a 0.05 (Tabla 5).
Tabla 5 Actividad relativa basada en proporciones para los mamíferos pequeños voladores en humedales de la costa central del Perú.
Índices de diversidad.Los índices de Shannon (H') para mamíferos pequeños terrestres mostraron un mayor valor para la albufera de Medio Mundo (H' = 1.38) y menor para Caucato (H' = 0.97). Igualmente, el índice de Simpson registró el valor más alto para albufera de Medio Mundo (1 D = 0.69) y el más bajo para Caucato (1 D = 0.45). Por otro lado, la equidad (J' = 0.768) fue alta en albufera de Medio Mundo lo cual sugiere que este lugar está cerca de alcanzar su máxima diversidad (Tabla 6).
Tabla 6 Índices de diversidad de roedores, número de especies e individuos capturados para los humedales evaluados en la costa central del Perú. Índices de diversidad: Dominancia (D), índice de diversidad de Simpson (1 D), índice de diversidad de Shannon (H'), índice de equidad (J') e índice de diversidad máxima (H'max).
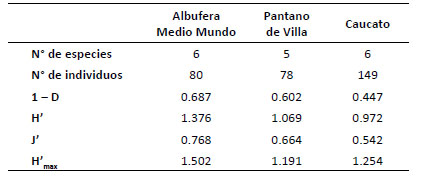
Estos resultados muestran que la diversidad de especies fue más alta en la albufera de Medio Mundo y más baja en los otros humedales.
En base a 173 pases de murciélagos para la estimación de los índices de actividad acústica (Tabla 7), la Ensenada San Antonio registró la mayor diversidad de Shannon (H' = 1.96) en función al número de pases y el valor más alto con el índice de Simpson (1 D = 0.8), éste último compartido con la albufera Medio Mundo; mientras que Pantanos de Villa registró la menor diversidad (H'= 1.49, 1 D = 0.76).
Tabla 7 Número de especies, pulsos e índices de la actividad acústica de los murciélagos de los humedales de la costa central del Perú: Albufera Medio Mundo, Pantanos de Villa y Ensenada San Antonio. Índices: 1-D, Diversidad de Simpson; H’, ShannonWiener; J, Equidad de Pielou.
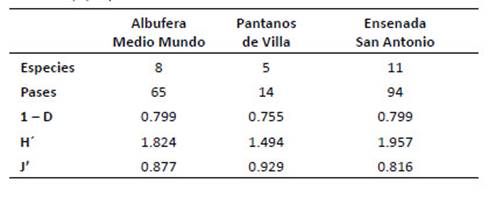
En cuanto al índice de equidad (J'), se observó que fue moderadamente alto en Pantanos de Villa y disminuye en la albufera de Medio Mundo y la Ensenada San Antonio en concordancia con la alta actividad relativa de Mormopterus kalinowskii¸ comportándose como especie dominante.
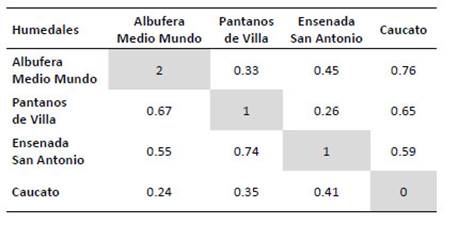
Diversidad β.La similitud de la comunidad de mamíferos menores voladores y no voladores fue mayor entre Pantanos de Villa y la ensenada San Antonio (I = 0.74, C = 0.26) seguidos por la albufera de Medio mundo y Pantanos de Villa (I = 0.67, C = 0.33). Caucato fue el humedal que más se diferenció de los demás con un I de 0.24 a 0.41 (Tabla 8).
Tabla 8 Coeficientes de similitud de Jaccard (debajo de la diagonal) y los valores de complementariedad (arriba de la diagonal) de los humedales Albufera Medio Mundo, Pantanos de Villa, ensenada San Antonio y Caucato. Los valores de la diagonal representan el número de especies de mamíferos pequeños exclusivos para cada humedal.
Discusión
Este estudio representa la primera síntesis sobre la diversidad de mamíferos menores de los humedales de la costa central del Perú, representada por los humedales de la Albufera de Medio Mundo, Refugio de vida silvestre Pantanos de Villa, Ensenada San Antonio y Caucato; probablemente los más grandes e importantes en la zona (ProNaturaleza 2010) y que abarcan un rango aproximado de 340 km. De esta forma, nuestro estudio complementa los estudios previos de flora (Cano et al. 1993, Montoya 2004, Ramírez & Cano 2010, Aponte & Ramírez 2011) y fauna (Tovar 1977, Guillen & Barrio 1994, Obando et al. 1998, Guillén et al. 2003, Iannacone & Alvariño 2007, Iannacone et al. 2010, Pisconte 2010) para los humedales mencionados, acrecentando la información para el hábitat de humedales costeros y evidenciando su potencial para albergar importantes especies. Este estudio complementa también la síntesis sobre diversidad y biogeografía de los mamíferos del Perú de Pacheco (2002) donde no se hizo mayor referencia a los humedales y actualiza la lista de mamíferos para la costa del Perú de Pacheco et al. (2009). Las especies nativas registradas aquí se pueden considerar también típicas de la costa central del Perú.
Los registros más notables incluyeron al cuy silvestre Cavia tschudii que registramos por primera vez en Caucato y nuevamente en Pantanos de Villa, al igual que Pacheco et al. (2015) y Ramirez et al. (2019). Ello sugiere que esta especie podría estar presente en los humedales no evaluados y que están presentes entre Caucato y Pantanos de Villa, entre los cuales existe una distancia de 165 km. Al presente, los registros en Pantanos de Villa son los más boreales de C. tschudii en los humedales de la costa, por lo que su distribución se limita a la costa central y sur del Perú (Dunnum 2015, Vertnet 2019). El roedor akodontino Akodon sp. registrado en los Pantanos de Villa (Pacheco et al. 2015, este estudio) no fue encontrado en los otros humedales evaluados. El roedor Akodon mollis colectado en la Albufera de Medio Mundo es el primer registro para el departamento de Lima y el más austral para la especie a lo largo de la costa peruana. Aunque los murciélagos Nyctinomops laticaudatus y N. macrotis son especies de amplia distribución, nuestros registros son los primeros para el departamento de Lima. El registro de Didelphis pernigra en la albufera de Medio Mundo es el segundo registro de la especie a nivel del mar (ver más abajo).
Es probable que en estos humedales habiten también los zorros Lycalopex culpaeus, L. griseus y L. sechurae ya que están reportadas para la costa de Lima (Cossíos 2010, Vivar & Pacheco 2014), al igual que el gato del pajonal Leopardus colocolo (Cossíos et al. 2007). Son necesarias más evaluaciones en los humedales costeros incorporando la búsqueda de avistamientos o rastros de mamíferos grandes, así como instalación de cámaras trampa según metodologías estandarizadas para tener una apreciación más exacta de su biodiversidad (Jimenez et al. 2010, MINAM 2015, García-Olaechea & Hurtado 2018).
Una especie de roedor potencialmente presente en los humedales de la costa central es el ratón de las Lomas Melanomys zunigae (Sanborn 1949), una especie en estado crítico de conservación y presumiblemente extinto por la expansión urbana de la ciudad de Lima y el impacto de las especies introducidas (Pacheco 2002, Mena et al. 2007, Gazzolo 2018). Esta especie fue descrita en base a ejemplares colectados en las Lomas de Atocongo, la localidad tipo, y San Jerónimo, Lima (Sanborn 1949). Las Lomas son un hábitat estacionalmente húmedo, con abundante vegetación herbácea y arbustiva en la época de invierno desde junio a octubre aproximadamente (Weberbauer 1936; Rundel et al. 1991). Sin embargo, a pesar de varias evaluaciones, M. zunigae no ha vuelto a ser encontrada hasta la fecha (Mena et al. 2007, Gazzolo 2018). Debido a que Melanomys es un roedor asociado a ambientes húmedos de bosque (Weksler & Lóss. 2015), se desconocía cómo este roedor podía sobrevivir en la época seca de las Lomas, cuando esta está prácticamente denudada de vegetación. Una posible respuesta la expuso Sanborn (1949) cuando presentó la observación de Zúñiga en 1942 de que Atocongo tenía pequeños manantiales de agua que probablemente duraban todo el año mientras que las otras lomas visitadas no lo tenían. Al igual que Atocongo, las Lomas de Lachay también tuvieron varios puquiales, algunos que incluso formaban pequeños riachuelos (Daniel Valle com. pers.). Es posible que las lomas, hace tres o más décadas fueron más húmedas por la presencia de estos puquiales, pero actualmente no existen o han disminuido considerablemente (V. Pacheco com. pers., Daniel Valle com. pers.). Dada la afinidad de Melanomys por ambientes húmedos, planteamos que M. zunigae podría habitar también en los humedales costeros, que son ambientes permanentemente húmedos, están presente a lo largo de toda la costa peruana, y están relativamente cercanos de las lomas, y que incluso puede ser el hábitat que conecta a la especie a otras del género. La especie de Melanomys geográficamente más cercana a M. zunigae está en el bosque pluvial de Tumbes, donde habita M. caliginosus (Pacheco et al. 2009). Sugerimos también que M. zunigae necesita ser buscada en las lomas y humedales desde Lima hasta Tumbes, antes de ser formalmente considerada extinta. En nuestro trabajo, lamentablemente tampoco fue colectada. Considerar a M. zunigae como endémica de las lomas probablemente refleje la escasez de muestreos y la alteración antrópica del hábitat.
Taxonomía.La taxonomía y relaciones filogenéticas de varias de las especies encontradas en los humedales no están aún resueltas. Un caso complejo lo constituye Akodon mollis, con localidad tipo en Tumbes, a orillas del río Tumbes y a nivel del mar (Thomas 1882); sin embargo, no se ha encontrado un ejemplar de Akodon en evaluaciones realizadas cerca de Tumbes (Pacheco et al. 2007, Hurtado & Pacheco 2015); por lo que la especie es más conocida por registros en zonas andinas (Alvarado-Serrano et al. 2013). Recientemente, nuevos registros de A. mollis se han conseguido a nivel del mar en ambientes de humedales en Lambayeque (Molina 2019) y Lima (este trabajo), los cuales resultaron idénticos al holotipo (Molina & Pacheco en prep.). La apreciación de que esta especie se encuentra en ambientes extremos (Pardiñas et al. 2015) debe ser cambiada parcialmente ya que en la costa peruana A. mollis no se encuentra en zonas desérticas sino siempre asociada a ambientes húmedos, humedales o cultivos.
Akodon sp., presente en los Pantanos de Villa, habita también en ambientes húmedos, en los totorales y en la vega de ciperáceas. Sin embargo, faltan estudios adicionales que permitan conocer si esta especie ocurre en otros humedales al norte de Pantanos de Villa y al sur de la albufera de Medio Mundo, donde se encuentra Akodon mollis. Al sur de los Pantanos de Villa no se conoce ninguna localidad con registros de Akodon hasta el departamento de Tacna (Pacheco et al. 2015, Pardiñas et al. 2015). La población disyunta de Tacna fue identificada como A. mollis (Pardiñas et al. 2015), pero probablemente represente un taxón distinto, dado que A. mollis sensu stricto no se distribuye más al sur de la albufera de Medio Mundo.
Otra especie taxonómicamente compleja es el cuy silvestre Cavia tschudii. Esta especie presenta una amplia distribución y variación geográfica como el tamaño corporal y la coloración del pelaje dorsal, lo que ha generado la descripción de ocho subespecies (Dunnum 2015). Este cuy se encuentra distribuido en los Andes y costa de Perú y llega hasta el norte de Argentina pasando por una pequeña región en el norte de Chile y en la región central de Bolivia que corresponde al Altiplano (Dunnum 2015). La localidad tipo de C. tschudii es "Ica, 70 mi E of Pisco", pero esta es aún imprecisa. Una interpretación literal de esta localidad la ubica claramente lejos del nivel de mar, pudiendo estar más bien en las cabeceras del río Pisco, sobre los 3000 m, en el departamento de Ica o tal vez en el departamento de Huancavelica. Dunnum y SalazarBravo (2010) restringieron la subespecie C. t. tschudii a las poblaciones de la región de Ica, Perú, incluyendo en los análisis moleculares dos ejemplares de Ica, ca. 300 m de altitud; por lo que un análisis de variabilidad intraespecífica del cuy silvestre es necesario incluyendo poblaciones presentes a nivel del mar y de zonas altoandinas de la región de Ica, especialmente de la cuenca del río Pisco, y la región de Huancavelica, para evaluar la hipótesis de que son una población homogénea y caracterizar la población de C. tschudii sensu stricto.
Cerqueira (1985) y Lemos y Cerqueira (2002) registraron a la muca de orejas blancas Didelphis pernigra para el puerto del Callao, con registros históricos de 1899 y 1900, colectados por P. Simons, siendo estos los registros de menor elevación de la especie; sin embargo, Brown (2004) opinó que por la localidad estos registros deberían de corresponder a D. marsupialis. Nuestro registro en la albufera de Medio Mundo, después de 120 años, confirma que D. pernigra si se encuentra a nivel del mar, y que a pesar de los cambios antrópicos en la zona (e.g. carreteras, corrales de pollos, etc.) aún se mantiene en el humedal. Por otro lado, Brown (2004) registró también a D. marsupialis a nivel del mar en la costa norte del Perú en el departamento Lambayeque y en las vertientes del departamento de Lima, este último registro basado en un resto de mandíbula incompleto de Yangas, Lima (1030 m). Dado que otros registros de Lima y Callao han sido determinados como D. pernigra (Lemos & Cerqueira 2002; Cerqueira & Tribe 2008), incluyendo la revisión de otros ejemplares de la región de Lima de la colección MUSM (V. Pacheco & E. Escobar, com. pers.), es más probable que el ejemplar de Yangas (restos de mandíbula, MVZ 137241) corresponda también a D. pernigra, especie común en la serranía del departamento de Lima, y no a D. marsupialis.
Diversidad y Conservación.A pesar de que los humedales evaluados son muy semejantes en paisaje y la distancia máxima entre ellos es de unos 340 km, se observó un moderado grado de diversidad β, con un rango de similitud de 0.24 a 0.74%. La similitud entre la Albufera Medio Mundo, Pantanos de Villa y Ensenada San Antonio fue más semejante, con un rango de similitud de 0.55 a 0.74%. Caucato fue el humedal que más se diferenció de los otros, con un rango de similitud de 0.24 a 0.41%; pero esto es debido al escaso registro de murciélagos obtenidos en el lugar. Es probable que las diferencias encontradas entre los 4 humedales reflejen la necesidad de mayores muestreos. Exceptuando el caso de la distribución, posiblemente parapátrica, de Akodon mollis y Akodon sp. y la ausencia del cuy silvestre al norte de Pantanos de Villa, es probable que las otras especies de roedores nativos se encuentren en los cuatro humedales.
La presencia de los roedores Mus musculus y Rattus rattus encontrados en los tres humedales muestreados y de R. norvegicus en los Pantanos de Villa y Caucato, aunados a su abundancia, sobre todo de M. musculus, es preocupante ya que puede ser un peligro para las especies nativas. A nuestro entender, estos son los primeros estimados de abundancia de estos roedores en comparación a la abundancia de roedores nativos en humedales. Estos múridos han demostrado que han sido capaces de adaptarse con éxito, y tal vez mejor que varias especies nativas, pudiendo ser un peligro para su sobrevivencia (Rodríguez 2001; Mena et al. 2007). Su mayor abundancia indica que están usando recursos alimenticios y refugios, y aparentemente son más competitivas que las especies nativas. Estos roedores introducidos pueden causar también otros impactos negativos como la depredación de huevos de aves, transmisión de parásitos y enfermedades, modificación del hábitat, así como la alteración de redes tróficas por ser especies invasoras (Lobos et al. 2005, Camus 2005).
La mayor abundancia de especies introducidas en los humedales de Caucato y Pantanos de Villa nos indican que ambos humedales han sido los más impactados sea por las actividades agropecuarias o por la urbanización en los alrededores, respectivamente. Por el contrario, en la albufera de Medio Mundo se registró una mayor abundancia de especies nativas coincidente con su mejor estado de conservación y menor impacto antrópico. Por ello, es necesario monitorear y controlar la abundancia de los roedores introducidos en los hábitats de humedales para limitar su impacto negativo sobre la biodiversidad nativa (Magurran 2004, Cano et al. 1993, Mena et al. 2007). Estos monitoreos deben ser realizados por personal entrenado ya que algunas especies son muy parecidas. Por ejemplo, Oligoryzomys arenalis puede ser confundida por Mus musculus (Fig. 7). Colectores inexpertos podrían incluso confundir a Aegialomys ica por Rattus rattus; aunque ambas presentan un mismo porte, A. ica carece de pelos de guarda largos y una cola fuertemente anillada. Igualmente, es importante estar atento a la posible presencia de la rata bandicota menor Bandicota bengalensis (Gray & Hardwicke 1833), roedor múrido de Asia y potencial Especie exótica invasora (EEI) y altamente perjudicial, que fue encontrado en el contenedor de un barco en el puerto marítimo del Callao durante una inspección sanitaria (Pacheco 2019). Como el autor menciona, esta especie puede ser confundida con una especie de Rattus.
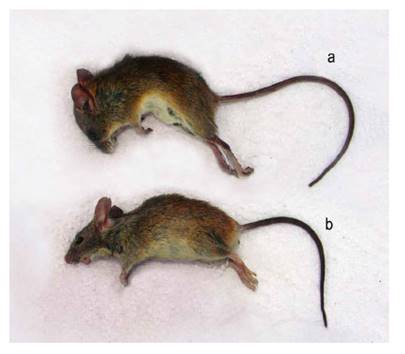
Figura 7 Comparación entre un roedor nativo Oligoryzomys arenalis (a) y el roedor introducido Mus musculus (b). Aunque de tamaños similares, O. arenalis tiene el pelaje dorsal más rojizo, el pelaje ventral más blanquecino, patas posteriores más largas y hocico más corto, entre varias otras características.
El método de detección acústica demostró ser superior a una evaluación convencional con redes, incrementando la riqueza de los inventarios en humedales caracterizados por espacios abiertos y vegetación homogénea de baja altura. El mejor ejemplo lo representa la Ensenada San Antonio donde de un total de 11 especies registradas con el método acústico, solo seis lograron ser capturadas con redes de neblina instaladas alrededor de refugios potenciales, incrementando casi el doble de las especies capturadas. En Pantanos de Villa y albufera Medio Mundo, el incremento en el inventario alcanza valores aún mayores con 1.5 y 7 veces el número de especies capturadas respectivamente; sin embargo, para estos humedales se requeriría un aumento en los esfuerzos de captura y detección debido a la baja representatividad del total de especies esperadas (menor al 70%) evidenciada en sus curvas de acumulación (Jiménez-Valverde y Hortal 2003, Kingston 2016).
Respecto a la actividad relativa de los quirópteros, las tres especies de la familia Phyllostomidae (Artibeus fraterculus, Desmodus rotundus y Glossophaga soricina valens) junto a Lasiurus blossevilii y Eumops perotis muestran una actividad representada por menos del 5% del total de pases, por lo que podrían ser consideradas especies raras. Sin embargo, esto discrepa parcialmente con inventarios históricos y contemporáneos de quirópteros en Lima, los cuales demuestran que A. fraterculus y G. s. valens son las especies más comunes en zonas urbanas (Ortiz de La Puente 1951, Mena & Williams 2002) sumado a registros en humedales de Lima y Callao que reportan colonias numerosas de D. rotundus o demuestran la ocurrencia de A. fraterculus y G. s. valens a través de capturas (Carazas et al. 2015, Pacheco et al. 2015). Esta controversia nace en las diferencias del comportamiento de ecolocación que exhiben murciélagos filostómidos, cuyos pulsos son de muy baja intensidad y alta frecuencia (>120 kHz) por lo que no son considerados candidatos idóneos para el monitoreo acústico, ya que este favorece la detección de murciélagos insectívoros aéreos que emplean generalmente pulsos de alta intensidad a frecuencias menores a 100 kHz (Kingston 2016). Por ello, reforzamos la propuesta de emplear detectores de ultrasonido y redes en simultáneo para estudios de diversidad de murciélagos en humedales y otros ambientes costeros del Perú (ciudades, desiertos y lomas), enfocando los esfuerzos de captura alrededor de refugios o áreas de forrajeo; mientras que, la detección acústica dirigido al gremio de insectívoros aéreos para enriquecer los inventarios basados en la presencia (Jung & Kalko 2011, Pech-Canche et al. 2010).
Finalmente, se sugiere se continúe con la evaluación de mamíferos de los humedales de la costa norte y sur del Perú para complementar el conocimiento de su biodiversidad, ya que tienen una riqueza de especies apreciable y moderadamente diferente entre ellas. De lograrse esto, los humedales costeros serían el hábitat mejor conocido en el Perú, con respecto a mamíferos, convirtiéndose en un hábitat y modelo ideal para estudios ecológicos, evolutivos, filogeográficos, entre otros. Los futuros estudios deben incluir también una evaluación de las actividades antrópicas como urbanizaciones, actividad agropecuaria y avícola y de las especies introducidas, proponiendo medidas a implementar en la gestión ambiental de los humedales con el fin de conservar estos ecosistemas frágiles (Aponte & Ramírez 2011). Solo la Albufera de Medio Mundo y los Pantanos de Villa gozan de una categoría de conservación. El humedal de Caucato requiere una iniciativa regional para ser propuesta en una categoría de conservación.
El registro de D. pernigra en la albufera de Medio Mundo, después de 120 años y el registro de la mayoría de las especies de murciélagos registrados para Lima por Ortiz de la Puente (1951), casi 70 años después, sugieren que la fauna costera de pequeños mamíferos de la región de Lima durante los últimos 100 años y probablemente durante su vida republicana desde 1821 ha sido la misma. Estos resultados de biodiversidad deberían tenerse en cuenta por los estudiosos de las ciencias sociales, ya que los estudios históricos o arqueológicos de la fauna están generalmente limitados a muy pocas especies de mamíferos como camélidos, cuyes o el perro sin pelo peruano (Wheeler et al. 1976, Kent 1982, Bonavía 1996), muy comprensible por su relación más cercana al hombre y por ende su mayor importancia económica y/o ritual-religioso; sin embargo, una excelente excepción que documenta la biota, geomorfología, ecosistemas y biota, historia y cultura del valle de Lurín es Bueno-Mendoza (2014). Conocer mejor el medio ambiente y su diversidad en la época republicana, incaica y preincaica contribuirá a conocer mejor la historia del hombre peruano; esta propuesta es sin duda un gran reto considerando que no conocemos a plenitud nuestra biota peruana actual, ni siquiera de la cercana a la ciudad de Lima, capital del Perú.












 uBio
uBio 


