Introducción
Athene cunicularia (Molina 1782), la lechuza de los arenales, es una especie de la familia Strigidae y Orden Strigiformes que aunque algunos autores la asignan al género Speotyto (i.e. Monroe & Sibley 1996), en la actualidad ha regresado al género Athene según el South American Classification Committee (Remsem et al. 2021), un género con cinco especies de las cuales A. noctua es la más cercana (Poulin et al. 2020). Es una lechuza de una amplia distribución en el continente americano, es considerada común o poco común en la mayor parte de los lugares donde habita, es residente y ocupa una gran variedad de hábitats naturales, urbano-rurales y agroecosistemas.
Si bien su distribución abarca toda América, el estado de conservación y conocimiento de la biología es limitado en muchos países. Sin embargo, se han realizado algunos estudios con una visión global de la especie. Los estudios más completos se han realizado en poblaciones de Norteamérica, donde se ha determinado su estado de conservación (James & Espie 1997) y evaluado el grado de amenaza de la subespecie A. cunicularia hypugaea (Brown, 2001). Fish and Wildlife Service de Estados Unidos de Norteamérica desarrolla un Plan de Conservación para las lechuzas en Norte América (Klute et al. 2003) y Lincer et al. (2018) presentan una reseña de la literatura publicada hasta el año 2016 sobre A. cunicularia, a través de un análisis bibliométrico de 1681 artículos, que muestra tendencias y vacíos de información.
En América del Sur se conocen algunos trabajos relevantes como la bibliografía comentada acerca de los estudios de egagrópilas de rapaces argentinas (Pardinas & Cirignoli 2002), un estudio sobre dos siglos de conocimiento de las aves rapaces de Chile (1810 2010) (Muñoz-Pedreros & Norambuena 2011), el análisis del conocimiento de la biología y ecología de los Strigidae en Brasil (Motta-Junior & Braga 2012) y la productividad científica sobre aves rapaces en Chile (Rau et al. 2015).
Las investigaciones que se han realizado en el Perú sobre A. cunicularia, se han enfocado principalmente en la dieta alimenticia (Pulido &Aguilar 1979, Medina et al. 2013, Martínez et al. 2018), sin embargo, la biología, el comportamiento y la reproducción no han sido abordados a profundidad, por lo que se han identificado algunos vacíos de información.
El presente trabajo, elaborado en base a una revisión de la bibliografía y datos propios no publicados, está orientado a identificar el estado actual del conocimiento de la biología y estado de conservación de A. cunicularia con especial énfasis en las poblaciones que habitan en el Perú.
Materiales y métodos
En el presente trabajo se incluyen observaciones de campo sobre el comportamiento, distribución, desplazamientos estacionales y estado de conservación realizadas desde 1977 hasta el 2020, en Piura, Lambayeque, Lima, Ica, Arequipa, Iquitos y Madre de Dios. En el periodo de 1977 a 1978, se efectuó la colecta de regúrgitos, que permitieron conocer directamente los patrones estacionales de la dieta alimenticia de la lechuza de los arenales en la Reserva Nacional de Lachay.
Así mismo, se realizó una búsqueda sistemática utilizando: Scopus, Web of Science, Scielo y Google Académico; además de la información proporcionada por autores de algunos de los artículos utilizados. La búsqueda se realizó tanto en español como en inglés utilizando las palabras clave: "Athene cunicularia," "lechuza de los arenales," "Strigiformes," "egagrópilas," y "conservación de especies." Se tuvo en cuenta 87 artículos científicos relevantes (con datos sobre poblaciones en Perú o países cercanos) publicados entre 1973 y el 2021. Datos de distribución de la especie fueron obtenidos de la base de datos de GBIF (2020) los que incluyen los registros de múltiples bases de datos tanto de colecciones científicas como de observaciones de campo (i.e. eBird) y también de la información bibliográfica revisada, descartando observaciones poco probables, esos datos fueron utilizados mediante el programa ArcGis para obtener datos de abundancia de registros (densidad Kernel), distribución altitudinal y complementar los datos sobre la presencia de la especie en áreas naturales protegidas.
Resultados y discusión
Distribución geográfica
La lechuza de los arenales cunicularia tiene una amplia distribución, que abarca todo el continente americano: Canadá y Estados Unidos de Norte América, Centro América y el Caribe hasta el sur del continente en Chile y la Patagonia en Argentina; en un rango altitudinal desde el nivel del mar hasta los 4000 metros de altura. En algunos lugares es considerada vagrante: Islas Malvinas (Falkland Islands), Panamá, Georgia del sur y las islas Sandwich del sur. La especie está probablemente extinta en las islas San Cristóbal y Nieves y se ha extinguido en Antigua y Barbuda y Guadalupe (BirdLife International 2016). Estudios moleculares (ADN mitocondrial) muestran que las poblaciones de Norte y Sudamérica están separadas desde el momento del "gran intercambio de fauna" ocurrido al formarse Centroamérica y se cree que la especie tiene un origen norteño con una posterior dispersión al sur en esa época (Desmond et al. 2001). Después se mantuvieron con una distribución relativamente fragmentada que indujo a la formación de muchas subespecies geográficas.
De las 18 subespecies actualmente reconocidas (dos extintas), en el Perú se registran las siguientes (Cory 1917, Poulin et al. 2020, Gill et al. 2021, Plenge 2021, Figura 1):
Athene cunicularia nanodes (Berlepsch y Stolzmann, 1892). Incluye a las antes consideradas subespecies para Perú A. c. punensis (Chapman, 1914) y a A. c. intermedia (Cory, 1915); aunque Plenge (2021) aun considera a la primera como válida. Esta subespecie es de distribución amplia en la costa desde el límite con Ecuador hasta el límite con Chile. Su localidad tipo es Lima. Tiene tamaño mediano (longitud del ala menor a 170 mm), coloración pálida, barras ventrales dispersas y una estrecha banda blanca en la frente (Ridgely & Greenfield 2001, Poulin et al. 2020). Esta subespecie es considerada como una especie representativa de varios ecosistemas de la costa peruana, en especial en las lomas y zonas de cactáceas columnares (Koepcke & Koepcke 1953), contándose con ejemplares en la colección ornitológica del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos de tanta antigüedad como 1913 (MUSM 19134) y 1944 (MUSM 19127).
Athene cunicularia juninensis (Berlepsch y Stolzmann, 1902). Residente en los Andes desde el centro del Perú hasta el límite con Bolivia. Su localidad tipo es Ingapirca, Junín, Perú. Tienen gran tamaño (longitud del ala mayor a 192 mm), el dorso es color ante pálido con puntos blanquecinos grandes, barras ventrales dispersas de color leonado (Poulin et al. 2020).
Athene cunicularia cunicularia (Molina, 1782), incluye a A. cunicularia boliviana (Kelso, 1939)considerada aun por Plenge (2021). Registrada en el Parque Nacional Manu, región Madre de Dios (Yabar 2007), así como en varia otras localidades de esa región; coincide con el registro de Miserendino (2007), para el departamento de Pando en Bolivia colindante con Madre de Dios en Perú. Su localidad tipo es Chile. Es grande (longitud alar mayor a 178 mm), coloración del dorso marrón pálido con puntos grandes y de color blanco a ocre, zona ventral de blanquecina a color ante pálido con barreado denso y marrón oscuro (Poulin et al. 2020).
La distribución de A. cunicularia se extiende en gran parte del territorio peruano, en especial en la región de la Costa, sin embargo, existen registros en zonas de altitudes cercanas a los 4000 m en Ancash, Pasco, Junín, Ayacucho, Cusco, Puno, Arequipa y Moquegua (Figura 1). También se encuentra presente en la región de la Selva peruana, con registros alrededor de Iquitos y Pucallpa, pero la mayor cantidad de registros en la región de Madre de Dios (Figura 1). Las localidades con mayores números de registros en GBIF se encuentran en la costa norte (Lambayeque), costa central (Lima e Ica), costa y vertiente occidental sur (Arequipa), así como zonas altas al sur (Cusco) y en la selva de Madre de Dios, en la ribera de varios ríos (Figura 1).
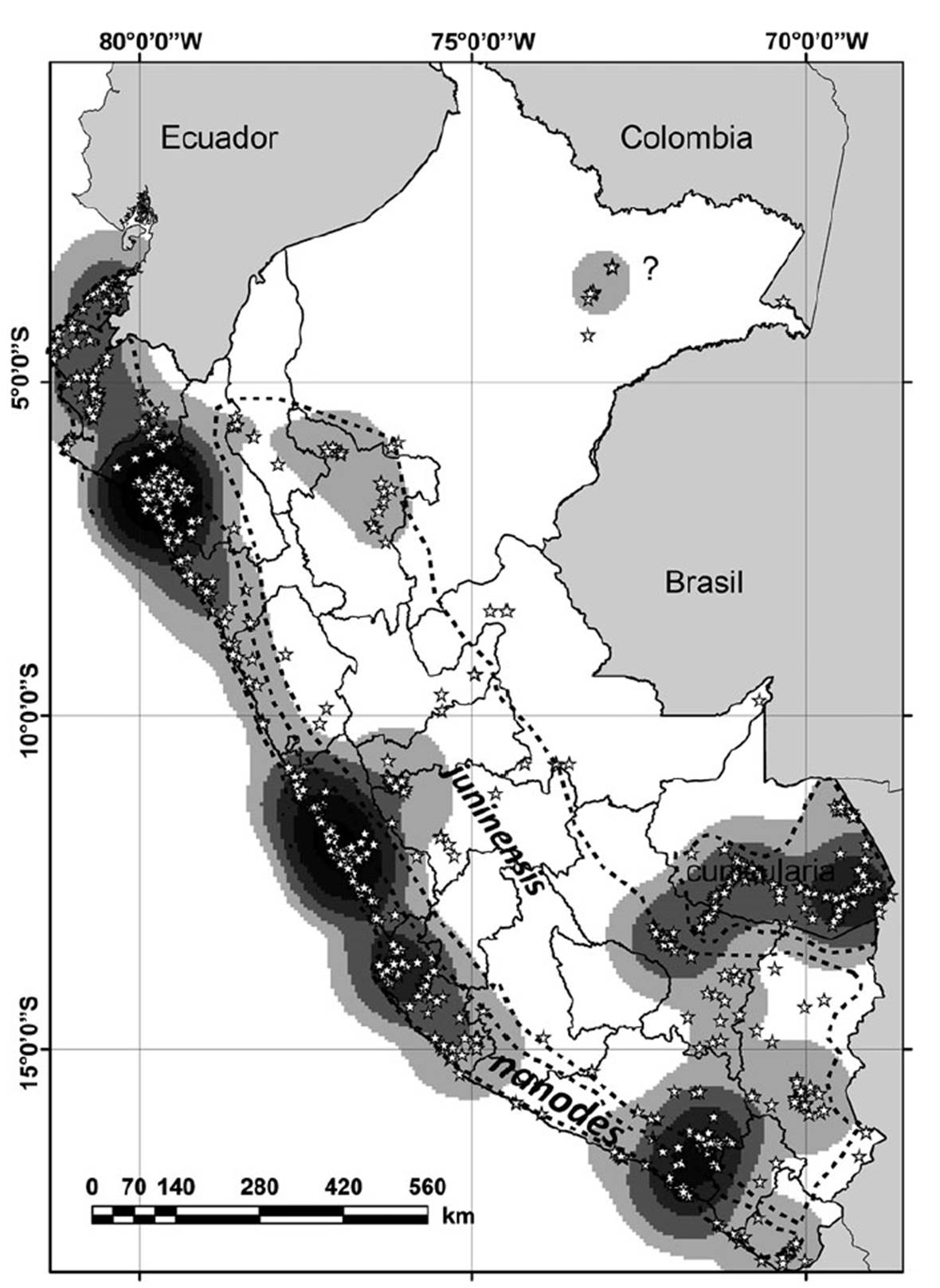
Figura 1 Distribución de Athene cunicularia en el Perú (estrellas blancas), las zonas con mayor número de registros presentan tonos más oscuros (densidad Kernel de registros). Se indican los límites aproximados de la distribución de las subespecies.
Según el país donde habita, A. cunicularia tiene diferentes nombres comunes, por ejemplo: lechucita vizcachera, lechucita pampa (Argentina), chiñi, búho minero, cuzco (Bolivia), murruco (Colombia), pequén (Chile), sijú de sabana, cuco de sabana (Cuba), búho terrestre, picpiga (Ecuador), tecolote llanero, tecolote zancón (México), urukurea chichï (Paraguay), lechuza de los arenales, lechuza de las huacas, lechuza de madriguera, lechuza de hoyo, búho de madriguera, pecpe, pecpe tuco (Perú), cucú, tucú (República Dominicana), lechucita de campo, vizcachera (Uruguay), mochuelo de hoyo, guarracuco (Venezuela) (IUCN 2020).
Descripción y hábitat
La lechuza de los arenales Athene cunicularia es un ave terrestre, de tamaño mediano, aproximadamente 23.5 cm y alcanza una envergadura de 53 a 61 cm, peso de 150 a 200 gramos. Posee patas largas y fuertes garras; cola corta; inconfundible por sus tarsos largos y actitud erguida. El pico es corto y de punta aguda. El iris es amarillo. El cuerpo es de coloración pardusca con manchas y línea superciliar blancas, el pecho y el vientre son blanquecinos con manchas estriadas color café, ala y cola rayadas con blanco y pardo (Figura 2).
Es muy abundante y generalmente habita zonas abiertas como pastizales, sabanas y estepas, zonas áridas y secas, como las lomas costeras, asociaciones de cactus o tilandsiales, también las playas de los ríos, humedales, en agroecosistemas; en la vertiente occidental y en los Andes muestra preferencia por las zonas rocosas y pedregosas; y también habita en áreas abiertas con poca cobertura vegetal sobre suelo arenoso donde construyen sus madrigueras (Pulido et al. 2007, Pulido et al. 2013).
Actividad y comportamiento en grupos familiares
Vive en grupos familiares que pueden llegar hasta los 12 individuos (Pulido et al. 2013). Es sedentaria, de actividad diurna y nocturna, tolerante a fuertes alteraciones del hábitat debido a actividades humanas tanto urbanos como rurales. Athene cunicularia se adapta fácilmente a diferentes presas dependiendo de qué tan abundantes son éstas en su ambiente, lo que le permite resistir fuertes cambios en la estructura del hábitat. Son depredadoras, cazan de día y de noche, tienen una gran sensibilidad y responden de manera inmediata a los cambios ambientales; de tal manera que se comportan como indicadores de los niveles de biodiversidad, el estado del ambiente y en el campo de la ecología trófica de la abundancia de sus presas (Bo et al. 2007). Un factor determinante en la actividad de esta especie es el clima. En días nublados y frescos las lechuzas están fuera de sus madrigueras hasta cerca del mediodía, y en días fríos, cuando la temperatura desciende, su actividad decrece significativamente, de manera que no vocaliza con frecuencia y es difícil detectarlo (Fischer et al. 2004). Emite gritos cuando algo extraño se acerca a su madriguera, de tal manera que, los primeros individuos que son localizados son los individuos que dan la alarma cuando alguien se acerca al nido. Este comportamiento de A. c. nanodes es muy similar a lo observado en otras subespecies como A. c. punensis (Specht et al. 2013). En la costa peruana observamos que A. c. nanodes está fuera de sus madrigueras en las horas del crepúsculo, antes de la media noche y temprano en la mañana, por lo que, en estos periodos de tiempo, no presenta un patrón definido de actividad. Sin embargo, es más activa y vocaliza más a la llegada del crepúsculo y en las primeras horas de la noche cuando está fuera del área de sus madrigueras, posiblemente cazando.
Ante una amenaza, las lechuzas adultas: emiten voces de alerta, ingresan al interior de sus madrigueras o realizan un movimiento corporal arqueando el cuerpo acompañado de vocalizaciones; mientras que polluelos y juveniles ingresan en la madriguera (Martin 1973). Estas reacciones defensivas son comunes frente a la presencia de drones y de aves rapaces (Borsellino & Rebolo 2017). En la mayoría de las madrigueras donde vocalizan, tanto machos como hembras se mantienen cerca haciendo guardia. En aquellos casos donde ambos hacen guardia, la mayoría de las vocalizaciones son realizadas solo por la hembra. Esta señal de alarma se produce a cierta distancia de la entrada de la madriguera si el intruso se acerca más, las lechuzas vuelan hacia distancias más cercanas. La alarma se emite secuencialmente, ininterrumpidamente, con mayor frecuencia de emisión y agitación de los individuos hasta que el intruso se retire. En ningún caso los adultos se ausentan de las guaridas con polluelos. La emisión de vocalizaciones de alarma es eficiente para alertar a los polluelos y juveniles de la presencia cercana de depredadores, como perros, gatos, ganado y otro tipo posible de depredadores (Buzá-Jacobucci 2007).
Madrigueras
Los grupos familiares utilizan madrigueras excavadas en el suelo, por ellos mismos o por otras especies animales, para el anidamiento y crianza. Las madrigueras tienen la forma de cuevas, que las lechuzas construyen o refaccionan a partir de otras preexistentes (Figura 3). Están ubicadas en suelos principalmente con desniveles y las entradas tienen diferentes tamaños, siendo más pequeñas en lechuzas que viven solas que en las que habitan en grupos. Las madrigueras de las lechuzas que viven en grupos tienen una o dos entradas de diferentes tamaños, que están precedidos de un montículo de tierra excavada, usualmente con restos de regúrgitos esparcidos por el suelo (Martinelli 2010). Generalmente, la entrada de la madriguera no presenta ningún patrón de orientación definido; puede ser circular o ligeramente ovalada, continúa en un túnel de longitud variable, que puede llegar hasta metro y medio o dos metros, usualmente en forma de una L y que se prolonga volviéndose más ancha en el extremo donde se ubica su nido. El nido y el túnel presentan en el piso restos de vegetación seca. Los huevos son alojados en una depresión a modo de plato hondo, sobre una acumulación de plumas y ramitas (Pulido 1982, Bellocq 1993). Estas excavaciones pueden ser consideras como actividades modificadoras de las condiciones edáficas, perturbando la costra biológica de suelo en los ecosistemas de Lomas (Arana et al. 2016, Rengifo & Arana 2019). De esta manera, estas lechuzas propiciarían micro heterogeneidad ambiental que podría favorecer la diversidad de hierbas anuales, por lo que serian consideradas como "ingenieros ecosistémicos" en estos ambientes (Rengifo & Arana 2019).
Reproducción
Es una especie monógama y en ocasiones poligínica, con una marcada filopatría. El periodo reproductivo comprende entre octubre y diciembre; en la primavera austral. Según Marks et al. (2019), en Argentina presenta una sola puesta de huevos al año, entre octubre y noviembre, la incubación dura aproximadamente de 27 a 30 días y comienza cuando se pone el primer huevo, lo que da como resultado una nidada de varias edades. Los huevos eclosionan a partir de la quincena de noviembre hasta principios de diciembre. En una misma nidada, las eclosiones consecutivas se producen a intervalos de algunas horas a dos días. En nidadas de cinco huevos, las eclosiones sincrónicas suceden durante tres días entre la primera y última eclosión, mientras que en las eclosiones asincrónicas duran hasta 10 días (Borsellino 2017). El tamaño de la puesta varía entre tres a seis huevos, el tamaño de la nidada o número de eclosiones por nido llega hasta cinco y el éxito reproductivo de 0.3 juveniles por puesta (Bellocq 1993) (Figura 3). Los polluelos son nidícolas, nacen con el cuerpo parcialmente cubierto de plumones y con los ojos cerrados; los cuales se abren a los cinco días de edad; se mueven dentro de las madrigueras a partir de los 10 días. Alcanzan una buena capacidad de vuelo a partir de las seis semanas de edad (Martinelli 2010, Olmedo 2019).
Hábitos tróficos
Generalmente las aves de presa que abarcan una amplia distribución geográfica utilizan diversos tipos de hábitats y demuestran una gran plasticidad en sus hábitos de alimentación (Rocha et al. 2011). Las poblaciones de A. cunicularia que habitan en zonas desérticas y abiertas presentan una dieta generalista (Orihuela-Torres et al. 2018).
La ecología trófica de esta especie ha sido extensamente tratada, sobre todo en ecosistemas agrícolas y principalmente referida a la identificación de mamíferos como presas (Aragón et al. 2002, Luna 2000, Nabte 2004). En ese sentido, uno de los métodos más importantes para determinar la dieta en la lechuza de los arenales es el análisis de las egagrópilas o regúrgitos. Estos se recolectan con relativa facilidad y rapidez debido a que son elementos grandes y fácilmente reconocibles (Bellocq 1987, Bellocq & Kravetz 1983).
El uso de egragópilas evita la necesidad de sacrificar ejemplares para el estudio de la dieta. Los regurgitos o egragópilas se forman debido a los restos de las presas que no son digeridos son regurgitados en forma de masas compactas, que son expulsadas en la cercanía de la entrada de sus nidos y en algunas perchas. En los regurgitos se encuentran pelos, huesos, plumas, restos de insectos y de otros artrópodos, conchas e incluso restos de piel (Bo et al. 2007, Vílchez 2016). Los datos de estos contenidos han permitido incrementar el conocimiento de la biodiversidad en áreas biogeográficas inexploradas (Andrade et al. 2010, Cadena-Ortiz et al. 2016), así como la variación estacional de la abundancia de las poblaciones de las presas en diferentes hábitats (Pulido & Aguilar 1979, Zelaya et al. 1999). Esta información contribuye a la elaboración de planes de manejo y conservación de la biodiversidad, debido a que la lechuza de los arenales cumple un rol fundamental en la cadena trófica como controlador biológico de poblaciones (De Tommaso 2009).

Figura 3 Guaridas y polluelos de Athene cunicularia. A. En Barranca, Lima. B. En Reserva Nacional de Lachay, Lima.
La mayoría de los artrópodos, especialmente insectos, constituyen en orden de importancia el mayor volumen, en la dieta de A. cunicularia. No obstante, la dificultad para identificar los individuos consumidos hasta el nivel de especie hace que en la mayoría de los casos se reporte solo hasta la categoría taxonómica de familia (Nabte et al. 2008, Valladares et al. 2018).
Athene cunicularia es de hábitos tróficos generalistas y parcialmente diurnos, con características de oportunista, debido a que la intensidad de depredación se basa en la disponibilidad y vulnerabilidad de la presa (Zunino & Jofre 1996). Este patrón de comportamiento se repite en varios tipos de hábitats. En agroecosistemas de las pampas argentinas, la dieta de A. cunicularia está relacionada a la disponibilidad de las presas y vulnerabilidad frente a la depredación más que a las preferencias de la lechuza (Bellocq & Kravetz 1983, Bellocq 1987). En la Reserva Nacional Pampa del Tamarugal y Los Verdes en Iquique, Chile, también se encontró que existe selectividad de presas por sus abundancias (Carevic 2011). De manera similar, la variación estacional de la dieta de A. cunicularia en la Meseta de Somuncurá, Argentina, se debe a la estacionalidad de las presas (Andrade et al. 2010), al igual que en la Reserva Nacional Pingüino de Humboldt, Chile, donde come roedores en la estación de reproducción y artrópodos en estaciones donde la densidad poblacional de estos mamíferos baja (Zunino & Jofre 1999). Sin embargo, algunos autores sostienen que si bien A. cunicularia posee una dieta oportunista, tiene cierto grado de selectividad por los artrópodos (como insectos y arácnidos), ya que están presentes de manera constante y sostenida durante todo el año (Torres-Contreras et al. 1994) y pueden representar más del 70% del volumen de las egagrópilas (Vílchez 2016). Estos datos llevan a describir a A. cunicularia como una especie de hábitos tróficos generalista pero con tendencia a una especialización en el consumo de insectos, lo que tipifica su dieta como básicamente insectívora u omnívora (Pardiñas & Cirignoli 2002, Bo et al. 2007, Carevic 2011), contradiciendo la base de datos general de rasgos ecológicos de las aves EltonTrait versión 1 (Wilman et al. 2014) donde se considera que su dieta se basa en aves o mamíferos (70%), artrópodos (20%) y reptiles (10%).
El particular hábito alimentario de A. cunicularia, le permite coexistir con otras rapaces que habitan en una misma región geográfica (Machado y Melo 2000), además de los horarios de actividad diferentes, como es el caso de Tyto alba cuya dieta se basa prácticamente en micromamíferos y es exclusivamente nocturno (Carmona & Rivadeneira 2006, Bo et al. 2007). Aún en el desierto de Atacama, donde A. cunicularia, Geranoaetus polyosoma y Tyto furcata fueron caracterizadas como generalistas por la gran variedad de especies presas que presentan, la superposición de nichos tróficos es muy baja, ya que la actividad de la lechuza de los arenales es diurna, crepuscular y nocturna; y que si bien comparte a coleópteros como presas con G. polyosoma y al roedor Eligmodontia dunaris con T. furcata, estos ítems alimentarios no son los predominantes en las dietas y el aporte en biomasa parece no ser significativo (Valladares et al. 2018).
La variación estacional de la dieta está relacionada con la época reproductiva, como se ha documentado en Iquique, extremo norte de Chile, en el desierto de Atacama, donde la lechuza presenta un pico de reproducción coincidente con el aumento de la producción primaria y el incremento de la abundancia de pequeños mamíferos (en especial Phyllotis darwini, Abrothrix olivaceus y Oligoryzomis longicaudatus), lo que provee abundante alimento a hembras preñadas y juveniles (Carevic 2011). En otros ámbitos de estudios se encuentra este mismo patrón, donde A. cunicularia se comporta como carnívoro durante la estación reproductiva y como carnívoro-insectívoro durante la estación no reproductiva ( Bellocq 1993, Bo et al. 2007, De Tommaso et al. 2009). En un estudio en Chile se registró que cuando la densidad de pequeños mamíferos se incrementa hasta alcanzar más de 100 animales por hectárea, la diera de A. cunicularia es prácticamente solo de estos animales, sugiriendo que prefiere este tipo de alimento por sobre los insectos (Siva et al. 1995).
El consumo parcial de vertebrados ha sido registrado en varios estudios, lo que ha sido relacionado con un comportamiento trófico que disminuye el consumo de partes no digeribles o evita las toxinas que provienen principalmente de glándulas parótidas y ovarios (Schlatter et al. 1980, Torres-Contreras et al. 1994, Andrade et al. 2004, Martínez et al. 2018, Orihuela-Torres et al. 2018). Por otro lado, se tienen registros de depredación de A. cunicularia por Geranoaetus melanoleucus tanto en Olmos, Región Lambayeque en el noroeste de Perú (Schoonmaker 1984) como en agroecosistemas de Ica, donde también es presa de Falco peregrinus.
Las egagrópilas
El tamaño de las egagrópilas es variable con longitudes de 1.41 a 2.86 cm, ancho de 1.21 y altos de 1.11 a 1.14 cm (Machado & Melo 2000, Vílchez 2016). Los tamaños están en función del tamaño y abundancia de las presas que ingiere, como es el caso de roedores, insectos, arácnidos, escorpiones (Vílchez 2016, Guerrero et al. 2017). El tamaño de las egagrópilas de A. cunicularia en comparación con otras especies que comparten hábitos tróficos similares es menor; debido a la baja predominancia de vertebrados (Gonzales et al. 2004, Aragón et al. 2002).
El color de las egagrópilas es otra característica que está en función del tipo de alimentación del ave. Las tonalidades varían de marrón claro a marrón oscuro debido a la presencia de diversos tipos de insectos, las de color pardo rojizo asociadas al consumo de Orthoptera, las de color pardo acaramelado a escarabajos de la familia Carabidae, las de color negro a restos de Tenebrionidae e Himenoptera en invierno y primavera; mientras que en verano y otoño, son marrones amarillentos cuando tienen una mezcla de insectos con escorpiones y de plomo oscuro a grisáceas por la presencia de pequeños mamíferos, especialmente roedores (Pulido 1982, Roque-Vásquez et al. 2017).
Presas
Estudios realizados en Argentina, Brasil, Chile, Ecuador, Paraguay, Perú, entre otros países, demuestran que los porcentajes de representación de los distintos ítems tróficos varían por efecto de los cambios ambientales y la oferta de presas, de una estación del año a otra (Andrade et al. 2004). Las rapaces pequeñas como Athene cunicularia están limitadas a consumir, entre los vertebrados, presas de menor tamaño, ya que posee una superficie alar insuficiente para sostener el peso que exceda el tamaño crítico de presa (Carevic 2011). Se ha reportado, aunque con poca frecuencia, que la lechuza de los arenales puede depredar vertebrados que pesan hasta 700 g. En Trujillo, Cerro Campana, La Libertad, excepcionalmente ha sido encontrada en la dieta Lagidium peruanum una especie de roedor de gran tamaño, de la familia Chinchillidae (Medina et al. 2013). Lo mismo sucede con Rattus rattus "rata negra" una especie cuyo peso es de 150 a 200 gramos, presente en la dieta de A. cunicularia a lo largo de todo el año, así como a R. norvergicus "rata gris" registrada en diferentes meses del año (Andrade et al. 2004, Mena et al. 2007, Carevic 2011, Medina et al. 2013) (Tabla 1).
Entre los roedores de menor tamaño se ha encontrado en su dieta a: Aegialomys xantheolus, Phyllotis amicus, Phyllotis andium, Mus musculus (Mena et al. 2007). Mus musculus es la principal presa, aunque la más pequeña en comparación con los otros Muridae. A. cunicularia consume distintas especies de roedores generalmente dentro de un rango de peso entre 26.3 y 85.0 gramos (Carevic 2011). Incluso en algunos casos los roedores brindan el mayor aporte de biomasa a lo largo de todo el año (Bo et al. 2007). En las lomas de Lima, M. musculus es la principal presa entre los vertebrados consumidos en otoño y verano, mientras R. rattus es más abundante en invierno y primavera, incluyendo también a una especie de marsupial Thylamys sp. (Mena et al. 2007) (Tabla 1).
Otros restos óseos encontrados en las egagrópilas pertenecen a tres especies de aves de tamaño pequeño, Geositta peruviana, una especie endémica del Perú, Zonotrichia capensis y Columbina cruziana, (Medina et al. 2013). También es considerado un depredador relativamente común en el litoral costero del Perú, registrándose el ataque de A. cunicularia sobre una población del gaviotín real (Thalasseus maximus) y gaviotín chico o peruano (Sternula lorata), en los alrededores de Punta Salinas, cerca de Huacho (Stucchi 2017) (Tabla 1).
En relación a los reptiles que son presa de esta lechuza, una especie pertenece a la familia Colubridae, tres a la familia Tropiduridae: Microlophus tigris (con un rango de distribución similar), así como otras dos especies de lagartijas Microlophus koepckeorum y Microlophus occipitalis, también se ha registrado a una especies de geko (Phyllodactylidae) Phyllodactylus sp. (Carrillo & Icochea 1995, Medina et al. 2013) (Tabla 1).
En general, el análisis de las egagrópilas en la mayor parte de su distribución muestra una predominancia de artrópodos. El mayor consumo de artrópodos es en verano y otoño alcanzando incluso el 93% del total de la dieta (Pulido & Aguilar 1979) mientras que disminuye en invierno y primavera, aumentando mamíferos y aves, lo que muestra un patrón estacional en el consumo de presas. Los arácnidos una morfoespecie del Orden Araneae y los escorpiones del Orden Scorpionida, Hadruroides charcasus son los de mayor abundancia en primavera y verano (Guerrero et al. 2017) (Tabla 1).
Entre los artrópodos, los insectos constituyen el mayor aporte en la dieta. El orden con mayor presencia varía de acuerdo con el lugar; en algunos casos fue Dermaptera, Coleoptera, Orthoptera, Hymenoptera y Diptera (Tabla 1); sin embargo, en la mayoría de los casos los órdenes más abundantes, en la dieta de esta especie son Coleoptera y Orthoptera (Bo et al. 2007, Carevic 2011, Machado y Melo 2000). En las lomas costeras los órdenes más frecuentes son Coleoptera (22.6%) seguido de Hymenoptera, Díptera, Lepidoptera, Hemiptera, Orthoptera y Dermaptera (Aguilar 1976). De manera similar en el tillandsial de Punta Hermosa (Aguilar 1976), Coleoptera constituyó el 30% seguido de Diptera, entre otros órdenes; en tanto Dermaptera representó menos de 0.1% (Aguilar 1977).
Otras especies registradas en lomas de Lachay, lomas de Lima hasta Asia en el sur, Cerro Campana en Trujillo y el Valle del Rímac, comprenden: Scarabaeidae, Carabidae (Calosoma sp.), Buprestidae (Ectigonia bilineata), Passalidae, Acrididae (Schistocerca sp.), Gryllidae (Acheta domestica), Curculionidae, Tenebrionidae, Cerambycidae, Blattodea, Dermaptera, Hemiptera, Lepidoptera, Diptera (Pulido 1979, Mena et al. 2007, Medina et al. 2013, Vílchez 2016) (Tabla 1). Para agroecosistemas, la abundancia de los artrópodos depredadores constituye un componente importante, donde el orden Dermaptera puede llegar a ocupar el 11.77% y la familia Carabidae el 2.53% del total de depredadores (Schuller & Sánchez 2003).
Otro aspecto importante es que A. cunicularia dirige su dieta hacia la especialización en el consumo de insectos rastreros. Dentro de las familias identificadas para el orden Coleoptera (Carabidae, Scarabaeidae, Tenebrionidae, Curculionidae y Cerambycidae), Carabidae fue la más consumida por A. cunicularia ya que presentó la mayor abundancia relativa en las egagrópilas (Vílchez 2016). El alto consumo de insectos permite de manera indirecta la identificación y composición de la fauna entomológica, en su gran mayoría rastreros. Su dieta también incluye caracoles terrestres de la Familia Bulimulidae a Scutalus sp. y Bostryx sp. (Medina et al. 2013) (Tabla 1).
La relación de A. cunicularia con los agroecosistemas (Filloy & Bellocq 2007) la síndica como un potencial controlador biológico de especies plaga ya que incluye en su dieta, plagas de la agricultura y pequeños mamíferos que constituyen reservorios de enfermedades zoonóticas (Bo et al. 2007). En Ica hemos registrado un importante consumo de algunos insectos plaga como la polilla del género Copitarsia.
Leucismo y melanismo
Se han observado también casos de leucismo en esta especie, con el primer reporte para Sudamérica en octubre de 2008 en el Parque Natural Municipal do Pássaros, localizado en la Municipalidad de Rio das Ostras, Rio de Janeiro (Brasil), donde el ejemplar fue capturado cerca a la restinga. El ave exhibió plumaje enteramente blanco, así como las piernas y el pico. La coloración de los ojos se mostró normal (iris amarillo), aunque más brillante que lo observado comúnmente (Nogueira & Alves 2011).
Tabla 1 Especies de vertebrados e invertebrados presentes en la dieta de la lechuza de los arenales en Perú.
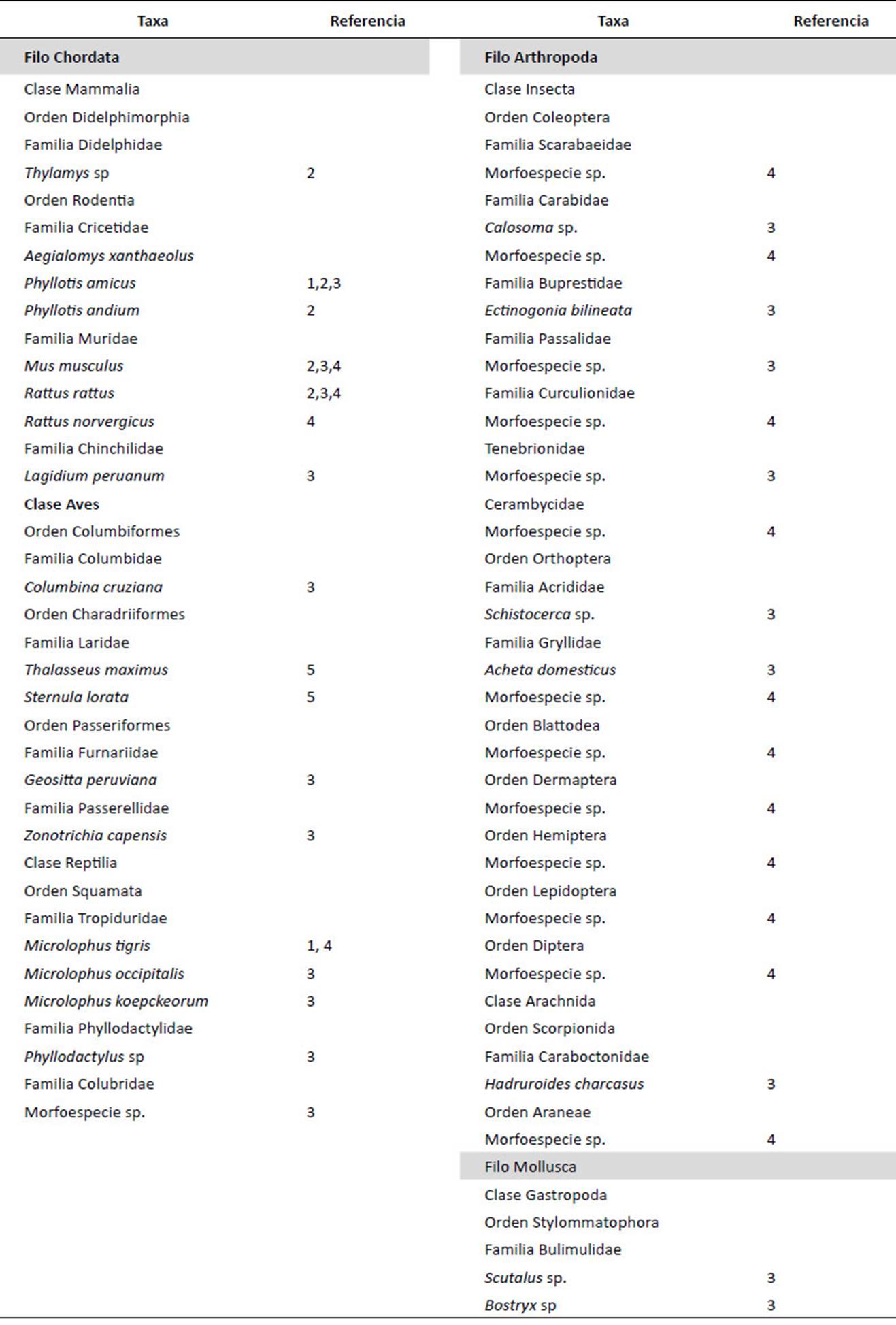
1 Pulido 1979, Lomas de Lachay
2 Mena et al. 2007, Lomas de Lima desde Lachay hasta Asia
3 Medina et al. 2013, Cerro Campana, Trujillo
4 Vílchez 2016, Valle del Rímac, Callao
5 Stucchi 2017, Punta Salinas, Huacho
En el año 2009, en Montevideo, Uruguay fue fotografiado un ejemplar de Athene cunicularia parcialmente melánico, con una coloración marrón oscurecida en la espalda; el vientre marrón claro con algunas manchas blanquecinas, contrapuesto al patrón normal; el rostro oscuro y las clásicas ceja y línea blanca por debajo del pico poco marcadas, particularmente en el centro del rostro. El melanismo es el resultado de la expresión de un solo alelo dominante en heterocigosis; menos frecuente en las poblaciones de aves que los causantes del albinismo (Montenegro & Caballero-Sadi 2009).
Estado actual y conservación
Athene cunicularia está incluida en el Apéndice II de la Convención sobre el Comercio Internacional de Especies Amenazadas de Fauna y Flora Silvestres (MINAM 2018, CITES 2020) y es considerada en la categoría de preocupación menor (LC) en la Lista Roja de la Unión Internacional para la Conservación de la Naturaleza (IUCN 2020). Por otro lado, en Canadá, y Estados Unidos de Norte América se está actualmente evaluando su estado de conservación, debido a que su población está disminuyendo por la destrucción y pérdida de su hábitat (Conway y Pardieck 2006). La disminución de las lechuzas se debe probablemente a la pérdida de pastizales y estepas de arbustos en Washington, donde anidan dentro de terrenos privados, por lo que se necesitan programas de educación y divulgación que promuevan la conservación de los ambientes y especies dentro de las propiedades privadas (Conway et al. 2006).
En algunos estados de Norte América se han reportado la desaparición de las poblaciones. Hace 50 años podía encontrarse en muchos lugares por sus abundantes poblaciones y amplia distribución; pero en las últimas décadas su hábitat natural se ha reducido tanto por la pérdida de la vegetación natural como por la agricultura intensiva, que hace uso indiscriminado de pesticidas, envenenando insectos y roedores que constituyen las presas en zonas donde las lechuzas anidan y se alimentan (Lantz et al. 2004).
Aunque a nivel global A. cunicularia muestra una tendencia poblacional decreciente, no obstante, en la mayor parte de los países de América del sur se considera que su estado de conservación es de "preocupación menor"; en ese sentido los mismos factores perjudiciales que las afectan en América del Norte, ocurren en América del Sur, con similar impacto en sus poblaciones.
En la región metropolitana de Chile, el seguimiento en campo del estado de conservación durante 24 años, reportó que la población de A. cunicularia está decreciendo. Esta declinación se debe a la pérdida de hábitats por la rápida transformación de tierras agrícolas en viviendas, no obstante que esta especie es tolerante a ambientes suburbanos (Jaksic et al. 2001). Lo mismo sucede en Magallanes y Tierra del Fuego donde la especie está virtualmente extinta debido a la destrucción de sus lugares de reproducción por efecto de la ganadería intensiva (Figueroa & Alvarado 2012). En los hábitats xerofíticos del noreste de Venezuela, las amenazas ambientales están provocando el abandono de madrigueras, enfermedades y éxodo poblacional; por lo que la especie está en situación de vulnerabilidad local (Roque-Vásquez et al. 2017).
En el Perú, A. cunicularia presenta una amplia distribución en los bosques secos del noroeste, el desierto costero, las vertientes occidentales y los valles interandinos, aunque se cierne sobre ella diversas amenazas potenciales y reales. En gran parte de su distribución ocurre una destrucción y reducción de su hábitat natural y sus potenciales presas, pese a que esta especie es bastante tolerante al ambiente semirrural, la agresión por animales domésticos como perros y gatos, el uso de pesticidas para actividades agrícolas, el desarrollo de actividades agropecuarias informales; las colisiones con vehículos y la cacería son fuentes de presión para sus poblaciones. Estas acciones antropogénicas ocasionan la eliminación de las madrigueras y sitios importantes de alimentación; así como la disminución de las poblaciones de vertebrados que son potenciales recursos alimentarios para esta lechuza (Vílchez 2016, Orihuela-Torres et al. 2018).
Una de las graves amenazas para esta especie en las ciudades, es la mortalidad de los individuos y el abandono de las madrigueras a consecuencia de acciones vandálicas, así como la perturbación por acción de las personas. Los ataques de personas a estas aves pueden estar relacionados a la creencia de que sus cantos anuncian la muerte, lo que está ampliamente diseminado en América del Sur (Mires 2000). Sin embargo, en el antiguo Perú las lechuzas de los arenales tuvieron un papel relevante, en especial en las culturas de la costa, como los mochicas, donde se le atribuía un importante rol de conexión entre el inframundo (por sus madrigueras), el mundo superficial (al desplazarse por el suelo) y el mundo superior (al poder volar), además de considerarse con un importante rol de ayuda en la labor agrícola y asignarles varias características sobrenaturales, esto se refleja en su iconografía donde se encuentran representaciones naturales y antropomorfizadas de esta especie, e inclusive un personaje de importancia religiosa denominado Sacerdote Lechuza (Narvaez 2014, Ruiz 2013). Incluso, tanto en el pasado como hasta la actualidad a muchos chamanes se les atribuye la capacidad de transformarse en lechuzas para acompañar a las almas al morir (Arriaga 1968, Ruiz 2013). Otro importante dato sobre la relación entre las lechuzas y los hombres del antiguo Perú es la hipótesis fuertemente apoyada del origen del nombre Cusco, que estaría relacionado al mito de origen del incanato y al antiguo lenguaje del área (aymara), significando "lechuza" o "roca (hito) donde se posó la lechuza" (Cerrón-Palomino 2006).
Una forma de contrarrestar la disminución de las poblaciones de A. cunicularia en las regiones urbanas o rurales es el establecimiento de madrigueras artificiales, lo que constituye un método efectivo, de bajo costo y con buenos resultados cuando la especie no es capaz de excavar una por si sola (Borsellino 2017). En ese caso pueden ser además utilizadas para trasladarlos cuando están instaladas en lugares poco adecuados o ante la posible desaparición de esta por el avance de la frontera urbana. Un factor importante que hay que tener en consideración es que hay que trabajar en la sensibilización de las personas a través de la implementación de programas de educación ambiental lo cual contribuirá al manejo y conservación de poblaciones de las lechuzas en ambientes urbanos.
Athene cunicularia es considerada como una de las 24 especies de aves rapaces que son comercializadas ilegalmente en los mercados de Lima y con una captura ilegal cada vez mayor debido a la creciente demanda de aves de presa para el control de especies de aves consideradas plaga tanto para cultivos como en las zonas urbanas (Beingolea 2009).
En el Perú las poblaciones de A. cunicularia cuentan con protección, a través del Sistema Nacional de Áreas Naturales Protegidas por el Estado (Figura 4). Esta protección incluye áreas naturales protegidas por el estado (24), áreas naturales regionales (5) y áreas de conservación privada (12), repartidas en 13 regiones del país (Fig. 4). El mayor número de áreas de conservación donde se encuentran son de las categorías Área de Conservación Privada y Reserva Nacional; mientras que las regiones con más áreas son Lima y Cusco (Figura 4).
En la Región de Piura, que está comprendida en el EBA (Endemic Bird Area) Región Tumbesina es registrada como poco común, particularmente en el Coto de Caza el Angolo, entre los 130 y 1600 metros de altura (Barrio et al. 2015). En la ciudad de Piura (un desierto superárido Premontano Tropical) la especie es común y frecuenta áreas urbanas, jardines, bosques de algarrobos, playas del río Piura y zonas de cultivo (Chávez-Villavicencio 2013). En el relicto del manglar de San Pedro, una asociación boscosa de 1200 ha (límite sur en la distribución de los manglares de la costa del pacifico oriental) se han reportado algunos ejemplares aislados (Valega 2007). Otro estudio efectuado en la zona de San Juan de Curumuy, región Piura, registra que en esta zona es común (Martínez et al. 2008); del mismo modo la hemos registrado como común en el desierto de Sechura.
En la Zona Reservada Laquipampa (región Lambayeque) se ha registrado como poco común entre los 300 y 800 metros de altura, por los ríos Moyán y La Leche (Angulo et al. 2012). En la parte costera de Piura y Lambayeque la hemos registrado como común en varios tipos de ecosistemas. En los agroecosistemas de Ica y Lima se reportan como comunes (Pulido et al. 2007, Salinas et al. 2007, Pulido et al. 2013). En los humedales de Ite, ubicados en la desembocadura del río Locumba, al sur de la costa peruana en la Región Moquegua, se ha registrado como poco común (Vizcarra 2008). En la región Arequipa en el valle de Majes desde donde confluye el río Colca con el río Capiza o Andamayo a los 900 m de altura y desciende por un recorrido de 115 km hasta el Océano Pacífico y en el Santuario Nacional Lagunas de Mejía es una especie común (González & Málaga 1997).
Tomando como ejemplo lo determinado para las poblaciones de Norteamérica (Holroyd et al. 2001), se pueden determinar algunas alternativas de solución para los problemas de conservación de Athene cunicularia en Perú:
Identificación precisa del "estatus" de amenaza: se requiere monitorear la distribución y abundancia de las poblaciones.
Manejo de hábitat y recursos: determinar los usos de los diferentes hábitats, realizar mapas de distribución específicos por áreas, identificar las amenazas en cada tipo de hábitats. Desarrollar protocolos de mitigación del impacto de actividades humana en sus hábitats en particular en zonas áridas, así como el uso de pesticidas que no sólo disminuyan su alimento sino también pueden envenenar de manera indirecta a las lechuzas.
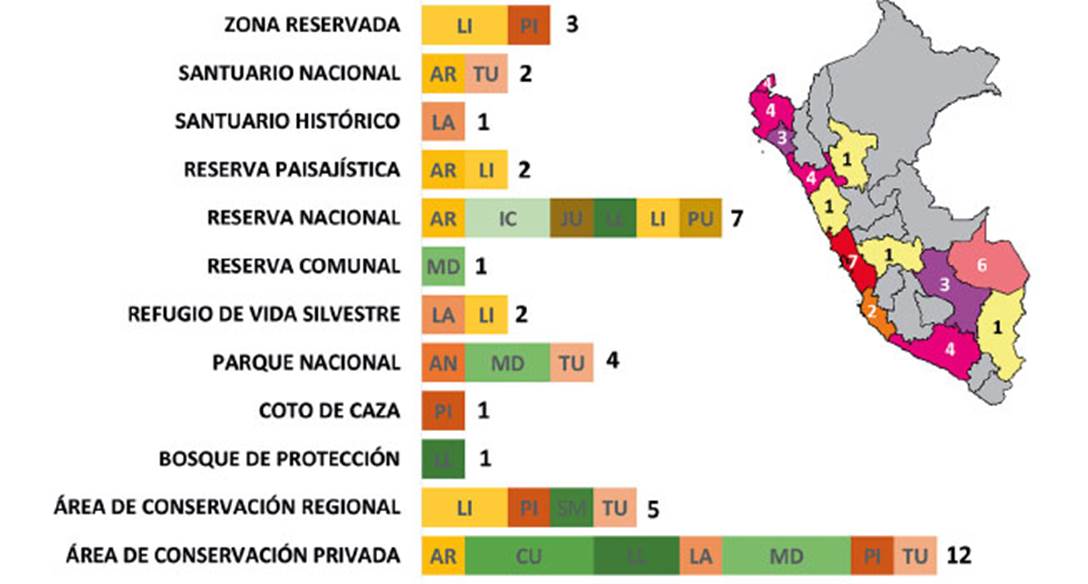
Figura 4 Número de áreas protegidas donde se presentan registros de Athene cunicularia. Se indican las categorías de las áreas, el número de éstas y las regiones donde se ubican. AN: Ancash, AR: Arequipa, CU: Cusco, IC: Ica, JU: Junín, LA: Lambayeque, LI: Lima, LL: La Libertad, MD: Madre de Dios, PI: Piura, PU: Puno, SM: San Martín, TU: Tumbes. El Mapa muestra el número de áreas por región.
Educación: se requiere programas de educación sobre la conservación de los suelos, la importancia de sitios de reproducción y alimento de A. cunicularia y promover información sobre el importante rol que desempeñan. Se requiere material de educación para colegios, en periódicos, noticieros y redes sociales para revertir la percepción negativa de su presencia.
Investigación: se necesita investigación orientada a determinar las causas de la declinación y el modelamiento de sus poblaciones, modelos de uso de hábitat incluyendo el efecto de la modificación de los suelos, la diversidad genética de sus poblaciones, entre varios temas.
Gestión: promover la incorporación entre las instancias del gobierno nacional, regional y local la importancia de conservar la especie de lechuza más común en los ambientes áridos y semiáridos del Perú.
Por último, en base a la información científica, es necesario realizar planes de conservación que permitan que las poblaciones de Athene cunicularia se incrementen y mantengan estables, lo mismo que de otras rapaces nocturnas en especial en ecosistemas frágiles, asegurando a los importantes servicios ecosistémicos que presta, como regulador de poblaciones de insectos y pequeños mamíferos, así como ingeniero ecosistémico en las Lomas costeras debido a sus hábitos fosoriales












 uBio
uBio 



