Introducción
Physalis peruviana L, (Solanaceae) conocida en Perú como “aguaymanto”, crece principalmente en regiones andinas (Puente et al. 2011). Históricamente fue introducida en Sudáfrica provocando su expansión a países del trópico y sub-trópico, donde actualmente es cultivada con fines comerciales (Mazorra et al. 2006). Debido a su amplia distribución y a las diversas condiciones geográficas, P. peruviana ha sido agrupada en ecotipos según descriptores de fruto como color, forma y sabor o descriptores de la planta como hábito y altura. Colombia, Sudáfrica y Kenia son los ecotipos comerciales más conocidos en la actualidad, todos ellos cultivados en Colombia (Fischer 2005).
La distribución de P. peruviana en Perú ha sido reportada en la región Yunga y Quechua (2000 y 2500 m de altitud), principalmente en las zonas andinas de las regiones Ancash, Arequipa, Ayacucho, Cajamarca, Cusco, Huánuco y Junín (Dostert et al. 2012, Tapia & Fries 2007). Su amplia distribución y su capacidad de adaptación, además del corto proceso de domesticación, han fomentado variaciones de color, tamaño y sabor entre los frutos que, sumado a la falta de conocimiento sobre la diversidad genética de P. peruviana, afecta a la cadena productora y exportadora de este recurso, por lo cual la caracterización genética del fruto se hace necesaria.
El número cromosómico de P. peruviana ha sido reportado en diferentes poblaciones. Inicialmente Menzel (1951), describió especies del género Physalis con 24 y 48 cromosomas, concluyendo que el número básico del género es x = 12. Rodríguez y Bueno (2006) en Colombia reportaron 2n = 3x = 24 y 2n = 4x = 32 cromosomas para el ecotipo Colombia; mientras que para el ecotipo Kenia 2n = 48 cromosomas; además, describieron una correlación directa entre los números cromosómicos y descriptores morfométricos de hoja y fruto. Posteriormente, Sánchez (2014) analizó genotipos colombianos reportando variación de números cromosómicos tales como 2n = 4x = 48, 32 y mixoploides.
Considerando la variación de números cromosómicos descrita por diversos autores, en el presente trabajo se describe y compara citogenéticamente tres poblaciones cultivadas de P. peruviana de la región Cajamarca: San Pablo, Celendín y Cajabamba, empleando técnicas de citogenética clásica. Esta caracterización citogenética contribuirá al conocimiento de la diversidad biológica proporcionando información base para futuros trabajos de caracterización del germoplasma con fines de conservación y mejoramiento genético.
Material y métodos
Material biológico.La colecta de frutos de P. peruviana se realizó en colaboración con la empresa AgroAndino Perú een la provincia de San Pablo, con la asociación AZ ingenieros EIRL en la provincia de Celendín y con el Ing. Lenin Abanto en la provincia Cajabamba (Tabla 1).
Durante la colecta fueron realizadas algunas observaciones en campo, en relación con el hábito de las plantas y el manejo agronómico:
San Pablo: Plantas de aguaymanto obtenidas por selección masal. Plantas en promedio de 1.50 m (la mayor de las tres poblaciones) y de tipo semierecto. Manejo agronómico tecnificado con plantación lineal, control de tutoreo y poda.
Celendín: Plantas de tamaño mediano y del tipo semi-erecto. Las plantas en la fase final de producción presentaban plagas y algunos casos de infección por hongos. Fue observado el uso de tutores para el crecimiento de las plantas.
Cajabamba: Plantas de menor tamaño, aproximadamente 50 cm, de tipo semirrastrero. Las plantas estaban en proceso de fructificación. Sin manejo agronómico tecnificado, pero sí una notoria presencia de polinizadores e insectos herbívoros.
En cada campo de cultivo se realizó un muestreo aleatorio de 10 plantas, colectándose 10 frutos por planta. La elección de los frutos se hizo según la escala de maduración de la Norma Técnica Colombiana (NTC 4580) para P. peruviana. En total fueron colectados 100 frutos por población. En condiciones de laboratorio, fueron extraídas las semillas generándose un stock de 2000 semillas aproximadamente por población.
La identificación taxonómica de las muestras herborizadas fue realizada en el Herbario del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (MHN-UNMSM).
Preparación de láminas.Semillas de P. peruviana fueron colocadas en placas Petri conteniendo papel filtro humedecido con agua destilada y luego de cinco días se realizó la colecta de raíces de entre 1.5 mm a 2 mm. Las raíces fueron pre-tratadas con una solución de colchicina 0.25% y DMSO 2% (dimetil sulfóxido) por 1 hora y 20 minutos a temperatura ambiente (18° ‒ 22° C) y en oscuridad. Para fijar el material se utilizó una solución de etanol: ácido acético (3:1), por un tiempo máximo de 24 horas a 4 °C. El meristemo radicular fue sometido a una hidrólisis ácida con HCl 5N por 10 minutos a 14500 rpm y posteriormente macerado con solución Targa a temperatura ambiente por 5 minutos. El montaje de las láminas se realizó empleando la técnica de squash con ácido acético 45% y coloración con orceína lacto acética 2%.
Análisis de placas metafásicas.Por cada población fueron preparadas 100 láminas, de las cuales fueron seleccionadas 30 metafases para el conteo de número de cromosomas por presentar una adecuada dispersión de los cromosomas. De este grupo, las 5 mejores metafases fueron consideradas para el análisis morfométrico y la elaboración del cariotipo. La captura de microfotografías se realizó empleando el software LAS EZ de Leica.
El análisis morfométrico de las microfotografías fue realizado en el software IdeoKar, desarrollado por Mirzaghaderi (2015). Este software proporciona parámetros como tipo de cromosoma, índice braquial o arm ratio (AR) y longitud total del complemento haploide (HCL) basándose en Levan et. al. (1964). Otros parámetros considerados son índice de asimetría intracromosómica (A ) e intercromosómica (A ) según Romero-Zarco(1986) y el índice de asimetría según Paszko(2006).
Resultados
Número cromosómico.De un total de 30 metafases por población, el número cromosómico más frecuente en las tres poblaciones estudiadas es 2n = 4x = 48. Concordando con lo descrito por Rodríguez & Bueno (2006), Sánchez (2014) y Liberato et al. (2014).
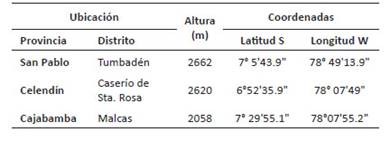
La población de San Pablo, 2n = 48 presentó una frecuencia de 57% de las células analizadas. Otros números cromosómicos oscilan entre 2n = 44 a 2n = 52 y representan el 43%; evidenciando casos de aneuploidía somática (Tabla 2). Se observo un caso de una célula con 82 cromosomas, posiblemente consecuencia de la ausencia de citocinesis (Fig. 1).
Tabla 2 Frecuencia de números cromosómicos (2n) en 30 metafases de Physalis peruviana analizadas en la población de San Pablo.
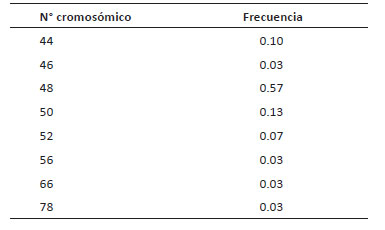
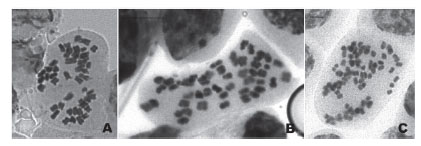
Figura 1 Metafases de Physalis peruviana, población San Pablo, evidenciando aneuploidía somática. A. Célula metafásica con 2n=44 cromosomas, B. Célula con 2n=50 cromosomas y C. célula conteniendo 82 cromosomas. Barra de escala: 5µm en A y B, 2 µm en C.
En Celendín el número cromosómico fue 2n = 48 y tuvo una frecuencia del 50%. Otros números cromosómicos también fueron registrados con una frecuencia menor (2n = 24, 46, 50, 52 y 54) (Tabla 3). Algunos de ellos también fueron reportados en la caracterización de San Pablo. Se observó el caso de una célula con 80 cromosomas (Fig. 2).
Tabla 3 Frecuencia de números cromosómicos (2n) en 30 metafases de Physalis peruviana analizadas en la población de Celendín.
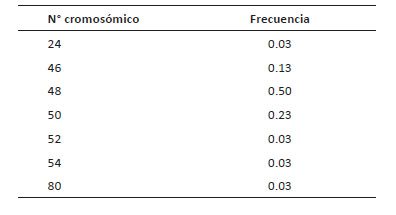
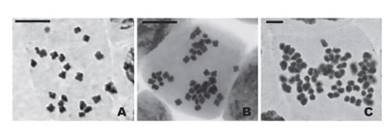
Figura 2 Metafases de Physalis peruviana, población Celendín, evidenciando aneuploidía somática A. Célula metafásica con 2n = 24, el menor número registrado. B. Célula con 2n = 46 cromosomas y C. Célula conteniendo 80 cromosomas. Barra de escala: 5µm en A y B, 2 µm en C.
Cajabamba, presentó 2n = 4x = 48 como número cromosómico más frecuente, siendo observado en 34% del total de metafases analizadas (Fig. 3) (Tabla 4). Sin embargo, es una frecuencia menor a la observada en San Pablo y Celendín. Otros números cromosómicos registrados fueron 2n = 44, 50, 52 y 54, los cuales también fueron reportados en las otras dos poblaciones en estudio (Tabla 4).
Tabla 4 Frecuencia de números cromosómicos (2n) en 30 metafases de Physalis peruviana analizadas en la población de Cajabamba.
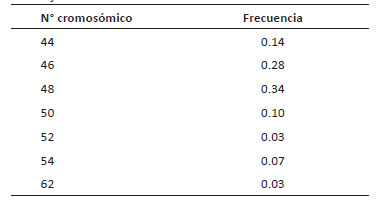
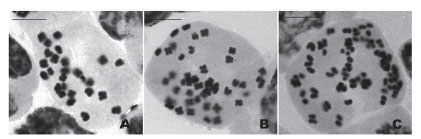
Figura 3 Metafases de Physalis peruviana, población Cajabamba, evidenciando aneuploidía somática. A. Célula metafásica con 2n = 26, el menor número registrado. B. Célula con 2n = 46 cromosomas C. Célula 2n = 62 cromosomas. Barra de escala: 5µm.
De esta manera, el número cromosómico con mayor presencia en las poblaciones descritas de P. peruviana, oscila entre 2n = 46 a 52 cromosomas, siendo el número más frecuente 2n = 48 (Fig. 4). La población Cajabamba, particularmente presenta números cromosómicos de 46 y 48 cromosomas con frecuencia.
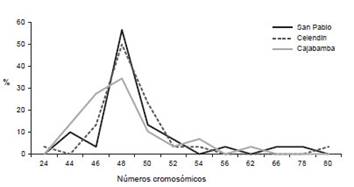
Figura 4 Frecuencia de los números cromosómicos encontrados en tres poblaciones de Physalis peruviana. Nótese que 2n = 48, presenta un pico más elevado en todos los casos analizados.
Así mismo, los casos atípicos de número cromosómicos como 2n = 62 y 2n= 82 con bajísima frecuencia permite suponer posibles errores durante la citocinesis.
Análisis morfológico de los cromosomas.A pesar de que 2n = 48 fue el número cromosómico con mayor frecuencia registrado en las tres poblaciones; no puede concluirse que es un caso de tetrapoliplodía; por ello, en este caso, fue necesario determinar la composición de los cariotipos, por tinción convencional como orceína o por patrón de bandas con Giemsa o FISH.
La ordenación de los cromosomas para cada cariotipo fue realizada según Levan et al. (1964): a) orden decreciente de tamaño, b) incremento de índice braquial o arm ratio y c) tomando ambas opciones, dando prioridad al valor de arm ratio como primer factor de agrupamiento sobre el ordenamiento decreciente por tamaño (Figs. 5, 6, 7 y Tablas 6, 7, 8). De acuerdo con el índice braquial o arm ratio (r), que describe la posición del centrómero, se reporta la prevalencia de cromosomas metacéntricos en 16 de los 24 pares que conforman el cariotipo en las tres poblaciones.

Figura 5 A. Metáfase de Physalis peruviana, población San Pablo. B. Cariograma ordenado según el valor del índice braquial (r) y en orden decreciente de tamaño. C. Idiograma.

Figura 6 A. Metáfase de Physalis peruviana, población Celendín, B. Cariograma ordenado según el valor del índice braquial (r) y en orden decreciente de tamaño, C. Idiograma.

Figura 7 A. Metáfase de Physalis peruviana, población Cajabamba, B. Cariograma ordenado según el valor del índice braquial (r) y en orden decreciente de tamaño, C. Idiograma.
Los cariotipos obtenidos muestran diferencias interpoblacionales en las fórmulas cariotípicas haploides de P. peruviana. El cariotipo de San Pablo registró la siguiente fórmula 17m+4sm+3t, Celendín 24m y Cajabamba 20m+2sm+2t; donde m: metacéntrico, sm: submetacéntrico y t: telocéntrico (Figs. 5, 6, 7). A su vez, las diferencias i nterpoblacionales observadas dentro de la misma especie, se relacionan directamente con la diferente localización geográfica de cada población (Tabla 5).
Tabla 5 Índice braquial (r) y tipo de cromosoma para cada par cromosómico que conforma el cariotipo de Physalis peruviana proveniente de San Pablo, Celendín y Cajabamba, respectivamente (2n=48).
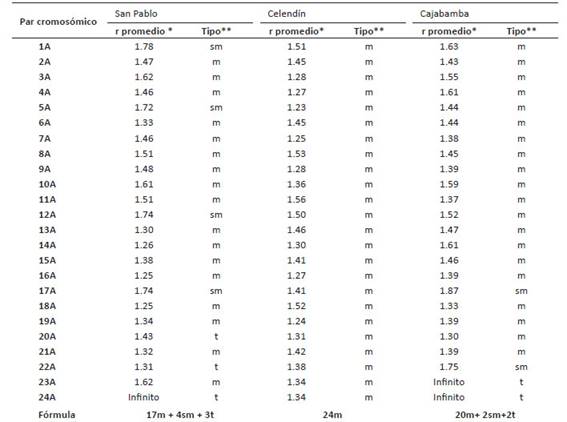
*r promedio: se refiere al promedio de los índices braquiales (r) de las 5 metafases analizadas por población. **Tipo: m: metacéntrico, sm: submetacéntrico y t: telocéntrico.
La caracterización morfológica de cada par de homólogos permitió la elaboración de cariotipos para cada población; los cuales fueron caracterizados a partir de cinco variables cuantitativas mostradas en la Tabla 9. De esta forma, la longitud total del complemento haploide (HCL) mayor fue descrita en el cariotipo de San Pablo con un valor de 24.593 µm. El cariotipo más simétrico fue el de Celendín con valores de S%= 53.226 y A= 0.17; en cuanto que San Pablo y Cajabamba fueron descritos como asimétricos por sus valores de asimetría intra e intercromosómica (A1 y A2).
Los resultados cuantitativos del cariotipo corroboran lo que se obtuvo en el análisis morfológico de cada par cromosómico. Por lo cual, la simetría de Celendín se correlaciona con la fórmula cariotípica de 24 cromosomas metacéntricos; mientras que la asimetría de San Pablo y Cajabamba se explica por los diversos tipos de cromosomas presentes en sus respectivos cariotipos: metacéntricos, submetacéntricos y telocéntricos (Figs. 5, 6 y 7).
Discusión
Número cromosómico.El número cromosómico diploide 2n = 48, registrado como el más frecuente en las poblaciones de San Pablo, Celendín y Cajabamba, coincide con el número cromosómico esperado según trabajos anteriores que describen citogenéticamente a P. peruviana (Menzel 1951; Badr et al. 1997; Rodríguez & Bueno 2006; Liberato et al. 2014, Sánchez 2014).
Sin embargo, Rodríguez y Bueno (2006), Liberato et al. (2014) y Sánchez (2014), reportaron ecotipos colombianos de P. peruviana con 2n = 24 y 2n = 32; Menzel (1951) realizó una revisión en base a 25 especies del género Physalis, reportando que la mayoría de ellas presenta 2n = 24 cromosomas y sólo P. angulata, P. minima y P. peruviana presentan 2n = 48 cromosomas.
Estas variaciones numéricas se atribuyen a rearreglos cromosómicos como aneuploidías e inversiones, propios de cada población (Rodríguez & Bueno 2006); o también a eventos de autopoliploidía o anfiploidía (Menzel 1951). Al respecto, Badr et al. (1997) estudiando varios géneros de la familia Solanaceae encontró que la mayor parte de los géneros descritos, entre ellos el género Physalis, presentaba x = 12 como número básico de cromosomas. Otros géneros presentaron números básicos menores como Petunia x =7 y Nicotiana x = 9 a 11. Por tanto, el autor sostiene que la evolución cromosómica de las angiospermas, en general, fue dirigida por ciclos de aneuploidías y poliploidización. Así mismo, Stebbins (1971) propuso un sistema similar de evolución del número básico, considerando x =12 como el número básico con mayor frecuencia entre las plantas superiores, el cual podría haberse originado por eventos de poliploidía y aneuploidía a partir de números básicos menores como 7 u 8. Por otro lado, herramientas modernas como bioinformática corroboraron que el género Physalis pertenece a un clado monofilético, con número básico x=12, conformado también por la tribu Anthocercidae y los géneros Nicotiana y Solanum (Ferreira de Melo 2009).
Considerando entonces x =12 como el número básico del género Physalis, en este trabajo se asume que el número cromosómico 2n = 48 observado en las tres poblaciones de P. peruviana, sería el resultado de un proceso de poliploidización que alcanzó el nivel de tetraploidía 2n = 4x = 48.
Además, en el presente trabajo fueron reportados números cromosómicos diferentes de 2n = 48 con frecuencias menores al 30%. La mayor frecuencia de variaciones numéricas fue observada en Cajabamba, seguido por Celendín y San Pablo. Si bien estas variaciones no son múltiplos del número base x = 12, algunos casos han sido reportados en trabajos anteriores. Por ejemplo, Lagos (2006) caracterizó células de meristemo radicular de P. peruviana con 24, 32, 36, 48, 52 y 54 cromosomas; sin reporte de frecuencias. Una de las principales causas de variaciones numéricas en células somáticas es la aneuploidía, que se refiere a la ganancia o pérdida de uno o más cromosomas, siendo más frecuente en plantas poliploides cultivadas y en tejidos no diferenciados (De Storme & Mason 2014). Otro factor que puede conducir a la variación de números cromosómicos es la aneusomatía -aunque poco común en angiospermasque se refiere al aumento de cromosomas (supernumerarios) que aparean con el completo A y no con el complemento B, causado por una no disyunción de los cromosomas durante la mitosis (Greilhuber & Weber 1975).
Morfología cromosómica.La construcción de un cariotipo tetraploide se basa en el ordenamiento de grupos de homólogos conformados por cuatro cromosomas con similar morfología, tamaño y estructura. En el presente trabajo, a pesar de que las tres poblaciones analizadas fueron descritas numéricamente como tetraploides 2n = 4x = 48 cromosomas, en ninguno de los casos fue posible elaborar cariotipos tetraploides. Eso debido a que los resultados de morfología y tamaño de los cromosomas obtenidos por tinción convencionalevidencian que no es posible la formación de cuartetos cromosómicos similares, principalmente en San Pablo y Cajabamba porque el número y tamaño de cromosomas telocéntricos dificultó su agrupamiento. De la misma forma Rodríguez y Bueno (2006) y Liberato et al. (2014), elaboraron cariotipos para los ecotipos colombianos de P. peruviana basados en pares de homólogos, ellos señalan que para un agrupamiento de homólogos más detallado es preciso ampliar la descripción cromosómica a nivel estructural empleando técnicas de bandeo cromosómico (como bandas C) o por marcación con fluorocromos como (DAPI o CMA ).
La descripción morfológica de los cromosomas de Physalis peruviana es escasa. Rodríguez y Bueno (2006), describieron cromosomas acrocéntricos en ecotipos colombianos silvestres (4m+6sm+2acr), y cultivados (Colombia 5m+8sm+3acr y Kenia 12m+9sm+3acr). Estos resultados concuerdan con los nuestros en la presencia de cromosomas bibraquiales (cromosomas con brazo corto (c) y brazo largo (l)) principalmente los metacéntricos y submetacéntricos; mientras que la diferencia más notoria es la ausencia de cromosomas acrocéntricos en las fórmulas cariotípicas de las tres poblaciones estudiadas. En su lugar, fueron reportados cromosomas telocéntricos en las poblaciones de San Pablo y Cajabamba.
Por otro lado, Liberato et al. (2014) a partir de siete genotipos colombianos de P. peruviana, con respuesta diferencial a Fusarium oxysporum, describe la predominancia de cromosomas metacéntricos, submetacéntricos, subtelocéntricos y telocéntricos (en menor número). Estos resultados revelaron cariotipos con alto grado de asimetría intercromosómica, lo cual se asemeja a lo obtenido en las poblaciones de San Pablo y Cajambamba en el presente trabajo; sin embargo, una vez más la presencia cromosomas subtelocéntricos (también llamados acrocéntricos según Levan et al. 1964) marca la diferencia con nuestros resultados.
La diversificación de cariotipos puede ser considerada si se observan variaciones con relación a (1) número básico de cromosomas, (2) forma y tamaño relativo de los cromosomas, (3) número y tamaño de constricción secundaria y región satélite, (4) tamaño absoluto de los cromosomas y (5) localización de regiones eucromáticas y heterocromáticas (Cheema & Pant 2013 y Furtado Nani et al. 2015). Siendo así, los resultados obtenidos en las Tablas 6, 7,8 y 9 evidenciaron que las diferencias entre los cariotipos de San Pablo, Celendín y Cajabamba se basan en la forma y el tamaño relativo de los cromosomas de cada población en concordancia con el punto número dos señalado por Cheema y Pant (2013) y Furtado Nani et al. (2015).
Tabla 6 Variables utilizadas para la elaboración del cariotipo de Physalis peruviana de la población San Pablo, obtenidos a partir del software Ideokar l: long. brazo largo, s: long. brazo corto, c: Long total del cromosoma, PC: par cromosómico, L (MH): promedio de la long. brazo largo del par homólogo, S (MH): promedio de la long. brazo largo del par homólogo, r: índice braquial,i: índice centromérico, DE: desvío estándar.
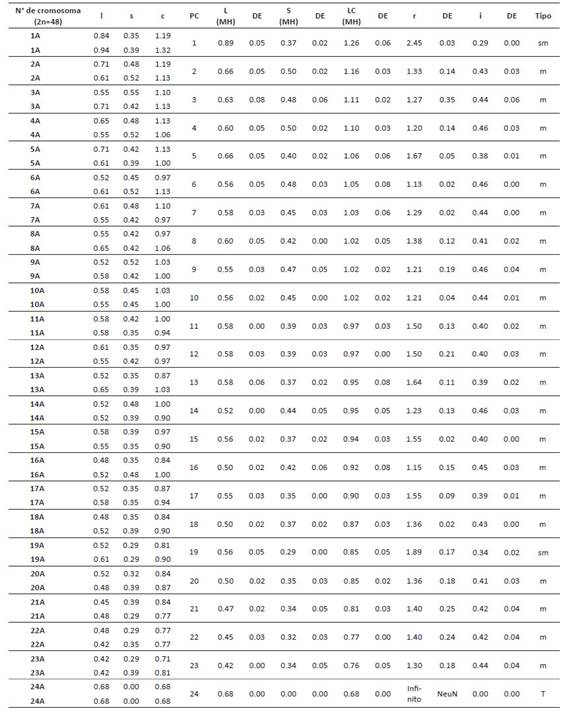
Tabla 7 Variables utilizadas para la elaboración del cariotipo de Physalis peruviana de la población Celendín, obtenidos a partir del software Ideokar. l: long. brazo largo, s: long. brazo corto, c: Long total del cromosoma, PC: par cromosómico, L (MH): promedio de la long. brazo largo del par homólogo, S (MH): promedio de la long. brazo largo del par homólogo, r: índice braquial, i: índice centromérico, DE: desvío estándar.
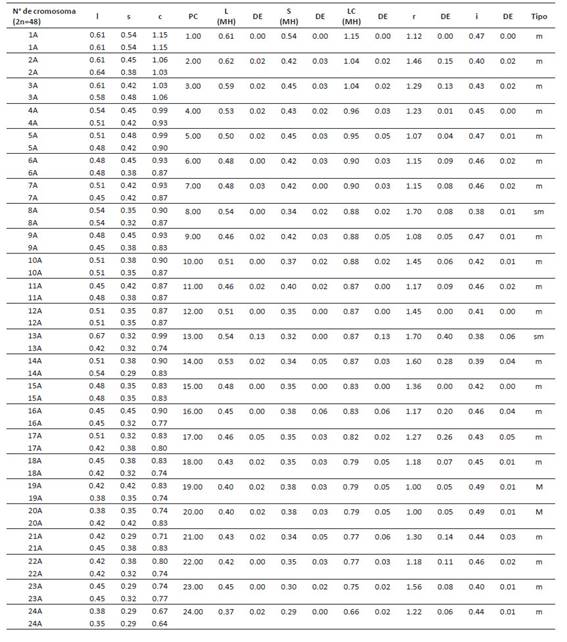
Tabla 8 Variables utilizadas para la elaboración del cariotipo de Physalis peruviana de la población Cajabamba, obtenidos a partir del software Ideokar. l: long. brazo largo, s: long. brazo corto, c: Long total del cromosoma, PC: par cromosómico, L (MH): promedio de la long. brazo largo del par homólogo, S (MH): promedio de la long. brazo largo del par homólogo, r: índice braquial, i: índice centromérico, DE: desvío estándar.
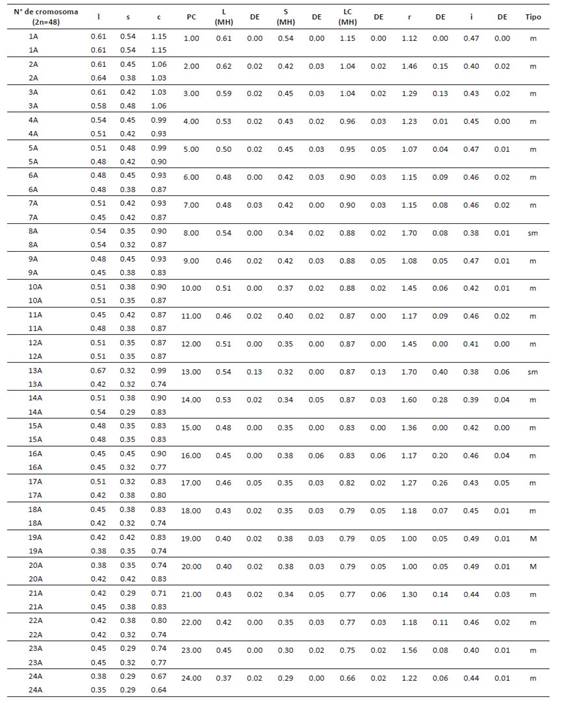
Tabla 9 Parámetros evaluados en el cariotipo de cada población de Physalis peruviana. HCL: complemento haploide , S%: simetría, A: Asimetría (Paszko, 2006), A1 y A2: asimetría intra e intercromosómica (Romero-Zarco, 1986).
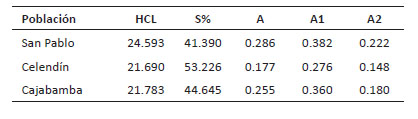
La diferencia cariotípica que observamos, distingue al cariotipo de Celendín como el más simétrico, mientras que los cariotipos de San Pablo y Celendín fueron descritos como asimétricos a nivel intra e intercromosómico. No se encontraron trabajos que describan el comportamiento de estas variables en P. peruviana, pero en su lugar se tienen reportes que las describen a partir de cariotipos de otras especies de la familia Solanaceae. Chiarini et al. (2011) sostienen que la familia Solanaceae presenta mayoritariamente cromosomas metacéntricos (m) o submetacéntricos (sm), con valores de índice braquial de 1.17 hasta 2.78 µm lo cual coincide con nuestras observaciones (1.23 hasta 1.78 µm). Por otro lado, cromosomas telocéntricos han sido confirmados en pocas especies de la familia Solanaceae, por ejemplo, en Solanum muricatum y S. basendopogon, (Bernardello & Anderson 1990, Nair & Ravindran 1994) y Nicotiana plumbaginifolia (Villa 1984, Nair & Ravindran 1994).
Otra variable analizada fue la longitud total del complemento haploide, reportándose un rango de variación de 3 µm aproximadamente entre los cariotipos de San Pablo, Celendín y Cajabamba. Teodoro-Pardo et al. (2007) describen un mayor rango de variación de HCL evaluando tres muestras de Capsicum annuum provenientes de distintas provincias de México. La comparación de ambos estudios explica que la variación de HCL se relaciona con el estado de condensación de los cromosomas analizados, pudiendo ser desde prometafase hasta metafase; sin embargo, Teodoro Pardo et. al. (2007) señalan que la diferencia de compactación de la cromatina no implica directamente variaciones en el tamaño del genoma.
Por otro lado, cariotipos simétricos fueron reportados en la familia Solanaceae como Capsicum annuum (Moscone et al. 2007; Teodoro-Pardo et. al. 2007) y la subfamilia Solanoideae (Chiarini et al. 2011). En la misma familia, un ejemplo de cariotipo asimétrico fue dado por Gómez Pulgarín et al. (2012) estudiando Solanum phureja, pariente silvestre diploide de la papa cultivada. En P. peruviana esas variables no fueron descritas anteriormente. Sin embargo, Liberato et al. (2014) y Rodríguez & Bueno (2006) revelaron fórmulas cariotípicas que incluyen cromosomas acrocéntricos y telocéntricos respectivamente; por lo cual es posible inferir cierto grado de asimetría en los cariotipos de ambos estudios. Stebbins (1971) plantea la hipótesis que, durante la evolución de las angiospermas, los cariotipos primitivos fueron inicialmente simétricos y con el paso del tiempo las nuevas especies fueron descritas por cariotipos asimétricos, como en las gimnospermas. Considerando esta premisa, suponemos que el grado de simetría observado en el cariotipo de Celendín (S% = 53.226, A = 0.177), podría mantener aún características de su antecesor silvestre considerando el reciente proceso de domesticación que tuvo el aguaymanto en Perú. Mientras que, la asimetría cariotípica observada en San Pablo podría ser justificada por el proceso de mejoramiento mediante selección masal de los cultivos. Sin embargo, se hace necesario profundizar con estudios de citogenética molecular el trasfondo evolutivo de los cariotipos.












 uBio
uBio