Introducción
El Perú es uno de los cinco países a nivel mundial con mayor diversidad de mamíferos, estimándose alrededor de 573 especies distribuidas entre las 11 ecorregiones naturales del territorio peruano (Pacheco et al. 2009, Pacheco et al. 2018, Pacheco et al. 2020a, Ruelas et al. 2021, Ruelas & Pacheco 2021, Pacheco et al. (2021). En particular, destaca la cuenca amazónica que ocupa el 60.9% de todo el territorio peruano y alberga las dos ecorregiones con mayor biodiversidad: la selva baja tropical con 320 especies y las Yungas orientales con 256 aproximadamente (Pacheco et al. 2021). En el Perú, políticamente, los bosques amazónicos se ubican en los departamentos de Loreto, Ucayali y Madre de Dios, y en parte en los departamentos de Amazonas, San Martín, Huánuco, Pasco, Junín, Cusco y Puno. En todos ellos se han realizado importantes inventarios sobre la diversidad de mamíferos (Thomas 1926; Thomas 1927a; Thomas 1927b; Thomas 1928a; Thomas 1928b; Woodman et al. 1991; Pacheco et al. 1992; Hutterer et al. 1995; Soini et al. 1996; Pacheco & Arias 2001; Figueroa 2004, Solari et al. 2006; Jorge & Velazco 2006; Pacheco et al. 2011; Aquino et al. 2012a; Castro 2012; Arias et al. 2016; Mena & Germana 2016; Ruelas et al. 2018; Velazco & Patterson 2019, Díaz 2020, Velazco et al. 2021). Además, se han elaborado listas de todos los mamíferos para los departamentos de Loreto y Ucayali, en los que se indica la ocurrencia de 191 y 267 especies, respectivamente (Quintana et al. 2009; Pitman et al. 2013). El listado de especies de mamíferos de Loreto presentado por Pitman et al. (2013) se basó principalmente en mapas elaborados por IUCN y la lista de Pacheco et al. (2009); sin embargo, los recientes cambios taxonómicos, como descripciones de nuevas especies, y un importante incremento de información sobre la diversidad de especies de mamíferos, como registros nuevos de especies, hacen necesaria la presentación de una lista actualizada que ayude a entidades asociadas a la toma de decisiones en cuanto a las prioridades de conservación y en la lucha contra el tráfico ilegal de fauna silvestre. Los incrementos de información incluyen por lo menos 22 inventarios sobre la diversidad de mamíferos de Loreto que registran entre 35 y 103 especies de mamíferos según el área de estudio (Soini et al. 1996, Pacheco & Arias 2001, Valqui 2001, Salovaara et al. 2003, Hice 2003, Hice et al. 2004, Montenegro & Escobedo 2004, Amanzo 2006, Jorge & Velazco 2006, Bravo & Ríos 2007, Bravo & Borman 2008, Montenegro & Moya 2011, Bravo 2010, Voss & Fleck 2011, Castro 2012, Hice & Velazco 2012, López 2013, Patterson & López 2014, Escobedo 2015, Medina et al. 2015, Bravo et al. 2016, Voss & Fleck 2017, Pérez-Peña et al. 2019, Voss et al. 2019, Díaz 2020). No obstante, la mayoría de los inventarios se han enfocado en mamíferos mayores y murciélagos, mientras que sólo cinco estudios han abarcado la diversidad de pequeños mamíferos no voladores de forma más detallada estimando la ocurrencia de 19 a 37 de estas especies en Loreto (Valqui 2001, Hice & Velazco 2012, Medina et al. 2015, Voss et al. 2019, Díaz 2020). Por ello, en este trabajo nos enfocamos en la compilación de información sobre la diversidad de pequeños mamíferos no voladores para la región de Loreto, incluyendo la revisión de bases de datos de museos nacionales e internacionales y literatura especializada, para generar una lista actualizada de este grupo de mamíferos, indicando las especies endémicas a nivel regional y nacional, especies raras y comunes, categoría de amenaza, mapas de distribución, y presentamos un mapa de las localidades contabilizadas indicando las áreas del departamento con cinco vacíos de información.
Material y métodos
Área de estudio. - El departamento de Loreto se localiza al extremo nororiental del Perú, aproximadamente entre los paralelos 0°2’5”- 8°42’6”S y 77°47’14”-69°56’41”W. Cuenta con una extensión territorial de 368 851.95 Km2 equivalente al 28.7% del territorio nacional, donde predominan la ecorregión de Selva Baja o Llanura amazónica occidental (49.9% de la Amazonia peruana y 4% de la Amazonia continental) (Odicio 1992). Su superficie es bastante plana, con elevaciones entre 70 y 220 m de altitud, excepto en el límite con los departamentos de Amazonas y San Martín donde la presencia de las Cordilleras Kampankis y Escalera pueden alcanzar altitudes de 1400 y 2000 m, respectivamente (Pitman et al. 2012; Pitman et al. 2014). La región de Loreto presenta un clima cálido (27 °C en promedio) con abundantes precipitaciones y humedad (>2000 mm, >85%, respectivamente) durante todas las estaciones del año (Odicio 1992). Loreto está conformado por 3 grandes cuencas (Marañón, Amazonas y Ucayali) que albergan por lo menos 15 ríos principales, de los cuales el río Ucayali (1771 km) y el Marañón (1414 km) son los de mayor extensión y confluyen para dar origen al gran río Amazonas, cuya extensión alcanza los 713 km en el Perú (INEI 2017). Loreto alberga tres ecorregiones naturales: el Bosque Húmedo Amazónico (BHA) de mayor extensión, mientras que el Bosque muy húmedo Pre-montano (BMHP) y el Bosque Muy Húmedo Montano (BMHM) ambos restrictos al límite con los departamentos de Amazonas, San Martín y Ucayali (Britto 2017). En el área de estudio también se han establecido 11 Áreas Naturales Protegidas (ANP) con administración nacional definitiva o transitoria: Los parques nacionales Cordillera Azul, Güeppí-Sekime, Sierra del Divisor y Yaguas; las Reservas Nacionales Allpahuayo Mishana, Pacaya-Samiria Pucacuro y Matsés; y las Reservas Comunales Airo Pai y Huimeki, y la Zona Reservada Santiago-Comaina. Además de ello, Loreto cuenta con cuatro áreas de conservación regional y 30 áreas de conservación privadas (SINANPE, https://www.sernanp.gob.pe/el-sinanpe).
Datos y análisis. - El grupo de pequeños mamíferos no voladores (<1000 g aprox.) incluye los órdenes Rodentia (con excepción de las familias Erethizontidae, Dinomyidae, Dasyproctidae, Cuniculidae y, dentro de Caviidae, el género Hydrochoerus), Didelphimorphia, Lagomorpha y el género Neogale del orden Carnívora. La taxonomía y elaboración de una lista preliminar se basaron en los trabajos de Pacheco et al. (2021), Gardner (2008) y Patton et al. (2015a). La lista se actualizó con las nuevas fuentes de información encontradas en artículos científicos, libros, informes técnicos y bases de datos disponibles en portales especializados (GBIF, www.gbif.org; VERNET, http://vertnet.org/), los que incluyen información de los repositorios más importantes de colecciones científicas norteamericanas como del American Museum of Natural History, New York (AMNH); Field Museum of Natural History, Chicago (FMNH); Museum of Vertebrate Zoology, University of California, Berkeley (MVZ); Louisiana State University, Museum of Zoology (LSUMZ); Florida Museum of Natural History, University of Florida, Gainesville (FLMNH); University of Kansas Biodiversity Institute, Kansas (KU); Natural History Museum of Los Angeles County (LACM); Museum of Comparative Zoology, Cambridge (MCZ); Museum of Texas Tech University, Lubbock (TTU). A nivel nacional, se incluyó la base de datos de la colección del Museo de Historia Natural, Universidad Nacional Mayor de San Marcos (MUSM). Para actualizar las informaciones taxonómicas, se verificó que los váuchers (espécimen preservado en una colección científica) listados en las bases de datos científicas disponibles hayan sido mencionadas en alguna publicación científica.
Se elaboró una base de datos que incluyó referencia bibliográfica, nombre científico, nombre común, número de individuos colectados, tipo de registro (espécimen en museo, avistamientos, fotografía, video, restos, etc.), nombre y acrónimo de la colección científica donde está preservado el espécimen, número de catálogo, provincia, distrito y nombre de la localidad de colecta, fecha de colecta, coordenadas geográficas, categoría de amenaza según la lista roja de la IUCN y la legislación peruana Decreto Supremo N°004-2014-MINAGRI (MINAGRI 2014), estado de endemismo: con distribución restringida a nivel nacional (N, especie cuyo rango de distribución ha sido reportado solo en el Perú) o departamental (R, especie con registros solo en el departamento de Loreto), presencia en Área Natural Protegida, presencia en tipo de ecorregión y otros comentarios.
Se contabilizó el número de localidades únicas, definiéndose como una localidad única a cada coordenada diferente. Según ello, se clasificó las especies como raras si ocurren en menos del 1% o comunes si están presentes en más del 10% de las localidades únicas. Además, según la fecha de las evaluaciones se consideraron como datos históricos aquellas registradas antes del año 2001 y como actuales a los registros posteriores.
Teniendo estos datos se elaboraron diferentes mapas con el programa ArcMap v.10.3. Elaboramos un primer mapa que muestra las tres ecorregiones descritas para Loreto por Britto (2017): Bosque Húmedo Amazónico (BHA), Bosque muy húmedo Pre-montano (BMHP) y Bosque Muy Húmedo Montano (BMHM) y en ella la distribución de las localidades únicas clasificadas como datos históricos o recientes. En un segundo mapa se muestran la densidad de localidades evaluadas en cuadrículas de 50km para una mejor visualización de los vacíos de información. Los vacíos de información corresponden a áreas con ninguna o menos del 1% de las localidades encontradas. Finalmente, elaboramos mapas de distribución para cada una de las especies de pequeños mamíferos no voladores.
Resultados
Localidades y vacíos de información. - Se encontraron 536 localidades únicas, 417 de ellas son registros actuales y 115 registros históricos; solo cuatro localidades fueron visitadas antes y después del 2001 (Anexo 1, Tabla 1). Las provincias de Maynas (n=330 ~ 61.7% de localidades) y Loreto (n=69, 12.9% de localidades) presentan la mayor cantidad de localidades evaluadas; mientras que, las provincias de Alto Amazonas, Mariscal Ramón Castilla, Putumayo y Ucayali tienen menos de 20 localidades evaluadas (Tabla 1, Figs. 1 y 2). La ecorregión BHA (sensu Brito 2017) por su gran extensión fue las más exploradas con 530 localidades; mientras que, dentro del BMHP solo cinco localidades (localidad 487, 493, 514, 525 y 535; ver Anexo 1) fueron evaluadas (Fig. 1).
Tabla 1 Se resume el número de tipos de registros, localidades y especies de mamíferos pequeños no voladores encontradas en cada provincia del departamento de Loreto. El número entre paréntesis indica el total de registros.
| Provincia | Avistamientos y entrevista | Huella | Colectado y liberado | Media (foto, video, o cámara trampa) | Espécimen de museo | N° localidades | N° especies |
|---|---|---|---|---|---|---|---|
| Alto Amazonas | 2 | 142 | 13 | 29 | |||
| Datem del Marañón | 17 | 177 | 42 | 26 | |||
| Loreto | 6 | 520 | 69 | 41 | |||
| Mariscal Ramón Castilla | 8 | 87 | 10 | 28 | |||
| Maynas | 37 | 2 | 4527 | 330 | 65 | ||
| Putumayo | 26 | 2 | 8 | 14 | 10 | ||
| Requena | 36 | 1 | 4 | 1 | 545 | 38 | 54 |
| Ucayali | 3 | 300 | 20 | 40 | |||
| Total (6451) | 135 | 1 | 4 | 5 | 6306 | 536 | 75 |
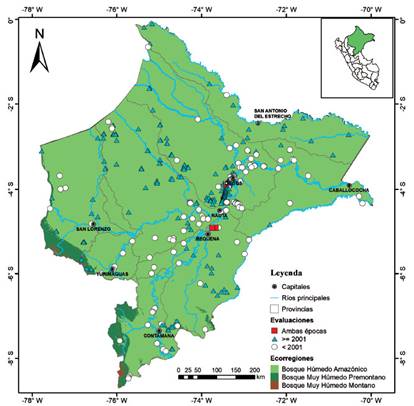
Figura 1 Mapa de distribución de las localidades analizadas de los registros de mamíferos pequeños no voladores mostrando las ecorregiones según Britto (2017) para la región de Loreto.
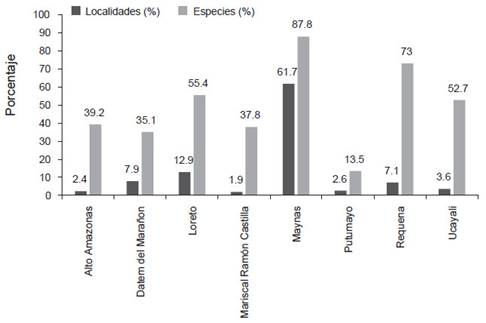
Figura 2 Número de localidades y riqueza de especies registradas en cada provincia del departamento de Loreto (expresado en porcentaje). La lista detalla de las especies presentes en cada provincia se encuentra en la Tabla 1 y las de las localidades en el Anexo 1.
La mayoría de las localidades están distribuidas alrededor de las principales capitales del departamento (Iquitos y Nauta) o en cercanías a los ríos Amazonas, Marañón, Tigre y Ucayali; por lo que, en la Figura 3 se evidencian como zonas con mayor intensidad de naranja dejando ver que grandes áreas del departamento han sido poco exploradas (sin localidades registradas), señaladas con elipses rojas que representan cinco áreas con vacíos de información:
Zona 1: Al noreste de la provincia de Maynas y a lo largo de toda la provincia de Putumayo en la que solo 15 localidades han sido evaluadas y 10 especies reportadas (Tabla 1).
Zona 2: Sur del río Amazonas en la provincia de Mariscal Ramón Castilla y Requena, donde apenas cuatro localidades han sido evaluadas reportando pequeños mamíferos.
Zona 3: Norte y centro de la provincia del Datem del Marañón, donde la mayoría de las localidades (n=14) se concentran a lo largo del río Pastaza y dentro o en la zona de amortiguamiento (n=3) de la Zona Reservada Santiago Comaina.
Zona 4: al suroccidente de la provincia Datem del Marañón.
Zona 5: Sur y occidente de la provincia de Ucayali, aunque parte de esta área conforma el P.N. Cordillera Azul solo cinco localidades y cuatro especies han sido reportadas es urgente una mayor evaluación.
Riqueza de especies. - Durante nuestra revisión encontramos un total de 6451 registros de mamíferos menores no voladores en el departamento de Loreto (Tabla 1), los cuales están representados por especímenes de museo (n=6306), avistamientos y entrevistas (n=135), especímenes colectados, marcados y liberados (n=4), huellas (n=1) y fotos, videos o registros por cámaras trampa (n=5). En base a ello, contabilizamos un total de 75 especies de pequeños mamíferos no voladores presentes en el departamento de Loreto, distribuidas en cuatro órdenes (Carnívora, Didelphimorphia, Lagomorpha y Rodentia), seis familias y 38 géneros (Tabla 2). Siendo los roedores el grupo más diverso con 46 especies, seguidos de los marsupiales con 27 especies, mientras que los carnívoros y lagomorfos están representadas por solo una especie cada uno. A nivel provincial (Fig. 2, Tabla 1), la mayor cantidad de especies ha sido reportada en Maynas (n= 65), seguido de Requena (n=54) y Loreto (n=41); mientras que, Putumayo muestra la menor cantidad de especies (10), la mayoría reportadas por avistamientos y solo dos especies (Holochilus nanus Thomas, 1897 y Proechimys quadruplicatus) cuentan con especímenes en colecciones científicas (Anexo 2).
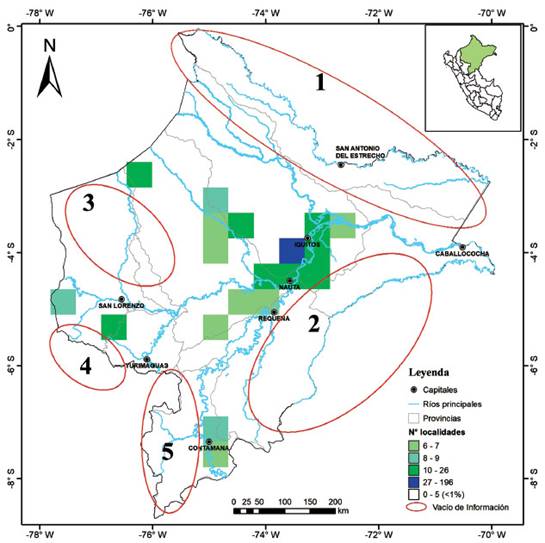
Figura 3 Mapa de densidad de localidades encontradas dentro de cuadrículas de 50 km indicando los Vacío de Información.
Por otro lado, 12 especies (cuatro marsupiales y ocho roedores) han sido registradas en una gran cantidad de localidades (> 53) y tienen un número considerable de registros basados en especímenes de museo y avistamientos (> 100); por lo que, son consideradas como especies comunes (Tabla 2). Mientras que, 24 especies son consideradas raras porque cuentan con registros en menos del 1% de localidades contabilizadas (≤ 5 localidades), estas incluyen un carnívoro, nueve marsupiales y 14 roedores (Tabla 2). Algunas de estas especies raras corresponden a especies recientemente descritas como Marmosops (Marmosops) soinii, Monodelphis (Mygalodelphys) handleyi y Neusticomys peruviensis musseri (Solari 2007, Voss et al. 2019, Pacheco et al. 2020b), o recientemente elevadas a especie como Holochilus nanus, Neacomys carceleni y Philander canus (Voss et al. 2018, Brito et al. 2021, Prado et al. 2021). Otras especies raras cuentan solo con registros históricos; por ejemplo, el carnívoro Neogale africana con solo dos registros basados en especímenes de museos, los cuales fueron colectados en 1880 y 1929 en las provincias de Alto Amazonas y Datem de Marañón, respectivamente; además de un registro basado en entrevista en Requena entre 1995-1999 (Taczanowski 1881, Ramírez-Chavez et al. 2017, Voss & Fleck 2017). Otros ejemplos corresponden a los roedores Melanomys robustulus con registros basados en muestras colectadas en 1925 (Pacheco et al. 2009, Weksler & Lóss 2015), Leuiromys occasius con un solo registro y un espécimen en museo colectado en 1925 por los Olalla e hijos (Emmons & Fabre 2018) y Echimys saturnus colectado en 1929 por Schunke (Juárez-Pérez et al. 2021). Otra especie rara es Akodon orophilus, la cual cuenta con un solo registro en el Loreto en los bosques montanos de la provincia de Alto Amazonas (Patterson & López 2014). Ver Anexo 2 para más información sobre los registros y referencias bibliográficas.
Especies endémicas. - Un total de 87 especies endémicas habitan en el Perú, 66 corresponden a mamíferos menores no voladores (56 roedores y 10 marsupiales). De las cuales cinco están presentes en Loreto: dos especies con registros en Loreto y otros departamentos del Perú: Akodon orophilus y Neusticomys peruviensis musseri; y tres con registros solo en el departamento de Loreto: los marsupiales Marmosops (Marmosops) soinii y Monodelphis (Mygalodelphys) handleyi, y la ardilla Hadrosciurus "species 3". Estas cinco especies además de ser endémicas son también consideradas como raras en este trabajo porque han sido registradas en menos del 1% de localidades (Tabla 2, Anexo 2). Aunque ninguna de las especies endémicas en Loreto ha sido reportada dentro de un ANP, estas ocurren cerca o dentro de las zonas de amortiguamiento, o en alguna área de conservación regional.
Distribución. - Los registros de las 75 especies reportadas en Loreto están graficadas en el Anexo 4. Diez de estas especies, cuya distribución se extiende también a otros países, en el Perú solo han sido registradas en el departamento de Loreto: el carnívoro Neogale africana; los marsupiales Marmosa (Micoureus) germana, Monodelphis (Mygalodelphys) adusta; y los roedores Amphinectomys savamis, Melanomys robustulus, Neacomys aletheia, Oecomys paricola, Proechimys kulinae, Scolomys melanops y Sciurillus pusillus.
Para algunas especies el departamento de Loreto representa un hito importante en la distribución geográfica de la especie. Así: 1) para Akodon orophilus representa la localidad más oriental de su distribución; 2) para Amphinectomys savamis, Marmosa (Micoureus) germana y Melanomys robustulus representa la más al austral y uno de los más sureños para Hadrosciurus igniventris; 3) para Caluromysiops irrupta; Hadrosciurus ignitus, Hadrosciurus “species 3”, Oecomys phaeotis, Neacomys aletheia, Neacomys musseri, Rhipidomys gardneri, Neusticomys peruviensis musseri, Proechimys kulinae y Toromys rhipidurus la localidad más septentrional; 4) para Oecomys paricola, Gracilinanus emiliae, Neogale africana y Sciurillus pusillus la más occidental; y 5) para Nectomys rattus y Oligoryzomys microtis la más noroccidental.
Conservación. - En Loreto, considerando las once áreas naturales protegidas a nivel nacional, solo el 20% (~71,988.12 km2) del territorio se encuentra protegido por el estado peruano de forma definitiva o en estatus transitorio. En este 20%, a penas 77 localidades han sido evaluadas siendo la Reserva Nacional Pacaya Samiria (24 localidades), Reserva Nacional Allpahuayo Mishana (18) y el Parque Nacional Sierra del Divisor (17) las ANP con mayor número de localidades evaluadas; mientras que, el resto de ANP cuentan con cuatro o menos localidades evaluadas (Tabla 3, Fig. 4).
En cuanto a la diversidad de especies, 53 han sido registradas dentro de alguna ANP (Anexo 3), donde el Parque Nacional Pacaya Samiria (32 especies), el Parque Nacional Sierra del Divisor (28), la Reserva Nacional Pucacuro (25) y la Reserva Nacional Allpahuayo-Mishana (21) cuentan con el mayor número de especies registradas, las cuales a su vez y con excepción de la Reserva Nacional Pucacuro cuentan también con la mayor cantidad de localidades registradas (Tabla 2 y 3, Fig. 3, Anexo 3). El resto de ANP registran menos de 9 especies. Además, 22 especies registradas solo en localidades fuera de ANP incluyen las cinco especies endémicas, cuatro de ellas se encuentran cerca o en la zona de amortiguamiento de alguna ANP (Marmosops (Marmosops) soinii se encuentra en la zona de amortiguamiento de la R. N. Matsés, Neusticomys perviensis musseri en la zona de amortiguamiento de la R. N. Allpahuayo Mishana, Monodelphis (Mygalodelphys) handleyi en la zona de amortiguamiento del P. N. Pacaya Samiria, Hadrosciurus “species 3” se encuentra cercano a la zona de amortiguamiento del P. N. Cordillera azul, y Akodon orophilus se encuentra dentro del áreas de conservación regional Cordillera Escalera.
Por otro lado, 58 especies están dentro de alguna categoría de amenaza (Tabla 2). En su mayoría (48 spp.) están categorizadas como Preocupación menor (LC), 10 dentro de la categoría de datos insuficientes (DD) y una especie (el conejo o liebre amazónica, Sylvilagus brasiliensis) como En Peligro (EN). En el caso de Sylvilagus brasiliensis, Ruedas y Smith (2019) aclaran que esta categorización se basó considerando solo la población de la Mata Atlántica brasileña; por ende, la categoría de amenaza de las poblaciones peruanas de S. brasiliensis no ha sido debidamente evaluada. Por su parte, en base a la legislación peruana Decreto Supremo 004-2014, cinco especies están consideradas dentro de alguna categoría de amenaza Vulnerable (VU) y las tres restantes como DD (Tabla 3).
Tabla 2 Lista de especies de mamíferos menores no voladores registrados para Loreto con datos de distribución por provincias, endemismo y estado de amenaza. Las abreviaturas empleadas son para Provincias: AAm, Alto Amazonas; DdM, Datem del Marañón; Lor, Loreto; MRC, Mariscal Ramón Castilla; May, Maynas; Put, Putumayo; Req, Requena; Uca, Ucayali; BHA, Bosque Húmedo Amazónico; BMHP, Bosque Muy Húmedo Premontano; END, Endemismo: N, Nacional; R, Regional; CR, En Peligro Crítico; EN, En Peligro; VU, Vulnerable; NT, Casi Amenazado; LC, Preocupación Menor; DD, Datos insuficientes. Los números en paréntesis indican el número total de especies por categoría taxonómica y los números negrita y cursiva indican el número total de especies por categoría taxonómica en cada provincia. Se incluye las localidades de ocurrencia por cada especie, agrupadas entre corchetes por provincia. Los detalles de cada localidad se encuentra en el Anexo 1 y las referencias que sustentan cada localidad en el Anexo 2. Los asteriscos (*) indican que son especies raras y el doble asterisco (**) que son comunes para el departamento de Loreto. ¹ Categorización de la IUCN realizada solo en base a la población sensu stricto. ² Especies con registro solo fuera de ANP (ver Anexo 3).
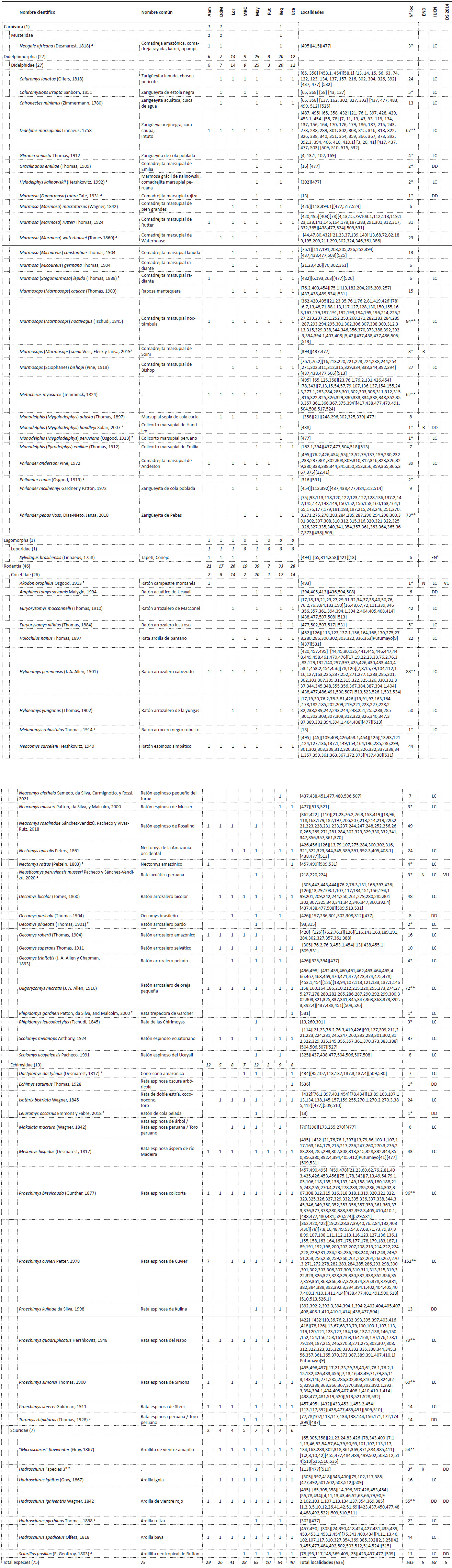
Tabla 3 Cantidad de registros, localidades y especies de mamíferos pequeños no voladores encontradas en las Áreas Naturales Protegidas del Departamento de Loreto. El número entre paréntesis indica el total de registros.
| Área Natural Protegida | Avistamientos y Entrevista | Huella | Espécimen de museo | N° localidades evaluadas | N° especies |
|---|---|---|---|---|---|
| P. N. Cordillera Azul | 5 | 4 | 4 | ||
| P. N. Güeppí-Sekime | 3 | 1 | 3 | ||
| P. N. Sierra del Divisor | 15 | 1 | 102 | 17 | 28 |
| P. N. Yaguas | 2 | 2 | 1 | ||
| R. C. Airo Pai | 4 | 16 | 2 | 6 | |
| R. C. Huimeki | 2 | 1 | 2 | ||
| R. N. Allpahuayo Mishana | 96 | 18 | 21 | ||
| R. N. Matsés | 7 | 2 | 5 | ||
| R. N. Pacaya Samiria | 4 | 202 | 24 | 32 | |
| R. N. Pucacuro | 145 | 3 | 25 | ||
| Z. R. Santiago Comaina | 17 | 2 | 3 | 9 | |
| Total (623) | 54 | 1 | 568 | 77 | 53 |
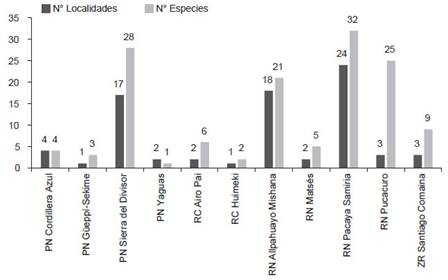
Figura 4 Número de localidades y especies registradas en las Áreas Naturales Protegidas (ANP) del departamento de Loreto. La lista detalla de las especies presentes en cada ANP se encuentra en el Anexo 3 y Tabla 2.
Discusión
El presente trabajo está basado en diversas fuentes de información y revela la ocurrencia de 75 especies de mamíferos menores no voladores en el departamento de Loreto, que considerando las 573 especies de mamíferos listados por Pacheco et al. (2021) representa el 13% del total de mamíferos registrados para Perú. Además, constituye el 30% de la diversidad total de mamíferos de Loreto (259 spp.) y el 25% de toda la mastofauna reportada para la llanura Amazónica (210 especies, Pacheco et al. 2009). Por su parte, Pitman et al. (2013) basándose en mapas de distribución de la IUCN y la lista de Pacheco et al. (2009) estimaron 267 especies para este departamento, de las cuales 64 correspondían a mamíferos pequeños no voladores. Estas diferencias en el número de especies totales y para el grupo evaluado en relación con nuestro trabajo se deben principalmente a cambios taxonómicos realizados en las diversas especies (sobre todo dentro de los marsupiales), la descripción de nuevas especies y los nuevos reportes para el departamento.
A diferencia de Pitman et al. (2013) no consideramos la presencia de Akodon aerosus en Loreto, que probablemente se trate de A. orophilus reportado por Patterson y López (2014). Por otro lado, tampoco consideramos en nuestra lista a las especies Didelphis pernigra, Microryzomys minutus, Nephelomys albigularis, Oligoryzomys destructor y Rhipidomys modicus cuyos reportes, hasta la fecha, corresponden solo a bosques pre- y montanos de los departamentos como Amazonas, Huánuco y San Martín (Lemos & Cerqueira 2002, Brown 2004, Cerqueira & Tribe 2008, Pacheco et al. 2009, Carleton 2015, Percequillo 2015a, Tribe 2015, Weksler & Bonvicino 2015ª, Hurtado & D’Elía 2019, Pacheco et al. 2020, Ruelas et al. 2021). No se descarta la probabilidad de ocurrencia de alguna de estas u otra especie relacionadas en el departamento de Loreto, debido a que los registros más orientales se ubican en la localidad de Cordillera Colán, East of La Peca, Amazonas (305m, 05.51092°S, 78.33683°W) aproximadamente 70 km al este del límite con el departamento de Loreto. Debido a ello, estas especies podrían estar presentes en el límite occidental de Loreto donde existen hábitats ideales como las ecorregiones del bosque muy húmedo montano (BHM) y bosque muy húmedo premontano (BMHP) (sensu Britto 2017). Un claro ejemplo de ello, son los registros en Loreto de Akodon orophilus (Patterson & López 2014) en cordillera Escalera (Alto Amazonas), especie que había sido registrada en Puca Tambo (San Martín) a casi 70 km al oeste del registro actual en Cordillera Escalera (Loreto). Todo esto indicaría que más estudios y evaluaciones en estas ecorregiones del departamento de Loreto permitirían el descubrimiento de más especies.
La diversidad de mamíferos menores no voladores reportados en Loreto (n=75) es equivalente al 84, 48 y 39% de la diversidad del total de mamíferos reportados en provincias aledañas como Orellana y Pastaza (n=89) en Ecuador (Tirira et al. 2020), Putumayo (n= 154) en Colombia (Ramírez-Chaves et al. 2013) y Ucayali (n=192) en Perú (Quintana et al. 2009), respectivamente. Comparando solo en la diversidad de mamíferos menores no voladores reportadas en Loreto y dichas localidades muestra que el departamento de Loreto supera en 57, 33 y 17 especies respectivamente a la diversidad reportada en las provincias mencionadas. Por otro lado, las especies de mamíferos menores no voladores reportadas para Pastaza y Orellana (Ecuador) y Putumayo (Colombia) han sido reportadas también en el departamento de Loreto, contrariamente en Ucayali (Perú) ocurren dos especies Proechimys pattoni da Silva, 1998 y Dactylomys boliviensis Anthony, 1920 (Quintana et al. 2009; Emmons et al. 2015a; Emmons et al. 2015b) que aún no han sido reportadas para Loreto pero las cuales por su cercanía geográfica podrían ocurrir también en este departamento.
La riqueza de especies es considerablemente alta en el departamento de Loreto posicionándola como una de los más diversos del Perú. Más aún, si consideramos que aproximadamente solo el 20% de la literatura especializada disponible sobre mamíferos del departamento de Loreto describen total o parcialmente la diversidad de pequeños mamíferos no voladores, al igual que pocos han corroborado la identificación y localidad de alguna de las especies (Soini et al. 1996, Fleck & Hardes 2000, Valqui 2001, Hice & Velazco 2012, Medina et al. 2015, Patton et al. 2015, Emmons & Fabre 2018, Voss et al. 2019, Díaz 2020). La información restante está abocada al estudio de la diversidad y/o ecología de mamíferos medianos, mayores o murciélagos (Pacheco & Arias 2001, Valqui 2001, Salovaara et al. 2003, Hice et al. 2004, Montenegro & Escobedo 2004, Amanzo 2006; Jorge & Velazco 2006, Bravo & Ríos 2007, Bravo & Borman 2008, Bravo 2010, Montenegro & Moya 2011, Voss & Fleck 2011, Aquino 2012a, Castro 2012, López 2013, Patterson & Lopez 2014, Escobedo 2015, Bravo et al. 2016, Ramos et al. 2017, Pérez-Peña et al. 2019, Velazco et al. 2021). Por ello, los registros presentes en las colecciones científicas (alrededor de 6035 especímenes preservados, Tabla 1), han sido fundamentales para una mejor actualización de esta lista de especies y constituyen un recurso irremplazable para muchas de las especies nocturnas, sigilosas y recelosas que difícilmente son registradas por avistamientos o encuestas.
Esta desproporción entre los estudios y métodos de muestreo destinados a mamíferos menores no voladores frente a otros grupos de mamíferos se evidencia al comparar la riqueza de especies encontrada entre la provincia de Mariscal Ramón Castilla y Putumayo. Ambas provincias presentan un número similar de localidades evaluadas (10 y 14 respectivamente, Tabla 1; Figs. 1 y 2), no obstante; en la provincia de Mariscal Ramón Castilla se registraron casi el triple (n=28) de las especies encontradas en la provincia de Putumayo (n=10) (Tabla 1; Figs. 1 y 2). Esta diferencia se debe a que las evaluaciones en la provincia de Putumayo estuvieron enfocadas al estudio de mamíferos mayores y murciélagos registrándose solo algunas ardillas como parte de los mamíferos menores no voladores (Montenegro & Escobedo 2004, Aquino et al. 2007b, Bravo & Borman 2008, Bravo 2010, Montenegro & Moya 2011, López 2013, Bravo et al. 2016); mientras que, en la provincia de Mariscal Ramón Castilla las colectas de Mr. Hendee publicados por Thomas (1928a, 1928b), revisiones taxonómicas por Patterson & Velazco (2006), Emmons & Fabre (2018) y la considerable presencia de muestras colectadas y preservadas en colecciones científicas desde 1869 a 1987 han permitido ampliar el conocimiento sobre la diversidad de este grupo en esta provincia.
Por otro lado, el acceso a lugares muy remotos genera complicaciones logísticas y económicas que dificultan el incremento de la información sobre la diversidad, principalmente de este grupo de mamíferos, en el departamento de Loreto. Por ejemplo, Mena et al. (2021) estima una inversión de 6,600.00 (US $) solo en el transporte para la ejecución de un inventario de mamíferos menores (incluyendo murciélagos) por un periodo de 48 días en un lugar remoto de la provincia de Tahuamanu en el departamento de Madre de Dios. A ello se suman los aspectos burocráticos dentro de las ANP que dificultan el otorgamiento de permisos de colecta y acceso a recursos genéticos disminuyendo el interés de investigadores nacionales y extranjeros por trabajar dentro de estas áreas. Ello conlleva a que muchas de las ANP cuenten con listas desactualizadas y/o basadas en especies potenciales cuya presencia no ha sido corroborada hasta la fecha, o listas sesgadas a grupos carismáticos como primates o carnívoros, en el caso de mamíferos. Esta desactualización y desconocimiento pueden tener consecuencias negativas en el manejo adecuado de la biodiversidad y la gestión ambiental, incurriendo en errores al momento de emitir las opiniones técnicas que sustentan de normas o la evaluación de los proyectos de desarrollo o investigación que involucren a la ANP, generando discordancia con los objetivos listados en el artículo 2 del reglamento de la Ley de Áreas Naturales Protegidas (Ley N° 26834 y el Decreto Supremo N° 038-2001-AG) como el proporcionar medios y oportunidades para el desarrollo de la investigación científica. Nuestros resultados, por ejemplo, muestran que existen 21 especies presentes en Loreto que no han sido registradas en ninguna ANP y que, por ende, la protección de sus poblaciones no está siendo contemplada.
Sin duda, las diferentes dificultades mencionadas han repercutido en la existencia de los cinco vacíos de información en el departamento de Loreto y en los valores subestimados de la diversidad de mamíferos presentada actualmente, en particular del grupo de pequeños mamíferos no voladores. Incrementar la información sobre la diversidad de estos pequeños mamíferos implica el fortalecimiento de nuestras instituciones y el financiamiento adecuado de las entidades depositarias de material biológico que permitan albergar grandes colecciones científicas, sea en la región de Loreto y/o a nivel nacional.
Recomendaciones
Con el fin de incrementar el conocimiento de la diversidad de este grupo de mamíferos, es importante implementar nuevos métodos de muestreo. Por ejemplo, el uso de trampas cámara en el dosel, a nivel de suelo, y cercanos a collpas ha demostrado ser un método eficiente para estudios de biodiversidad arbórea como equímidos, ardillas y marsupiales (por ejemplo, Echimys saturnus, Mesomys hispidus, Rhipidomys sp., Hadrosciurus spadicues, Hadroscirus ignitus, Marmosa spp., Cuscomys oblativus) (Blake et al. 2010; Gregory et al. 2014; Bowler et al. 2017; Ochoa et al. 2020); además, son una opción adecuada no solo para el estudio de la diversidad o composición de la comunidad sino también para analizar la distribución de las especies en relación a variables ambientales o antropogénicas, cuando la abundancia y estimaciones de densidad no son requeridas (Bowler et al. 2017). A nivel del suelo, las trampas cámara son ampliamente usados con similares objetivos y para evaluar el uso de recursos especiales como collpas (Griffiths et al. 2020), que al parecer suelen ser frecuentados por equímidos como Echimys saturnus (Blake et al. 2010, Mosquera et al. 2016). Aunque las identificaciones pueden ser confiables para ciertas especies, sobre todo para equímidos y ardillas, puede ser más compleja en el caso de los pequeños mamíferos como roedores cricétidos o marsupiales; por lo que, este método debe considerarse como complemento a las técnicas convencionales (uso de trampas de captura viva y trampas de golpe) para obtener una mejor información de la diversidad de especies e incluir a especialistas en de estos grupos para una mejor aproximación en cuanto a las identificaciones. Además, es prioritario incorporar el uso de trampas de caída (pitfall) en los monitoreos porque han demostrado su eficacia para la colecta de pequeños mamíferos con hábitos terrestres y semiacuáticos en los bosques Neotropicales (Umetso et al. 2006, Ribeiro-Junior et al. 2011, Miranda et al. 2012, Pacheco et al. 2020b).
Por su parte, el eDNA (environmental DNA) ha sido propuesto también como un método complementario para el monitoreo y conservación de especies (Harper et al. 2019, Mena et al. 2021). Es así como, Mena et al. (2021) registraron únicamente en base al eDNA el 47% de un total de 106 mamíferos registrados con métodos convencionales de captura y cámaras trampa, mostrando un gran potencial del eDNA como herramienta complementaria para conocer la diversidad de un lugar. La incorporación de estos métodos de evaluación en las zonas de vacíos de información es de suma importancia, y deberían de realizarse con urgencia para conocer mejor la distribución de las especies en este departamento, y poder conocer el impacto y la presión de las diferentes actividades humanas como la actividad maderera, la extracción de productos del bosque, la ganadería, agricultura y construcciones sobre la diversidad de mamíferos, y con ello la implementación de mejores normas y leyes para el buen manejo y control de este y otros organismos dentro y fuera de ANP.
Finalmente, los cambios taxonómicos ocurren continuamente y conllevan a la rápida desactualización de las distintas listas. Por ello, es necesario que se incentive la digitalización y actualización de las bases de datos nacionales e internacionales para tener un mejor rastreo de los ejemplares depositados en colecciones científicas y faciliten los trabajos de investigación futuras tanto en sistemática como ecología (e.g. modelos de nicho ecológico y distribución potencial), así como en la elaboración de manuales para entidades dedicadas a la protección de fauna silvestre. Estas actualizaciones y la inclusión de especialistas en su elaboración son de suma importancia para evitar potenciales errores como los presentados en Allgas et al. (2017) sobre la guía de identificación de fauna silvestre debidamente reportados por Serrano et al. (2018).
Comentarios taxonómicos
Carnivora
Neogale africana (Desmarest, 1818)
La comadrejita amazónica, es una de las especies más raras entre los carnívoros y junto a Neogale frenata son las dos únicas especies del género presentes en Perú. En Loreto, N. africana se conocía solo de dos registros uno en Yurimaguas, Alto Amazonas (holotipo de N. frenata stolzmanii, Tackzanowski 1881 preservado en el Museum and Institute of Zoology Polish Academy of Sciences en Warsaw, Polania según Piechnik et al. [2017]) y el otro en Menseriche, Datém del Marañón en base al ejemplar AMNH 98552 colectado en 1929 (Ramírez-Chavez et al. 2017). Recientemente, Voss & Fleck (2017) y Fleck & Harder (2000) consideran la presencia de N. africana también en el distrito de Nuevo San Juan, Requena, en base a observaciones realizadas por los Matsés, quienes conocen a esta especie como “mayanën opampi”. Voss & Fleck (2017) agregan que debido a las características particulares de N. africana su confusión con otras especies es poco probable por lo que las observaciones de la especie por los Matsés son confiables. Este último registro sería el más oriental dentro del territorio peruano y con ello, la distribución de esta especie se extiende casi 500 km ESE desde Menseriche
Conservación: A pesar de los escasos registros y gran desconocimiento de su historia natural esta especie es considerada como preocupación menor (LC) por la IUCN y no ha sido considerada en ninguna categoría en la legislación peruana. Por ello, concordamos con Ramírez-Chavez et al. (2017) que esta especie debería considerarse como Datos Insuficientes (DD) e instamos que se incluya dentro de las próximas evaluaciones a nivel regional en el Perú.
Didelphimorphia
Gracilinanus emiliae (Thomas, 1909)
Esta especie fue reportada en la Zona Reservada Pucacuro (provincia de Maynas, distrito de Alto Nanay) por primera vez por Huamaní et al. (2009) aunque fue registrado como Gracilinanus agilis remarcando que podría tratarse de la subespecie G. a. peruanus. Semedo et al. (2015) elevaron a G. peruanus al nivel de especie plena. Esta decisión fue seguida por Pacheco et al. (2020) quienes listaron al individuo registrado por Huamaní et al. (2009) como Gracilinanus peruanus para Loreto. No obstante, Voss et al. (2019:58) revisó este y otros especímenes de G. agilis señalando que el espécimen colectado y reportado por Huamaní et al. (2009) como G. agilis (MUSM 24430) es en realidad un individuo juvenil de G. emiliae. En el presente trabajo seguimos la propuesta dada por Voss et al. (2019) considerando solo la ocurrencia de G. emiliae para el departamento de Loreto.
Marmosa (Marmosa) macrotarus (Wagner, 1842) y Marmosa (Marmosa) waterhousei (Tomes 1860)
Gutiérrez et al. (2010) reconoció como especies válidas a las antes consideradas subespecies de Marmosa murina: macrotarsus y waterhousei, quedando Marmosa (Marmosa) murina restricta al este brasileño y las Guyanas. Mientras que Marmosa (Marmosa) macrotarsus y Marmosa (Marmosa) waterhousei presentan registros para el Perú y son listadas para el departamento de Loreto en los trabajos de Gutiérrez et al. (2010, 2011), Hice y Velazco (2012) y Voss et al. (2019). Marmosa (Marmosa) macrotarsus ha sido listada anteriormente como Marmosa (Marmosa) murina por Fleck & Harder (2000) en Nuevo San Juan (Requena, Loreto). Debido a estos cambios taxonómicos la evaluación de su estado de conservación tanto nacional como global es necesaria.
Marmosa (Micoureus) germana Thomas, 1904
El nombre Marmosa (Micoureus) regina corresponde a la población del Valle del Cauca (Colombia), localidad tipo de la especie (Voss et al. 2019). Las poblaciones de la Amazonía (región Cis-Andina) han sido asignadas bajo los nombres de germana, parda o rutteri, todas ellas con distribución en el Perú (Pacheco et al. 2020); sin embargo, en Loreto solo han sido reportada germana y rutteri (Silva et al. 2019, Voss et al. 2019, Voss et al. 2020). En el caso de germana cabe resaltar que Voss et al. (2020) identificó tres haplogrupos a los que denominó germana A, germana B y “Yasuni”, las cuales tiene localidades de registro tanto en Perú (Loreto) como en Ecuador (Orellana), excepto germana B que solo cuenta con un registro en Loreto en la localidad de Quebrada Orán (ver Anexo 1 localidad 70 y Anexo 2 para el voucher) pudiendo considerarse como una potencial especie con endemismo regional de ser aceptada como una especie válida. Sin embargo, como la descripción formal de estos haplogrupos aún no ha sido presentada mantenemos a todo este grupo de forma conservadora bajo el nombre de germana.
Voss et al. (2020) reidentificó como Marmosa (Micoureus) germana algunos individuos listados por Hice & Velazco (2012) como Marmosa (Micoureus) demerarae y Marmosa (Micoureus) regina. Aunque no todos los especímenes listados por Hice & Velazco (2012) han sido mencionados en el trabajo de Voss et al. (2020), en este trabajo momentáneamente consideramos a todos los especímenes listados por Hice & Velazco (2012) como Marmosa (Micoureus) germana hasta que se haga una revisión más detalla sobre la identificación de dichos individuos.
Marmosops (Marmosops) caucae (Thomas 1900)
Siguiendo la nomenclatura propuesta por Díaz-Nieto et al. (2016), Marmosops (Marmosops) caucae (haplogrupo A) es el nombre válido para referirse a los individuos previamente identificados como Marmosops neblina, M. celicae, M. oroensis (ahora considerados todos sinónimo junior de caucae en base a datos moleculares) o M. impavidus (nombre no aplicable por ser un nomen dubium). En base a ello, especímenes previamente identificados como Marmosops impavidus reportados en Loreto en las localidades de Jenaro Herrera, río Pucacuro, boca del río Curaray, río Ampiyacu y río Samiria (Anexo 1 y 2) son asignados en este trabajo como caucae; sin embargo, una revisión más detallada es necesaria para corroborar la identificación de cada una (ver Anexo 2 para más información sobre los vouchers)
Por otro lado, Thomas (1928a) listó Marmosa madescens Osgood, 1913 en las localidades de Contamana y San Jerónimo (Loreto, Perú), nombre que podría asociarse al haplogrupo caucae B según Díaz-Nieto et al. (2016); sin embargo, dichos autores sugieren un análisis más exhaustivo porque la localidad tipo de madescens está a casi 2700 m de altitud, mientras que las muestras analizadas de caucae B analizadas por ellos provienen de localidades de menos de 815 m En base a esta información es probable que los especímenes de Thomas (1928a), provenientes también de zonas bajas, estén relacionados al haplogrupo caucae B debido a la cercanía geográfica de las localidades de Contamana y San Jerónimo a la localidad de las muestras del haplogrupo B en Igarapé Porongaba y Nova Empresa en Acre y Amazonas en Brasil, respectivamente. La revisión de las muestras colectadas por Thomas (1928a) son necesarios para confirmar su identificación taxonómica.
Metachirus myosurus (Temminck, 1824)
La nominación de Metachirus nudicaudatus ha sido restringida a los especímenes de la Amazonía nororiental por Voss et al. (2019) en base a datos morfológicos y moleculares que la diferencian de las poblaciones de la Amazonía occidental, la Mata Atlántica y de América Central a las cuales se ha asignado el nombre disponible de Metachirus myosuros. Siguiendo esta propuesta, los individuos identificados previamente como M. nudicaudatus en Maynas por Calderón & Rengifo (2010), en la R.N. Allpahuayo Mishana por Hice & Velazco (2012), en Qda. Sábalo en el P. N. Sierra del Divisor por Medina et al. (2015), en Jenaro Herrera por Pacheco (1991), Fleck & Harder (1995) son considerados como M. myosuros en este trabajo hasta una mayor evaluación de estos. Otras localidades y vouchers están listas en el apéndice 2.
Philander canus (Osgood, 1913)
El único registro de esta especie para Loreto era el espécimen (MUSM 30157/MDD 3865) identificado por Flores et al. (2008) como Philander olrigi. No obstante, Voss et al. (2018) mencionan que las características diagnosticas mencionadas por Flores et al. (2008) para describir P. olrigi son variaciones intraespecíficas de P. canus; por lo que, consideran olrigi sinónimo de P. canus. Por otro lado, Thomas (1928a) lista un ejemplar bajo el nombre de “Metachirus opossum canus Osg.” en la localidad de San Jerónimo (Loreto) y otros seis en Cumeria y Chicosa (Ucayali). Lamentablemente, no hemos encontrado esta combinación de nombre en Gardner (2008) o Voss et al. (2018) que abordan una lista bastante completa de sinónimos y revisiones taxonómicas de este género. Momentáneamente, estamos considerando dicho ejemplar como parte de Philander canus pero una revisión de dichos ejemplares es necesaria.
Cricetidae
Euryoryzomys macconnelli (Thomas, 1910)
Esta especie tiene una amplia distribución y ha sido reportado en todas las provincias de Loreto excepto Putumayo. Sin embargo, muchos de los datos que hemos encontrado corresponden a vouchers no listados en trabajos previos por lo que una revisión detalla de estas muestras sobre todo aquellas presentes al sur del río Amazonas son importantes porque pueden estar confundidas con E. nitidus.
Aunque Percequillo (2015b) considera esta especie como monotípica, los estudios de Patton et al. (2000: Fig. 99) y de Almeida (2014: Fig. 2.2.) muestran una diferencia genética significativa (8% a 11%) entre sus poblaciones (occidente, centro y oriente Amazónico). De igual forma las poblaciones de al lado izquierdo del río Negro presentan un cariotipo 2n=76, FN=85 distinto a las del margen derecho 2n=59, FN=90 y en el resto de su distribución al sur del río Amazonas las poblaciones han sido reportadas con el cariotipo 2n=64, FN=70 (Musser et al. 1998). Ambas líneas de evidencia sugieren que E. macconnelli se trataría de un complejo de especies cuya revisión es necesaria. El nombre disponible para esta población es mureliae Allen,1915 (Voss et al. 2001)
Euryoryzomys nitidus (Thomas, 1884)
En el Perú, el rango de distribución de esta especie abarca los bosques montanos y bosque tropical del centro y sur del país. En la selva tropical E. nitidus se conocía solo en el departamento de Ucayali y Madre de Dios (Gardner & Patton 1976, Percequillo 2015b); sin embargo, los trabajos de Escobedo (2015) y Medina et al. (2015) reportaron los primeros registros de esta especie para el departamento de Loreto. Mientras que, en las bases de datos de las colecciones científicas encontramos individuos identificados como E. nitidus de la localidad de Nuevo San Juan. Aunque estamos considerando los registros de Medina et al. (2015) y los de las bases de datos como parte de la distribución de E. nitidus una revisión más detallada, sobre todo de las listadas en las bases de datos (ver Anexo 2), es necesaria para confirmar su identificación porque podrían estar siendo confundidas con E. macconnelli o confirmar si ambas especies se encuentran en simpatría.
Por otro lado, el nombre Hesperomys [Oryzomys] laticeps var. nitidus Thomas, 1884 es considerado, actualmente, sinónimo de Euryoryzomys nitidus (Percequillo 2015b). Por ello, tentativamente, los especímenes listados por Thomas (1928a) como Oryzomys laticeps nitidus Thomas en las localidades de Contamana, Cerro Azul y San Jerónimo en Loreto son atribuidos en este trabajo a Euryoryzomys nitidus, pero sugerimos los análisis pertinentes para confirmar la identidad de estos individuos.
Hylaeamys perenensis (J. A. Allen, 1901)
Thomas (1928b) reporta esta especie como Oryzomys laticeps Lund (= Mus laticeps Lund). Actualmente, Mus laticeps Lund es considerado sinónimo de Hylaeamys laticeps (Lund, 1840) y la subespecie H. l. perenensis es reconocida como especie válida (Percequillo 2015c). Es probable que los especímenes mencionados por Thomas (1928b) corresponden a esta última, Hylaeamys perenensis. Por ello, momentáneamente, consideramos la presencia de H. perenensis en las localidades de Contamana y San Jerónimo, pero instamos a una revisión futura y confirmación de la identidad de estos especímenes.
Neacomys rosalindae Sánchez-Vendizú, Pacheco, Vivas-Ruiz, 2020
Díaz (2020) reconoce la ocurrencia de Neacomys minutus y N. musseri al norte del río Amazonas en la provincia de Maynas (Loreto) extendiendo la distribución de ambas especies 160 km NW de la localidad previa más al norte, al sur del río Amazonas, en Nuevo San Juan (Requena, Loreto) basándose en el tamaño pequeño de dichos individuos sugiriendo, además, que el espécimen MUSM 30350 identificado como N. rosalindae por Sánchez-Vendizú et al. (2018) correspondería a N. minutus; sin embargo, el tamaño pequeño de este individuo en comparación a los demás se debe a que es un individuo juvenil de edad 2 (Sánchez-Vendizú obs. pers.). Debido a que Díaz (2020) no proporciona evidencia que sustente sus argumentos mantenemos la distribución previamente descrita para N. minutus y N. musseri al sur del río Amazonas en la provincia de Requena y N. rosalindae al norte del río de Amazonas (Weksler & Bonvicino 2015b; Sánchez-Vendizú et al. 2018) (Tabla 1, anexo 2 y 4).
Melanomys robustulus Thomas, 1914
Esta especie, con registros en Ecuador y Perú, ha sido registrada en el Perú solo en el departamento del departamento de Loreto y en una sola localidad a partir de cuatro ejemplares colectado por los Olalla e hijos en la boca del Curaray en 1925 (Pacheco et al. 2009, Weksler & Lóss 2015; Tabla 1 y apéndice 1 y 2) un área que no ha vuelto a ser evaluada (al menos no para mamíferos pequeños terrestres). Esta especie esta categorizada por IUCN en Preocupación Menor (LC) aludiéndose su “amplia distribución” y asumiéndose una población grande (Tinoco 2016); sin embargo, debido al escaso conocimiento tanto en distribución como historia natural de esta especie en el Perú recomendamos que esta su categorización como Datos insuficientes (DD) al menos a nivel regional.
Nectomys rattus (Pelzeln, 1883)
Nectomys rattus es conocida en el Perú por escasos cuatro a cinco registros distribuidos en los departamentos de San Martín, Loreto y Ucayali (Bonvicino & Weksler 2015, Velazco & Patterson 2019). En Loreto, solo se conoce de dos registros en la provincia de Alto Amazonas a partir de individuos colectados en 1912. Por otro lado, Thomas (1928a) reporta siete especímenes bajo el nombre N. garleppi en la localidad de San Jerónimo (Loreto). Recientemente, cuatro de estos especímenes han sido re-identificados por Chiquito (2015) como N. rattus al igual que otros especímenes de la localidad de Sarayacu (Ucayali, Loreto). La evaluación de los otros individuos listados por Thomas (1928a) es necesaria para confirmar si se tratan también de especímenes de N. rattus o son tal vez N. apicalis.
Oecomys paricola (Thomas 1904)
Esta especie presenta una distribución disyunta con individuos al sur del río Amazonas en el este brasileño e individuos al norte del río Amazonas en el oriente peruano (Carleton & Musser 2015). Aunque esta especie es tratada como monotípica, el reciente estudio de Oliveira da Silva et al. (2020) reveló la existencia de al menos tres citotipos de esta especie solo en el este brasileño sugiriéndola como un complejo de especies. Por lo cual, la incorporación de datos morfológicos detallados y moleculares de los individuos presentes en el Perú son necesarios para verificar su identificación y su relación filogenética respecto a la población de Brasil.
Oecomys phaeotis (Thomas, 1901)
Esta especie ocurre en Perú y Bolivia y tiene una distribución asociada, principalmente, a bosques premontanos. Sin embargo, Carleton & Musser (2015) y Díaz (2020) han presentado los primeros registros de O. phaeotis en selva baja en el departamento de Loreto. Aunque momentáneamente aceptamos la presencia de O. phaeotis es necesario un estudio más detallado, incluyendo un análisis molecular, para confirmar la identificación de ambas muestras LSUMZ 27975 y CML 13587 porque podrían tratarse de individuos de O. paricola, especie con la cual comparte mucha similitud morfológica.
Rhipidomys gardneriPatton, da Silva, Malcolm, 2000
Thomas (1928a) registró por primera vez siete individuos juveniles bajo el nombre de Rhipidomys leucodactylus en la localidad de San Jerónimo en Loreto. Sin embargo, Tribe (2015) lista uno de los especímenes de Thomas (1928a) como Rhipidomys gardneri (BMNH 28.5.2.180), ampliando su rango de distribución 250 km al noroeste del registro anterior más al norte- ubicado en Acre (Brasil) (Patton et al. 2020)- siendo este el primer registro para el departamento de Loreto. Tribe (2015) no menciona si los otros seis individuos reportados por Thomas (1928a) corresponden también a R. gardneri y como la localidad de San Jerónimo tampoco ha sido considerada dentro del rango de distribución de R. leucodactylus estamos considerando que dichos especímenes deben de tratarse también de R. gardneri y listamos la localidad de San Jerónimo solo para esta especie. Una re-evaluación de estos especímenes es necesaria para confirmar su identificación.
Scolomys melanops Anthony, 1924
La distribución de Scolomys melanops era conocida en Ecuador y Perú solo al norte del río Amazonas (Patton 2015). Recientemente, Medina et al. (2015) registraron la especie al sur del río Amazonas en el P.N. Sierra del Divisor, considerándose el primer registro de simpatría de ambas especies, S. melanops y S. ucayalensis. Sugerimos un análisis más detallado de las muestras para corroborar su identificación y ampliar el conocimiento sobre la variación morfológica de esta especie.
Scolomys ucayalensisPacheco, 1991
En el Perú solo eran conocidos cuatro registros de S. ucayalensis, todos al sur del río Amazonas en el departamento de Loreto y Ucayali (Pacheco 1991, Quintana et al. 2009, Medina et al., Patton 2015). Sin embargo, Díaz (2020) reportó el primer registro de esta especie al norte del río Amazonas en el departamento de Loreto en base a dos especímenes (CML 13604, MDD 4278). Este registro representa un segundo caso de simpatría entre S. ucayalensis y S. melanops. No obstante, debido a la falta de descripción y fotos que sustenten la identificación de estas muestras sugerimos que se realice un estudio más detallado para verificar la identidad de estos especímenes como S. ucayalensis.
Echimyidae
Leiuromys occasius Emmons y Fabre, 2018
Las diferencias morfológicas y moleculares entre las especies del género Pattonomys llevó a la descripción de un nuevo género monotípico, Leiuromys, por Emmons & Fabre (2018) con la especie tipo L. occasius (antes Pattonomys occasius). Esta especie, aunque, con aparente amplia distribución es conocida solo en una localidad (río Curaray, loalidad 13, espécimen AMNH 71897) en el departamento de Loreto.
Sciuridae
“Microsciurus” flaviventer (Gray, 1867)
Los resultados de Abreu-Jr. et al. (2020) indicaron que el género Microsciurus sería parafilético con uno de sus clados incluía a especies con distribución Trans-Andina: Microsciurus alfari y Microsciurus “species 1” emparentadas a los géneros Syntheosciurus y Echinosciurus; mientras que, un segundo clado alberga a las especies Cis-Andinas: M. sabanillae, M. flaviventer y Microsciurus “species 2” como clado hermando del género Hadrosciurus. Debido a que el primer clado alberga a la especie tipo del género Microsciurus, M. alfaroi y al no existir un nombre disponible para el segundo clado, este amerita la designación de un nuevo nombre. Por ello, Abreu-Jr. et al. (2020) mantienen la nominación de "Microsciurus" entre comillas para referirse a este grupo de especies hasta la descripción formal de este nuevo género. Por otro lado, de Vivo & Carmignotto (2015) listan para Loreto a “Microsciurus” flaviventer en base al espécimen LSUMZ 17720 con localidad en Hacienda Santa Elena, ca. 35km NR Tingo María; sin embargo, esta localidad pertenece al departamento de Huánuco. De igual forma, Díaz (2020) considera la localidad anterior mencionada y la localidad Alto Río Yavarí para flaviventer citando a Thomas (1928b); sin embargo, las localidades reportadas por Thomas (1928b) para flaviventer, corresponden solo a Iquitos y Pebas. Por ello, en la distribución presentada en este trabajo para flaviventer no se ha tomado en consideración ninguna de estas dos localidades (Hacienda Santa Elena, ca. 35km NR Tingo María; de Alto Río Yavarí). Por otro lado, Thomas (1928b) lista cinco especímenes capturados en Pebas con los códigos de campo de Mr. Hendee 1576-78, 1582 y 1653 los cuales corresponden a los números de catálogos BM 28.7.21.74 - 78 listados por de Vivo & Carmignotto (2015). Abreú-Jr. et al. (2020) lista “Microsciurus” sabanillae para Loreto en base al espécimen AMNH 69283 registrado en Santa Rosa, upper river Ucayali (= alto río Ucayali); sin embargo, esta localidad se encuentra en realidad en el departamento de Ucayali y no en Loreto.
Hadrosciurus ignitus (Gray, 1867)
Los análisis mitogenómicos de Abreú-Jr. et al. (2020) mostraron que las subespecies Notosciurus pucheranii ignitus, N. p. argentineus y N. p. boliviensis forman parte del género Hadrosciurus y no de Notosciurus. En base a ello, la clasificación taxonómica propuesta por Abreú-Jr. et al. (2020) propone designar tentativamente a estas subespecies (argentineus, boliviensis e ignitus) bajo un único nombre: Hadrosciurus ignitus al ser el epíteto ignitus el nombre más antiguo (principio de prioridad) hasta que se realice un estudio más profundo sobre el estado taxonómico de cada una de estas subespecies.
La distribución de Hadrosciurus ignitus parece ser amplia dentro de Loreto (Anexo 4) aunque todos los registros, excepto uno, se conocen de especímenes de museo colectados entre 1927 y 1996 (vertnet, Timm et al. 2015, de Vivo y Carmignotto 2015). De Vivo & Carmignotto (2015) reportan la presencia de ignitus en Puerto Punga (=Quebrada. Punga, río Tapiche) en el distrito de Alto Tapiche a partir del espécimen AMNH 99203 colectado en 1927, siendo este el registro más sureño de esta especie en Loreto. Posteriormente, Escobedo (2015) registró ignitus (como Sciurus ignitus) el 2014 mediante un avistamiento en la localidad de Anguila distrito de Tapiche a solo 15km al SE del registro previo, ello indicaría que la especie a lo largo de todo este tiempo todavía está presente en la cuenca de Tapiche-Blanco; sin embargo, es necesario la colecta de estos especímenes porque las identificaciones basadas en solo en avistamientos podrían ser dudosas. Por ejemplo, Jessen et al. (2013a) resaltan que debido a las grandes similitudes morfológicas entre Hadrosciurus spadiceusy Hadrosciurus igniventris la distinción de ambas especies es difícil basados solo en avistamiento; por lo que, sus análisis están basados considerando ambas especies en la reserva Tamshiyacu-Tahuayo. Por otro lado, Timm et al. (2015) resalta que ignitus fue una de las especies más comunes a lo largo del río Madre de Dios, por lo que, un mayor estudio de esta especie en Loreto podría indicar lo mismo.
Hadroscirus igniventris Wagner, 1842
de Vivo & Carmignotto (2015) consideran tres subespecies de las cuales Hadrosciurus igniventris cocalis (Thomas 1900) corresponde a los especímenes listados como igniventris por Thomas (1928b), con distribución en Ecuador y norte de Perú (Cajamarca, Loreto y San Martín). La subespecie H. i. igniventris (Wagner, 1842) está presente a lo largo del río Napo en el departamento de Loreto y aunque ambas presentan las patas naranjas o rojizas se diferencian porque cocalis exhibe el color dorsal negruzco o rojo oscuro salpicado con naranja y la presencia de manchas naranjas detrás de las orejas; mientras que, la segunda igniventris tiene una coloración dorsal negruzca o marrón oscuro salpicado con naranja o rojo, manchas detrás de las orejas si existen poco notorias. Debido a la presencia de ambas subespecies en el departamento de Loreto sugerimos que futuros estudios de esta especie incluyan la colecta de especímenes para entender mejor la variación morfológica y límites de distribución de ambas subespecies.
Hadrosciurus pyrrhinus Thomas, 1898
La distribución de Hadrosciurus pyrrhinus en el Perú estaba restricta al centro y sur del país abarcando parte de los bosques montanos en los departamentos de Huánuco y Junín y selva baja de Pasco y Cusco; sin embargo, el registro de H. pyrrhinus al margen derecho del río Yavarí en Estirão do Equador (Amazonas, Brasil) proponía su potencial presencia en el departamento de Loreto (de Vivo & Carmignotto 2015). Ello ha sido corroborado recientemente con el análisis mitogenómico realizado por Abreú-Jr. et al. (2020), quienes revelaron la presencia de H. pyrrhinus en Loreto a partir de muestras colectadas en el distrito de Nuevo San Juan (Loreto, Peru), al margen izquierdo del río Yavarí, a solo 186 km SW de su registro en Estirão do Equador (Amazonas, Brasil). De igual forma sus análisis revelaron que los especímenes previamente identificados como H. igniventris por Hice & Velazco (2012) corresponden en realidad a H. pyrrhinus siendo este el registro más norteño de la especie y el primero al norte del río Amazonas dentro del territorio peruano, puesto que el registro más al norte de toda su distribución se encuentra en Ecuador. Debido a la dificultad al identificar H. pyrrhinus e H. igniventris es importante que se realice una revisión minuciosa de los especímenes de esta última especie porque algunas podrían tratarse de H. pyrrhinus incluyendo los especímenes listados por Fleck & Harder (2000) como H. igniventris también en Nuevo San Juan.
Hadrosciurus spadiceus Olfers, 1818
Esta ardilla presenta una amplia distribución en Loreto. de Vivo & Carmignotto (2015) reconocen cuatro subespecies de las cuales solo H. s. tricolor está distribuida en el Perú; sin embargo, aún falta un estudio detallado de cada una de estas subespecies y sus límites geográficos.
Hadrosciurus “species 3”
Guerlinguetus aestuans fue registrada en dos localidades del departamento de Loreto por de Vivo y Carmignotto (2015). Sin embargo, los análisis moleculares de Abreu-Jr. et al. (2020) evidenciaron que estos especímenes están relacionados al género Hadrosciurus y no a Guerlinguetus, siendo recuperado como clado hermano de todas las otras especies del género Hadrosciurus. Por ello, Abreú-Jr. et al. (2020) nombran momentáneamente a estos especímenes como Hadrosciurus “species 3”, la cual se trataría de una especie endémica del Perú en base a los especímenes analizados hasta el momento que indican su ocurrencia solo en el departamento de Loreto.
Sciurillus pusillus (E. Geoffroy, 1803)
Aunque esta especie no es endémica del Perú ha sido registrada solo en el departamento de Loreto principalmente al occidente y norte del río Amazonas y con escasos tres registros al sur del río Amazonas en las provincias de Maynas, Requena y Ucayali (Thomas 1928a, Thomas 1928b, Hafner et al. 1994, Heymann & Knogge 1997, Fleck & Harder 2000, Aquino et al. 2007, Jessen et al. 2013b, de Vivo y Carmignotto 2015, Palmer & Koprowoski 2015) (Table 1, Anexo 2).
Conclusión
Loreto es uno de los departamentos con una importante diversidad de mamíferos en el Perú, contabilizando aquí 75 especies, no obstante, es necesario un mayor esfuerzo de muestreo en las cinco zonas de vacíos de información reportadas para un mejor entendimiento de la diversidad de este grupo de mamíferos. Además, resaltamos que estos nuevos trabajos en campo no deben incluir solo la metodología de avistamiento para el monitoreo o inventario de especies sino también el uso de trampas que permitan la colecta de especímenes para una identificación adecuada, y la inclusión de trampas cámara o eDNA para complementar y tener una lista de especies más robusta. Por otro lado, en el aspecto de la taxonomía y sistemática el análisis detallado de las poblaciones de Euryozymomys macconnelli a ambos lados del río Amazonas es prioritaria para definir la identidad de cada una de ellas, la revisión del género Scolomys porque recientemente dos casos de simpatría entre S. melanops y S. ucayalensis han sido listados al norte y sur del río Amazonas, pero sin una justificación detallada sobre su identificación, la descripción formal de Hadrosciurus sp. 3 y del género “Microsciurus”, la confirmación de la ocurrencia de Neacomys carceleni y Proechimys quadruplicatus al sur del río Amazonas y la de Neacomys amoenus al norte del rio Amazonas, así como, la revisión de los especímenes listados por Thomas (1927, 1928) son aspectos a considerar en futuros estudios. Estos estudios nos permitirán entender mejor los patrones de distribución de estas especies y el rol del río Amazonas en la diversificación de estas especies. Finalmente, instamos a las ANP a impulsar los estudios de biodiversidad (inventarios, monitoreos, etc.), la digitalización y actualización frecuente de los inventarios que poseen sobre la biodiversidad que protegen.












 uBio
uBio 


