Introducción
La urbanización es un proceso de transformación que conduce a la modificación, fragmentación, y destrucción de hábitats naturales (McKinney 2006). Este proceso es una de las principales causas de pérdida de la diversidad biológica, siendo motor de extinciones locales y desplazamiento de especies nativas (Knop 2016). Sin embargo, algunos hábitats urbanos como los parques ecológicos, lotes baldíos o senderos ofrecen condiciones favorables para la permanencia y conservación de especies, especialmente las eurotípicas, debido en gran parte a la disponibilidad de áreas verdes (remanentes de vegetación nativa) (Beninde et al. 2015, Delgado et al. 2017). Estos pequeños remanentes de vegetación son recursos valiosos al funcionar como peldaños (stepping stones) (Lynch 2019) e incluso como corredores biológicos, cuando las condiciones de conectividad ecológica son adecuadas (Fuentes-Medina & Camero-Rubio 2009). Por esto las zonas verdes urbanas, dependiendo de sus características, logran albergar diversas especies de flora, fauna y fungí (MacGregor-Fors et al. 2016).
Diferentes grupos taxonómicos se han escogido como modelos ecológicos para estudiar la diversidad en las zonas urbanas, entre los que encontramos aves, anfibios e insectos (Hamer & McDonnell 2008, McKinney 2008, Ortega-Álvarez & MacGregor-Fors 2011). En este contexto, los escarabajos coprófagos se han seleccionado como un buen modelo ecológico para evaluar el impacto de la urbanización sobre la biodiversidad, debido a su papel funcional dentro de los ecosistemas (Andresen 2001, Nichols et al. 2008, Arriaga et al. 2012). Las especies de la subfamilia Scarabaeinae (Scarabaeidae), reconocidos cómo verdaderos coprófagos, actúan como descomponedores de la materia orgánica y reincorporadores de nutrientes al suelo, así mismo, contribuyen a la aireación, favorecen la penetración del agua, y a la diseminación de semillas (Nichols et al. 2008) e inclusive, bajo ciertas condiciones, ayudan a mitigar el efecto de los gases invernadero producidos por la ganadería (Fowler et al. 2020). Adicionalmente, reúnen características de grupos indicadores como su sensibilidad a los cambios en el medio ambiente, fácil recolecta a través de métodos estandarizados, taxonomía relativamente estable y distribución e historia natural conocidas (Halffter & Favila 1993).
De igual manera, los escarabajos coprófagos han sido utilizados como bioindicadores para evaluar la perturbación antrópica, debido a su sensibilidad a los cambios producidos por la intervención humana, tales como la fragmentación y reducción de las áreas boscosas (Tonelli et al. 2018). Estudios realizados en regiones de Colombia demostraron que las perturbaciones humanas afectan de manera negativa la diversidad, estructura y funcionamiento del ensamble de escarabajos coprófagos, así como a la tasa de remoción que ellos realizan (Noriega et al. 2020, Noriega et al. 2021a), reduciendo los servicios ecosistémicos proporcionados por este grupo (Stokstad 2004). Con respecto a estudios sobre escarabajos coprófagos en zonas urbanas, se han reportado investigaciones a nivel mundial (Ramírez-Restrepo & Halffter 2016, Correa et al. 2021, Shizukuda & Saito 2021), algunos de ellos publicados para el Caribe colombiano (Jiménez-Ferbans et al. 2008, Noriega et al. 2016, Taboada-Verona et al. 2019), en el que se demuestra la importancia de las zonas verdes como refugio y hábitat de escarabajos coprófagos en áreas urbanizadas.
Dada la destrucción de los bosques por los cambios en los usos del suelo con fines agrícolas y ganaderos, y por el proceso de urbanización, los hábitats aptos para los escarabajos coprófagos se han reducido de manera acelerada. Los pocos estudios que evalúan el impacto de zonas urbanas sobre estos insectos reflejan la necesidad de realizar más investigaciones para entender la importancia ambiental, la prestación de servicios ecosistémicos y su contribución al mantenimiento del ensamble de especies de escarabajos coprófagos, todo en aras de desarrollar estrategias que aporten a la subsistencia de la biodiversidad en zonas urbanas y periurbanas. Por lo anterior, se planteó como objetivo estimar la diversidad de escarabajos coprófagos (Coleoptera: Scarabaeidae) en tres zonas urbanizadas del departamento de Sucre, Caribe colombiano.
Materiales y métodos
Área de estudio. - Los municipios de Sincelejo y Sampués se ubican en el departamento de Sucre, al noreste de Colombia (Fig. 1). Estos municipios se encuentran a una altitud media de 213 m y 160 m respectivamente, con una temperatura anual aproximada de 27 °C, una humedad relativa del 60% (Aguilera-Díaz 2005) y según la clasificación de Holdridge (1987) corresponden a la zona de vida de Bosque seco Tropical (BsT). Para el estudio se seleccionaron tres sitios, correspondientes a los tres campus de la Universidad de Sucre: campus Puerta Roja (CPR), campus Ciencias de la Salud (CCS) y campus Ciencias Agropecuarias (CCA), cada uno con características ecológicas distintas (Fig. 1). La sede CPR (09°18’23.61” N - 75°23’42.58” W) se localiza en la zona urbana de Sincelejo, con una superficie de 23 ha que alberga edificaciones, jardines y un parche de bosque de vegetación secundaria (11 ha) con un dosel que puede variar entre los 6 - 15 m, con dos estratos bien definidos; las especies más representativas pertenecen a las familias Araceae, Bignoniaceae, Fabaceae, Malvaceae y Moraceae. La sede CCS (09°18’15.3” N - 75°24’02.2” W) se encuentra ubicada en la parte céntrica de Sincelejo, rodeada de edificaciones; tiene una superficie total de 1 ha, con escasas zonas verdes y poca cobertura vegetal. La sede CCA (09°12’44.56” N - 75°24’08.14” W) con una superficie de 12 ha, está ubicada en la zona periurbana de Sampués y se caracteriza por ser un área abierta con pocas edificaciones, donde la mayor parte del suelo (80%) corresponde a pastizales, destinados al uso agrícola y ganadero.
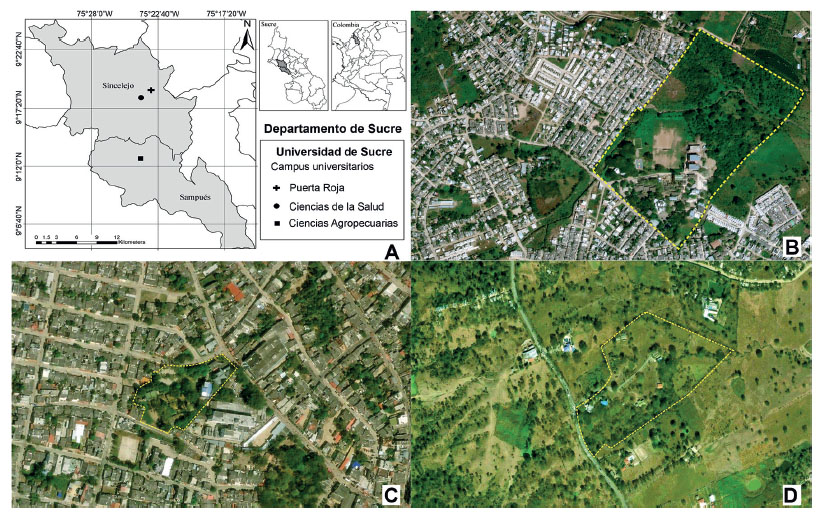
Figura 1 Área de estudio. (A) Localización de las zonas de estudio, (B) campus Puerta Roja (CPR), (C) campus Ciencias de la Salud (CCS) y (D) campus Ciencias Agropecuarias (CCA) de la Universidad de Sucre, Colombia.
Muestreo de escarabajos. - Las colectas se realizaron en abril y mayo de 2017, llevando a cabo dos muestreos mensuales por sitio con diferente tipo de cebo. Para la captura se utilizó la metodología propuesta por Escobar (1997) y Escobar y Chacón de Ulloa (2000) con algunas modificaciones. En cada campus se trazaron transectos lineales y se instalaron trampas pitfall separadas cada 100 m entre sí, acorde a la extensión de cada campus (seis trampas pitfall en CPR, cuatro trampas en CCS y cuatro trampas en CCA). En total se instalaron 28 trampas cebadas con pescado en descomposición y 28 con excremento humano. Las trampas consistieron en recipientes plásticos de 400 mL enterrados a ras de suelo, con 100 mL de solución conservante (alcohol al 70%); en la parte superior del vaso se ubicó un alambre de aluminio en forma de letra “L” invertida que suspendía 20 g de cebo envuelto en gasa. Las trampas permanecieron activas durante 48 horas en campo, fueron revisadas solo una vez y no se cambió o renovó el cebo. Los especímenes recolectados se envasaron y rotularon de acuerdo con el sitio de muestreo, tipo de cebo y fecha, y se trasladaron al Laboratorio de Conservación de la Universidad de Sucre para su respectiva identificación taxonómica. A nivel de género, se utilizaron las claves propuestas por Medina y Lopera (2000) y Smith y Skelley (2007), y a nivel de especie, las claves de Kohlmann y Solís (2001), Solís y Kohlmann (2002, 2004), Camero-Rubio (2010), Edmonds y Zidek (2010), Sarmiento-Garcés y Amat-García (2014). Los ejemplares obtenidos se depositaron en el Museo Zoológico de la Universidad de Sucre, Sincelejo, Sucre, Colombia (MZUSU).
Análisis de datos. La representatividad del muestreo fue evaluada mediante el estimador de cobertura propuesto por Chao y Jost (2012). Para el cálculo de la diversidad alfa, se generaron perfiles de diversidad a través de los números efectivos de especies propuestos por Jost (2006), donde el orden cero (q = 0) corresponde a la riqueza y es independiente de la abundancia relativa, el orden uno (q = 1) en el que se estima la diversidad teniendo en cuenta todas las especies y su abundancia en el ensamble, y el orden dos (q = 2) donde la estimación de la diversidad está influenciada por las especies dominantes o comunes.
Para conocer la distribución en términos de abundancia en los tres sitios de estudio, se utilizó el modelo de dominancia/diversidad utilizando el Log10 (Whittaker 1965). La diversidad beta se calculó con el índice de Sorensen-Dice (Baselga 2010). Dado que la diversidad beta se explica mediante dos procesos diferentes y opuestos como lo son el anidamiento (βNES) y el recambio (βSIM). Todos los análisis se calcularon en el entorno de programación R v.4.0.4. (R Core Team 2021), la interfaz RStudio v 1.4.1103, utilizando los paquetes betapart (Baselga & Orme 2012) e iNEXT (Chao et al. 2014).
Resultados
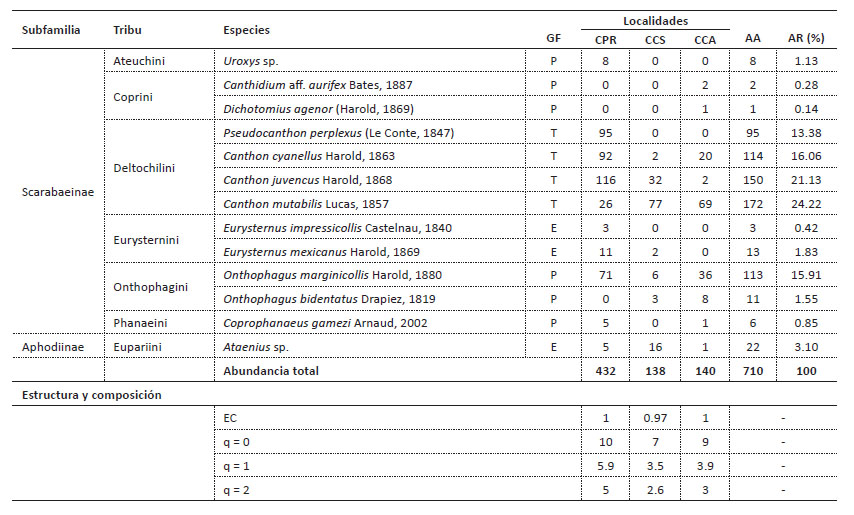
Se recolectaron 710 individuos, que correspondieron a 432 en el CPR, 140 en el CCA y 138 en el CCS; distribuidos en ocho tribus, nueve géneros y 13 especies. Los géneros más representativos fueron Canthon Hoffmannsegg, 1817 con tres especies (n= 436; 61.41%), seguido de Onthophagus Latreille, 1802 (n=124; 17.46%) y Eurysternus Dalman, 1824 (n=16; 2.25%) con dos especies cada uno. Especies como Canthidium aff. aurifex Bates, 1887, Dichotomius agenor (Harold, 1869), Coprophanaeus gamezi Arnaud, 2002, y Eurysternus impressicollis Castelnau, 1840, se consideraron especies raras con tan solo el 1.7% de la abundancia total (Tabla 1).
La representatividad del muestreo fue alta (mayor de 97%), con valores del estimador de cobertura (EC) que oscilaron entre 0.97 y 1, indicando una probabilidad menor a 0.03 de encontrar una especie no colectada en los sitios de estudio si se realizan más muestreos o captura de individuos (ECCPR: 1; ECCCS: 0.97 y ECCCA: 1) (Figs. 2 y 3, Tabla 1).
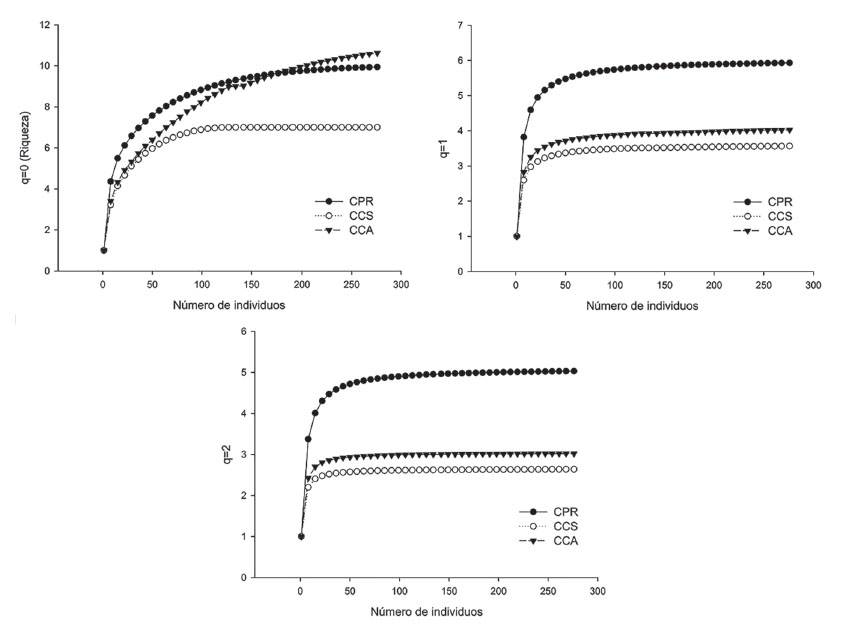
Figura 2 Curvas de rarefacción y extrapolación basadas en el número total de individuos para los diferentes órdenes de diversidad “q” en los campus de la Universidad de Sucre, Colombia. CPR: campus Puerta Roja, CCS: campus Ciencias de la Salud, CCA: campus Ciencias Agropecuarias.
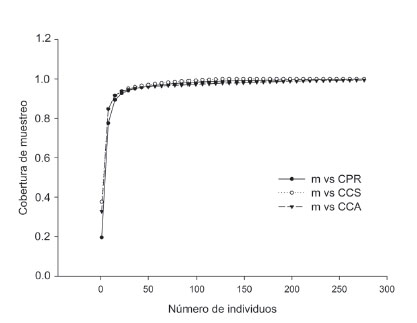
Figura 3 Curva de rarefacción y extrapolación basada en el número de individuos para la cobertura de muestreo en los campus de la Universidad de Sucre, Colombia. CPR: campus Puerta Roja, CCS: campus Ciencias de la Salud, CCA: campus Ciencias Agropecuarias.
Tabla 1 Listado de especies y estructura y composición (números de Hill) del ensamble de escarabajos coprófagos en los campus de la Universidad de Sucre, Colombia. GF: gremio funcional; P: paracóprido; T: telecóprido; E: endocóprido. CPR: campus Puerta Roja; CCS: campus Ciencias de la Salud; CCA: campus Ciencias Agropecuarias; AA: abundancia absoluta; AR: abundancia relativa; EC: estimador de cobertura.
El ensamble más diverso en cualquiera de los tres órdenes de “q” se encontró en CPR, seguido por CCA, y el ensamble menos diverso se encontró en CCS. La pendiente de los perfiles indica que el ensamble encontrado en CCA presenta menos equidad en términos de abundancia de individuos que los encontrados en CPR y CCS (Fig. 4).
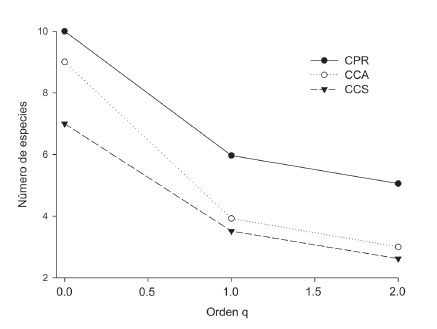
Figura 4 Perfil de diversidad para el ensamble de escarabajos coprófagos en los campus de la Universidad de Sucre, Colombia. CPR: campus Puerta Roja; CCS: campus Ciencias de la Salud; CCA: campus Ciencias Agropecuarias.
La especie Canthon mutabilis Lucas, 1857 dominó la abundancia en los campus CCS y CCA, mientras que en el campus CPR se observó mayor equidad entre las especies más abundantes, con mayor presencia de Canthon juvencus Harold, 1868, Pseudocanthon perplexus (Le Conte, 1847), Canthon cyanellus Harold, 1863, y Onthophagus marginicollis Harold, 1880 (Fig. 5).
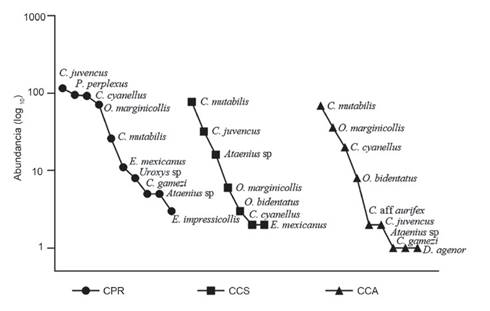
Figura 5 Gráfico rango-abundancia del ensamble de escarabajos coprófagos en los campus de la Universidad de Sucre, Colombia. CPR: campus Puerta Roja; CCS: campus Ciencias de la Salud y CCA: campus Ciencias Agropecuarias.
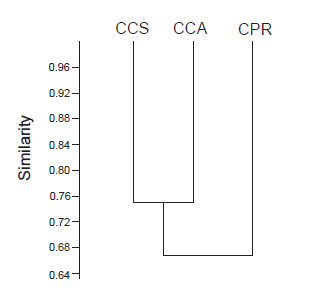
El índice de similitud de Sorensen arrojó una similitud total entre los tres campus del 38%, de la cual un 27% es explicado por el recambio entre especies del ensamble y un 10% se explica por fenómenos de anidamiento de diversidad (Bsor=0.38; Bsim= 0.27; Bnes=0.1). De igual manera, se observó que CPR comparado con CCS y CCA compartieron un valor del 63%, mientras que estos dos últimos compartieron un 75% (Fig. 6).
Discusión
El aislamiento y la reducción de las coberturas naturales alteran los ensambles de especies de escarabajos coprófagos, reduciendo la posibilidad de supervivencia de las especies menos tolerantes a dichos cambios (Filgueiras et al. 2011). El crecimiento de las ciudades y la falta de planeación para generar espacios verdes efectivos, conducen a escenarios extremos donde las especies de escarabajos se enfrentan a una combinación de factores negativos, a los que solo unas pocas especies pueden sobrevivir, llevando a una marcada disminución de la riqueza y abundancia (Salomão et al. 2019). Los resultados obtenidos en este estudio reflejan lo que otros trabajos sobre biodiversidad urbana han encontrado, la extensión de las áreas verdes y la ubicación/aislamiento de estas llevan a una disminución de la diversidad. El campus CCS fue el sitio de muestreo más central en la ciudad y con menor extensión de áreas verdes, el cual registró tres especies efectivas menos y el 9% de la abundancia con respecto al CPR. Korasaki et al. (2013) encontraron resultados similares, donde el área verde más aislada presentó una menor riqueza biológica, pero en este caso todas son especies comunes en áreas altamente perturbadas (Barraza et al. 2010).
La composición de las especies de escarabajos en los sitios de muestreo es un reflejo de la capacidad de cada una de ellas para sobrevivir a las condiciones en las que se encuentran, comportándose como especies altamente tolerantes. La distribución de la abundancia de los escarabajos puede representar un reajuste de la dominancia de las especies como respuesta a la disponibilidad de recursos, a las condiciones ambientales (Amell-Caez et al. 2019) o a la presencia o ausencia de otras especies con las que deben competir. Las especies C. cyanellus, C. juvencus y C. mutabilis se encontraron en los tres sitios de muestreo con altos valores de abundancia, esto demuestra su tolerancia a distintos grados de intervención humana en el hábitat; además, se evidenció su hábito copro-necrófago y su eficiencia en la explotación de los recursos alimenticios, pues estas especies fueron atraídas por los dos tipos de cebo utilizados. Algunos estudios consideran a las especies de Canthon como típicas del bosque seco, su dominancia se atribuye a sus hábitos generalistas y a que son moradores de bosques en diferentes estados de conservación (Navarro et al. 2011, Noriega et al. 2013).
La especie O. marginicollis se encontró en las tres áreas de estudio, con mayor abundancia en CPR; de acuerdo con lo registrado por Barraza et al. (2010) y Navarro et al. (2011) esta especie se ha capturado en lugares abiertos, específicamente en zonas de uso ganadero, incluso en un mayor número que en áreas de BsT. La presencia de O. marginicollis en todos los puntos muestreados también se debe a su hábito generalista, con una amplia preferencia por excrementos de cerdo, vaca, mono aullador y humano (Escobar 1997, Rangel et al. 2012). El comportamiento generalista les concede a estas especies de escarabajos la ventaja de poder establecerse en diferentes lugares, ambientes perturbados, bordes de fragmentos y pastizales (Hanski & Cambefort 1991).
Los lugares con alta intervención humana y poca cobertura vegetal estuvieron representados en su mayoría por especies de tamaño pequeño, con capacidad de sobrevivir con escasos recursos, mientras que la presencia de taxones como P. perplexus y Uroxys sp., aunque también son de tamaño pequeño, solo se encontraron en el sitio de muestreo CPR (Tabla 1), lugar con mayor cobertura vegetal y con presencia de escarabajos de gran tamaño y con alta capacidad de vuelo como C. gamezi, los cuales requieren de ambientes amplios que les aporten la cantidad suficiente de recursos alimenticios (Gámez & Acconcia 2009).
En dos de los sitios de muestreo, CPR y CCA se evidenció la presencia de heces de Bos taurus Linnaeus 1758 (vaca), Iguana iguana Linnaeus 1758 (iguana) y Canis lupus familiaris Linnaeus 1758 (perro), mientras que en CCS solo de C. lupus familiaris. El uso de excretas de perros por escarabajos coprófagos ha sido documentado por Cave (2005) y Carpaneto et al. (2005), así como el uso del excremento de vaca (Tovar et al. 2016); lo anterior indica que estas heces pueden ser usadas como una fuente potencial de alimento para los escarabajos en las zonas urbanizadas.
La mayor abundancia de telecópridos encontrada en las tres zonas urbanizadas estudiadas es un resultado diferente a lo reportado en estudios realizados en bosques secos de Colombia (Martínez et al. 2010, Delgado et al. 2012, Martínez et al. 2012, González-Alvarado et al. 2015, Rangel-Acosta y Martínez 2017). El cambio en la estrategia dominante de relocalización indica una modificación profunda en la organización de las especies y por lo tanto en la funcionalidad ecológica que estas cumplen (Sarmiento-Garcés & Hernández 2021). En general todas las especies de bosques secos tienen cierta capacidad de tolerar los disturbios antrópicos debido, al menos en parte, a que el efecto de dichos disturbios sobre la temperatura es semejante a las condiciones del bosque seco durante el largo verano (Pizano & García 2014). Esta es una razón por la que la composición de especies presentes en estos bosques es similar entre áreas con diferente grado de disturbio (Rangel-Acosta & Martínez 2017), y se tienden a mantener las proporciones entre el número de especies de cada uno de los hábitos de relocalización. En el caso del presente estudio, en el que los telecópridos son dominantes, es difícil aceptar la existencia de un gremio trófico tradicional donde mayormente son las especies paracópridas las que dominan el ensamble (Moreno et al. 2007), y se necesita más información para establecer si las especies encontradas son especies visitantes o residentes, al menos en la zona con menos vegetación y mayor grado de disturbio. Adicionalmente, las especies detectadas son todas de pequeño tamaño (menos de 2 cm) a excepción de C. gamezi y D. agenor y que solo se registraron en las dos zonas con mayor cantidad de remanentes de vegetación nativa. Una ventaja de las especies de tamaño pequeño es que son más eficientes al utilizar pocas cantidades de recurso (Howden et al. 1991, Andresen 2001).
El gremio funcional cavador (paracópridos) presentó la mayor riqueza de especies, lo que también se ha encontrado en otros estudios del neotrópico (Martello et al. 2016, Amell-Caez et al. 2019, Noriega et. al 2021b), sin embargo, al igual que los residentes (endocópridos) presentaron menor abundancia. La desventaja que presenta estos grupos es que en las zonas urbanas los recursos pueden ser limitados y la posibilidad de anidar y establecerse son pocas (Hanski & Cambefort 1991), por tal razón se cree que hubo poca abundancia de estos gremios, lo que puede influir a nivel ecológico en las zonas verdes, pues las especies con hábitos cavadores tienden a remover mayor cantidad de excremento y de suelo.
La sumatoria de factores negativos que se presentan en las ciudades, como la reducción, aislamiento y baja conectividad de las zonas verdes, la polución, el ruido y la luz artificial (Lovett et al. 2009, Fattorini 2011, Proppe et al. 2013) ha llevado a la reducción de la abundancia y a la pérdida sistemática de especies que habitan en ellas, las cuales muestran valores atípicos comparados con áreas mejor conservadas. En nuestro estudio, la composición del ensamble de escarabajos en cada uno de los sitios de muestreo fue dependiente de las condiciones ambientales generales y el grado de perturbación antrópica, los cuales influyen en la disponibilidad de recursos. Este estudio permite evidenciar las especies que pueden ser susceptibles a extinciones locales y aquellas que son altamente tolerantes. Se demuestra que las áreas verdes, así como los parches de vegetación en las ciudades albergan una gran diversidad de especies, como los escarabajos coprófagos, sin embargo, estos se encuentran en constante amenaza, por lo que es fundamental identificar estas áreas funcionales para así entender la ecología de las especies dentro de las ciudades, y promover su preservación y la planificación territorial que garantice su conservación.












 uBio
uBio