Introducción
Las floraciones algales hacen referencia a la proliferación de microalgas, que pueden tener efectos negativos en la acuicultura, pesquería, turismo e importante impacto en la salud humana y medioambiental, denominándose Floraciones Algales Nocivas (FAN) (en inglés: Harmful Algal Blooms o su acrónimo HABs) (Hallegraeff 1993; Zingone & Oksfeldt 2000). Sin embargo, el término FAN ha sido discutido (Smayda 1997) en su significado; y algunos autores utilizan el término “Microalgas Marinas Nocivas” como el más adecuado, el cual permite incluir especies nocivas como Chrysochromulina y Dinophysis, que causan serios efectos ecológicos aun en bajas biomasas, y a otras especies no necesariamente del fitoplancton, como la microalga bentónica Prorocentrum (Hallegraeff 1995). Por otro lado, los eventos FAN se han incrementado en las últimas décadas, debido al incremento de las actividades de acuicultura, la eutrofización, el transporte de quistes en las aguas de lastre, la dispersión natural (Anderson et al. 2008, Glibert 2020), y por el cambio climático (Gobler 2020; Wells et al. 2020).
Dentro de los dinoflagelados, Blixaea quinquecornisGottschling, 2017 (anteriormente denominado como Peridinium quinquecorne) ha sido reportado como especie formadora de floraciones algales alcanzando altas densidades, ocasionando el cambio de coloración del agua de mar y mortandad de peces (Gárate-Lizárraga & Muñetón-Gómez 2008) en diferentes ambientes marinos, pero principalmente en zonas costeras (Y. B. Okolodkov et al. 2016). A nivel mundial se han registrado floraciones de B. quinquecornis en Las Filipinas (Horiguchi 1994, Horstmann 1980); Sudáfrica (Horiguchi & Pienaar 1991); norte de España (Boaich & Orive 1989), costas de Omán (Al-Hashmi et al. 2013), Yemen (Alkawri et al. 2016), en lagunas de manglares de arrecifes de coral en Belice (Faust et al. 2005), costas de México (Alonso-Rodríguez & Ochoa 2004, Barón-Campis et al. 2005, Gárate-Lizárraga & Muñetón-Gómez 2008; Playa et al. 2008; Aké-castillo & Vázquez 2011, Rodríguez-Gómez et al. 2019a, Rodríguez-Gómez 2019b), ambiente estuarino en China (Yu et al. 2009), costas de Egipto (Ismael 2014), el Mar Negro (Krakhmalnyi et al. 2018), en el Pacífico de Panamá (Seixas 2010), y con respecto a Sudamérica ha sido registrado en el caribe colombiano (Lozano-Duque et al. 2011) y en Brasil (Forzza et al. 2010).
La parte norte del Gran Ecosistema de la Corriente de Humboldt frente al Perú se caracteriza por una alta variabilidad ambiental a diferentes escalas espacio-temporales con la presencia de aguas templado-frías, intenso afloramiento, una zona mínima de oxígeno somera, alta productividad primaria, y por la ocurrencia de eventos cálidos El Niño (Chavez et al. 2008). Según Trainer et al. (2010) existen 29 especies algales tóxicas reportadas en zonas de afloramiento costero a nivel mundial, comprendiendo 27 especies de dinoflagelados, diatomeas del género Pseudo-nitzschia spp. y la rafidofícea Heterosigma akashiwo. Asimismo, frente a la costa peruana las FAN son muy frecuentes, especialmente en primavera, verano y eventualmente en otoño. A pesar del ciclo de vida corto de las especies que las forman, estas floraciones algales pueden mantenerse entre días a meses, si las condiciones ambientales óptimas persisten (Sánchez et al. 2004). En particular, frente a Lima, en la zona de Callao, entre los años 1980 y 1995 se han registrado eventos FAN ocasionados por 15 especies, y entre las más frecuentes se mencionan Akashiwo sanguinea, Alexandrium peruvianum y Heterosigma Akashiwo (Sánchez & Delgado 1996).
Los géneros y especies fitoplanctónicas que conforman las FAN en el litoral del Perú son consideradas entre inocuas y nocivas. En general, pueden provocar efectos negativos debido a su alta densidad celular, por ejemplo, la obstrucción de las branquias en peces o causar la anoxia del agua de mar. Mientras que también han sido registradas FAN de especies algales tóxicas en litoral del departamento de Lima: Alexandrium affine, (Huacho, Callao y Miraflores) (Vera et al. 1999), A. minutum (Callao) (Baylón et al. 2015), Azadinium polongum, dinoflagelado no productor de biotoxinas en Chancay (Tillmann et al. 2017), especies nocivas como Akashiwo sanguinea y Heterosigma akashiwo (Chorrillos) (Baylón et al. 2019); al norte del Perú: A. tamyavanichi (Paita y Máncora) (Bárcena-Martinez et al. 2013). Además, han sido reportadas especies de la comunidad fitoplanctónica, pero con bajas biomasas y productoras de biotoxinas como Dinophysis caudata, D. acuminata, Pseudo-nitzschia grupo seriata, Pseudo-nitzschia grupo delicatissima, Alexandrium peruvianum, Gonyaulax spinifera, Azadinium sp., Karlodinium sp., Karenia sp., Protoceratium reticulatum y Prorocentrum cordatum al norte de Lima, en las bahías de Samanco (Chimbote), norte del Perú, Sechura (Piura) y sur de Lima Paracas (Ica) (Ochoa et al. 1999; Sánchez et al. 2017).
Aunque en el Perú las FAN son cada vez más frecuentes en las últimas décadas, existe poca información sobre ellas. Al respecto, el Instituto del Mar del Perú (IMARPE) estableció monitoreos de alta frecuencia en diferentes bahías del litoral para el estudio de eventos FAN y las especies potencialmente tóxicas en la costa peruana, encontrándose en general que la morfología y topografía costera, que asociada con la dinámica oceanográfica y físico química son las que inducen la generación y retención de especies tóxicas en bahías del ecosistema costero peruano (Sánchez et al. 2017). Este monitoreo de alta frecuencia realizado por IMARPE permitió el primer registro de la floración algal del dinoflagelado tecado Blixaea quinquecornis para el mar peruano, la cual en algunos casos coincidió con la floración del dinoflagelado atecado Akashiwo sanguinea, que es muy frecuente en las aguas costeras (Rojas de Mendiola 1979, Chang et al. 2019). El presente trabajo proporciona información sobre Blixaea quinquecornis en el mar peruano, se realiza la determinación taxonómica; así como, la ocurrencia de floración algal nociva de B. quinquecornis asociado a variables ambientales en las principales bahías del norte y centro del Perú.
Material y métodos
Áreas de estudio. - La cobertura geográfica del presente estudio comprendió las bahías de Sechura (Piura), Miraflores (Callao) y Paracas (Pisco) (Fig. 1), en el periodo de 2014 a 2017.
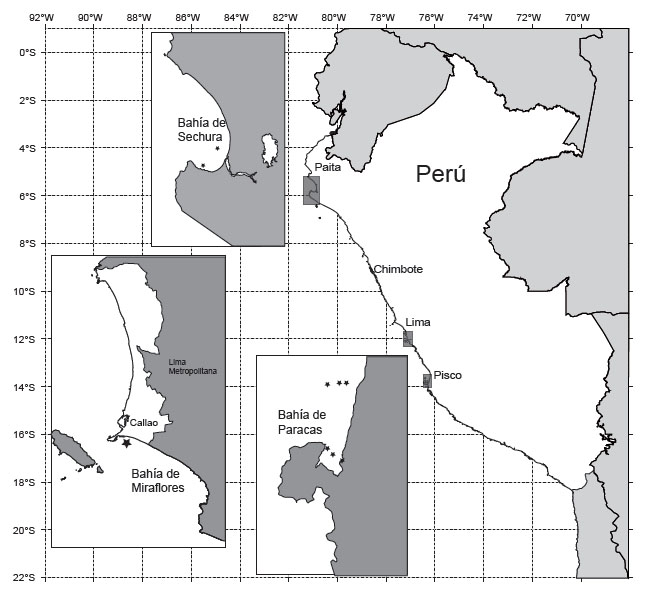
Figura 1 Ubicacion de las estaciones de estudio del dinoflagelado Blixaea quinquecornis, en las Bahías Sechura (Piura), Miraflores (Callao-Lima) y Paracas (Ica).
La bahía de Sechura se ubica en el litoral de la provincia de Sechura, departamento de Piura, entre 05°12’ S y 05°50’ S y de 80°50’ W a 81°12’ W, con una extensión de 1120 km2 es considerada de gran importancia por su alta productividad biológica y gran biodiversidad marina; aquí se desarrolla la maricultura de concha de abanico, Argopecten purpuratus, una actividad extractiva artesanal económicamente importante (Mendo et al. 2008), que ha llegado a representar el 50% de la producción de este molusco en Latinoamérica (Kluger et al. 2019). Los rangos de temperatura superficial del mar (TSM) de la bahía fluctúan entre 15 y 24 °C. El afloramiento es continuo y cerca de la línea costera se registran los valores más elevados de temperatura y oxígeno, con variaciones de la salinidad por efecto de descargas continentales (Morón et al. 2013).
La bahía de Miraflores ubicada entre los 12°03’ S a 12°03’ S y 77°15’ W a 77°01’ W, en el litoral oeste de Lima y al sur de la bahía del Callao, comprende una franja costera de aproximadamente 32.5 km entre La Punta en el extremo norte y La Chira en el extremo sur. Esta bahía es de importancia económica, pesquera y recreativa. Para el estudio de esta bahía el IMARPE ha establecido un punto fijo de muestreo interdiario frente a la playa Carpayo (12°04’09.7” S y 77°09’14.4” W), la cual se caracteriza por su poca profundidad, la comunidad fitoplanctónica dominante de la zona es típica de aguas someras y en ocasiones se observan especies fitoplanctónicas de aguas oceánicas (Kameya et al. 1995).
La bahía de Paracas se encuentra ubicada en el distrito de Paracas de la provincia de Pisco, departamento de Ica, entre los 13°47’2” S y 13°51’5” S y 76°15’0” W y 77°18’5” W, limita por el norte con bahía de Pisco y por el sur con la península de Paracas, tiene una extensión aproximada del borde costero de 24 km, además se encuentra en una zona considerada un área de intenso afloramiento (Strickland et al., 1969, Guillén & Calienes 1981), presenta una profundidad máxima aproximada de 14 m, sin embargo, la mayor parte de la bahía se encuentra a menos de 5 m de profundidad. La bahía presenta flujos de corrientes entrantes y salientes que están verticalmente estratificados desde la superficie hasta el fondo, donde el mayor o menor flujo están relacionados con la intensidad de los vientos.
Colecta de muestras y datos ambientales. - Se recolectaron muestras de agua superficial para análisis cuantitativo y semicuantitativo con red estándar de fitoplancton (75 µm de abertura de malla). Asimismo, se midieron variables ambientales como la TSM, se recolectaron muestras de agua en botellas de 250 mL para los análisis en laboratorio. La salinidad fue determinada utilizando un salinómetro Portasal 8410A, el oxígeno superficial (OSM) fue determinado mediante el método Winkler. Para la medición de nutrientes (nitritos, nitratos, silicatos y fosfatos), los frascos de agua se almacenaron a -20 °C hasta su análisis mediante las metodologías de Strickland y Parsons (1972). Adicionalmente se recolectaron 100 mL de agua de mar para la medición de concentración de Clorofila-a, la cual se determinó mediante la técnica de fluorometría (Strickland & Parsons 1972).
Análisis e identificación taxonómica. - Las muestras de la floración algal de B. quinquecornis fueron colectadas e inmediatamente fijadas con lugol o formalina al 2% concentración final y trasportadas al laboratorio para su análisis. Adicionalmente y con el objetivo de corroborar la presencia de B. quinquecornis como un miembro esporádico de la comunidad fitoplanctónica, la serie de muestras y registros de la estación costera fija (ECF) de la playa Carpayo (bahía de Miraflores) volvieron a ser analizadas para el periodo del año 2014 hasta el 2017.
Para la determinación taxonómica se utilizaron microscopios invertidos Zeiss y Leica DMIL LED, bajo 100X y 200X aumentos. Las muestras fueron tratadas previamente en cámaras de sedimentación de 25 y 50 mL según el procedimiento de Utermöhl (1958). Se realizaron microfotografías utilizando la microscopía de epifluorescencia y la técnica de contraste interferencial (DIC-Nomarski) para la observación de las placas tecales, utilizando aproximadamente 1 mL de muestra y se tiñó con Calcofluor White SM2 (Fritz & Triemer 1985). La distribución y forma de las placas de la teca de B. quinquecornis se observaron con el microscopio invertido de fluorescencia Nikon Eclipse Ti-U equipado con una lámpara UV Nikon Intensilight DS-U3, las imágenes de dichas características fueron capturadas utilizando una cámara Nikon Digital Sight DS-U3.
Para la observación de la morfología externa de los individuos de B. quinquecornis, las muestras fueron fijadas con tetraóxido de osmio y fueron desecadas con la técnica de puntos críticos y se metalizaron con oro para la obtención de microfotografías electrónicas de barrido (MEB) mediante un microscopio TESCAN Vega 3 del Laboratorio de Microscopía Electrónica del Instituto de Patología de la Facultad de Medicina de la Universidad Nacional de San Marcos.
Morfometría. - Se realizaron mediciones de la morfología externa de 40 individuos de B. quinquecorne proveniente de las floraciones algales ocurridas en bahía de Paracas y en la ECF Carpayo (bahía de Miraflores). Las mediciones se realizaron con el programa digital NIS Element-D de NIKON. La longitud se midió desde el extremo apical al antapical sin considerar las espinas y otra medida considerando las espinas, así como el transdiámetro sin considerar las crestas. Los promedios se presentan entre paréntesis acompañados del error estándar.
Análisis estadístico. - Las muestras utilizadas para el análisis estadístico fueron tomadas de la serie de la ECF Carpayo entre julio del 2015 y mayo del 2016, solo fueron consideradas las fechas que contenían todos los datos de parámetros fisicoquímicos completos. Con el fin de establecer las relaciones del ambiente con la presencia de B. quinquecornis y la comunidad acompañante se realizó un Análisis de Coinercia (COIA) (Dolédec & Chessel 1994; Dray et al. 2003), previamente se eliminaron las especies que tuvieron menos del 5% de frecuencia relativa y se eliminaron una especie muy abundante de diatomea como Chaetoceros affinis y fitoflagelados como Heterosigma akashiwo para evitar sesgos en el análisis. El análisis fue realizado mediante la biblioteca “ade4” del software R (R Core Team 2021, Bougeard & Dray 2018, Dray & Dufor 2007).
Resultados
Taxonomía
Clase: Dinophyceae
Orden: Peridiniales Haekel
Familia: Kryptoperidiniaceae F.R Lindemann
Género: Blixaea Gottschling
Blixaea quinquecornis (T.H.Abé) Gottschling
Basionimio: Peridinium quinquecorne T.H.Abé.
Morfología. - El dinoflagelado tecado Blixaea quinquecornis se caracteriza por presentar células solitarias de tamaño y forma variable, dependiendo de la etapa de crecimiento de ésta, observándose formas pequeñas y alargadas cuando son células de escasa edad, la hipoteca se hace más ancha y redondeada cuando son adultas, posee varios cloroplastos y una característica mancha ocular (eyespot) de color rojizo (Fig. 2). La célula posee una epiteca cónica cuyo ápice posee una pequeña espina apical, la hipoteca es redondeada y posee 4 espinas antapicales, aunque en ocasiones se han observado 5 espinas, en general la distribución de las placas de la epiteca fue de 3 placas apicales, 2 placas intercalares y 7 placas pre-cingulares coincidiendo con la fórmula tecal propuesta por Abé (1981): pp, 3’, 2a, 7’’,5c, 5”’ y 2’’’ 4s, la placa epitecal 2a es la más grande y tiene forma heptagonal, a su izquierda se encuentra una pequeña placa intercalar 1a de forma pentagonal (Fig. 3).

Figura 2 a) Individuos de Blixaea quinquecornis, se muestra la variación en tamaño, b) Individuo “maduro” de B. quinquecornis las flechas señalan 4 espinas.
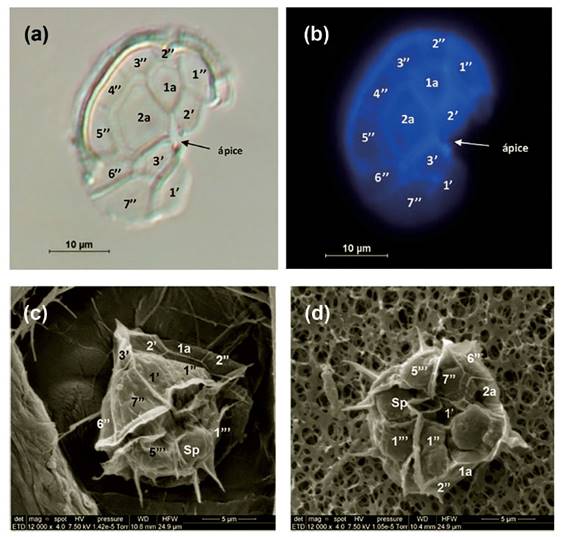
Figura 3 Microfotografías de Individuos de Blixaea quinquecornis mostrándose la distribución de las placas epitecales. a) Técnica de microscopía de Contraste Diferencial Interferencial (DIC Nomarski), b) Técnica de Epifluorescencia con Calcofluor White; c y d) Individuo de B. quinquecornis vista ventral a Microscopia electrónica de barrido (MEB).
Morfometría. - Las medidas de los individuos observados en la bahía de Paracas (Pisco) estuvieron en un intervalo de 19.29 - 27.84 µm de longitud (23.32 ± 2.25 µm) y de 14.74 a 23.9 µm de transdiámetro (19.34 ± 2.47); mientras que, en la ECF Carpayo (bahía de Miraflores) se observaron individuos “maduros” con longitud y transdiámetro promedio de 34.75 µm y 27.79 µm, respectivamente.
Variables ambientales asociadas. - En la Tabla 1 se muestran los registros de B. quinquecornis, abundancia y las variables ambientales asociadas en las 3 bahías estudiadas. En la ECF Carpayo (bahía de Miraflores) se registró una pequeña floración el día 06 de febrero 2016, con una densidad de 32760 cel.L-1, el reanálisis de muestras colectadas permitió determinar que a finales de enero ya había registro de B. quinquecornis con abundancia de 3160 cel.L-1. Los registros de la comunidad fitoplanctónica en el área nos permitieron determinar que B. quinquecornis permanece a concentraciones no detectables o en alguna etapa de resistencia (quiste) incluso desde enero del 2014 con una densidad celular del 720 cel.L-1, asociada a una TSM de 22.4 °C, salinidad de 34.83 ups y OSM de 5.62 mg L-1. La floración de B. quinquecornis estuvo asociada a una TSM de 24.7 °C, salinidad de 35.12 ups y pH de 5.75, y ocurrió en simultáneo con la FAN de A. sanguinea que desarrolló abundancias de hasta 7 x 106 cel.L-1. En la Figura 4 se muestran las abundancias de ambas especies en escala logarítmica entre enero 2014 a mayo 2017.
Tabla 1 Ocurrencias de Blixaea quinquecornis en las bahías de Sechura, Paracas y Miraflores, se muestran las concentraciones celulares y variables fisicoquímicas asociadas.
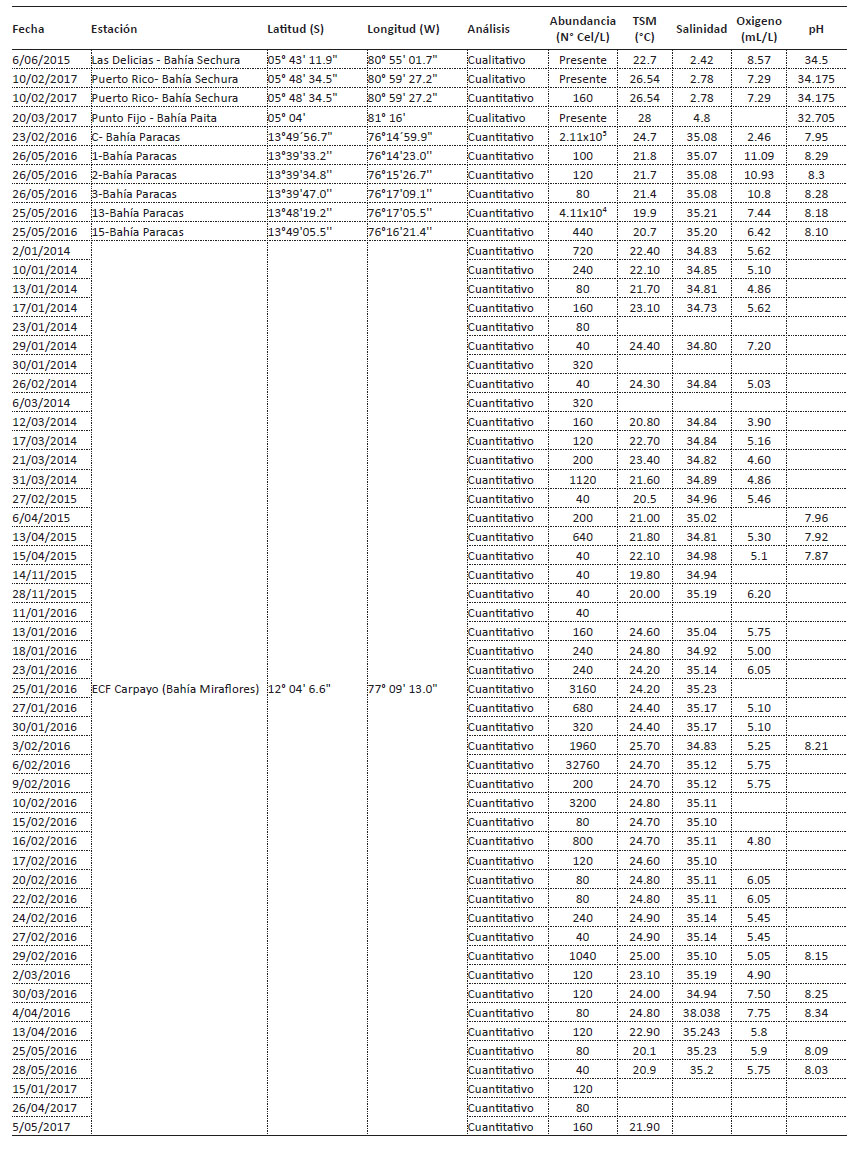
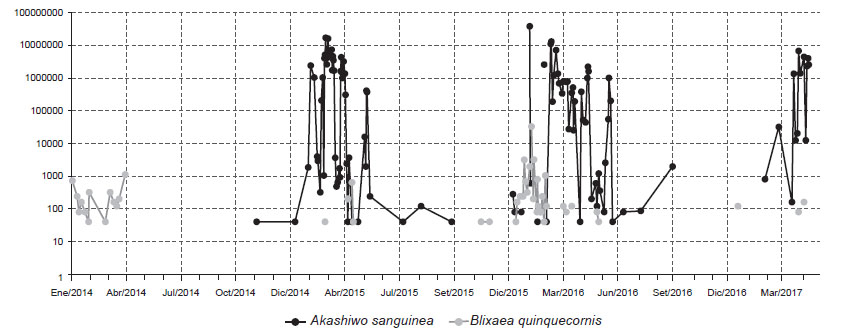
Figura 4 Concentración celular de Blixaea quinquecornis y Akashiwo sanguinea (Log Cel.L-1) desde abril del 2014 a mayo del 2017 en la estación costera fija Carpayo (bahía Miraflores, Callao).
En Bahía Paracas, B. quinquecornis provocó una floración algal importante el 23 de febrero de 2016, con una concentración de 2.11 x 105 cel.L-1, la coloración fue marrón y tuvo una extensión aproximada de 3.5 km2. El 25 y 26 de mayo del 2016, se tomaron muestras en 12 estaciones de la bahía de Paracas, observándose esta especie en 5 de ellas. La concentración máxima de B. quinquecornis se registró en la estación 13 (ver Tabla 1) esta floración alcanzó una densidad de 4.11 x 104 cel.L-1 y se observó simultáneamente una marea roja de A. sanguinea (1.93 x 105 cel.L-1), la marea tuvo una extensión aproximada de 4.1 km2. Tanto en febrero como en mayo, por acción del viento las mareas fueron desplazadas hacia el sur de la bahía (playas Santo Domingo, La Aguada, Cangrejal y Sequión). En mayo se observaron daños al ambiente marino, percibiéndose emisiones fétidas, como consecuencia de la mortandad algal, sin embargo, no hubo registro de intoxicación humana por consumo de alimentos marinos (peces y mariscos).
El 19 de enero del 2017, se produjo una mortandad de peces y algunos moluscos en la bahía de Paracas, estación de monitoreo P4 (13°47’46.2” S, 76°14’34.7” W) (ver Tabla 1) al analizar las muestras de fitoplancton se encontraron especies potencialmente tóxicas como Gymnodinium sp. (1.1 x 106 cel.L-1) y B. quinquecornis en una densidad de 9400 cel.L-1. Los parámetros fisicoquímicos asociados fueron TSM 21.8 °C, pH 7.65 y OSM 5.38 mg/L, las razones de la varazón no fueron determinadas.
En la bahía de Sechura (Piura, 05°S), se tuvieron pocos registros de B. quinquecornis como se muestra en la Tabla 1. Se registró en otoño del 2015, en la estación Las Delicias, asociada a valores de TSM 22.7 °C, OSM 2.42, pH 8.57, y salinidad 34.5 ups, colectada en una muestra de red y en escasa cantidad. En febrero del 2016 se registró también en la zona de Puerto Rico (05°48’34.5” S, 80°59’27.2” W) con una densidad de 160 cel/L.
La Figura 5b muestra que el primer y el segundo axis del análisis de Co-Inercia explican el 77.382 % de la inercia entre las tablas abiótica y biótica (variables fisicoquímicas y las abundancias de especies de fitoplancton). Los parámetros (autovalores) que explican la estructura según la tabla abiótica fueron la temperatura superficial (SST) y los silicatos (Fig. 5c derecha), se observa que la SST se relaciona inversamente con los nitratos, pero directamente con la salinidad. En la Figura 5c izquierda se observa que B. quinquecornis, Scripsiella trochoidea, Pseudo-nitzschia grupo delicatissima, Cerataulina pelagica están relacionadas y a su vez tienen una relación directa con la elevación de la SST; mientras que Akashiwo sanguinea se observa en una posición que la relaciona directamente con la concentración de fosfatos y oxígeno superficial. En la Figura 5c izquierda, se observa que las especies Entomoneis alata, Eucampia zoodiacus, Asterionellopsis glacialis y Dactyliosolen fragilissimus, especies comunes de masas de agua frías, se relacionaron inversamente con la elevación de la temperatura y directamente con la concentración de nitratos, condiciones típicas de aguas de afloramiento. La Figura 5d explica las relaciones entre la comunidad de fitoplancton en cada fecha de muestreo (números) y parámetros fisicoquímicos del agua, las fechas de muestreo encerradas en el área roja están determinadas por la presencia y mayor abundancia de A. sanguinea, mientras que las flechas encerradas en el área azul se asocian con presencia y mayor abundancia de B. quinquecornis (semejante que el gráfico 5c izquierdo); a su vez están estos dos grupos diferenciados por su correlación con la temperatura (área azul) y concentración fosfatos (área roja).
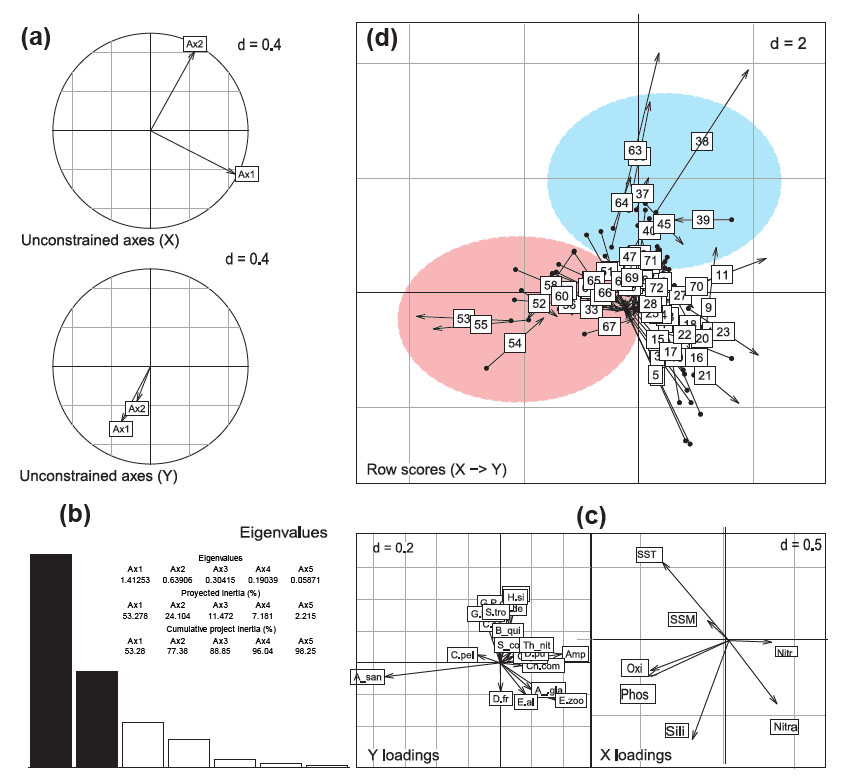
Figura 5 Gráfico de análisis de co-inercia (COIA) para variables ambientales y abundancia de especies de fitoplancton incluyendo a Blixaea quinquecornis (B_qui). (a) Proyecciones de los ejes principales de las dos tablas sobre los ejes del análisis de co-inercia, X: a partir de datos ambientales, Y: a partir de datos de abundancia; (b)Autovalores; (c) coeficientes de las combinaciones de las variables de cada tabla para definir el COIA. Leyenda de especies: Amp = Amphiprora sp., A_san = Akashiwo sanguinea, A_gla = Asterionellopsis glacialis, B_quin = Blixaea quinquecornis, C_pel = Cerataulina pelagica, D.fr = Dactyliosolen fragilissimus, E.al = Entomoneis alata, E.zoo = Eucampia zoodiacus, Ch.comp = Chaetoceros compressus, D.pu = Detonula pumila, H.si = Hemiaulus sinensis, G.P.de = Grupo Pseudo-nitzschia delicatissima, G. P.se = Grupo Pseudo-nitzschia seriata, S.tro = Scripssiella trochoidea, S_cos = Skeletonema costatum. (d) Fechas de muestreo (periodo del julio 2015 a mayo 2016), el comienzo de la flecha es la posición del sitio descrito por el conjunto de datos ambientales y el final descrito por la abundancia.
Discusión
Análisis taxonómico. - Blixaea quinquecornis (Abé, 1927) Gottschling, 2017 (antes denominado Peridinium quinquecorne) es un dinoflagelado tecado que presenta una amplia variación en la forma y tamaño del cuerpo, posee compresión dorso-ventral, la epiteca es cónica y posee una espina corta, la hipoteca es hexagonal con lados medios convexos y siempre posee 4 espinas (Horiguchi & Pienaar 1991). Esta especie es principalmente marina y alberga una diatomea central tipo Chaetoceros como endosimbionte, que está separada del huésped por una membrana de unidad única (Horiguchi & Takano 2006).
Balech (1974) transfirió a Peridinium quinquecorne al género Protoperidinium proponiendo una nueva combinación, Protoperidinium quinquecorne (Ábe) Balech, nombre científico que aún es utilizado por algunos investigadores como un sinónimo de Peridinium quinquecorne. Posteriormente, basados en un análisis detallado de la morfología y ultraestructura, Horiguchi y Pienaar (1991) sustentaron la retención de esta especie en el género Peridinium basados en el número y conformación de placas epitecales y cingulares.
Por otro lado, el nombre de Heterocapsa quadridentata ha sido mencionado como especie con-especifica de Peridinium quinquecorne Abé (Abé 1927, 1981; Horiguchi & Pienaar 1991) (basionimio Heterocapsa quadridentata Stein 1883; p. 13, Tab. IV, fig. 3). La sinonimia de P. quinquecorne T. Abé, 1927 a Heterocapsa quadridentata F. Stein, 1883 casi siempre se ha evitado en la literatura publicada. Hansen (1995) discute la ubicación genérica de todas las especies de Heterocapsa sp. dando como resultado la reubicación de H. quadridentata al nombre de Peridinium quadridentatum (Stein) comb. nov, aunque el mismo autor señala que dicha especie no pertenecería al género Peridinium debido a su peculiar distribución de placas. Finalmente, Gottschling et al. (2017) aportaron un mejor conocimiento sobre la sistemática filogenética de este dinoflagelado mediante la técnica de concatenación de secuencias de ARN ribosómico dando como resultado la creación de un nuevo género “Blixaea” al cual fue trasferida la especie tomando el nombre científico actual de B. quinquecornis.
Los resultados de este estudio confirman la presencia de B. quinquecornis en el litoral peruano, la distribución de las placas de la teca de importancia taxonómica está de acuerdo con la descripción de Abé (1981) (fórmula tecal: pp, 3’, 2a, 7’’,5c, 5”’ y 2’’’ 4s) y Gottschling et al. (2017). En la Figura 3b se observan las 4 espinas en la hipoteca de B. quinquecornis lo que concuerda con la descripción de Abé (1927,1981) y Horiguchi & Pienaar (1991). No obstante, difiere de Aké-Castillo & Vázquez (2011) que propusieron la variedad Peridinium quinquecorne var. trispiniferum, debido a que observaron individuos con 3 espinas rígidas y 2 pequeñas espinas laterales.
Biometría. - Las medidas de los individuos de B. quinquecornis (bahía de Paracas) fueron ligeramente de menor tamaño que los individuos observados en la ECF Carpayo (bahía de Miraflores) donde se observaron individuos de mayor tamaño (longitud: 34.75 µm, ancho: 27.79 µm) las diferencias podrían atribuirse a la etapa del crecimiento celular. Sin embargo, las medidas de los individuos de bahía de Paracas son similares con los resultados de otros autores como en bahía Maribago (Filipinas) con longitud en el rango de 20 - 35.0 µm y de ancho 17.5 - 30.0 µm (Horstmann 1980), en las lagunas costeras Al Hodeidah y Khor Al-Khateeb (Yemen) la longitud de B. quinquecornis fue de 21 - 38 µm y de ancho 17 - 30 µm (Alkawri et al., (2016), en Veracruz (México) Barón-Campis et al. (2005) encontraron la longitud en el rango de 13.5 - 33.9 µm (media de 24.5 µm) y ancho de 12.2 - 29.3 µm (media de 20.3 µm) y Okolodkov et al. (2016) en el Golfo de México (México) se observaron células con una longitud en el rango de 17.5 - 28.8 µm (23.22+/-2.37 µm) y de ancho 16.3 - 25.0 µm (20.26+/-2.46). En la descripción original de Abé (1927) se reporta la longitud excluyendo espinas de 30 µm y transdiámetro o ancho de 26 µm, pero debe tenerse en cuenta que Abé refiere que tuvo poco material para examinar, además las medidas morfométricas dependen de factores medioambientales que influyen en la fisiología de los individuos.
Aspectos relacionados a las variables ambientales. - Blixaea quinquecornis es un dinoflagelado autótrofo de vida libre, generalmente marino (Gottschling et al. 2017). Según Okolodkov et al. (2016) B. quinquecornis tiene una distribución nerítica tropical-boreal, con distribución hacia los polos tanto en el hemisferio norte como en el sur y habita aguas salobres tanto marinas como estuarinas. Es una especie asociada a altas temperaturas como las de Filipinas, donde se presentaron floraciones en el verano con salinidades de 35 a 37 ups y temperaturas de 26 a 28 °C; aunque en zonas someras la temperatura puede llegar hasta 38 °C, coincidiendo con la mayor abundancia de esta especie (Horstmann 1980). En Yemen la FAN de B. quinquecornis fue reportada en temperaturas entre 33 a 34 °C y salinidad de 36.0 ups, donde la alta concentración de células (14.3 x 106 cel.L-1) disminuyó el oxígeno disuelto a 1.9 mL/L, lo que causó gran mortandad de peces por asfixia, un hecho similar al ocurrido en la bahía de Paracas en enero del 2017.
Blixaea quinquecornis es una especie que también ha sido reportada flotando entre el detritus (Okolodkov et al. 2016), las células están adaptadas tanto floraciones algales bentónicas como a las planctónicas de aguas tropicales poco profundas. En Brasil, se registró que las células toleran altas temperaturas (38 a 42 °C) (Faust et al. 2005), además están adaptadas a ambientes eurihalinos tropicales, eutróficos y someros donde suelen desarrollar floraciones e incluso proliferan en ambientes con contaminación (Horstmann 1980).
La presencia y proliferación de B. quinquecornis en las bahías estudiadas se relacionó con incremento en la temperatura habituales para las zona (mayores a 20 °C) principalmente en verano y especialmente durante eventos cálidos tipo El Niño, y en el caso de bahía de Miraflores también se asoció, aunque con menor proporción, con un aumento en la salinidad, esta bahía no recibe descargas de ríos, lo cual puede tener un fuerte impacto sobre la distribución vertical de las propiedades del agua y sedimentos con una estratificación en la columna de agua, y que serían características propicias para la generación de las FAN en la zona costera peruana (Sánchez et al. 2019). Según Rodríguez-Gómez et al. (2019a) las floraciones de B. quinquecornis ocurren con incrementos de temperatura mayores a 30 °C y con salinidades menores a 31 ups, en la zona del litoral costero de Veracruz (México), área que está influenciada por periodos de intensas lluvias en verano y fuerte descarga de los ríos, por otro lado se observó la misma tendencia a resistir bajos niveles de nutrientes como el nitrato y fosfato (Fig. 5), debido a que esta especie estaría adaptada a obtener nitrógeno del amonio en ambientes pobres en nitratos y fosfatos (< 1.0 µM) (Rodríguez-Gómez et al. 2019b).
Blixaea quinquecornis, fue observada compitiendo con el dinoflagelado atecado A. sanguinea, una especie frecuentemente observada formando FAN en las bahías Paracas y Miraflores en los meses de verano y otoño. Akashiwo sanguinea alcanza mayores densidades celulares y su floración se prolonga durante más días, según el análisis realizado para bahía de Miraflores. Asimismo, A. sanguinea se asoció con valores altos de fosfatos, y bajos niveles de nitritos y nitratos (Fig. 5), lo que indicaria su mejor adaptación a una disminución de nutrientes. Esta superioridad competitiva podría ser explicada, por la característica mixótrofa de A. sanguinea, es decir que es capaz de de seguir proliferando en ambientes donde los nutrientes son escasos (Burkholder et al. 2008, Badylak et al. 2014). Por otro lado, sumaría el mayor tamaño corporal de A. sanguinea y su mayor tolerancia a eventos ambientales extremos, lo que se refleja en su mayor ocurrencia en rangos más amplios de salinidad y temperatura que B. quinquecornis (Phlips et al. 2011).
Para el Perú, las mayores densidades reportadas en este trabajo (2.11 x 105 cel.L-1) se registraron en los meses de enero y febrero de 2016, con valores de temperatura superiores a 24.7 °C, los cuales son elevados para las zonas en estudio, dicho calentamiento inusual estuvo asociado a la disminución de los vientos durante el evento cálido El Niño 2015-16 (ENFEN 2016), y por lo tanto habría producido la estratificación en la columna de agua y la disminución de nutrientes debido al rápido consumo de la comunidad fitoplanctónica, especialmente diatomeas, lo que se asocia con formación de floraciones algales de dinoflagelados (Smayda & Trainer 2010; Du et al. 2011).
Conclusión
En el presente trabajo se reporta el primer registro de la floración algal de Blixaea quinquecornis principalmente en las bahías de la costa peruana (Miraflores y Paracas), se observaron aguas de color marrón claro de pequeña extensión y corta duración, en la mayoría de los casos fue seguida de una floración de Akashiwo sanguinea. Los máximos picos de abundancia se presentaron a TSM de 24.7 °C y salinidad de 35 ups. En la bahía de Paracas, B. quinquecornis causó mortandad de peces ocasionada por la anoxia generada ya que no se ha reportado ser productor de alguna toxina hasta el momento.
El efecto del cambio climático y la mayor ocurrencia de eventos cálidos El Niño en el ecosistema marino peruano podrían causar la proliferación de nuevas especies formadoras de FAN que en otras latitudes son más frecuentes, como es el caso descrito del primer registro de la ocurrencia de la floración algal de B. quinquecornis en años influenciados con eventos cálidos El Niño 2015-2016 en bahías del litoral peruano.












 uBio
uBio 


