Introducción
Los Pleurobranchida son un grupo relativamente pequeño de babosas marinas conocidas en inglés como "side-gilled sea slugs" por la ubicación de la branquia en el costado derecho del cuerpo, con 93 especies (MolluscaBase 2021) distribuidas en los mares del mundo, incluyendo las zonas polares; pero con una mayor diversidad en aguas costeras tropicales y templadas (Martynov & Schödl 2008, Göbbeler & Klussmann-Kolb 2010). Aunque en la clasificación tradicional de los Gastropoda, los Pleurobranchida se agrupaban con los Umbraculida, formando el orden Notaspidea, dentro de la clase Opisthobranchia; posteriores estudios morfológicos (Wägele & Willan 2000, Wägele & Klussmann-Kolb 2005, Martynov & Schödl 2008) y moleculares (Grande et al. 2004, Vonnemann et al. 2005, Göbbeler & Klussmann-Kolb 2011, Pabst & Kocot 2018) han permitido concluir que los Pleurobranchida son el grupo hermano de los Nudibranquia, formando un clado llamado Nudipleura (Wägele & Willan 2000) convirtiéndose en un grupo crucial para entender la evolución temprana de los nudibranquios (Martynov & Schödl 2008, Göbbeler & Klussmann-Kolb 2010). Los Pleurobranchida también son conocidos por la secreción ácida que varias especies utilizan como mecanismo de defensa (Gillette et al. 1991, Wägele et al. 2006, Wägele et al. 2017) y por su creciente uso como organismos modelo en neurobiología (Gillette & Brown 2015).
Actualmente se reconocen 3 familias dentro de los Pleurobranchida: Pleurobranchidae Gray 1827, Pleurobranchaeidae Pilsbry 1827, y la recientemente descrita Quijotidae Ortea, Moro & Bocallado 2016; habiéndose reportado para el Pacífico Oriental especies de las 2 primeras familias. La familia Pleurobranchaeidae está representada en la región por una única especie, Pleurobranchaea californicaMacFarland 1966; mientras que la familia Pleurobranchidae es mucho más diversa en el Pacífico Oriental con 3 géneros y varias especies reportadas, principalmente para la Provincia del Pacifico Oriental Tropical (ver Tabla 1). En los últimos años se ha incrementado el conocimiento de la diversidad de los Pleurobranchida en el Pacífico Oriental (Hermosillo & Valdés 2008, Ortea et al. 2014, Goodheart et al. 2015, Araya & Valdés 2016, Ghanimi et al. 2020a y b), sin embargo, para Perú solo se ha mencionado la posible presencia de Berthellina ilisima Marcus & Marcus, 1967 en Piura e Isla Foca (Piura), en reportes informales sin descripciones ni ilustraciones.
El género Berthellina está formado por animales anaranjados-rojizos de distribución circumtropical (Moustafa et al. 2018) y en años recientes han recibido bastante interés con la descripción de varias especies nuevas para Cabo Verde en el Atlántico (Ortea et al. 2014), islas Galápagos en el Pacífico Oriental (Ortea et al. 2014) y Brasil (Alvim & Pimenta 2015), por lo que el número de especies a nivel mundial es incierto y se ha sugerido la necesidad de una revisión sistemática del género en varias regiones del mundo (Moustafa et al. 2018). Alvim y Pimenta (2015) realizaron una revisión detallada de la anatomía de Berthellina, remarcando que en el pasado muchas veces se ha extendido el rango de distribución de una especie sin agregar información morfológica, la cual ayudaría a facilitar la comparación y delimitación de especies, como se ha comprobado en otros géneros de Pleurobranchida como Pleurobranchaea (Alvim et al. 2014), Pleurobranchus (Alvim & Pimenta 2016, Moustafa et al. 2018), Berthella (Alvim & Pimenta 2015, Ghanimi et al. 2020a y b), o la misma Berthellina (Alvim & Pimenta 2015), en donde se ha utilizado información morfológica o una combinación de datos morfológicos y moleculares para diferenciar las especies.
El objetivo de este trabajo es registrar por primera vez y describir la anatomía de Berthellina ilisima con el fin de incrementar el conocimiento de esta especie en la región del Pacifico Oriental.
Tabla 1 Especies de la familia Pleurobranchidae reportadas para el Pacífico Oriental.
| Especies | Distribución en el Pacífico Oriental | Referencias |
|---|---|---|
| Pleurobranchus digueti Rochebrune, 1895 | California, EE. UU. a Ecuador | Valdés 2019, Goodheart et al. 2015 |
| Berthella chacei (Burch, 1944) | Norte de California. También distribuida en Rusia | Ghanimi et al. 2020a |
| Berthella californica (Dall, 1900) | Sur de California, EE. UU. a Panamá; reportes previos no corroborados para las islas Galápagos, Ecuador | Ghanimi et al. 2020a, Camacho-García et al. 2005 |
| Berthella andromeda Ghanimi, Schrödl, Goddard, Ballesteros, Gosliner & Valdés, 2020 | Baja California, México y posiblemente Costa Rica | Ghanimi et al. 2020b, Camacho-García et al. 2005 |
| Berthella strongi (MacFarland, 1966) | California, EE. UU. a Baja California, México | Ghanimi et al. 2020b, Valdés 2019 |
| Berthella martensi (Pilsbry, 1896) | Baja California, México a Panamá. También distribuida en el Indo-Pacífico | Gosliner y Bertsch 1988, Camacho-García et al. 2005 |
| Berthella grovesiHermosillo & Valdés, 2008 | México a Panamá | Hermosillo & Valdés 2005 |
| Berthella agassizii (MacFarland, 1909) | Baja California, México | Gosliner y Bertsch 1988 |
| Berthella schroedliAraya & Valdés, 2016 | Atacama, Chile | Araya y Valdés 2016 |
| Berthella platei (Bergh, 1898) | Centro sur de Chile. También se distribuye en Argentina | Schrödl et al. 2005 |
| Berthellina ilisima Marcus & Marcus, 1967 | California a las Islas Galápagos, Ecuador | Valdés 2019 |
| Berthellina barquiniOrtea, 2014 | Islas Galápagos, Ecuador | Ortea et al. 2014 |
| Berthellina magmaOrtea, 2014 | Islas Galápagos, Ecuador | Ortea et al. 2014 |
Material y métodos
Se colectaron 2 ejemplares provenientes de Tumbes, Perú en julio 2018 y se encuentran depositados en la colección del Laboratorio de Biología y Sistemática de Invertebrados Marinos (LaBSIM) de la Facultad de Ciencias Biológicas, UNMSM. Los ejemplares examinados fueron fotografiados con una cámara digital Nikon Coolpix P90, y se realizó una disección anatómica detallada con un microscopio estereoscópico Leica S APO/ LED2500. Se utilizaron las siguientes abreviaturas anatómicas: ab.f, abertura femenina; ab.p, abertura prebranquial; am, ampolla; an, ano; ar, arteria radular; au, aurícula; br, branquia; bc, bursa copulatrix; c.clb, conectivo cerebropleural-bucal; c.pd, comisura pedal; ca, canal oral; cd.ac, conducto de la glándula ácida; cd.df, conducto deferente; cd.s, conducto salival; cg, collar genital; co, concha; es, esofago; et, estómago; ga.b, ganglio bucal; ga.cl, ganglio o complejo cerebropleural; ga.p, ganglio pedal; gl.d, glándula digestiva; gl.f, glándula femenina; gl.h, glándula hermafrodita; gl.p, glándula del pene; gl.sg, glándula sanguínea; gl.sl, glándula salival; in, intestino; m1d, músculos yugales dorsales; m4, músculos dorsales tensores de la rádula; m5, músculos dorsales tensores auxiliares; m10v, músculos ventrales protractores; ma, manto; mj, músculo de la mandíbula; mr, músculo retractor; nB, nervios del ganglio bucal; nCL, nervios del ganglio cerebropleural; nP, nervios del ganglio pedal; nR, nervios rinóforales; oj, ojo; pi, pie; pc, pericardio; pp, papila penial o pene; pr, próstata; ri, rinóforo; rs, receptáculo seminal; sr, saco radular; va, vagina; ve, ventrículo; vl, velo oral.
Sistemática y taxonomía
Clase Gastropoda Cuvier, 1795
Subclase Heterobranchia Burmeister, 1837
Superorden Nudipleura Wägele & Willan, 2000
Orden Pleurobranchida Minichev & Starobogatov, 1975
Superfamilia Pleurobranchoidea Gray, 1827
Familia Pleurobranchidae Gray, 1827
Genero BerthellinaGardiner, 1936
Berthellina ilisima Marcus & Marcus, 1967
(Figs. 1-11)
Berthellina engeli: MacFarland 1966: 70-75, Pl. 13, figs. 14-24; Pl. 16, fig. 9.
Berthellina engeli ilisima Marcus & Marcus 1967: 160-163, fig. 18.
Berthellina ilisima: Behrens 2004: 32; Hermosillo 2004: 108; Camacho-García et al. 2005: 72; Valdés 2019: 252, fig. 4B.
Material examinado.- 2 ejemplares, 45-49 mm de longitud; Bonanza Sur, Tumbes, Perú, 03°44'28.6''S, 80°46'44.8''W, 2 m; col. Alexander Alemán, 20 Julio 2018; LaBSIM 15.06-0048. Se diseccionó el ejemplar de 49 mm, pero la concha es del ejemplar de 45 mm.
Diagnosis.- Animales vivos rojo-anaranjado, alcanzando hasta 100 mm de longitud. Rinóforos fusionados basalmente durante más de la mitad de longitud. Branquia entre 1/3 y 1/2 de la longitud corporal, unida a la pared del cuerpo durante los 2/3 de su longitud; con 16-24 pinnas a cada lado del raquis, de las cuales 4-12 son pinnas libres. Concha pequeña, incluso menos de 1/9 de la longitud corporal, ovalada, con líneas de crecimiento y estrías radiales bien desarrolladas. Mandíbulas formadas por elementos cruciformes no denticulados, pero pueden tener un orificio o hendidura cerca de la punta. La rádula puede tener más de 100 filas y más de 200 dientes por media fila (104 x 205.0.205), con usualmente 12 (8 - 16) dentículos subterminales en los dientes más desarrollados.
Morfología externa.- Animales vivos de color rojo-anaranjado; animales preservados de color blanco (Fig. 1 A-B). Cuerpo ovalado y aplanado (Fig. 2 A-B), aunque más o menos elevado en el centro del manto que es más delgado que el resto del cuerpo. Superficie dorsal del manto cubierta por pequeñas bolsas glandulares blancas. Manto y superficie dorsal del pie reforzados con pequeñas espículas calcáreas alargadas (Fig. 3 A-B); usualmente con varias ramificaciones delgadas en uno de sus extremos, en el extremo opuesto sin ramificaciones o solo con algunas ramas; algunas espículas rotas o incompletas. Velo oral (Fig. 2 A-D: vl) ancho y trapezoidal, sus márgenes laterales con un surco longitudinal que ocupa más de la mitad de su longitud. Rinóforos (Fig. 2 A-D: ri) enrollados y gruesos, basalmente unidos durante más de la mitad de su longitud. Branquia (Fig. 2 B-C: br) visible lateralmente, su longitud un poco menos de la mitad de la longitud corporal, unida a la pared del cuerpo durante los 2/3 de su longitud; raquis principal liso con pinnas alternadas secundariamente pinnadas; con 16-24 pinnas a cada lado del raquis, de las cuales 4-12 son pinnas libres de la pared corporal, adheridas solo por la membrana branquial. Ano (Fig. 2 C: an) ubicado sobre el extremo posterior de la membrana branquial. Abertura prebranquial (Fig. 2 C: ab.p) ubicada en la base de la branquia. Nefridioporo ventralmente ubicado entre la segunda y tercera pinna. Abertura genital rodeada por el collar genital (Fig. 2 E: cg). Pene (Fig. 2 B-C, E: pp) parcialmente interno. Pie (Fig. 2 A-C: pi) posteriormente redondeado, proyectándose más allá del manto; anteriormente bilabiado, con el labio superior menos desarrollado que el labio inferior. Glándula pedal ausente. Medidas de los ejemplares revisados: longitud corporal: 45 y 49 mm; ancho del cuerpo: 22 y 23 mm; longitud de la branquia: 22 y 23 mm; longitud de la fusión entre la pared corporal y la branquia: 15 y 17 mm.
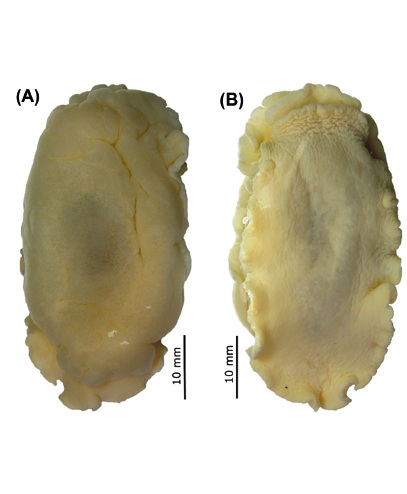
Figura 1 Fotografía del ejemplar de Berthellina ilisima capturado en Tumbes. A, vista dorsal. B, vista ventral.
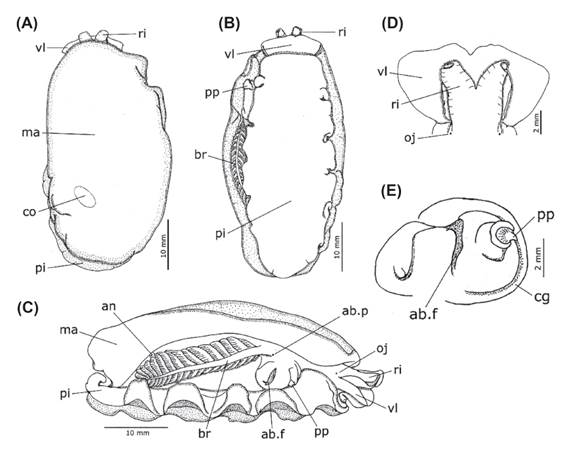
Figura 2 Morfología externa de Berthellina ilisima. A, vista dorsal. B, vista ventral. C, vista lateral. D, detalle de los rinóforos y el velo oral. E, collar genital.
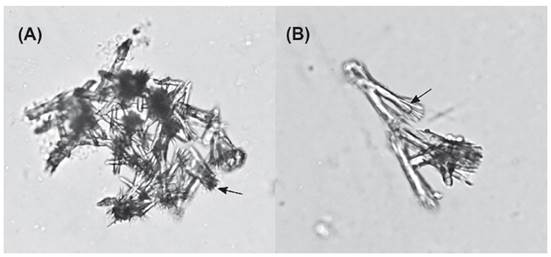
Figura 3 Espìculas calcáreas de Berthellina ilisima. A, espículas del manto. B, espículas de la superficie dorsal posterior del pie.
Concha.- Pequeña, menos de 1/9 de la longitud corporal (Fig. 2: co); aplanada y ovalada, casi dos veces más larga que ancha (5 x 2.7 mm en el ind. de 49 mm, 4.2 x 2.1 mm en el ind. de 45 mm); blanca, calcificada y frágil; ubicada en la parte posterior del cuerpo sobre la glándula digestiva. Espira formada por dos vueltas y media. Ápice (Fig. 4A) sobresaliendo en el centro del borde anterior de la concha, orientado hacia la izquierda. Escultura formada por estrías concéntricas bien desarrolladas y por filas de estrías radiales (Fig. 4B) que se extienden por los 3/4 de la longitud de la concha, aunque sin alcanzar el extremo opuesto al ápice.
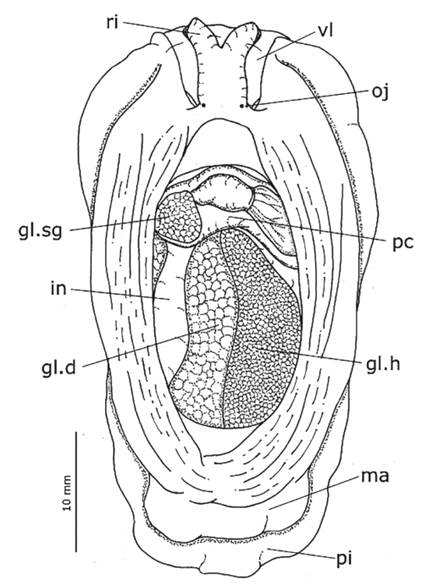
Sistema circulatorio.- Pericardio (Fig. 5: pc) bien desarrollado, casi dos veces más ancho que largo, ubicado en la región anterior del cuerpo. Corazón ocupando la mayor parte del pericardio, formado por la aurícula a la derecha, y el ventrículo a la izquierda. Aurícula (10A: au) de pared delgada, con algunas fibras longitudinales en su superficie interior. Ventrículo (10A: ve) muscular y globoso. Glándula sanguínea (Figs. 5 & 10A: gl.sg) casi del mismo volumen que el ventrículo, cubriendo la porción izquierda del pericardio, y conectada a la aorta. Aorta larga y delgada, casi la mitad del ancho de la abertura izquierda del ventrículo.
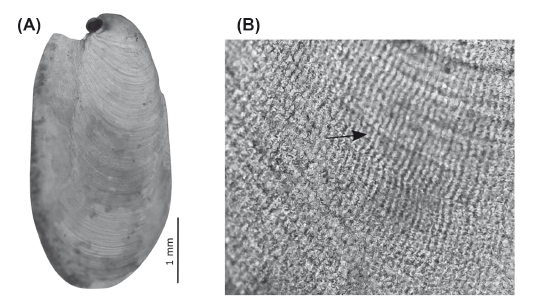
Figura 4 Concha de Berthellina ilisima. A, vista dorsal. B, superficie de la concha mostrando las estrías radiales.
Sistema digestivo. - Boca en el extremo anterior del bulbo faríngeo. Canal oral (Figs. 6A-B & 7A-B: ca) muscular inmediatamente posterior a la boca, representando casi 1/3 de la longitud del bulbo faríngeo; con pliegues en su superficie interna. Músculos de la mandíbula (Fig. 7A: mj) fuertes, representando 1/6 de la longitud del bulbo faríngeo, insertándose dorsal y lateralmente en la masa bucal. Un par de mandíbulas (Fig. 7C) en forma de delgadas láminas alargadas (6.5 x 2.2 mm) de color ámbar, aunque ligeramente más claras posteriormente; formadas por filas alternadas de elementos cruciformes alargados (112 filas x 72 columnas), sin ornamentaciones ni dentículos, aunque generalmente con un orificio cerca del extremo de la punta y una hendidura longitudinal posterior a esta (Fig. 8); márgenes laterales de la mandíbula con elementos cruciformes menos regulares y desarrollados, pero conservan el orificio en la punta. Un par de músculos yugales dorsales (Fig. 7A: m1d) originándose en la superficie dorsal de m4 y continuando anteriormente, insertándose en el extremo anterior del canal oral. Músculos del odontóforo: m4, par de músculos dorsales tensores de la rádula, se originan en la región lateral de los cartílagos del odontóforo, y se insertan en la membrana subradular; m5, par de músculos dorsales tensores auxiliares, cubren la región media de los cartílagos del odontóforo y se insertan lateralmente en mj; m10v, par de músculos ventrales protractores del odontóforo, formados por fibras delicadas, conectan la masa bucal con el canal oral. Músculo ventral tensor de la rádula (m10a) ausente. Un par de músculos retractores (Fig. 7A-B: mr) bien desarrollados, originándose en la región posterior de m5 y del saco radular, separados durante la mitad de su longitud, se dirigen posteriormente hacia la superficie ventral de la glándula digestiva. Un par de cartílagos del odontóforo (Fig. 7D) delgados y ovalados.
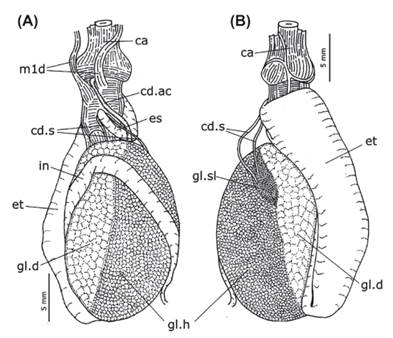
Figura 6 Vista dorsal y ventral de los órganos del hemocele de Berthellina ilisima mostrando la disposición del sistema digestivo.
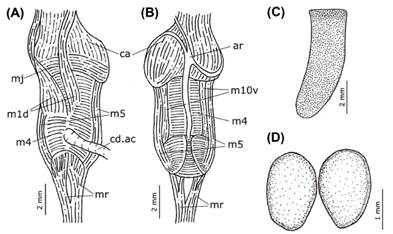
Figura 7 Detalles del sistema digestivo de Berthellina ilisima. A, vista dorsal del bulbo faríngeo. B, vista ventral del bulbo faríngeo. C, placa mandibular. D, cartílagos del odontóforo.
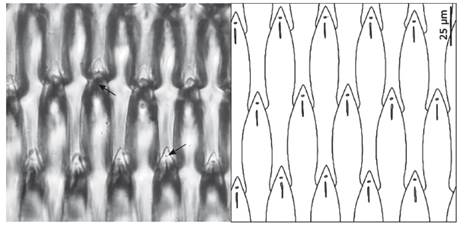
Figura 8 Elementos mandibulares de Berthellina ilisima. Las flechas señalan el orificio y la hendidura en la punta del elemento.
Conducto de la glándula ácida (Fig. 6A: cd.ac) dos veces más ancho que el conducto salival. Un par de conductos salivales (Fig. 6A-B: cd.s) delgados y sinuosos, nacen de la glándula salival (Fig. 6B: gl. sl) y desembocan en el techo de la cavidad oral. Esófago (Fig. 6A: es) relativamente corto, conduciendo a un estómago (Fig. 6A-B: et) voluminoso que cubre la superficie lateroventral izquierda del resto de órganos de la glándula digestiva. Intestino (Fig. 6A: in) largo, dorsalmente recorriendo una vuelta alrededor de las glándulas digestiva y hermafrodita para desembocar en el recto.
Rádula (Fig. 9).- Diente raquídeo ausente; dientes laterales largos y delgados con dentículos subterminales irregulares; dientes laterales internos relativamente cortos, con 5-7 dentículos subterminales, de los cuales el primero es el más desarrollado; subsecuentes dientes laterales más largos y desarrollados, con 11-13 dentículos subterminales en el centro de la fila, siendo el primer dentículo el más notorio; dientes laterales externos menos desarrollados, con 10 dentículos subterminales como máximo, pero la mayoría con 5-8. Rádula amarillo ámbar, fórmula: 104 filas x 205.0.205 dientes.
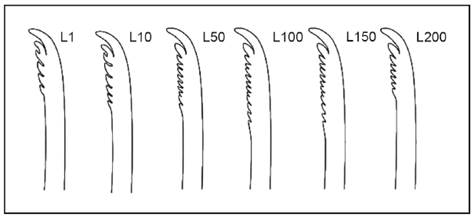
Figura 9 Dientes radulares laterales de Berthellina ilisima; dientes laterales internos: L1 y L10, dientes laterales del centro de la fila: L50, L100 y L150; dientes laterales externos: L200.
Sistema reproductor. - Glándula hermafrodita (Figs. 5 y 6A-B: gl.h) voluminosa, cubriendo la superficie derecha de la glándula digestiva. Ampolla (Fig. 10B: am) alargada y estrecha, aunque ligeramente más ancha que el conducto deferente, fuertemente sinuosa; nace en la glándula hermafrodita y se dirige lateralmente hacia la glándula femenina. Glándula femenina (Fig. 10B-D: gl.f) voluminosa, formando una masa compacta. Próstata (Fig. 10B-D: pr) glandular, 4 veces más ancha que el conducto deferente. Conducto deferente alargado y sinuoso (Fig. 10B-D: cd.df). Glándula del pene (Fig. 10B-D: gl.p) alargada, fuertemente sinuosa, ligeramente más ancha que el conducto deferente. Pene (Figs. 2 & 10B-D: pp) parcialmente interno, alargado (3 mm), con su extremo puntiagudo y quitinizado. Receptáculo seminal (Fig. 10B-D: rs) alargado y pedunculado; el pedúnculo ligeramente sinuoso y más ancho que el conducto deferente. Bursa copulatrix (10B-D: bc) redondeada, 2-3 veces más voluminosa que el receptáculo seminal. Vagina (10B-D: va) no sinuosa, casi del mismo ancho que el conducto deferente. Abertura de la vagina posterior al pene.
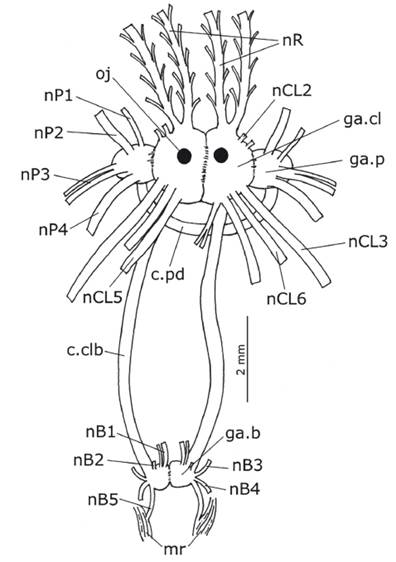
Sistema nervioso. - Anillo nervioso sobre el canal oral. Par de ganglios cerebrales y pleurales fusionados formando el complejo cerebro pleural (Fig. 11: ga.cl). Ojos ubicados lateralmente al complejo cerebropleural, originándose en nervios ópticos muy cortos. Par de ganglios rinoforales ubicados cerca del complejo cerebropleural en la base de los rinóforos; con dos nervios principales, los nervios rinoforales (Fig. 11: nR), que se dirigen hacia el extremo de los rinóforos, emitiendo numerosas ramas secundarias perpendiculares a los nervios principales. Nervios del complejo cerebropleural: nCL2, nervio pequeño y poco diferenciado, bifurcándose cerca de su origen; nCL3, nervio grueso y alargado, se dirigen posteriormente insertándose en el manto; nCL5, nervio alargado, se dirige posteriormente insertándose dorsalmente en el manto; nCL6, nervio relativamente corto, se inserta dorsalmente en el manto. Conectivo cerebropleural-visceral pobremente desarrollado, no se pudo reconocer el ganglio visceral. Conectivos cerebropleural-bucales (Fig. 11: c.clb) gruesos y bien desarrollados. Par de ganglios bucales (Fig. 11: ga.b) redondeados y fusionados. Nervios del ganglio bucal: nB1, nervio delgado, se bifurca en dos ramas delgadas que se insertan en el esófago; nB2, nervio corto y delgado, se inserta en los conductos salivales; nB3, nervio alargado, se inserta en m4; nB4, nervio alargado y más grueso que nB3, se inserta en el saco radular; nB5, nervio alargado, se dirige posteriormente insertándose en los músculos retractores del bulbo faríngeo (mr). Conectivos cerebropleural-pedales muy cortos. Par de ganglios pedales ovalados (Fig. 11: ga.p), más pequeños que el complejo cerebropleural, conectados por una comisura pedal gruesa (Fig. 11: c.pd). Nervios del ganglio pedal: nP1, nervio grueso, se dirige anteriormente insertándose en el velo oral; nP2, nervio grueso, se inserta en el pie; nP3, nervio grueso, se bifurca en dos ramas delgadas que se insertan en el pie; nP4, nervio grueso, se dirige posteriormente inervando la región posterior del pie.
Material Tipo: Holotipo. - 1 ejemplar; United States National Museum, Washington, D.C. (USNM 678401).
Localidad Tipo. - Puerto Peñasco, Sonora, México (Marcus & Marcus 1967).
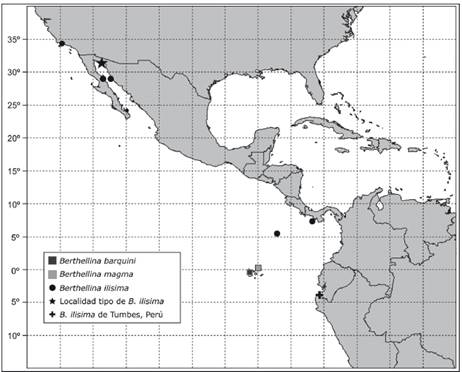
Distribución Geográfica. - Especie relativamente común en la Provincia del Pacifico Oriental Tropical (Camacho-García et al 2005, Valdés 2019), con reportes para Panamá (Hermosillo 2004), el Golfo de California (Bertsch & Marlett 2011) y Costa Rica (García-Méndez & Camacho-García 2016) (Fig. 12). Valdés (2019) la registra desde Santa Barbara, California, EE. UU. hasta las Islas Galápagos, Ecuador; indicando que los registros para California ocurren durante los eventos de El Niño. Los registros para las islas Galápagos (Camacho-García et al. 2005, Valdés 2019) no han sido corroborados por Ortea et al. (2014). En el presente estudio, la registramos para Bonanza sur, Tumbes, Perú (Fig. 12).
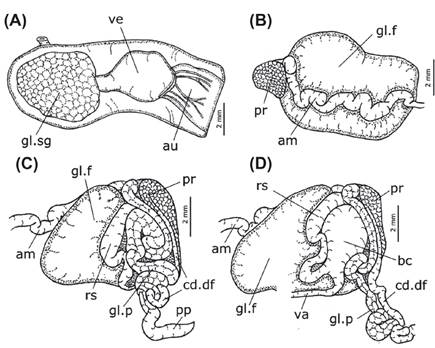
Figura 10 Sistemas circulatorio y reproductor de Berthellina ilisima. A, órganos del pericardio. B, vista posterior del complejo genital. C, vista in situ de los órganos del complejo genital. D, vista del complejo genital con la glándula del pene y receptáculo seminal extendidos.
Hábitat. - En el sublitoral, a 2 m de profundidad sobre piedras con grietas, en parches de macroalgas. Información ecológica adicional sobre esta especie puede encontrarse en Bertsch & Marlett (2011).
Discusión
Gardiner (1936) propuso el género Berthellina, basado en B. engeli, para incluir especies con dientes radulares laminares. MacFarland (1966) identificó y redescribió veinte ejemplares del Golfo de California como Berthellina engeli Gardiner 1936. Al año siguiente, Marcus y Marcus (1967) describieron 4 ejemplares de las localidades de Puerto Peñasco, Isla Tiburón y Guaymas, México estableciendo una subespecie, Berthellina engeli ilisima. Reportes posteriores han demostrado que se trataba de una sola especie, la cual ha sido citada bajo el nombre de B. engeli (Sphon & Mulliner 1972, Golestani 1991, Skoglund 1991), pero según Gofas sería un taxon inquirendum (MolluscaBase 2021) y actualmente ha sido asignada como especie B. ilisima Marcus y Marcus 1967 (Behrens 2004, Hermosillo 2004, Camacho-Garcia et al. 2005, Bertsch & Marlett 2011, García-Méndez & Camacho-García 2015, Valdés 2019). Recientemente Ortea et al. (2014) describieron dos especies nuevas de Berthellina para las islas Galápagos: Berthellina barquini Ortea 2014 y Berthellina magma Ortea 2014. B. barquini se caracteriza por los rinóforos fusionados basalmente durante 1/5 de su longitud y por sus elementos mandibulares ornamentados con dos "agallas" a cada lado, asemejándose a un arpón, mientras que en B. magma los rinóforos están fusionados a lo largo de su porción media posterior y sus elementos mandibulares poseen una hendidura en su extremo con 2 estrías a cada lado. Aunque en este trabajo se observó una hendidura en la punta de los elementos mandibulares de B. ilisima que no había sido reportada previamente por MacFarland (1966) ni por Marcus y Marcus (1967), la ausencia de ornamentaciones como "agallas" o estrías, así como los rinóforos fusionados basalmente hasta la mitad de su longitud; permiten diferenciar fácilmente B. ilisima de las especies descritas para las islas Galápagos, diferencias que también fueron remarcadas por Ortea et al. (2014) y que se detallan en la Tabla 2.
Tabla 2 Comparación de las especies de Berthellina reportadas en el Pacífico Oriental.
| Berthellina ilisima | Berthellina barquini | Berthellina magma | |
|---|---|---|---|
| Color del cuerpo | rojo anaranjado | rosa anaranjado | rosa anaranjado |
| Manto | suave | áspero | suave |
| Rinóforos | Fusionados en su base, durante la mitad de su longitud | Fusionados en su base, durante 1/5 de su longitud | Fusionados en su porción media posterior |
| Pinnas de la branquia | 16 - 24 | 24 | 25 |
| Pinnas libres | 4 - 12 | 12 | 5-6 |
| Elementos mandibulares | Sin ornamentación o con una hendidura cerca de la punta | Parecen arpones, con dos agallas laterales y un gancho dorsal | Parecen un punzón, con un orificio cerca de la punta y dos estrías laterales |
| Color de la rádula | amarilla | amarilla | roja |
| Fórmula radular | 104 x 205.0.205 60-100 x 170.0.170 90 x 250.0.250 | 126 × 170.0.170 | 120 × 160.0.160 |
| Máximo número de dentículos subterminales | con 8 - 16 dentículos subterminales, pero usualmente 12 | hasta 7-8 dentículos subterminales, que pueden llegar a 11 | hasta 8 dentículos subterminales |
| Concha | 5 x 2.7 mm, forma ovalada regular | 4 x 2 mm, forma ovalada regular | 5 x 2.5 mm, forma auriculada irregular |
| Ornamentación de la concha | Estrías concéntricas y radiales | Solo con estrías concéntricas | Solo con estrías concéntricas |
Excepto por la diferencia ya mencionada en los elementos mandibulares, el material revisado en este trabajo concuerda con las descripciones de MacFarland (1966), y Marcus y Marcus (1967), con algunas pequeñas variaciones. Se observó que el número de pinnas del raquis varía entre 16-24, un rango ligeramente mayor al reportado por MacFarland (1966: 17-22) pero con un promedio igual al valor reportado por Marcus y Marcus (1967: 20). La fórmula radular del material revisado de Tumbes (104 x 205.0.205) tiene un mayor número de filas respecto a lo encontrado por MacFarland (1966: 60-100 x 170.0.170) y Marcus y Marcus (1967: 90 x 250.0.250), probablemente debido a la diferencia de tamaño del material revisado (46 mm de long. en el material de Tumbes, 35 mm en MacFarland (1966) y 18 mm en Marcus & Marcus (1967). En los dientes más desarrollados de la rádula se observaron 11-13 dentículos subterminales, concordando con los valores reportados por MacFarland (1966: 8-10) y Marcus y Marcus (1967: 12-16). La forma de la concha concuerda con lo descrito y figurado por Marcus y Marcus (1967: 18A) y Valdés (2019: 3C), encontrando que la espira posee dos vueltas y media. La escultura radial de la concha está bien desarrollada y fue resaltada por Marcus y Marcus (1967), comentando que no alcanza el extremo opuesto al ápice, característica que también se observó en el material de Tumbes. El sistema reproductor de B. ilisima se caracteriza por la ampolla fuertemente sinuosa; la glándula del pene sinuosa, bien desarrollada y más gruesa que el conducto deferente; y el receptáculo seminal alargado y grueso, lo cual concuerda con lo descrito por MacFarland (1966: Pl. 16, fig. 9). Desafortunadamente, no existe información sobre el sistema reproductor de las especies descritas para las islas Galápagos (Ortea et al. 2014), la cual resultaría muy útil con fines comparativos, ya que una revisión de las descripciones de Berthellina en otras regiones del mundo (Marcus & Marcus 1970: B. cuvieri, Ortea et al. 2014: B. utris, Alvim & Pimenta 2015: B. circularis y B. ignis, Moustafa et al. 2018: B. delicata y B. citrina) muestra que el sistema reproductor es una de las mejores fuentes de caracteres taxonómicos en el género.
Alvim y Pimenta (2015) indicaron que los músculos del odontóforo pueden ser caracteres taxonómicos útiles en Pleurobranchida pudiendo separar géneros y en algunos casos, incluso especies; recomendando su inclusión en las descripciones morfológicas. En este trabajo se encontró que B. ilisima posee los músculos m4, m5 y m10v, en un desarrollo similar al descrito por Alvim y Pimenta (2015), además del músculo m1d que fue observado en Berthellina circularis, pero no en Berthellina ignis (Alvim & Pimenta 2015); sin embargo, no se identificó el músculo m10a, un músculo auxiliar que funciona como tensor ventral de la rádula y que fue incluido por Alvim y Pimenta (2015) como parte de la descripción del género Berthellina. Alvim y Pimenta (2015) también revisaron la anatomía del género Berthella en Brasil, encontrando que una de las tres especies revisadas no tenía el músculo m10a, lo que sugiere que el desarrollo de este músculo puede variar incluso entre especies del mismo género.
Aunque el conjunto de nervios cerebropleurales identificados en el material revisado (nCL2, nCL3, nCL5 y nCL6) difiere de lo registrado por Alvim & Pimenta (2015) para B. circularis (nCL2, nCL3 y nCL6) y B. ignis (nCL2, nCL3, nCL4, nCL5 y nCL6), esto necesita ser corroborado revisando más ejemplares, dada la naturaleza delicada de los nervios. En el caso de los nervios del ganglio bucal no se identificó el nervio nB6, que tampoco fue descrito en B. circularis (Alvim & Pimenta 2015), mientras que los nervios del ganglio pedal de B. ilisima no difieren de lo observado por Alvim & Pimenta (2015). El sistema circulatorio de B. ilisima concuerda con lo reportado en B. circularis y B. ignis (Alvim & Pimenta 2015), aunque en estas especies no se describe la presencia de la arteria radular, que es muy notoria en B. ilisima.
Dado el rango de distribución de otras especies de Pleurobranchida en el Pacífico Oriental como Pleurobranchus digueti (California a Ecuador; Valdés 2019), Berthella californica (sur de California a Panamá; Ghanimi et al. 2020a), Berthella martensi (Panamá; Ghanimi et al. 2020a) e incluso Berthella schroedli (Atacama, Chile; Araya & Valdés 2016), es probable la presencia de otras especies de Pleurobranchida en aguas peruanas por lo que se espera que este trabajo sirva como base para incentivar más estudios en el Perú sobre las babosas marinas.












 uBio
uBio