Introducción
El gato andino Leopardus jacobita (Cornalia, 1865) es uno de los gatos más raros en Sudamérica. Si bien su distribución es amplia, solo habita en zonas rocosas con pendiente pronunciada donde interactúa con otros mamíferos (Cuyckens et al. 2015, Lucherini & Vidal 2003). Su dieta alimenticia se basa principalmente en la vizcacha (Walker et al. 2007). Se distribuye en los Andes de Perú, Bolivia, Chile y Argentina, con una superficie estimada de 1172320 Km² (Marino et al. 2011). En el Perú, está presente en 9 departamentos (Cossíos et al. 2007) incluido el departamento de Puno, donde los únicos registros del gato andino provienen de registros indirectos (pieles y heces) (Cossíos et al. 2007, Pino 2017), por lo que su distribución, así como otros datos poblacionales, son desconocidos.
En Puno, las principales amenazas para la conservación del gato andino están relacionadas a la fragmentación, alteración y pérdida de hábitat, caza y disminución de sus presas (SERFOR 2018). Ante estas amenazas, el Gobierno Regional de Puno en el 2015, reconoció el sitio prioritario Andenes de Cuyocuyo (en adelante, SPAC), que abarca un área de 11387.22 ha, con la finalidad de conservar especies y ecosistemas y para la continuidad de procesos esenciales para la vida y el bienestar de las personas y la diversidad biológica (GOREP 2016). En el presente trabajo se confirma la presencia del gato andino L. jacobita y estima la abundancia relativa y patrones de actividad de los mamíferos altoandinos en el SPAC, lo cual contribuirá a un mejor conocimiento de esta especie y mejorar la gestión de conservación acorde con la finalidad del SPAC.
Material y métodos
Área de estudio. El estudio se realizó en el SPAC (14.50°S, 69.75°W) ubicado en la comunidad campesina de Puna Laqueque, distrito de Cuyocuyo, provincia de Sandia, región de Puno. El clima es lluvioso, frío y con otoños e inviernos secos, con temperaturas entre los -3 y 19 °C. La precipitación anual varían entre 500 y 1200 mm, tanto como lluvia o nieve (SENAMHI 2021). El ecosistema representativo es el pajonal altoandino de la puna húmeda, con presencia de roquedales escarpados con afloramientos rocosos, bofedales, lagunas y nevados; con asociaciones de graminoides (pajonales), dominados por especies robustas de crecimiento amacollado, generalmente de hojas duras y con presencia de vegetación saxícola (MINAM 2019). La principal actividad económica de la comunidad es la crianza de alpacas, llamas y ovejas (GOREP 2016).
La etapa de campo. Se realizó entre mayo y agosto del 2018, periodo en el que se establecieron 15 estaciones de muestreo de trampas-cámara (Reconyx y Bushnell), en un rango altitudinal de entre 4600 - 4900 m de altitud (Fig. 1). Las cámaras trampas estuvieron activas simultáneamente durante 88 días las 24 horas del día. Las estaciones fueron establecidas tomando en cuenta pasos de fauna y bordes de montañas. Las cámaras se colocaron entre 30 a 45 cm del suelo, y fueron programadas para tomar series de 3 fotografías por evento, registrando la hora y fecha. Cada estación fue georreferenciada con un GPS marca Garmin® modelo 64s. El esfuerzo total de muestreo se obtuvo multiplicando el número total de estaciones por el total de días de muestreo.
Análisis de los registros fotográficos. La presencia del gato andino y otros mamíferos se obtuvieron de los registros fotográficos (detecciones) identificados por localidad (estación de muestreo), fecha y hora. Los registros fotográficos fueron mapeados y las localidades descritas. Con las detecciones obtenidas, se estimó la abundancia relativa y se evaluaron los patrones de actividad. Se consideraron detecciones independientes sí se cumplía que: a) eran registros consecutivos de diferentes especies, b) eran registros no consecutivos de la misma especie (separados por registros de otras especies) y c) eran registros consecutivos de la misma especie que ocurren con al menos una hora de diferencia (Norris et al. 2010). Para especies gregarias (camélidos y ovejas), el número de registros independientes fue igual al número de individuos observados en una fotografía (Monroy-Vilchis et al. 2011).
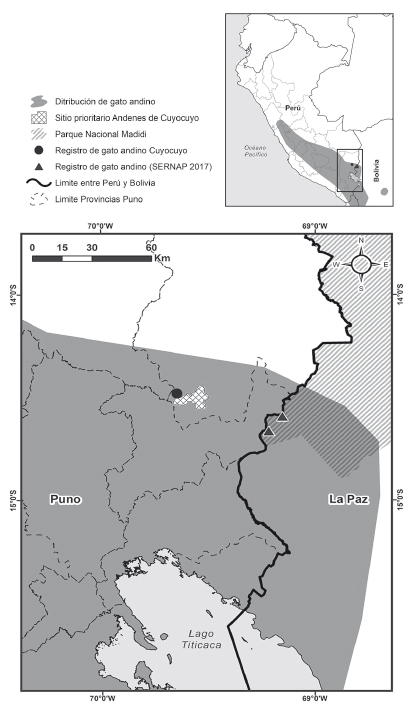
Figura 1 Mapa de ubicación de la zona de muestreo y localidades en el sitio prioritario Andenes de Cuyocuyo, distrito Cuyocuyo, provincia Sandia, departamento Puno.
La abundancia relativa de los mamíferos. Se determinó a utilizando el número de detecciones independientes con relación al esfuerzo de muestreo (Díaz-Pulido & Payán 2012) expresado como la frecuencia de registros por cada 1000 trampa cámaras por día (Maffei et al. 2002, Cortés-Marcial & Briones-Salas 2014, Carrillo-Reyna et al. 2015, Mosquera-Guerra et al. 2018, Cossíos & Ricra 2019). Para ello, la abundancia relativa se calculó para cada estación de muestreo i (IAR i ) utilizando el número de detecciones obtenidas en esa estación (N detecciones TC i ), dividido entre el número de días que la estación estuvo activa (N días actividad TC i ) y estandarizado a 1000 días de esfuerzo o cámaras-trampa/día (Maffei et al. 2002). El promedio del índice de abundancia relativa se calculó con la suma estimada de todos los IAR estimados (donde i = 1, 2, hasta n), dividido entre el número total de estaciones de TC, que fue expresado como frecuencia (f) de registro por cada 1000 cámaras-trampa/día.
La actividad horaria de los mamíferos. Se determinó con el número de detecciones independientes obtenidas por cada periodo de una hora, considerando únicamente especies que obtuvieron más de 10 detecciones independientes; registros menores fueron considerados insuficientes para determinar el horario de actividad de una especie (Cossíos & Ricra 2019). Cada detección se clasificó como diurna (entre 8:00 am - 6:00 pm), nocturna (entre 8:00 pm - 06:00 am) y crepuscular, entendiendo el crepúsculo como el periodo entre el amanecer y la hora de salida del sol (crepúsculo matutino, entre 6:00 am - 08:00 am), del mismo modo, entre la hora de puesta del sol y el atardecer (crepúsculo de la tarde, entre 6:00 pm - 08:00 pm) (Maffei et al. 2002, Díaz-Pulido & Payán 2012, Cossíos & Ricra 2019). Se calculó la frecuencia de actividad para cada especie por categoría horaria, considerando el número de detecciones por categoría y el total de detecciones de cada especie.
Taxonomía. La descripción taxonómica de las especies se realizará siguiendo las publicaciones de Pacheco et al. (2020, 2021).
Resultados
Con un esfuerzo de muestreo de 1275 cámaras-trampa/día, se identificaron 11 mamíferos en total, de estos, 8 mamíferos silvestres y 3 mamíferos domésticos. Se obtuvieron 123 detecciones independientes de mamíferos: 3 carnívoros, Leopardus jacobita, Leopardus garleppi (Matschie, 1912) y Lycalopex culpaeus (Molina, 1782); 3 roedores, Lagidium viscacia (Molina, 1782), Chinchillula sahamae (Thomas, 1898) y Phyllotis osilae; 1 cérvido, Hippocamelus antisensis (D'Orbigny, 1834) y 1 camélido, Vicugna vicugna (Molina, 1782) (Fig. 2).

Figura 2 Presencia de mamíferos. A) Leopardus jacobita, B) Lagidium viscacia, C) Lycalopex culpaeus, D) Leopardus garleppi, E) Hippocamelus antisensis, F) Canis lupus familiaris.
Leopardus jacobita fue detectado en 2 localidades (L6 y L7) dentro del área de muestreo (Fig. 1) junto con L. viscacia. L. garleppi fue detectado en 2 localidades (L7 y L9) compartiendo una localidad con L. jacobita (L7), H. antisensis y L. culpaeus (L9). El registro de perros pastores fue en 2 localidades (L5 y L8) donde también se registraron rebaños de ovejas, alpacas y vicuñas (L8). El resto de los mamíferos silvestres fueron detectados en otras localidades. En las localidades donde se detectaron mamíferos domésticos no se detectó al gato andino ni al gato del pajonal (Tabla 1).
Las especies con mayor abundancia relativa fueron: L. viscacia (IAR=50.76, DE= 73.88), L. jacobita (IAR=9.09, DE= 32.20), H. antisensis (IAR=7.58, DE= 14.67) y L. garleppi (IAR=3.79, DE= 10.22). Entre las especies introducidas se registró al perro pastor (IAR=7.58, DE= 19.05).
Los resultados sobre el patrón de actividad de L. jacobita (N=12) indican que es una especie de hábitos principalmente diurnos (Fr = 0.42) y nocturnos (Fr= 0.33), aunque se obtuvieron algunas detecciones en el período crepuscular de la tarde (Fr= 0.25). L. viscacia (N=67), una de las principales presas de L. jacobita la cual presentó hábitos principalmente nocturnos (Fr= 0.42), con algunas detecciones diurnas (Fr= 0.30) y pocas crepusculares. Para L. garleppi, (N=5) las detecciones fueron realizadas principalmente el período crepuscular de la tarde (Fr= 0.40), mostrando cierta actividad diurna, nocturna y matutina (Fr= 0.20 respectivamente) (Tabla 2)
Tabla 1 Localidades y categoría de amenaza de los mamíferos altoandinos registrados en el sitio prioritario Andenes de Cuyocuyo.
| Nombre científico | Nombre común | Localidades | Categoría de amenaza |
|---|---|---|---|
| Leopardus jacobita | Gato andino | L6,L7 | EN |
| Leopardus garleppi | Gato del pajonal | L7,L9 | DD |
| Lagidium viscacia | Vizcacha | L1,L3,L4,L6,L7,L8,L9,L12,L13,L14 | |
| Hippocamelus antisensis | Taruca | L6,L9,L14 | VU |
| Chinchillula sahamae | Ratón chinchilla | L5 | |
| Phyllotis osilae | Ratón de altura | L5 | |
| Vicugna vicugna | Vicuña | L8,L9,L14 | NT |
| Lycalopex culpaeus | Zorro andino | L6,L8 | |
| Canis lupus familiaris | Perro doméstico | L8,L5 | |
| Vicugna pacos | Alpaca | L8 | |
| Ovis aries | Oveja | L8 |
Tabla 2 Abundancia relativa y patrón de actividad de mamíferos silvestres y domésticos registrados en el sitio prioritario Andenes de Cuyocuyo. N= Número de detecciones por cada 1000dt, IAR= Índice de abundancia relativa promedio, DE= desviación estándar. Diurno (8:00 am a 6:00 pm), Crepúsculo de la tarde (6:00 pm a 8:00 pm), Nocturno (8:00 pm a 6:00 am) y Crepúsculo matutino (6:00 am a 8:00 am).
| Nombre científico | N | IAR | DE | Frecuencia de detecciones | |||
|---|---|---|---|---|---|---|---|
| Diurno | Crepúsculo de la tarde | Nocturno | Crepúsculo matutino | ||||
| Leopardus jacobita | 12 | 9.09 | 32.20 | 0.42 | 0.25 | 0.33 | 0.00 |
| Leopardus garleppi | 5 | 3.79 | 10.22 | 0.20 | 0.40 | 0.20 | 0.20 |
| Lagidium viscacia | 67 | 50.76 | 73.88 | 0.30 | 0.10 | 0.42 | 0.18 |
| Hippocamelus antisensis | 10 | 7.58 | 14.67 | 0.30 | 0.50 | 0.20 | 0.00 |
| Chinchillula sahamae | 7 | 5.30 | 20.54 | 0.00 | 0.00 | 0.71 | 0.29 |
| Phyllotis osilae | 3 | 2.27 | 8.80 | 0.00 | 0.00 | 1.00 | 0.00 |
| Vicugna vicugna | 5 | 3.79 | 9.28 | 1.00 | 0.00 | 0.00 | 0.00 |
| Lycalopex culpaeus | 2 | 1.52 | 4.00 | 0.50 | 0.50 | 0.00 | 0.00 |
| Canis lupus familiaris | 10 | 7.58 | 19.05 | 0.20 | 0.50 | 0.20 | 0.10 |
| Vicugna pacos | 1 | 0.76 | 2.93 | 1.00 | 0.00 | 0.00 | 0.00 |
| Ovis aries | 1 | 0.76 | 2.93 | 1.00 | 0.00 | 0.00 | 0.00 |
Discusión
Nuestros resultados confirman la presencia del gato andino en el SPAC, al extremo Sureste del Perú. Por tanto, el SPAC se encuentra dentro de la distribución geográfica actual del gato andino en Perú. El SPAC contiene las características de hábitat preferidas del gato andino, como roquedales y afloramientos rocosos con vegetación de gramíneas y su presa la vizcacha (Napolitano 2008, Villalba et al. 2012). La predominancia de este hábitat incrementa la importancia del lugar para la conservación del gato andino, con la posibilidad de tener poblaciones conectadas con el parque nacional Madidi en Bolivia, sustentada por el registró de L. jacobita, L. viscacia, C. sahamae y P. osilae (SERNAP 2017). Estas últimas especies son parte de la dieta del gato andino (Walker et al. 2007) y la distancia entre el sitio prioritario y el parque nacional Madidi es de aproximadamente 55 Km, mientras que el tamaño promedio el área de acción del gato andino es de 46.89 km2 a 79.89 km2 (Tellaeche 2015). Es posible que entre ambas áreas exista un intercambio de individuos que favorezca el mantenimiento de poblaciones bien conservadas (Fig. 1). Se sugiere realizar estudios poblacionales a lo largo de estas áreas que confirmen la distribución del gato andino y su estado poblacional.
En cuanto al patrón de actividad, según Lucherini et al (2009), saber cuándo una especie está activa es importante para comprender su nicho ecológico y, por lo tanto, desarrollar planes de conservación a largo plazo. En esta línea, nuestros registros confirman que el gato andino tiene un patrón de actividad diurno (Lucherini et al. 2009, Aravena et al. 2016, Llerena-Reátegui et al. 2017) y nocturno (Huaranca et al. 2019, Scrocchi & Halloy 1986, Reppucci 2011), similar al patrón de actividad de la vizcacha (Iriarte et al. 2013, Reppucci 2012, Torrico 2009, Di Martino et al. 2008, Napolitano et al. 2008, Walker et al. 2007). En el SPAC, se observó que el gato andino y la vizcacha tienen coincidencias en el patrón de actividad, durante el día y la noche, pero no son determinantes para afirmar que tienen un mismo patrón de actividad.
El registro de perros pastores en el SPAC podría ser una amenaza para el gato andino y los otros mamíferos altoandinos. Reed y Merenlender (2010) demostraron que la riqueza y abundancia de mamíferos se ve afectada en zonas donde hay presencia de perros. Lucherini et al. (2016) encontraron que los perros pastores resultaron una causa adicional de mortalidad para los pequeños felinos. Por otro lado, estudios realizados en proximidades del parque nacional Madidi encontraron que los perros y gatos domésticos son portadores del virus del moquillo canino, el parvovirus canino, Sarcoptes scabiei, Toxoplasma gondiise y Neospora caninum (Fiorello et al. 2004), lo cual podrían ser causa adicional de mortalidad para los pequeños felinos (Costanzi et al. 2021). Realizar estudios de interacción entre perros pastores y mamíferos silvestres podrían confirmar si los perros pastores son una amenaza para estos mamíferos en el SPAC.
La presencia de mamíferos amenazados (Tabla 1) en el SPAC como L. jacobita y H. antisensis (SERFOR 2018) conlleva a diseñar e implementar con las comunidades campesinas, autoridades, funcionarios y otros actores, mecanismos y estrategias de conservación que serán determinantes para la conservación del gato andino y los otros mamíferos en el corto y largo plazo.












 uBio
uBio 


