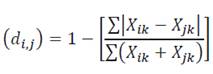Introducción
Los biomas tropicales secos, en especial los bosques estacionalmente secos (BES) están siendo rápidamente transformados y fragmentados debido al cambio de uso de suelo, procesos que a su vez son amplificados por los efectos del cambio climático (Pennington et al. 2018; Stan & Sanchez-Azofeifa 2019). Esto hace que los BES sean uno de los biomas más degradados del planeta, quedando actualmente menos de la cuarta parte de su extensión original (Jacobson et al. 2019). A pesar de representar el 42% de la superficie de los bosques tropicales y de incluir por lo menos 12 grandes grupos florísticos únicos en el neotrópico (Banda-Rodríguez et al. 2016), solo el 2% está intacto y solo el 8% está protegido legalmente (Stan & Sanchez-Azofeifa 2019). Por otro lado, los BES aportan con servicios ecosistémicos como alimento, leña, biocombustibles, oportunidades para el turismo y educación además de servicios como el control de la erosión, almacenamiento de carbono y el control del clima entre otros (Balvanera et al. 2011; Depenthal & Meitzner Yoder 2018; Nelson et al. 2020). Por tanto, es urgente incrementar los esfuerzos para comprender a estos ecosistemas y asegurar su conservación e integridad, que pueden incluir recursos vitales para el futuro de los países tropicales (Pennington et al. 2018). Parte de estos esfuerzos incluyen mejorar el conocimiento de su composición florística y de entender las relaciones entre los diferentes tipos de BES que existen en el Neotrópico (Banda-Rodríguez et al. 2016).
En el Perú se reconocen oficialmente cinco tipos de BES (Llanura, Ribereño, Interandino, Colina, Montaña y Oriental) que ocupan una superficie de 4025338.3 ha, equivalente al 3.11% del territorio nacional (MINAM 2018). Sin embargo, el reconocimiento de los BES ypropuestas para su clasificación vienen desde los trabajos de Poeppig (2003), Weberbauer (1945), Ferreyra(1979; 1983; 1996) y otros, usándose una variedad de criterios para diferenciarlos (Linares-Palomino 2004a).Linares-Palomino (2004b) diferenció tres subunidades principales para los BES del Perú, basadas en datos deinventarios y listas florísticas. La subunidad de BES ecuatoriales incluyó bosques de Tumbes, Piura, Lambayeque y La Libertad, donde se diferenciaron las formaciones de llanura y montaña. La subunidad de los BES interandinos incluyó bosques en los valles de los ríosHuancabamba, Marañón, Apurímac, y el Mantaro. Finalmente, la subunidad de BES Orientales estuvo compuesta por remanentes en los flancos orientales de losAndes en el departamento de San Martín.
Esta propuesta de Linares-Palomino (2004b) se basó en 23 inventarios cuantitativos, que constituían la información existente en ese momento. Una limita ción de hacer clasificaciones de este tipo es que muchasveces puede ser difícil obtener una muestra adecuadaque incorpore toda la variabilidad florística existente del sistema de estudio, particularmente cuando se es tudian escalas espaciales amplias. En los últimos 15 años ha habido un esfuerzo notable de incrementar la cobertura geográfica y el número de parcelas y transectos cuantitativos en los BES del Perú (por ejemplo:Eduardo-Palomino et al. 2017; García-Villacorta 2009;Huamantupa-Chuquimaco et al. 2017; Marcelo-Peña etal. 2016; Marcelo-Peña & Reynel Rodriguez 2014). Se hace entonces necesaria una evaluación de la propuestaoriginal del 2004 a la luz de la información disponible actualmente. El presente artículo tiene como objetivosrevisar, y de ser necesario, redefinir las relaciones florísticas y fitogeográficas de los BES del Perú.
Material y métodos
Para todos los análisis aquí presentados, se utilizó una base de datos de inventarios de especies leñosas y cactáceas arborescentes realizados en BES del Perú con datos de abundancia compilados por la Red Florística Latinoamericana del Bosque Tropical Estacionalmente Seco (DRYFLOR 2012-). Esta base de datos incluye inventarios cuantitativos que siguen una definición amplia de BES: que ocurren en áreas libres de heladas, donde las lluvias no superan los 1800 mm por año, las cuales, a su vez, son menores a 100 mm en al menos 5 o 6 meses; tienen un dosel continuo, que se ve disminuido en las zonas más secas; su vegetación es decidua generalmente, con especies espinosas y suculentas en los bosques más secos; son de suelos fértiles y ligeramente alcalinos (Pennington et al. 2009; Pennington et al. 2018).
La base de datos DRYFLOR cubre todo el Neotrópico, y se actualiza regularmente (en su taxonomía y con la incorporación de nuevas parcelas). Los datos para Perú contienen actualmente 526 inventarios cuantitativos individuales (parcelas o transectos, de áreas variables) y 651 especies de BES de distintos departamentos del Perú (Fig. 1). Los metadatos están disponibles en Figshare (Linares Palomino et al. 2021). Diferenciamos entre especies "unicadas" (que sólo ocurrieron en una parcela y representadas por un solo individuo) y únicas (que sólo ocurrieron en un grupo o subgrupo particular).
Con el fin de replicar los métodos multivariados usados por Linares-Palomino (2004b) para identificar grupos florísticos, aplicamos a nuestros datos un análisis de clasificación jerárquica aglomerativa y lo complementamos con otro de escalado multidimensional no-métrico (NMDS). Para desarrollar ambos análisis calculamos el índice de Bray-Curtis entre pares de parcelas:
Donde Xik y Xjk representan el número de individuos (abundancias) de la especie k en la parcela i y en la parcela j, como medida de distancia (Gotelli & Ellison 2004). Para la clasificación jerárquica aglomerativa aplicamos el método de agrupamiento por promedio aritmético de grupos de pares no ponderados (UPGMA) sobre la matriz de distancias para generar los dendrogramas. Con el fin identificar las especies que discriminan entre cada uno de los grupos hallados, realizamos un análisis SIMPER (Similarity Percentages; (Clarke 1993)).
Para evaluar los resultados de la clasificación UPGMA respecto a los tipos de BES identificados en el MapaNacional de Ecosistemas (MINAM 2018), asignamos acada parcela (usando sus coordenadas) el ecosistemacorrespondiente en el shapefile de ecosistemas (disponible en https://geoservidor.minam.gob.pe/recursos/intercambio-de-datos/) usando QGIS (QGIS Development Team 2020). Para el escalado multidimensionalno-métrico (NMDS) usamos la matriz de distanciaspara generar la ordenación. Durante los análisis exploratorios iniciales de ambos métodos, observamos quecinco parcelas se mostraron de manera atípica y hacíandifícil visualizar los resultados. Los valores atípicossuelen distorsionar cualquier ordenación, independientemente del método que se use. Cuando esto sucede, el valor atípico se muestra a un extremo del gráficoresultante, mientras que el resto de los datos (muchomás similares entre sí, que con el valor atípico) se agrupan compactamente al otro extremo. Con el fin de mejorar la visualización de las ordenaciones, seguimos aKent (2012) y excluimos de los análisis posteriores aestas cinco parcelas, ubicadas en los departamentos deAyacucho y Cusco, todas del sistema de valles secos delApurímac (AYA_TOROBAMBA17, AYA_TOROBAMBA18,AYA_TOROBAMBA19, AYA_Torobamba5, CUZ_Wayronqa). La matriz final incluyó 521 sitios y 644 especies.
Todos los procesos de manejo de datos se realizaron en el ambiente de programación R (R Core Team 2018) usando los paquetes openxlsx para importar archivosExcel (Schauberger & Walker 2020) y tidyverse paramanejar y editar datos (Wickham et al. 2019). Usamos el paquete vegan (Oksanen et al. 2017) para generar la matriz de distancias Bray-Curtis, hacer la clasificación jerárquica aglomerativa (UPGMA), el escalamiento multidimensional no métrico (NMDS) y el análisis SIMPER. Para visualizar el resultado del análisis de clasificación, construimos un dendrograma usando los paquetes dendextend para manejar las estructuras en forma de árbol (Galili 2015), ggtree para la visualización y anotación de los dendrogramas (Yu 2020b), tidytree para convertir el objeto del árbol en un marco de datos ordenado y proporcionar interfaces ordenadas para manipular los datos (Yu 2020a), y treeio para facilitar la importación y el almacenamiento de dendrogramas con datos asociados (Wang et al. 2019). Para visualizar los resultados de los análisis multivariados usamos los paquetes ggstance (Henry et al. 2020), cowplot (Wilke 2019) y ggordiplots (Quensen 2018).
Resultados
Logramos identificar tres grupos de BES claramente definidos a través de los dos análisis multivariados (NMDS y UPGMA, Figs. 2 y 3, respectivamente), que incluyen a los (i) BES costeros, (ii) BES interandinos, y (iii) BES orientales. Cada grupo contiene una comunidad de plantas leñosas que lo caracteriza florísticamente (Tabla 1). Dos parcelas no fueron incluidas en ninguno de estos grupos: TUM_ANGOSTURA y TUM_HUARAPAL, ambas en el departamento de Tumbes.
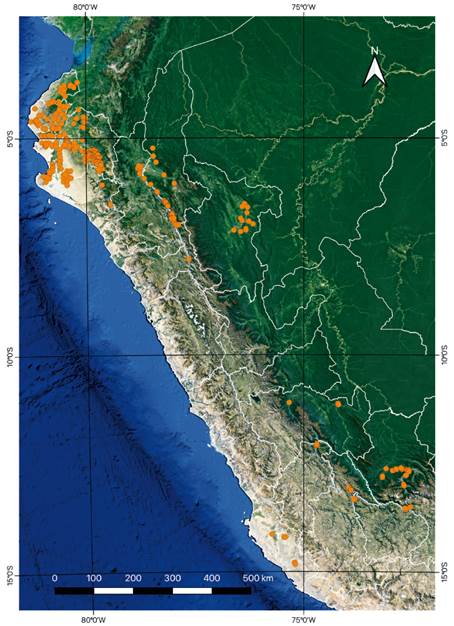
Figura 1 Distribución geográfica de las parcelas en la base de datos DRYFLOR Perú incluidas en el análisis.
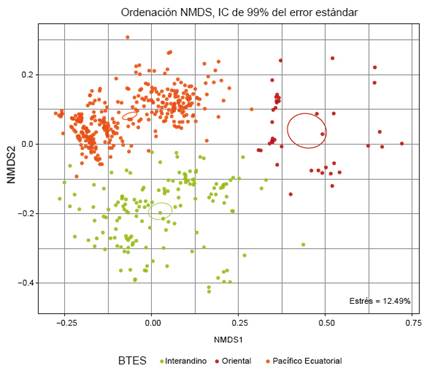
Figura 2 Escalado multidimensional no métrico (NMDS, 200 iteraciones) de los tres principales grupos de BES identificados para el Perú.
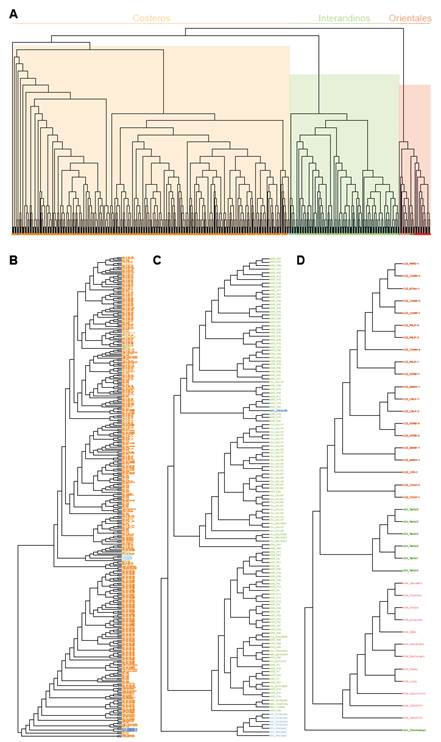
Figura 3 Clasificación multivariada jerárquica aglomerativa (UPGMA) de los grupos y subgrupos florísticos de BES en el Perú. A) Los tres grupos de BES principales en Perú, detalle de los grupos de B) BES Costeros, C) BES Interandinos, D) BES Orientales.
1. Bosques estacionalmente secos costeros (Fig. 3B).
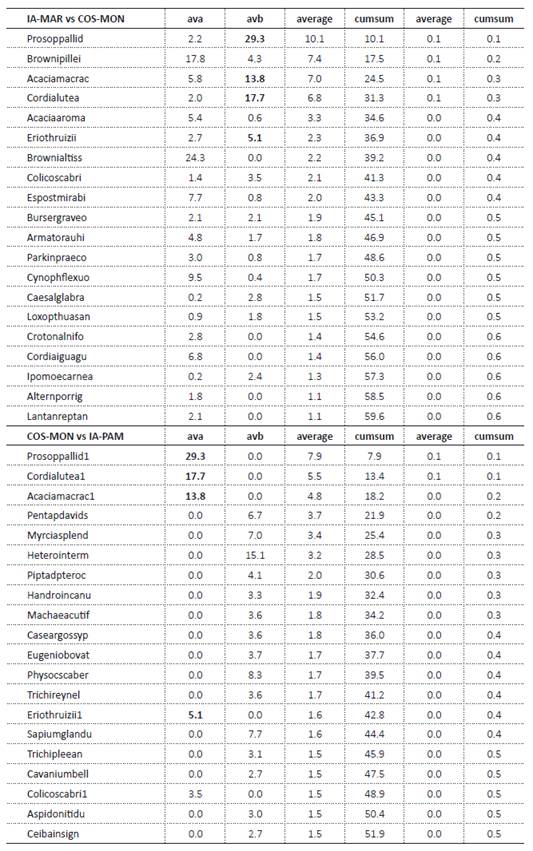
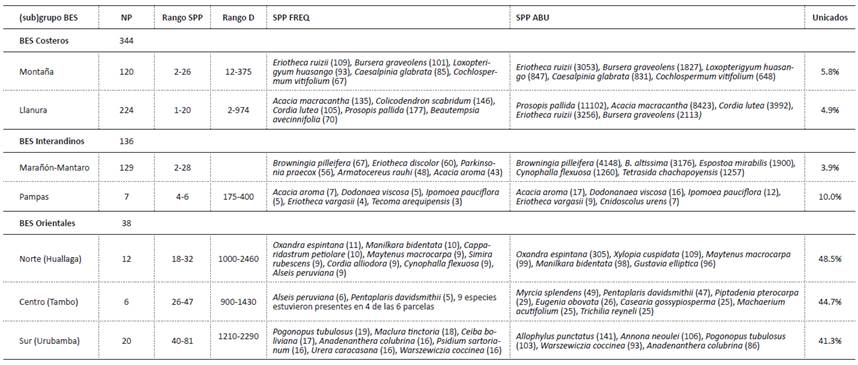
Este grupo está conformado por 344 sitios, incluye 190 especies y se restringe exclusivamente a bosques en la costa central y norte del Perú. A su vez, contiene a dos subgrupos (Tabla 1).
1A. BES Pacífico-Ecuatoriales de montaña (Tabla 1)
Este subgrupo está conformado por 120 sitios, donde se han registrado 98 especies. Se encuentra en las cadenas occidentales de la cordillera de los Andes en la costa norte (Tumbes, Piura, Lambayeque), presentando una densidad entre 12 y 375 individuos por parcela. La parcela TUM_UCUMARES (Tumbes) fue la que presentó mayores valores de abundancia, con dominancia de individuos de Handroanthus chrysanthus (Jacq.) S.O. Grose, mientras que una parcela en Piura (PIU_NCI.SH24C) presentó los menores valores de abundancia y con dominancia de Caesalpinia glabrata Kunth. Asimismo, este grupo registró valores de riqueza entre 2 y 26 especies por parcela. La parcela PIU_P66 (Piura) registró la mayor riqueza, con una representatividad de más del 26% del total de especies del subgrupo, mientras que tres parcelas de Lambayeque (LAM_CHOLOQUE1, LAM_CHOLOQUE3 y LAM_CHOLOQUE6) reportaron los menores valores de riqueza, cada una con tan solo un 2% de representatividad del subgrupo de montaña.
Entre las especies más abundantes y con mayor frecuencia del subgrupo se encontraron Eriotheca ruizii (K.Schum.) A. Robyns, Bursera graveolens (Kunth) Triana & Planch., Loxopterigyum huasango Spruce ex Engl., C. glabrata, Cochlospermum vitifolium (Willd.) Spreng, que representaron un 55.9% del total de la abundancia total del subgrupo. Entre los unicados (es decir, especies representadas por un solo individuo), se contabilizó 38 especies, representando un 38.8% del total de especies del subgrupo y un 5.8% del total de parcelas del estudio. Dentro de las especies únicas para el grupo de montaña se encontraron 19 especies, con valores importantes de abundancia en Buddleja americana L., Vernonia fulta Griseb., Cecropia ficifolia Warb. ex Snethl. y Senna undulata (Benth.) H.S. Irwin & Barneby. Se observó además afinidad florística entre este subgrupo y tres parcelas de la región de Huancavelica (HUV_CHIQUIACC1, HUV_CHIQUIACC2 y HUV_CHIQUIACC3) ubicadas en los BES Interandinos asociados al valle del Mantaro en Junin y que estuvieron dominadas por Acacia macracantha Willd., E. ruizii y Armatocereus cartwrightianus (Britton & Rose) Backeb. ex A.W. Hill. El análisis SIMPER mostró que entre las principales especies que están determinando el agrupamiento de los BES Pacífico-Ecuatoriales de Montaña se incluyen justamente las dos primeras (Material Suplementario 1).
Tabla 1: Resumen de las características de los subgrupos de BES del Perú. NP: número de parcelas en el (sub)grupo, Rango SPP: rango mínimo y máximo riqueza de especies en las parcelas del subgrupo, Rango D: rango mínimo y máximo de densidad en las parcelas del subgrupo, SPP FREQ: las cinco especies más frecuentes (que ocurren en más parcelas del subgrupo), SPP ABU: las cinco especies más abundantes en las parcelas del subgrupo, Unicados: porcentaje de especies que ocurren en una sola parcela en todo el análisis.
1B. BES costeros de llanura (Tabla 1)
Se ubica en las llanuras costeras de Tumbes, Piura, Lambayeque e Ica. Está conformado por 224 sitios, donde se han registrado 92 especies. La parcela con mayor riqueza fue PIU_TIMBES (20 especies, ubicada en el departamento de Piura). Las parcelas LAM_CHOLOQUE8 (Lambayeque), PIU_P_EP_110, PIU_P56 y PIU_P_EP_62 (Piura) registraron solo una especie, siendo Prosopis pallida (Humb. & Bonpl. ex Willd.) Kunth monodominante en las tres primeras parcelas y A. macracantha en la última.
La especie más frecuente en este grupo fue P. pallida, (79% de parcelas en las que ocurre), seguida de Colicodendron scabridum (65.2%) y A. macracantha (60.3%). Por otro lado, las especies más abundantes fueron Cordia lutea Lam., E. ruizii y B. graveolens. La parcela con mayor abundancia fue LAM_CHAPARRI1 (ubicada en el departamento de Lambayeque) donde C. lutea representó el 25.5% del total de individuos. Se registró 33 unicados, representando un 35.1% del total de especies del subgrupo y un 4.9% del total estudiado. Dentro de las especies únicas para este subgrupo se contabilizaron 21 especies, siendo las de mayor abundancia Grabowskia boerhaviifolia (L.f.) Schltdl. (83), Lafoensia punicifolia DC. (79), Armatocereus laetus (Kunth) Backeb. (55) y Cnidoscolus peruvianus (Müll. Arg.) J.F. Macbr. (54). Además, en términos de la composición florística de sus parcelas, fue el subgrupo más heterogéneo de todos, conteniendo también seis parcelas del valle del Marañón (MRÑ_P28, MRÑ_41, MRÑ_47, MRÑ_72, MRÑ_73, MRÑ_81) e incluso del valle Apurímac (CUZ_CUNYAQ, CUZ_QONOQ, CUZ_ SAUCEDA, CUZ_WAYNA) en la región del Cusco.
2. Bosques estacionalmente secos Interandinos (Fig. 3C).
Están compuestos por fragmentos y remanentes de BES en las cuencas de los ríos Marañón, Mantaro, Apurímac y Pampas e incluyeron 133 sitios y 152 especies. Los análisis mostraron dos subgrupos.
2A. BES del Marañón-Mantaro (Tabla 1)
Este subgrupo incluyó 126 parcelas ubicadas en los bosques de la cuenca del río Marañón (incluyendo las subcuencas del río Utcubamba y del río Chamaya) y una parcela en remanentes de bosque más pequeños en la cuenca del río Mantaro. En este subgrupo se registraron 145 especies, siendo los sitios con mayor número de especies CAJ_ELHUITO y CAJ_SHANANGO (ambos con 28 especies), mientras que el sitio de menor riqueza fue MRÑ_P66 con solo 2 especies. Respecto a la abundancia, AMA_CUMBA (3480) y CAJ_BALSAS (15) fueron las parcelas con mayor y menor número de individuos, respectivamente.
Las familias más abundantes y frecuentes fueron Cactaceae, especialmente el género Browningia, y Leguminosae. También fueron abundantes Malvaceae, Capparaceae y Boraginaceae. Las especies más abundantes fueron Browningia pilleifera (F.Ritter) Hutchison, Browningia altissima (F.Ritter) Buxb. y Espostoa mirabilis F.Ritter, mientras que las más frecuentes fueron B. pilleifera, Eriotheca discolor (Kunth) A.Robyns y Parkinsonia praecox (Ruiz & Pav.) Hawkins. Las parcelas de la cuenca del Marañón fueron altamente homogéneas entre sí, conformando un grupo bien delimitado en los análisis UPGMA y NMDS. La única parcela incluida del Mantaro presentó similitudes florísticas con los bosques del Marañón. Sin embargo, mostró también cercanía con otras parcelas que fueron clasificadas como costeras al estar en una posición intermedia en los análisis multivariados.
2B. BES del Pampas (Tabla 1)
Las siete parcelas de este grupo están ubicadas en la cuenca del río Pampas, a lo largo de los valles de los ríos Pampas (Apurímac) y Torobamba (Ayacucho). En este grupo se encontraron 10 especies; los valores de riqueza no presentaron diferencias notables (5 parcelas con 4 especies), destacando solo APU_PAMPAS3 y AYA_TOROBAMBA4 con 6 especies cada una. Respecto a la abundancia los valores fueron similares entre sí (175 - 400 ind). Al estimar la densidad de especies para una hectárea, resaltó AYA_TOROBAMBA1 (400 ind./ha) con un 43% de individuos de Dodonaea viscosa (L.) Jacq., especie considerada como pionera y excelente competidora en ambientes disturbados y áridos, (Becker et al. 2016). Vachellia aroma (Gillies ex Hook. & Arn.) Seigler & Ebinger fue la especie leñosa más frecuente y abundante en los BES del Pampas, pues se registró en todos los sitios de estudio. Sin embargo, la especie emblemática fue Eriotheca vargasii (Cuatrec.) A.Robyns, solo registrada en este subgrupo. En ambos análisis (NMDS y UPGMA) las parcelas del Pampas formaron un grupo muy diferenciado con respecto a los otros sitios de los demás valles interandinos, aunque mantuvieron afinidades con los BES del Marañón-Mantaro, debido a la presencia de V. aroma y Cyathostegia matthewsii (Benth.) Schery.
3. Bosques estacionalmente secos Orientales (Fig. 3D).
Contiene un grupo de bosques bien diferenciado del resto, aunque más heterogéneo que los otros grupos, tanto en su composición como en su distribución. Este grupo estuvo conformado por 39 sitios, incluyó 440 especies y los siguientes subgrupos:
3A. BES orientales del norte (Tabla 1)
Incluyeron 12 parcelas inventariadas en el departamento de San Martín (en las localidades de Tarapoto, Bellavista y Juanjuí), dentro de la cuenca del río Huallaga. Este subgrupo registró 103 especies. SAM_PONAZA fue el sitio con la mayor riqueza (32 especies), mientras que SAM_TARAPOT2 fue la parcela con la menor riqueza (18 especies). Las especies más abundantes fueron Oxandra espintana (Spruce ex Benth.) Baill., Xylopia cuspidata Diels, Maytenus macrocarpa (Ruiz & Pav.) Briq. y Manilkara bidentata (A. DC.) A. Chev. Asimismo, SAM_PUCACACA fue el sitio con la mayor cantidad de individuos (246), donde O. espintana representó un 31.7% del total. Asimismo, el sitio menos abundante fue SAM_PAUCAR, con 50 individuos. En cuanto a la densidad, el máximo y mínimo valor estimados de las parcelas del subgrupo son 2460 y 1000 individuos por hectárea, respectivamente, teniendo en cuenta que se muestrearon individuos desde los 2.5 cm de DAP. En el UPGMA constituyeron un subgrupo independiente, mientras que en el NMDS los bosques orientales del Norte y del Centro fueron más difíciles de diferenciar, aunque se mantuvieron separados de los orientales del Sur.
3B. BES orientales del centro (Tabla 1)
Incluyó seis parcelas inventariadas en Satipo (departamento de Junín), en la parte superior del valle del río Tambo. Este grupo registró 103 especies, donde JUN_TAMBO1 y JUN_TAMBO6 fueron los sitios con mayor y menor riqueza, presentando 47 y 26 especies, respectivamente. En cuanto a la abundancia en las parcelas, JUN_TAMBO6 y JUN_TAMBO3 fueron los sitios con la mayor y menor abundancia, 143 y 90, respectivamente. Asimismo, las especies más abundantes del subgrupo fueron Myrcia splendens (Sw.) DC., Pentaplaris davidsmithii Dorr & C. Bayer, Piptadenia pteroclada Benth. y Eugenia obovata Poir. El subgrupo presentó un alto porcentaje de especies únicas (44.7%). Las seis parcelas presentaron valores altos de densidades estimadas (entre 1430 y 900 individuos por hectárea), considerando que se muestreó desde los 5 cm de DAP.
3C. BES orientales del sur (Tabla 1)
Incluyó 20 parcelas ubicadas en el departamento de Cusco (provincia de La Convención), en la confluencia de los ríos Ene y Perené y cerca de Quillabamba. Todas dentro de la cuenca hidrográfica del Urubamba. El subgrupo presentó 288 especies, donde CUZ_MANA-1 fue el sitio con la mayor riqueza (81 especies) y CUZ_SMAR-1 el de menor riqueza (40). Las especies más abundantes del subgrupo fueron Allophylus punctatus (Poepp.) Radlk., Annona neoulei H.Rainer, Pogonopus tubulosus (A.Rich.ex DC.) K.Schum., Warszewiczia coccinea (Vahl) Klotzsch y Anadenanthera colubrina (Vell.) Brenan. Asimismo, CUZ_KORB-2 y CUZ_ECHA-1 fueron los sitios con mayor y menor abundancia, teniendo 229 y 121 individuos, respectivamente. En cuanto a la densidad, se estimaron 2290 y 1210 individuos por hectárea, considerando individuos con un DAP mayor a 2.5 cm. Por otro lado, el dendrograma y el NMDS mostraron que el subgrupo Orientales del sur se consolida como un grupo florístico más definido en comparación con los subgrupos de orientales del Norte y del Centro, dado que sus parcelas se encontraron más próximas entre sí. Este grupo florístico compartió 20 especies con el Grupo Orientales del norte y 38 con el Grupo Orientales del centro.
Discusión
El conocimiento florístico de los BES en el Perú se ha incrementado notablemente desde la propuesta de clasificación cuantitativa de Linares-Palomino (2004b). Más importante aún, es que la información que se ha generado ala fecha ha reducido el sesgo que existía hacia los BES de lacosta norte (donde se concentraban la mayoría de los estudios), con importantes contribuciones principalmenteen los BES interandinos (por ejemplo Gonzáles et al. 2020;Marcelo-Peña et al. 2016) y orientales (por ejemplo Huamantupa-Chuquimaco et al. 2017; Marcelo-Peña 2017).
El trabajo realizado por Linares-Palomino (2004b)brindó la primera clasificación florística de precisiónde los BES peruanos. Sin embargo, el bajo número deparcelas que usó para realizar dicho estudio impidióesclarecer adecuadamente algunos de los grupos propuestos, así como las relaciones entre estos. Con el presente trabajo confirmamos la existencia de tres grandesgrupos de BES y detallamos las relaciones entre los grupos y al interior de estos. En primer lugar, los BES considerados originalmente como "remanentes" porque noexistía información cuantitativa ni cualitativa de camporeciente (Linares-Palomino 2004b), han sido incluidosen su totalidad en los tres grupos principales y sus subdivisiones. El caso más resaltante se dio con los BES de Ica, que fueron incluidos en el grupo de BES costeros,extendiendo la ocurrencia de este grupo desde la costanorte hasta la costa central. Por el lado de los BES interandinos, los cambios se han dado en su subdivisión. Elincremento de parcelas inventariadas definió el sistemadel Marañón-Mantaro como una sola unidad, y la división del sistema del Apurímac en Apurímac (con relaciones aún indefinidas) y Pampas (con característicaspropias que lo diferencian de los demás BES interandinos). Finalmente, en el caso de los BES orientales, elmayor muestreo ha permitido pasar de una única zona(Tarapoto) a una mayor extensión con subdivisionesbien definidas. En lo que sigue, caracterizamos cadauno de los grupos y subgrupos en base a los resultadosde nuestros análisis (Tabla 1), complementando con laliteratura y conocimiento existente.
1. Bosques estacionalmente secos costeros
Los BES costeros se concentran en los departamentos de Tumbes, Piura y Lambayeque, pero se extienden hasta la Libertad y más al sur hasta Ica. Es en la planicie costera norte (incluyendo las estribaciones bajas de los Andes) donde presentan la mayor extensión continua de BES en Perú, representando el 1.47% del territorio nacional (MINAM, 2018). Linares-Palomino (2004b) separó los bosques de este grupo en formaciones de llanura y montaña en base a caracteres florísticos y estructurales. Nuestro análisis confirma esta separación.
1.A. BES Pacífico-Ecuatoriales de Montaña
Incluye BES que se encuentran en un área climática de transición de la costa hacia la región tropical subhúmeda del Ecuador y en un rango de elevación que va desde los 130 m hasta los 2200 m de elevación. La fisiografía predominante es regularmente ondulada a colinosa y empinada (Leal-Pinedo & Linares-Palomino 2005). En el departamento de Tumbes se reportó temperaturas que sobrepasan los 20 °C, con una precipitación de temporada de noviembre a abril de 297.4 mm y una precipitación anual aproximada de 582.3 mm (Linares-Palomino & Ponce Alvarez 2005). Dentro de su extensión incluye gran parte de las áreas naturales protegidas del Coto de caza El Angolo, Parque Nacional Cerros de Amotape, Reserva Nacional de Tumbes, Refugio de Vida Silvestre Laquipampa y otras áreas de conservación con categoría de protección privada y regional (More et al. 2014).
Los análisis NMDS y UPGMA muestran uniformidad y una agrupación notable para las parcelas incluidas. Nuestros análisis incluyeron en este subgrupo algunas parcelas de los BES de Huancavelica, cuando las esperábamos entre los BES Interandinos basados en criterios geográficos (particularmente entre los BES del Marañón- Mantaro). Dado que A. macracantha y E. ruizii fueron parte de las especies que determinaron el carácter del grupo de BES Pacífico-Ecuatoriales de Montaña, su dominancia en las parcelas de Huancavelica (solo estas dos especies constituyeron mínimamente el 32% de los individuos en cada una de las tres parcelas) ha generado su inclusión en este grupo. Consideramos necesario realizar un muestreo más amplio de los BES en Huancavelica para resolver mejor sus relaciones florísticas y definir si constituyen bosques más afines a los BES de la costa norte o si tienen un carácter más interandino.
Consideramos que las dos parcelas ubicadas en Tumbes (TUM_ANGOSTURA y TUM_HUARAPAL), y que no fueron incluidas en ninguno de los tres grupos principales de BES identificados aquí, si bien pertenecen al bioma de BES neotropicales, tendrían más afinidades con los poco explorados bosques secos de montaña del norte del Parque Nacional Cerros de Amotape, de la Reserva Nacional de Tumbes, el Área de Conservación Regional Angostura-Faical y los BES adyacentes del Ecuador. La dominancia de Celtis iguanaea (Jacq.) Sarg., C. vitifolium, Ceiba trischistandra (A.Gray) Bakh., Simira ecuadorensis (Standl.) Steyerm. y Pithecellobium multiflorum (Kunth) Benth. (en Angostura) y de H. chrysanthus, C. vitifolium y S. ecuadorensis (en Huarapal) confirma el carácter de BES de estas parcelas (Linares- Palomino et al. 2012) y coincide con las especies que definen los BES ecuatoriano-peruanos (Aguirre Mendoza et al. 2006). Consideramos que, para resolver adecuadamente estas relaciones más regionales y continentales, necesitamos analizar los datos de BES en Perú en un contexto más amplio, incluyendo no sólo datos de BES neotropicales, sino de los principales biomas boscosos del continente (Dexter et al. 2018).
1.B. BES costeros de Llanura
Se encuentran en la costa de los departamentos de Tumbes, Piura, Lambayeque, La Libertad e Ica, abarcando una superficie de 1.12% (1’452,575.98 ha) del territorio nacional, comprendidos entre el nivel del mar y los 500 m de altitud (La Torre-Cuadros & Linares-Palomino 2008; MINAM, 2018). Estos BES están expuestos a un clima semi-árido, que oscila entre los 75 y 180 mm de precipitación anual (SENAMHI-DRD 2021) y que puede variar por su fuerte relación con el fenómeno de El Niño. Durante el denominado Niño Costero en el 2017, en los meses de febrero a abril, la intensidad de precipitación aumentó drásticamente, alcanzando valores de 50 mm/h, causando severos daños a la población, pero beneficiando las dinámicas de regeneración de los bosques (Neyra & Olivares 2019). Es considerado como un ecosistema subárido caducifolio, homogéneo y extenso, tiene bajas densidades y riqueza de especies (6 especies con un DAP ≥ 10 cm, por hectárea), donde los extremos son áreas con presencia homogénea y dominante de P. pallida, o donde la densidad arbórea es tan baja que parece a una sabana arbórea.
Las especies más abundantes de este subgrupo se registraron en parcelas de La Menta (Rasal Sánchez et al. 2011) y fueron C. lutea (38 individuos), B. graveolens (22) y Tecoma stans (L.) Juss. ex Kunth (20), mientras las menos abundantes fueron Beautempsia avicenniifolia (Kunth) Gaudich., C. scabridum, C. glabrata, Geoffroea striata (Willd.) J.F.Macbr., Schrebera americana (Zahlbr.) Gilg y Ximenia americana L.
En las parcelas ubicadas en las localidades de Timbes (Piura) y Chaparrí (Lambayeque) la mayor abundancia también la tuvo C. lutea con 95 y 249 individuos, respectivamente. Distintas presiones humanas como la deforestación y el pastoreo explicarían la abundancia de esta especie (Linares-Palomino & Ponce-Alvarez 2009; Rasal Sánchez et al. 2011). En las llanuras costeras de Piura, la especie más frecuente fue P. pallida, que también fue monodominante en una de las parcelas (La Torre-Cuadros & Linares-Palomino 2008). Las familias más representativas de este subgrupo fueron leguminosas (34% del total de especies), Malvaceae-Bombacacoideae (9%), Polygonaceae (5%), Bignoniaceae, Boraginaceae, Lauraceae, Capparaceae y Moraceae (4%) (Linares-Palomino 2005).
La distancia de más de 600 km entre los BES de la costa norte e Ica presenta una interrogante fitogeográfica interesante. La conexión florística es clara, indicada principalmente por la dominancia de Prosopis en ambas zonas. Las zonas de contacto intermedias que podrían explicar esta relación están dadas por los valles costeños y zonas adyacentes, donde se han registrado especies de Prosopis (Romo & Rosina 2012; Romo et al. 2015). Adicionalmente, evidencia arqueobotánica e histórica sugiere que los bosques de algarrobo en estos valles fueron más extensos y densos de lo que se observa actualmente (Beresford-Jones 2011; Beresford-Jones & Whaley 2022), lo que pudo haber favorecido el intercambio y migración de especies de BES.
2. Bosques estacionalmente secos Interandinos.
Linares-Palomino (2006) reconoció la presencia de estos BES en los valles del Marañón, Mantaro y Apurímac. Geográficamente, los valles del Mantaro y Apurímac se encuentran separados entre sí por 200 km de bosque húmedo de selva baja y separados del valle del Marañón por 600 km de montañas entre los 4000 m y 5000 m de altitud (Pennington et al. 2010). Debido a su aridez, que contrasta con los ecosistemas aledaños, y al aislamiento surgido por la elevación de la cordillera de los Andes durante el Plioceno-Mioceno (Pennington et al. 2010), los bosques de estos valles se extienden a manera de islas en un archipiélago. Esto genera que cada uno de estos valles presente composición florística, densidades de plantas y riqueza de especies particulares (Marcelo-Peña et al. 2016). Banda-Rodríguez et al. (2016), en su ejercicio de comparar los BES en un contexto neotropical, distinguieron dos grupos restringidos a los valles secos del Perú: BES de valles interandinos centrales y de la región del Apurímac-Mantaro. Nuestros análisis mostraron que los BES interandinos conformaron un grupo consolidado e identificable, unavez que se excluyen las parcelas del valle del río Apurímac (que distorsionaban los patrones pues se presentaban como entidades muy diferentes del resto de datos).
Esto coincide con lo expuesto por Banda-Rodríguez etal. (2016), que mencionaban que los BES del Apurímacy del Mantaro poseían características que hacían difíciles clasificarlos inequívocamente. Reconocemos dossubgrupos de BES interandinos:
2.A. BES del Marañón-Mantaro
Los bosques de este sistema se distribuyen entre los 450 m y los 2200 m de altitud en los departamentos de Amazonas, Cajamarca, La Libertad y Huancavelica (Mantaro). El promedio anual de temperatura varía entre 25 y 28 °C, con una precipitación media anual de 550 mm en la zona septentrional (Amazonas), mientras que en la zona austral (Cajamarca), la temperatura oscila entre 28 y 34°C con precipitación media anual de 840 mm (Mar-celo-Peña et al. 2019).
La flora tiene niveles de endemismo elevados, mayores al 33% del total de especies registradas (Marcelo-Peña et al. 2016). En algunos sectores del valle del Marañón las especies endémicas son abundantes e incluso dominantes, como es el caso de B. pilleifera, B. altissima, E. mirabilis y Tetrasida chachapoyensis (Baker f.) Fryxell & Fuertes. Una característica distintiva de este subgrupo es la dominancia de la familia Cactaceae (Marcelo-Peña et al. 2016).
Si bien este subgrupo está principalmente compuesto por parcelas de los BES en el valle del Marañón, también incluye una parcela de Huancavelica (HUV_Chiquiacc4). Esta parcela tiene valores similares de diversidad y abundancia a los registrados en el Marañón y su afinidad estaría determinada principalmente por la presencia de A. colubrina y A. macracantha.
Hasta hace poco, estos bosques carecían de esfuerzos formales de protección y conservación, a pesar delllamado de diversos autores (Banda-Rodríguez et al.2016; Marcelo-Peña et al. 2016). Hay iniciativas de conservación que están revirtiendo la situación, como elÁrea de Conservación Regional (ACR) "Bosques Tropicales Estacionalmente Secos del Marañón" que se declaró en junio del 2018 (Decreto Supremo 006-2018-MINAM) o el ACR "Bosques secos del Marañón" declaradaen mayo del 2021 (Decreto Supremo 007-2021-MINAM), y otras en proceso, principalmente privadas. Apesar de los altos valores de endemismo y de su carácter florístico distinto, que tiene paralelos en la diversidad y niveles de endemismo en anfibios, artrópodos,aves, mamíferos y reptiles (Guzman Valqui et al. 2021;Koch et al. 2018; Roncal-Rabanal et al. 2013), los niveles de protección aún son bajos, y solo el 1% del áreade BES en el valle del Marañón está incluido en el Sistema Nacional de Áreas Naturales Protegidas (SINANPE)(Guzman Valqui et al. 2021).
2.B. BES del Pampas
Estos bosques se ubican entre los 1845 m y los 2334 m de elevación en los departamentos de Ayacucho y Apurímac; e incluyen los valles secos en las cuencas de los ríos Apurímac, Pampas y Torobamba. La precipitación total anual varía entre los 800 - 1000 mm (Eduardo-Palomino et al. 2017).
El subgrupo del Pampas se diferencia de los otros BES interandinos por su bajo número de especies e individuos por unidad muestral. Esta situación sería un reflejo del pequeño tamaño de los fragmentos de bosque remanente, un indicador de la necesidad de su conservación.
Finalmente, discutimos brevemente las características de las cinco parcelas de los valles del Torobamba (Ayacucho) y Apurimac (Cusco) identificadas como valores atípicos y que fueron excluidas del análisis final. Las parcelas AYA_TOROBAMBA17, AYA_TOROBAMBA18, AYA_TOROBAMBA19 y AYA_Torobamba5 tuvieron solo tres a cuatro especies. Si bien consideramos a varias de ellas como típicas de los BES del sistema del Apurimac (Tabla 1), como Vasconcellea quercifolia A. St.-Hil., E. vargasii e Ipomoea pauciflora subsp. vargasiana (O'Donell) McPherson (estas dos últimas incluso son endémicas de los valles secos del sistema del Apurimac), todas tuvieron densidades extremadamente bajas (1 - 5 individuos). Esta combinación de pocas especies y densidades bajas hace que los métodos multivariados no puedan establecer adecuadamente relaciones cuantitativas. Sin embargo, las consideramos a todas como parte de los BES interandinos del Pampas. El caso de la parcela CUZ_Wayronqa es diferente. Tuvo nueve especies, que en su mayoría no son típicas de los BES interandinos, cuatro de las cuáles sólo se registraron allí (unicados como Abutilon peruvianum (Lam.) Kearney y Berberis humbertiana J.F. Macbr.). Esta composición diferente hizo que los métodos multivariados la excluyeran.
3. Bosques estacionalmente secos Orientales.
Linares-Palomino (2004b) identificó a estos bosquescomo la subunidad de BES Orientales, en base a datosde dos parcelas de BES en Tarapoto. Hizo hincapié en sucomposición florística, reconocida como transicional ydistante de los BES Pacífico-Ecuatoriales e Interandinos. Principalmente, porque estos BES están inmersos en lamatriz de bosques más húmedos de la llanura amazónica y pre-montaña, pudiendo entonces contener especiesque son típicas de estos ecosistemas. Más recientemente,Banda-Rodríguez et al. (2016) reconoció el grupo BESde Tarapoto-Quillabamba para el Perú (con subgruposOrientales norte y Orientales sur). Este grupo, a pesar deque fue uno de los grupos con menor número de parcelas muestreadas y de los más pequeños en extensión delNeotrópico, registró 332 especies leñosas, superando agrupos como los BES costeros. Asimismo, presentó ende-mismos restringidos a Tarapoto (Bridgewater et al. 2003;Linares-Palomino 2004b). Nuestro análisis, ahora con másinventarios en regiones del norte, centro y sur, confirmaneste patrón florístico distintivo de los otros dos grupos deBES, y reconocemos tres subgrupos bien definidos.
3.A. BES orientales del Huallaga
Estos bosques se encuentran en el valle de la parte media del río Huallaga (departamento de San Martín) entre los 191 m hasta los 527 m de de elevación, próximos a las ciudades de Tarapoto y Juanjuí (con precipitaciones medias anuales de 1164 mm y 1433 mm, respectivamente, y una temperatura promedio anual de 26 °C para ambas localidades) (SENAMHI-DRD 2021). García-Villacorta (2009) mostró que las familias con mayor riqueza de especies fueron Myrtaceae (14 especies) seguida de Fabaceae (12). Mientras que Annonaceae y Myrtaceae fueron las familias con mayor abundancia de individuos. Por otro lado, M. bidentata (conocida localmente como quinilla) fue el árbol más importante en la estructura de estos bosques, por el área basal que presentó. Sólo una especie del género Coccoloba (Polygonaceae) y O. espintana (Annonaceae) estuvieron presentes en todos los sitios, mientras que 53 especies ocurrieron en un solo sitio. Adicionalmente a estas características florísticas, estos bosques también contienen comunidades de aves únicas y diversas (Vásquez-Arévalo et al. 2018) que confirman la definición de este subgrupo oriental. Sin embargo, estudios de las comunidades de mamíferos menores no encontraron especies endémicas o especialistas de BES y la mayoría de las especies registradas en los BES del Huallaga también ocurrieron en los bosques húmedos de llanura adyacentes (Ruelas & Pacheco 2021).
3.B. BES orientales del Tambo
Son BES en Satipo (departamento de Junín), dentro de la cuenca del Medio Ucayali. Presentan una precipitación media anual de 1757 mm y una temperatura media anual de 21.5 °C (ONERN 1976). Las especies más importantes que se registraron en un estudio florístico reciente fueron P. davidsmithii, Cavanillesia umbellata Ruiz & Pav., Casearia gossypiosperma Briq., M. splendens, Ceiba insignis (Kunth) P.E.Gibbs & Semir, Aspidosperma cylindrocarpon Müll.Arg., Machaerium acutifolium Vogel y Luehea grandiflora Mart., sólo Trichilia reynelii T.D. Penn. parece ser endémica de estos bosques y restringida al valle del Río Tambo (Marcelo-Peña 2017). Este autor indicó que estos BES presentan valores de riqueza de especies similares a otras formaciones de BES orientales, aunque resalta los bajos valores de endemismo, que pueden deberse a falta de conocimiento botánico de esta región.
3.C. BES orientales del Urubamba
Se ubican en la cuenca media del río Urubamba, Cusco, entre los 700 m y 1300 m de elevación. Según Huamantupa-Chuquimaco et al. (2017) las familias más comunes fueron Fabaceae (69 especies), Bignoniaceae (30), Moraceae (27), Apocynaceae (23) y Sapindaceae (22). Mientras que las cinco especies más abundantes fueron A. punctatus (142 individuos), P. tubulosus (122), W. coccinea (111), A. neoulei (106) y A. colubrina (95). El análisis fitogeográfico de estos BES sugirió que presentaban más similitudes con los bosques Chiquitanos de Bolivia que con otros BES peruanos (Huamantupa- Chuquimaco et al. 2017). Si bien nuestros análisis los reconocen como parte de un grupo homogéneo de BES Orientales en el Perú, queda pendiente un análisis comparativo con otros BES y biomas neotropicales para dilucidar relaciones fitogeográficas a niveles continentales (Silva de Miranda et al. 2018). Huamantupa-Chuquimaco (2011) y Huamantupa-Chuquimaco et al. (2017) identificaron a su vez tres tipos de BES en toda la cuenca media del Urubamba: el bosque seco Sabanero, el bosque seco Amazónico y el bosque seco sub-Andino, indicando que de estos BES solo quedan remanentes (se estima que se ha perdido aproximadamente el 70% de la superficie original, I. Huamantupa-Chuquimaco, obs. pers.) y por lo tanto están fuertemente amenazados.
¿Bosques o sabanas estacionalmente secas en Chanchamayo?
La parcela de vegetación estacionalmente seca de Chanchamayo se encontró florísticamente distante a las demás muestras de BES en nuestro set de datos. No pudimos demostrar afinidad ni siquiera con el grupo de los BES orientales del Tambo, con los que esperábamos alguna relación debido a que todas estas parcelas se ubican dentro de la cuenca hidrográfica del río Perené (departamento de Junín). Esta parcela en Chanchamayo sería parte de unos relictos fragmentados de vegetación seca a aproximadamente 900 m de elevación y con suelo fuertemente ácido, ya descritas por Weberbauer en su mapa de vegetación del Perú (Weberbauer 1922). La parcela se encuentra en una región con precipitación anual de alrededor de 2000 mm/año. Si esta parcela está expuesta a estos niveles de precipitación escaparía a la definición de BES que usamos en este trabajo. Al igual que todos los BES orientales, está embebida en una matriz de vegetación de bosque húmedo tropical montano del valle de Chanchamayo, cuyos estratos premontano y montano nublado son florísticamente muy distintos, presentando solo un 3 - 5% y 1% de similitud, respectivamente (Antón & Reynel Rodriguez 2009; Palacios & Reynel Rodriguez 2011). Esta parcela solo compartió tres especies (Allophylus floribundus (Poepp.) Radlk., Guazuma ulmifolia Lam. y Terminalia oblonga (Ruiz & Pav.) Steud.), de un total de 28 registradas por Palacios y Reynel Rodriguez (2011), con las parcelas geográficamente próximas del subgrupo de BES Orientales del Tambo. De igual manera, solo compartió tres especies con las parcelas de los BES del Huallaga (A. floribundus, Cecropia polystachya Trécul y Luehea paniculata Mart.). Con las parcelas de los BES del Urubamba compartió siete especies, entre ellas G. ulmifolia y L. paniculata. Banda-Rodríguez et al. (2016) también reconocieron esta diferencia con los BES orientales y más bien indicaron las afinidades de la parcela de Chanchamayo con el grupo florístico de BES del Brasil Central (con más de la mitad de las 28 especies de Chanchamayo registradas también en Brasil). Este grupo se describió como un conjunto de pequeños parches dispersos de bosque caducifolio en áreas de suelo fértil, dentro del gran ecosistema de sabana del Cerrado.
Los ecosistemas estacionalmente secos dominados por pastos, conocidos como sabanas, y embebidos en la matriz de bosques húmedos del oriente peruano representan aún una incógnita fitogeográfica por resolver.
Las encontramos en el valle del río Urubamba (Cusco), alinfluencia antrópica por la intensa intervención humanasur de Tarapoto (San Martín) y como fragmentos de po-que ha habido en el valle (Reynel Rodriguez 2012). Estocas hectáreas de extensión en el valle de Chanchamayopodría incluso ser un paralelo de lo que ocurre en el Gran(Junín). El reciente mapa de ecosistemas del Perú iden-Pajonal, donde lo que hoy vemos como pastizales a matifica a la vegetación seca en Chanchamayo como bosquenera de sabana responde a una larga historia de converbasimontano de Yunga (MINAM 2018) (Fig. 4). Sin embar-sión del bosque montano húmedo por ciclos repetidos dego, la vegetación seca del valle de Chanchamayo podríaagricultura migratoria, quema e introducción de especiesser más bien considerada una sabana antes que un BES,de pastos exóticas (Scott 2004). Consideramos necesariacomo lo demostró Palacios (2017) al identificar una bue-una evaluación detallada de la diversidad y composiciónna afinidad de esta zona con las sabanas del Cerrado. Adi-vegetal de las formaciones de BES y de sabanas secas encionalmente, es posible que esta vegetación correspon-el Perú, y del grado de la influencia humana en formar yda a un ecotono donde se mezclan especies del bosquemantenerlas, para aclarar sus afinidades florísticas en elpremontano húmedo con especies del BES, con marcada contexto nacional y neotropical.
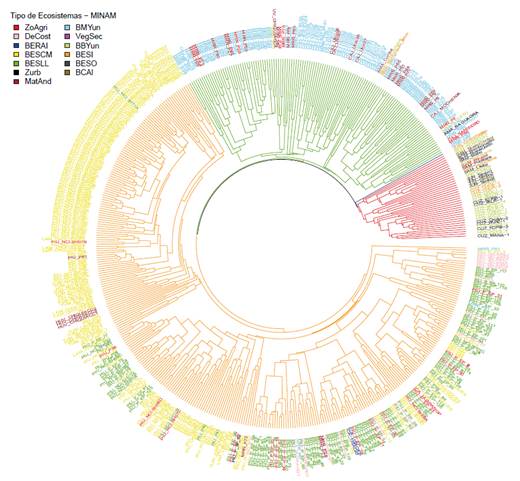
Figura 4: Contraste de la clasificación UPGMA de los BES del Perú (ramas del dendrograma, este estudio) con el mapa nacional de ecosistemas (MINAM, 2018, etiquetas del dendrograma). Los ecosistemas de BES identificados fueron: bosque estacionalmente seco de llanura (BESLL), bosque estacionalmente seco de colina y montaña (BESCM), bosque estacionalmente seco interandino (BESI), bosque estacionalmente seco oriental (BESO). Otros ecosistemas indentificados: desierto costero (DeCost), bosque relicto altoandino (BERAl), matorral andino (MatAnd), bosque montano de Yunga (BMYun), bosque basimontano de Yunga (BBYun), bosque de colina alta (BCAl). Identificamos también: vegetacion secundaria (VegSec), zona agrícola (ZoAgri) y zona urbana (Zurb).
Correspondencia de la clasificación florística de los BES del Perú con el mapa de ecosistemas del Perú
El Mapa Nacional de Ecosistemas del Perú (MINAM 2018) identifica cinco ecosistemas que coinciden, en términos geográficos, con los tres grandes grupos de BES que reconocemos en este trabajo. Para los BES costeros diferencia los ecosistemas de bosque estacionalmente seco de colina y montaña, bosque estacionalmente seco de llanura y bosque estacionalmente seco ribereño (algarrobal). Para los BES interandinos reconoce un solo tipo de bosque estacionalmente seco interandino (en los valles del Marañón, Mantaro y Pampas-Apurímac), igual que para los BES orientales el bosque estacionalmente seco oriental (en los valles del Huallaga, Ene-Perené y Urubamba). Ahora, ¿qué tan bien coinciden cada una de las parcelas que tenemos en BES con la delimitación geográfica de estos ecosistemas? Al mapear cada parcela sobre el mapa de ecosistemas (Figs. 4 y 5), en adición a parcelas que se ubicaron sobre un ecosistema definido como bosque estacionalmente seco (384 de 503 parcelas, 76.3%), tuvimos parcelas que según el mapa de ecosistemas fueron clasificadas como matorral andino (35 parcelas, 7%), zona agrícola (34 parcelas, 6.8%), vegetación secundaria (22 parcelas, 4.4%) y otros tipos de ecosistemas (28 parcelas en bosque tropical del pacífico, bosque de colina alta, desierto costero, pastizales/herbazales, bosque basimontano de yunga y zona urbana).
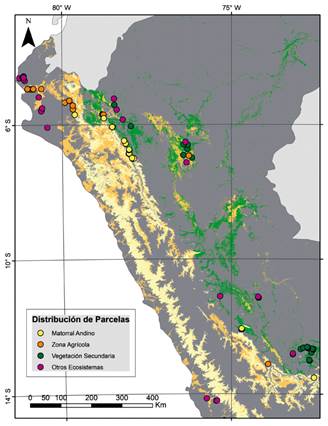
Figura 5 Distribución de parcelas que no fueron clasificadas como BES, según el mapa nacional de ecosistemas (MINAM, 2018).
Los BES costeros han pasado por un proceso dinámico de clasificación (La Torre-Cuadros & Linares-Palomino2008) y la reciente elaboración del Mapa Nacional de Cobertura Vegetal del Perú (MINAM 2015), identificó sieteformaciones vegetales de tipo bosque basándose en cuatrocriterios y clasificándolas como bosque seco tipo sabana,bosque seco de piedemonte, bosque seco de lomada, bosque seco de colina baja, bosque seco de colina alta y bosqueseco de montaña que se superponen con este tipo de BES.Cabe resaltar que algunas de las parcelas que tienen mástiempo de haber sido evaluadas, se han visto modificadasdebido a cambios de uso de tierra en años más recientes. Algunas han cambiado drásticamente su cobertura, comoparcelas en los bosques de Piura (16 parcelas) e Ica (1 parcela) que ahora forman parte de zonas agrícolas en el mapade ecosistemas (MINAM 2018). Adicionalmente, una revisión de imágenes satelitales recientes (junio 2021) mostróque algunas de estas parcelas habrían pasado incluso a serzona urbana debido a un proceso paulatino de invasión uocupación por la población. De los tres departamentos queincluyen grandes extensiones de BES costeros, Piura es laregión donde ha habido la mayor cantidad de parcelas queoriginalmente (al momento de su instalación e inventario)fueron consideradas como BES y que actualmente (a junio2021) son consideradas zonas agrícolas.
Con respecto a las parcelas del subgrupo de BES costeros de llanura, solo el 46.4% (del total de 224 parcelas)coincidió con la clasificación del MINAM. Un 29.4% se clasificó como bosque estacionalmente seco de colina y montaña, el 10% como zona agrícola y el 13% de las parcelasfueron consideradas como otro ecosistema (8.9% comodesierto costero, 3.1% matorral andino, 1.3% bosque estacionalmente seco interandino y 0.4% zona urbana). Delas 120 parcelas incluidas en el subgrupo de BES Pacífico-Ecuatoriales de montaña, el 87.5% correspondió a la clasificación establecida por el MINAM. El resto de las parcelasfue considerado como bosque estacionalmente seco interandino (6.7%), matorral andino (3.3%), zona agrícola(1.7%) y bosque tropical del pacífico (0.8%).
Para el sistema Marañón-Mantaro, el 60% de las parcelas fue clasificado como bosque estacionalmente secointerandino, mientras que el 17.7% como matorral andino, el 3.1% como río (posiblemente por errores de geo-localización), 5.4% como otros ecosistemas y 5.4% como zona agrícola. Al 8.4% de las parcelas no se le asignó ningún ecosistema por errores de geolocalización. Por el lado del sistema del Pampas, solo una parcela fue catalogada como zona agrícola.
Solo el 36% (de un total de 39 parcelas) se reportan como ecosistema de bosque estacionalmente seco oriental. El 46% está considerado como vegetación secundaria, y las restantes han sido consideradas como bosque basimontano de yunga, bosque de colina alta y una se habría transformado en zona agrícola.
¿Cómo seguimos avanzando el conocimiento florístico de los BES en el Perú?
Los BES neotropicales vienen siendo usados por grupos humanos desde tiempos pre-incas (Hocquenghem 1998; Ugent & Ochoa 2006), han sido fuertemente modificados y reducidos a un porcentaje mínimo de lo que se estima que originalmente cubrían (Portillo-Quintero & Sánchez-Azofeifa 2010). Para los BES Pacífico-Ecuatoriales, incluyendo los BES del suroeste del Ecuador, se estimó que sólo queda el 30% de la extensión original (25% en Ecuador, 5% en Perú) (Escribano-Avila et al. 2017). Un estudio reciente en los BES del Ecuador mostró que solo en el periodo 1990 - 2018 se perdió más de un cuarto de la superficie que existía en 1990 (Rivas et al. 2020). Ante estos escenarios, es evidente que el panorama futuro de estos bosques es preocupante. En términos de completar nuestro conocimiento de la florística, las relaciones fitogeográficas y la ecología de estos bosques, consideramos necesario implementar estudios a largo plazo en parcelas permanentes. Esto nos permitirá entender la dinámica y cambios en la composición de la vegetación a mediano y largo plazo. Asimismo, creemos que es urgente entender las principales causas de de gradación por grupo y subgrupo de BES; identificar los niveles de degradación, fragmentación y deforestación. Esto permitirá diseñar actividades de conservación y restauración específicas para cada tipo de BES, de manera similar como se ha hecho con la priorización de áreas para restauración de áreas degradadas (SERFOR 2019). Por último, es necesario contribuir a (y) extender los esfuerzos hechos por el Ministerio del Ambiente (MINAM, 2018) en cuanto al modelamiento de la distribución de los distintos grupos de BES del Perú, con fines de priorización de (nuevas) áreas de conservación y restauración de bosques degradados.
En términos de los grupos florísticos identificados, consideramos indispensable aumentar los esfuerzos de estudio en cada uno de los tres subgrupos de BES orientales. Ellos contienen a la fecha el menor esfuerzo de muestreo (38 parcelas), pero sus valores de densidad, diversidad, dominancia y especies únicas muestran que son formaciones vegetales muy particulares que son importantes conservar y seguir estudiando, ante un creciente impacto antropogénico que degrada sus áreas de manera constante. De la misma manera, aún no está resuelta la afinidad de los BES Interandinos en Huancavelica y en el Apurímac. Necesitamos adicionar parcelas cuantitativas en cada una de estas zonas para conocer mejor la estructura y composición de su vegetación y así mejorar la resolución de sus relaciones florísticas.












 uBio
uBio