Introducción
El género Anthias consta de nueve especies (Anderson & Heemstra 2012) las cuales habitan arrecifes rocosos y de coral hasta unos 200 m de profundidad; por lo general se encuentran por debajo de los 100 m (Heemstra & Randall 1986). Ocho especies están distribuidas en aguas tropicales y subtropicales del océano Atlántico y mar Mediterráneo, y una en el Pacífico oriental. Anthias noeli Anderson & Baldwin, 2000 ha sido registrado en las islas Galápagos, Isla del Coco (Costa Rica) y Ecuador continental (Anderson & Heemstra 2012; Béarez & Jiménez-Prado 2003). Para Béarez y Jiménez-Prado (2003), la presencia de A. noeli en la plataforma continental de Ecuador podría estar relacionada con el tardío régimen de El Niño Oscilación Sur (ENSO) de los años 1997-1998.
En agosto de 2016, en la localidad de Acapulco, departamento de Tumbes (extremo norte de Perú), se registró el desembarque de A. noeli como captura incidental de Merluccius gayi peruanus realizada con redes cortina de fondo. Debido a su coloración y semejanza morfológica, los pescadores artesanales la confundieron inicialmente con Pronotogrammus multifasciatus Gill, 1863 (Perciformes: Serranidae).
En el presente trabajo se registra a Anthias noeli por primera vez para Perú, lo que amplía su distribución sur. Además, se realiza por primera vez la secuencia del gen COI de esta especie y se compara con las secuencias de otras especies del mismo género.
Material y métodos
Colecta de materiales. Se analizaron 15 ejemplares capturados en el litoral de Tumbes; provenientes de capturas comerciales desembarcadas en la localidad de Acapulco (3°44’24.3”S, 80°46’19.1”W). La pesca fue realizada con redes de cortina de fondo con tamaños de malla de 69.9 y 88.9 mm. El primer ejemplar fue capturado el 11 de agosto de 2016 (3°31’00”S, 80°50’00”W), a 74 m de profundidad. Posteriormente, cinco ejemplares fueron capturados el 17 de octubre de 2019 (3°35’32”S, 81°09’18”W), a 229 m de profundidad; y finalmente, el 26 de octubre de 2019 fueron capturados tres ejemplares (3°34’38”S, 81°11’20”W), a 247 m de profundidad; y seis ejemplares (3°29’30”S, 81°15’20”O), a 265 m de profundidad (Fig. 1).
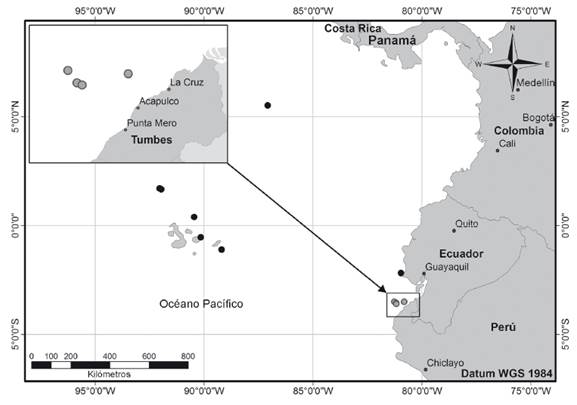
Figura 1 Distribución geográfica de Anthias noeli en el Pacífico oriental tropical. Círculos negros: distribución anteriormente conocida. Circulos grises: nuevos registros en el litoral de Tumbes, Perú.
Los ejemplares fueron trasladados al Laboratorio Costero de Tumbes (LC-Tumbes) del Instituto del Mar del Perú (IMARPE), donde fueron fotografiados en fresco, se realizaron los análisis merísticos y morfométricos para su identificación taxonómica; así mismo, se recolectó tejido muscular para el posterior análisis genético. Luego, los ejemplares fueron fijados en formol al 5% y preservados en alcohol etílico al 70%.
Para la revisión taxonómica se siguió la clave de Anderson y Baldwin (2000). Para los análisis merísticos y morfométricos se siguió a Chirichigno y Vélez (1998). Las medidas se registraron en milímetros en un formato prediseñado. Los especímenes recolectados se depositaron en la colección biológica del LC-Tumbes de IMARPE, con los códigos consignados en la Tabla 1, como parte del Proyecto “Identificación molecular de ADN de la diversidad ictiológica de los ambientes marino, de manglar y continental del departamento de Tumbes” (N° 192-2015-FONDECYT-DE).
Tabla 1 Datos merísticos de ejemplares de Anthias noeli colectados en Tumbes, Perú.
| Código | Escamas en la línea lateral | Espinas dorsales | Radios dorsales | Espinas anales | Radios anales | Radios pectorales | Espinas ventrales | Radios ventrales |
|---|---|---|---|---|---|---|---|---|
| LCT_600 | 41 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2261 | 42 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2262 | 44 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2263 | 43 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2264 | 43 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2265 | 41 | 10 | 15 | 3 | 7 | 20 | 1 | 5 |
| LCT_2266 | 42 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2267 | 41 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2268 | 44 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2269 | 42 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2270 | 45 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2271 | 42 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2272 | 41 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2273 | 42 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
| LCT_2274 | 43 | 10 | 15 | 3 | 7 | 19 | 1 | 5 |
Análisis genético. La extracción de ADN total se realizó a partir de las muestras de tejido muscular, usando el kit de extracción Thermo Scientific, siguiendo las recomendaciones del fabricante. La secuencia parcial del gen mitocondrial citocromo C oxidasa I (COI) se amplificó mediante la reacción en cadena de la polimerasa (PCR) utilizando los cebadores Fish F1 y Fish R1 (Ward et al. 2005). Los productos amplificados fueron secuenciados a través de la técnica de Sanger, en ambos sentidos de la cadena de ADN (forward y reverse). Los electroferogramas resultantes de este análisis fueron ensamblados, alineados y editados usando los programas GENEIOUS v.9.1.2 (Biomatters Ltd.) y BIOEDIT v.7.1.7 (Hall 1999), obteniendo una secuencia consenso de 652 pares de bases (pb).
Las secuencias obtenidas fueron comparadas con secuencias del gen COI pertenecientes a las especies Anthias anthias (Linnaeus 1758), Anthias woodsi Anderson y Heemstra 1980, Anthias nicholsi Firth 1933, y Anthias asperilinguis Günther 1859, las cuales se descargaron de la base de datos Genbank (https://www.ncbi.nlm.nih.gov/genbank/). La secuencia COI perteneciente a Epinephelus labriformis (Jenyns 1840), se utilizó como grupo externo. Las secuencias fueron obtenidas de la base de datos del Barcode of Life Data Systems (BOLD Systems, http://www.boldsystems.org/). Todas las secuencias obtenidas de Anthias noeli fueron depositadas en la base de datos del BOLD Systems con sus respectivos códigos de acceso como se muestra en la Tabla 2.
Tabla 2 Lista de taxones, código de acceso y lugar de origen de las especies analizadas en el presente estudio.
| Especies | Código de acceso | Localidad |
|---|---|---|
| Anthias anthias | KX925321.1 | Malta |
| Anthias anthias | MN134647.1 | Galicia, Spain |
| Anthias asperilinguis | MF322553.1 | Curacao |
| Anthias asperilinguis | MF322569.1 | St. Paul Rocks, Brazil |
| Anthias nicholsi | MF322571.1 | Bear Seamount, New England |
| Anthias nicholsi | MF322573.1 | New York, U.S.A. |
| Anthias noeli | FMCT1282N21 | Tumbes, Peru |
| Anthias noeli | FMCT1283N21 | Tumbes, Peru |
| Anthias noeli | FMCT1284N21 | Tumbes, Peru |
| Anthias noeli | FMCT1285N21 | Tumbes, Peru |
| Anthias noeli | FMCT1237N19 | Tumbes, Peru |
| Anthias woodsi | MF322577.1 | Delaware, U.S.A. |
| Anthias woodsi | MF322578.1 | Delaware, U.S.A. |
| Epinephelus labriformis | PMFSH974-21 | Tumbes, Peru |
Se utilizó el software MEGA v.X para realizar el análisis de distancia genética, utilizando el modelo de sustitución Kimura-2 parámetros (Kimura 1980) y el método bootstrap (Felsenstein, 1985) con 5000 repeticiones.
Resultados
Caracteres diagnósticos. Los individuos analizados presentaron cuerpo comprimido, alargado, oblongo; cabeza comprimida; ojos grandes; las narinas anteriores y posteriores muy juntas; la boca oblicua y subterminal; la mandíbula inferior saliente y la maxila expuesta cuando la boca estuvo cerrada; sin dientes en la lengua; el preopérculo con el margen posterior aserrado y el ángulo inferior sin espinas dirigidas hacia adelante (Fig. 2).
Además, presentaron aleta dorsal X, 15, espina IV o V más alargada y por lo menos dos radios blandos alargados; anal III, 7, espina II más gruesa y radio 3 alargado; pectorales con 19 radios; pélvicas I, 5; aleta caudal ahorquillada; línea lateral completa con 41 a 44 escamas; cabeza y mandíbulas completamente escamadas, excepto la mandíbula inferior que fue desnuda (a veces unas escamas en la parte posterior).
Los ejemplares analizados midieron entre 177 a 215 mm de longitud estándar (LS). Los datos morfométricos son mostrados en la Tabla 3.
Coloración en fresco. El cuerpo de los ejemplares analizados fue color rosa, azulado en el dorso, plateado pálido en la parte ventral; ojos azules, con centro amarillo alrededor de la pupila; pupila negra, con borde plateado; una franja amarilla en el lado del hocico hasta los ojos, que continuó detrás del ojo hacia el ángulo superior del opérculo; aleta dorsal espinosa rosada, parte blanda azul-rosa, con los rayos largos amarillos; aleta caudal rojiza a rosado oscuro con los bordes superior e inferior blancos; aleta anal rojiza, borde delantero amarillo; aletas pélvicas rojizas, las espinas y los radios anteriores amarillos; pectorales rosa a rojo (Fig. 2).
Tabla 3 Datos morfométricos de ejemplares de Anthias noeli colectados en Tumbes, Perú. Las medidas están en mm y las abreviaturas corresponden a longitud total (LT), longitud estándar (LS), diámetro ocular (DO), espacio interorbital (IO), longitud de la cabeza (LC), altura del cuerpo (AC), longitud del hocico (LR), longitud post-orbital (LPO), longitud de la maxila (LM), longitud de aleta ventral (LV), longitud de aleta pectoral (LP), longitud de aleta dorsal (LD), longitud de aleta anal (LA), longitud del pedúnculo caudal (LPC) y altura del pedúnculo caudal (APC).
| Código | LT | LS | DO | IO | LC | AC | LR | LPO | LM | LV | LP | LD | LA | LPC | APC |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| LCT_600 | 270 | 190 | 20.4 | 15.9 | 66.6 | 73.4 | 11.6 | 34.0 | 32.9 | 78.3 | 53.1 | 111.2 | 34.7 | 49.8 | 23.9 |
| LCT_2261 | 308 | 212 | 22.6 | 19.7 | 71.7 | 81.8 | 14.0 | 36.5 | 36.1 | 104.0 | 63.1 | 118.8 | 37.9 | 55.0 | 26.1 |
| LCT_2262 | 301 | 201 | 21.9 | 19.9 | 75.6 | 85.4 | 12.7 | 38.8 | 35.6 | 112.0 | 57.8 | 122.2 | 36.4 | 55.1 | 25.1 |
| LCT_2263 | 297 | 206 | 20.7 | 16.9 | 68.1 | 78.6 | 12.5 | 36.6 | 33.8 | 97.5 | 56.8 | 121.1 | 37.2 | 52.6 | 25.4 |
| LCT_2264 | 307 | 215 | 21.3 | 18.8 | 72.6 | 78.3 | 13.5 | 38.0 | 36.4 | 110.0 | 64.6 | 125.4 | 38.6 | 61.8 | 26.6 |
| LCT_2265 | 287 | 206 | 21.8 | 17.8 | 71.3 | 75.9 | 13.3 | 36.5 | 34.8 | 104.5 | 53.2 | 116.2 | 36.4 | 53.6 | 24.3 |
| LCT_2266 | 266 | 177 | 20.0 | 14.3 | 63.3 | 68.5 | 11.7 | 32.1 | 30.1 | 83.3 | 52.4 | 107.8 | 34.0 | 46.6 | 23.0 |
| LCT_2267 | 252 | 182 | 18.9 | 14.3 | 60.8 | 66.4 | 9.9 | 30.7 | 29.9 | 81.5 | 51.7 | 108.1 | 33.0 | 47.8 | 23.0 |
| LCT_2268 | 264 | 180 | 20.3 | 14.5 | 64.6 | 70.9 | 11.2 | 33.5 | 32.1 | 69.4 | 52.2 | 105.7 | 33.2 | 44.3 | 23.0 |
| LCT_2269 | 267 | 194 | 20.2 | 15.5 | 67.2 | 76.7 | 11.2 | 33.5 | 34.6 | 66.6 | 54.5 | 109.8 | 34.2 | 50.1 | 24.0 |
| LCT_2270 | 281 | 205 | 22.3 | 17.3 | 72.0 | 74.4 | 12.2 | 36.7 | 34.2 | 56.2 | 53.6 | 116.5 | 37.0 | 57.6 | 25.7 |
| LCT_2271 | 274 | 188 | 18.9 | 15.2 | 63.5 | 70.9 | 11.8 | 31.6 | 31.6 | 85.4 | 52.4 | 110.2 | 33.8 | 51.2 | 24.2 |
| LCT_2272 | 262 | 190 | 21.2 | 16.5 | 67.7 | 73.8 | 11.8 | 34.7 | 32.7 | 62.4 | 54.4 | 109.1 | 34.9 | 47.9 | 22.8 |
| LCT_2273 | 292 | 200 | 21.5 | 15.9 | 70.3 | 78.3 | 12.5 | 36.5 | 34.9 | 95.6 | 48.6 | 118.7 | 35.9 | 53.3 | 25.6 |
| LCT_2274 | 291 | 198 | 21.1 | 16.2 | 72.2 | 78.4 | 12.4 | 36.6 | 36.4 | 100.0 | 56.5 | 124.3 | 37.0 | 53.3 | 26.4 |
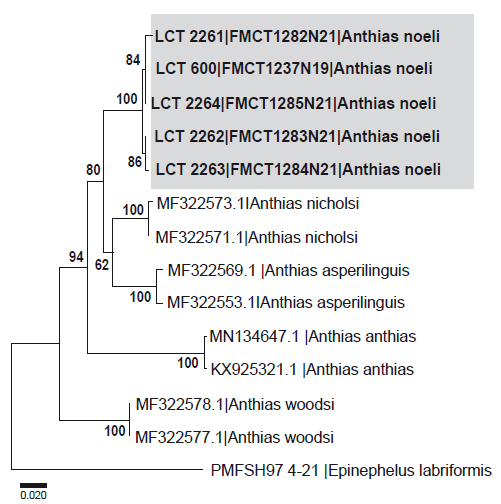
Análisis genéticos. El alineamiento de la secuencia COI de las especies del género Anthias (Tabla 2) consta de 652 pb, con 142 nucleótidos variables y 134 sitios informativos de parsimonia. Las distancias interespecíficas (Tabla 4), muestran que A. noeli presenta una menor distancia genética con A. nicholsi (0.069 ±0.011) y A. asperilinguis (0.081±0.012). Además, el dendrograma (Fig. 3) ubica a A. noeli dentro del grupo del género Anthias, respaldando su identificación.
Tabla 4 Distancia genética interespecífica (diagonal inferior) y error estándar (diagonal superior) según el modelo Kimura-2-parámetros entre especies del género Anthias, incluyendo a Epinephelus labriformis como grupo externo.
Discusión
Anthias noeli es una especie asociada a arrecifes, no migratoria y habita profundidades entre 184 y 351 m (Anderson & Baldwin 2000). Es endémica del Pacífico oriental tropical y su distribución geográfica conocida son las islas Galápagos, Ecuador continental (Anderson & Heemstra 2012; Robertson & Allen 2015) y sobre los montes submarinos Las Gemelas, al suroeste de la Isla del Coco, Costa Rica (Starr et al. 2012). Los ejemplares colectados en el mar de Tumbes se encontraban entre los 74 y 265 m de profundidad, asociadas a arrecifes rocosos de profundidad.
Béarez y Jiménez-Prado (2003) registraron A. noeli en Ecuador continental, e indicaron que esta especie podría haber estado permanentemente en la zona, sin ser identificada correctamente, esto debido a que la especie es confundida generalmente con Pronotogrammus multifasciatus. El norte de Perú se encuentra dentro de la provincia Panámica (Hastings 2000), la cual presenta aguas superficiales tropicales (TSW), cuyas temperaturas varían entre 25 y 30 °C y salinidades entre 33.8 y 34.8 ups (Zuta & Guillén 1970); estas condiciones y los desembarques continuos indican que la especie esta asociada a los arrecifes rocosos profundos del litoral de Tumbes, sin embargo, al igual que en Ecuador, esta especie habría sido confundida con P. multifasciatus “carapachudo”, por lo cual, podemos considerar que no existe un registro real de los desembarques A. noeli.
Los ejemplares evaluados en este trabajo son tan grandes como los registrados por Béarez y Jiménez-Prado (2003) en Santa Rosa, Ecuador (197 - 216 mm LS), pero más grandes que los analizados por Anderson y Baldwin (2000) en las islas Galápagos (62 - 173 mm LS); lo cual indicaría que ejemplares mayores a 62 mm LS ya habitan los arrecifes rocosos. Así mismo, es probable que las larvas de Anthias sp. determinadas por Luzuriaga-Villarreal (2015) al norte de Ecuador, pertenezcan a A. noeli, lo que sugiere un estadio larvario pelágico para esta especie. Aunque esta especie habitaría en arrecifes rocosos a profundidades entre los 184 y 351 m, también podría desplazarse a arrecifes más superficiales por la disminución de la temperatura, como lo registró Béarez y Jiménez-Prado (2003) y durante esta investigación en el 2016; sin embargo, esta hipótesis se confirmaría registrando la temperatura y la profundidad en la zona de captura.
Los análisis filogenéticos indican que las muestras de A. noeli colectadas en Perú, forman una unidad taxonómica molecular diferente a los otros Anthias reportados y secuenciados hasta el momento (Fig. 3), sustentados con un alto índice de bootstrap (100%). Al no existir secuencias de referencias de A. noeli de Ecuador, no se pudo integrar y comparar genéticamente con ejemplares de la localidad tipo; aunque las características morfológicas concuerdan con las características de A. noeli, descrita para las islas Galápagos (Béarez & Jiménez-Prado 2003).
Finalmente, se confirma la ampliación de la distribución de A. noeli hasta Tumbes, Perú. Las secuencias genéticas que se generaron en este trabajo corresponden a las primeras de dicha especie depositadas en la base de datos BOLD Systems.












 uBio
uBio