INTRODUCCIÓN
El venado de cola blanca es un cérvido endémico del continente americano; solo en Sudamérica se conocen ocho subespecies, de las que, Odocoileus virginianus peruvianus es la única reportada en Perú (Pacheco et al. 2009; Ramírez Lozano 2012). Esta especie se encuentra protegida por el Estado peruano mas no está registrada en la lista de especies en peligro de extinción (MINAGRI 2014; MINAM 2016). En Perú, esta especie se distribuye en las vertientes este y oeste de los Andes hasta aproximadamente 3800 m, Pacheco et al. (2009) anota su presencia en casi todas las ecorregiones del Perú sensu Brack-Egg, con excepción del Desierto costero.
Los agentes infecciosos que comprometen la salud de los venados son similares a los que se presentan en bovinos y rumiantes menores: Brucella spp., Leptospira spp., Anaplasma spp., Fusobacterium sp., virus de la Lengua Azul, virus de la Enfermedad Hemorrágica Epizoótica, entre otros (Martinez et al. 1999). Muchos de estos patógenos en su mayoría son transmitidos por artrópodos y representan un riesgo a la salud pública (Palmer et al. 2000; Brown & Burgess 2001). En venados de cola blanca se han registrado garrapatas Rhipicephalus (Boophilus) microplus, Amblyomma sp., Ixodes sp. y Dermacentor sp. (Allan 2001; Davidson 2006) y el piojo chupador Solenopotes binipilosus (Colwell et al. 2008). Asimismo, los parásitos internos más frecuentes son el trematodo Fascioloides magna (Pybus 2001), las larvas de Taenia hydatigena (Jones & Pybus 2001; Davidson 2006) y Haemonchus contortus en abomaso (Prestwood & Kellogg 1971).
En Argentina se ha reportado la presencia de R. microplus en ciervos Blastocerus dichotomus (Guillemi et al. 2018), en tres estados al norte de México en venados de cola blanca (Cuesy León et al. 2021) y en venados del páramo (Mazama Rufina) en bosques altoandinos de Ecuador (Carvajal & Castellanos 2022). El piojo Solenopotes binipilosus ha sido registrado en cérvidos Pudu puda e Hippocamelus bisulcus de Chile (González-Acuña et al. 2004; González-Acuña et al. 2009) y en Odocoileus virginianus chiriquensis de Panamá (Wenzel & Johnson 1966).
En Perú, los estudios parasitológicos en las especies silvestres son escasos, se ha descrito Fasciola hepatica en canalículos biliares de venados de cola blanca incautados de la caza furtiva en Cusco (Gomez-Puerta et al. 2019); también, Cysticercus tenuicollis en cérvidos Hippocamelus antisensis y Mazama americana de la misma región sureña (Gomez-Puerta et al. 2015). Por otro lado, la zona norte del país donde se extienden los bosques secos, es altamente influenciada por actividades antrópicas que amenazan a este peculiar ecosistema. Además, es de suma importancia por su diversidad biológica y solo en este territorio se han reportado hasta siete especies de garrapatas, principalmente del género Amblyomma spp. y Haemaphysalis sp.; Rhipicephalus (Boophilus) microplus se ha recolectado e identificado de caprinos, vacunos, equinos, caninos y humanos, mas no de cérvidos locales (Silva Elizalde et al. 2023). Se ha descrito que en esta área los venados comparten su hábitat con ganado bovino criollo y caprinos que se crían extensivamente por los pobladores (Elias et al. 2021). De esta forma, el presente estudio reporta los parásitos hallados en un venado de cola blanca silvestre (Odocoileus virginianus Gray, 1874) proveniente del bosque seco de la provincia de Chota, región Cajamarca, Perú.
MATERIAL Y MÉTODOS
Colección de muestras. En agosto del 2023, un venado de cola blanca (Odocoileus virginianus) macho de aproximadamente dos años de edad, fue capturado en estado agonizante por el Servicio Nacional Forestal y de Fauna Silvestre (SERFOR - Perú) en el Bosque Seco del Marañón del distrito de Paccha, provincia de Chota, región Cajamarca, con coordenadas geográficas en Latitud S 6º30'18.0" y Longitud W 78º23'27.2". La altitud de esta área de conservación regional donde se realizó la captura es de 2463.26 msnm con clima templado, húmedo y lluvioso.
El cérvido murió un día después de haber sido trasladado a la ciudad de Cajamarca para su recuperación. Los especialistas de SERFOR realizaron la necropsia y en ella obtuvieron ectoparásitos, quistes adheridos a la raíz del mesenterio y una muestra de heces del recto, que fueron inmediatamente remitidos al Centro de Investigación en Medicina Tropical de la Facultad de Ciencias Veterinarias de la Universidad Nacional de Cajamarca para la caracterización parasitológica.
Identificación de endoparásitos. Dos metacéstodos preservados en alcohol a 70º fueron identificados tomando medidas generales, montando cada escólex en láminas portaobjetos, ejerciendo presión contra otra lámina para aplanar los ganchos rostelares y finalmente la disección de los ganchos. Se siguieron las claves taxonómicas descritas por Loos-Frank (2000).
Las heces fueron procesadas inicialmente con la Técnica de Sedimentación de Dennis et al. (1954) para la detección de huevos de trematodos, esto, por tres repeticiones. Seguidamente, a otra porción se le aplicó la Flotación de Sheather para el diagnóstico de formas libres de helmintos o protozoarios gastrointestinales (1923). El recuento de huevos por gramo de heces (h.p.g.) se obtuvo con la Técnica de McMaster Modificada INTA (Fiel et al. 1998), el cultivo de larvas con la Técnica de Roberts & O’Sullivan y la colecta de larvas L3 con Baermann (Andersen & Walters 1973; Ueno & Gonçalves 1998; Kassai 1999). La identificación se realizó siguiendo las ilustraciones e indicaciones de Soulsby (1982; 1987).
Identificación de ectoparásitos. Siete garrapatas conservadas en alcohol a 70º se identificaron midiendo y comparando estructuras como el capítulo, primer par de coxas, forma y posición de los espiráculos, festones, placas adanales y proceso caudado. Para la correcta caracterización se siguieron las claves taxonómicas del CDC de Estados Unidos (2000) y Walker et al. (2000), la nomenclatura se basa en Murrell & Barker (2003).
De los cinco piojos colectados, tres se sumergieron en hidróxido de potasio al 10% por tres días, luego, se lavaron con agua destilada y se los colocó en una serie creciente de etanol (de 70º a 90º) manteniéndose 24 horas en cada concentración. Realizado el proceso de aclaramiento, se montó en lámina portaobjetos y se realizó la identificación siguiendo las claves taxonómicas de Fahrenholz (1915), Ferris (1932) y Kim & Weisser (1974).
Análisis y registro de especímenes. La observación de todos los parásitos se realizó en estereomicroscopio (Nikon SMZ745) o microscopio (Euromex Oxion-3045). Las fotografías se capturaron con la cámara Canon (EOS1200D) y la cámara para microscopio Celestron 2MP. Con el software Celestron Digital Imager HD se realizaron las calibraciones y mediciones correspondientes expresadas en milímetros y centímetros.
Los especímenes se depositaron en la Colección Científica del Departamento de Protozoología, Helmintología e Invertebrados Afines del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos el día lunes 04 de setiembre del 2023.
Taxonomía
Clase: Cestoda
Orden: Cyclophyllidea
Familia: Taeniidae
Género: Taenia
Taenia hydatigena (Pallas, 1776)
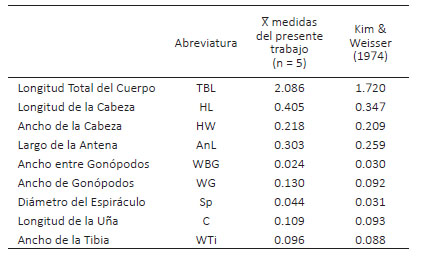
Descripción. El análisis de los dos metacéstodos corresponde a Cysticercus tenuicollis que es el estadio larval de Taenia hydatigena y se los encontró adheridos a la raíz del mesenterio. En promedio, el largo del cisticerco es de 4.2 cm, el diámetro del escólex 1.026 mm, el diámetro de las ventosas 0.349 mm, el largo de los ganchos grandes 0.103 mm y los pequeños 0.079 mm (Figura 1).
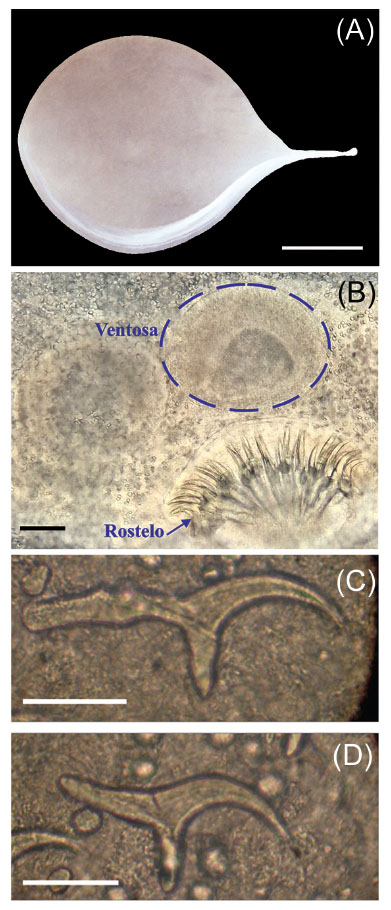
Figura 1 Cysticercus tenuicollis. (A) Vista macroscópica del cisticerco (barra de escala = 1 cm). (B) Ventosas y rostelo con corona de ganchos (barra de escala = 0.05 mm). (C y D) Ganchos rostelares grande y pequeño, respectivamente (barra de escala = 0.05 mm).
Comentarios. Las dimensiones, caracteres morfológicos y órgano donde se encontró a C. tenuicollis coinciden con los hallazgos en cérvidos de Cusco (Gomez-Puerta et al. 2015). En el Coto de Caza El Angolo, Piura, también se halló a C. tenuicollis en los mesenterios de cuatro venados (Muñoz 2022). En Estados Unidos, se detectó al cisticerco en omento de un venado de cola blanca hembra de cuatro años, con tamaños relacionados a los reportados en el presente estudio (Forrester and Rausch 1990). La infección es más prevalente en venados de alrededor de un año de edad (70%) en comparación con los demás grupos (29%) (Addison et al. 1988). Alrededor del mundo, la Taenia hydatigena utiliza a cánidos y algunos félidos silvestres como hospederos definitivos; por otro lado, los artiodáctilos son los principales hospederos intermediarios (Jones & Pybus 2001). En América del Sur, el puma (Puma concolor), el zorro andino (Lycalopex culpaeus) y el perro (Canis lupus familiaris), son los mayores depredadores de los cérvidos (Moro et al. 1998; Elbroch & Wittmer 2013; Lessa et al. 2016) y pueden infectarse con el cestodo en mención (Rausch et al. 1983). Dada esta interacción de depredador-presa, es que el ciclo biológico del parásito puede mantenerse en venados de cola blanca silvestres en el norte peruano.
Código de depósito. MUSM-HEL 5326.
Clase: Chromadorea
Orden: Strongylida
Familia: Molineidae
Género: Nematodirus
Nematodirus spp. (Ransom, 1907)
Descripción. En el examen coproparasitológico cualitativo se detectaron huevos tipo Strongílidos (HTS), de los cuales se identificó morfológicamente a Nematodirus spp. con una carga de 10 h.p.g.; el resto no pudo ser caracterizado por la similitud morfológica ni luego del cultivo de larvas, sin embargo, el recuento de estos fue de 40 h.p.g. (Figura 2).
Figura 2 (A) Huevo tipo Strongílido (barra de escala = 0.025 mm). (B) Nematodirus spp. (barra de escala = 0.05 mm).
Comentarios. Se identificaron únicamente huevos de Nematodirus spp., coincidente a lo encontrado en venados de Estados Unidos (Pursglove et al. 1976; Metro et al. 2019). Se conoce que Nematodirus odocoilei es de los más específicos en venados (Hoberg et al. 1989), pero tendría que respaldarse por identificación con técnicas moleculares o con claves taxonómicas de los adultos. El helminto más común en abomaso de venado de cola blanca es Haemonchus contortus y la adecuada caracterización sería posible si la carga se hubiera presentado elevada o si se hubiera examinado minuciosamente el tracto digestivo en búsqueda de formas adultas (Prestwood and Kellogg 1971; Davidson et al. 1980). En Perú, se ha descrito anteriormente la presencia de H. contortus y Trichostrongylus probolurus en cinco venados del Coto de Caza El Angolo, Piura, para diseñar un plan sanitario anual (Muñoz 2022). Por otro lado, en Florida, la mortalidad en cervatillos nacidos en cautivero fue del 39%, en la exploración posmortem presentaron cargas altas de Strongyloides papillosus en intestino delgado y los análisis coprológicos dieron de 200 a 286 000 h.p.g. (Forrester et al. 1974). Respecto a los resultados en la técnica de sedimentación natural, no se encontraron huevos de trematodos como Fascioloides magna que es lo más esperado (Pybus 2001) o Fasciola hepatica como se dio en Cusco (Gomez-Puerta et al. 2019). Esto es inusual, ya que en la región Cajamarca la fasciolosis es endémica en animales domésticos y humanos (Claxton et al. 1997; Rodríguez-Ulloa et al. 2018; Torrel Pajares et al. 2022). En Argentina, Uruguay y Chile también se ha reportado F. hepatica en cérvidos silvestres (Larroza & Olaechea 2010; Hernández & González 2012; Bravo 2013).
Clase: Arachnida
Orden: Ixodida
Familia: Ixodidae
Género: Rhipicephalus
Subgénero: Boophilus
Rhipicephalus (Boophilus) microplus (Canestrini, 1888)
Descripción. Las garrapatas correspondieron a Rhipicephalus (Boophilus) microplus, de la familia Ixodidae y fueron recuperadas de la zona anterior de las orejas. Se identificaron seis machos y dos hembras (Figura 3). Este hallazgo corresponde al primer reporte formal de la “garrapata del ganado” infestando a venados de cola blanca en Perú.

Figura 3 Rhipicephalus (Boophilus) microplus. (A) Macho adulto (vista ventral) (barra de escala = 1.0 mm). (B) Hembra adulta (vista ventral) (barra de escala = 2.5 mm).
Comentarios. El hallazgo constituye la primera descripción formal de R. (B.) microplus en la subespecie de cérvido Odocoileus virginianus peruvianus. En México ya se ha reportado la presencia de R. (B.) microplus en Odocoileus virginianus couesi y, luego del análisis molecular, se detectó Borrelia burgdorferi asociada a la enfermedad de Lyme (Cuesy 2016). En Estados Unidos, se había erradicado a esta garrapata desde el año 1943, pero la endemicidad en México y la frecuente interacción de venados silvestres transfronterizos con los bovinos ha conllevado a brotes o epidemias de babesiosis en las últimas décadas (Miller et al. 2013; Wang et al. 2020); por tal razón, hay esfuerzos para monitorear y controlar la propagación de garrapatas, y de esta manera, erradicar las enfermedades transmitidas por las mismas (Phillips et al. 2014; Wang et al. 2016). Por otro lado, hay reportes de resistencia a permetrina en poblaciones de R. (B.) microplus colectadas de venados (Currie et al. 2020). En Perú, la presencia de esta garrapata solo ha sido descrita en ganado bovino y algunas especies silvestres como Pecari tajacu “sajino” (Del Castillo et al. 2016; Rojas-Jaimes et al. 2021). Estos ectoparásitos representan un peligro importante en la salud humana y animal. Las garrapatas, que más allá de deprimir el sistema inmune (Gillespie et al. 2001), ocasionan cuadros de anemia y alergias (Rajput et al. 2006; van Nunen 2015) y son portadoras de una serie de microorganismos que pueden transmitirse a los mamíferos y ocasionar enfermedades letales (Hromníková et al. 2022). Se estima que el 80% de la población bovina mundial está en riesgo de contraer garrapatas y enfermedades transmitidas por garrapatas, equivalente a un perjuicio económico de 22-30 mil millones de dólares estadounidenses al año (Lew-Tabor & Rodriguez Valle 2016). Así, Rhipicephalus (Boophilus) microplus que es la principal garrapata del ganado y se reporta en Odocoileus virginianus en el presente estudio, representando un riesgo elevado en la región Cajamarca que concentra la mayor población de bovinos del país y es una de las principales cuencas lecheras (Instituto Nacional de Estadística e Informática 2013). La interacción de R. (B.) microplus con venados de cola blanca ya es conocida en Sudamérica (Cuesy León et al. 2021), incluso se pretende difundir la vacunación en esta especie para evitar infestaciones agudas (Carreón-Camacho 2021) o emplear métodos de erradicación con garrapaticidas en venados considerando con minuciosidad las variaciones climáticas o heterogeneicidad del hábitat (Wang et al. 2016). La transmisión de babesiosis y anaplasmosis mantienen su ciclo de vida parasitario en los mamíferos durante aproximadamente 21 días y la velocidad en la diseminación de estos patógenos en un ecosistema dependen de las cargas o facilidades de contagio por garrapatas (Tabor et al. 2017). En la biósfera noroeste de Perú, también se han reportado los géneros Amblyomma y Haemaphysalis en otros rumiantes, pero no en cérvidos (Silva Elizalde et al. 2023).
Clase: Insecta
Orden: Psocodea
Familia: Linognathidae
Género: Solenopotes
Solenopotes binipilosus (Fahrenholz, 1916)
Descripción. La caracterización morfológica y morfométrica de los piojos, indican que se trata del primer registro de Solenopotes binipilosus en Perú y en la subespecie del cérvido Odocoileus virginianus. Para tal efecto, se presentan medidas claves promediadas de las cinco hembras evaluadas (Tabla 1 y Figura 4). Las abreviaturas se representan en las imágenes para asociar las medidas y la ilustración esclarece el diseño de la genitalia de la hembra que es característica dentro del género Solenopotes la cual permitió realizar la correcta diferenciación (Figura 5).
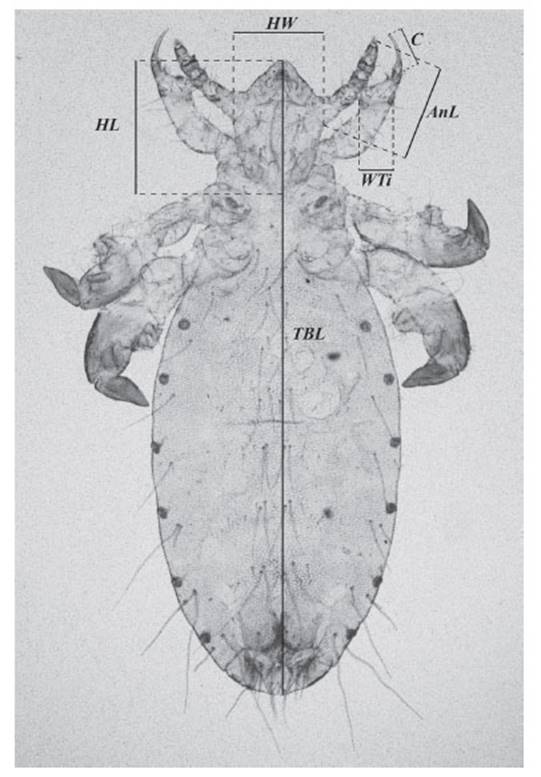
Figura 4 Solenopotes binipilosus. Cuerpo de la hembra (vista ventral): HW = Ancho de la Cabeza, HL = Longitud de la Cabeza, TBL = Longitud Total del Cuerpo, AnL = Largo de la Antena, C = Longitud de la Uña, WTi = Ancho de la Tibia.
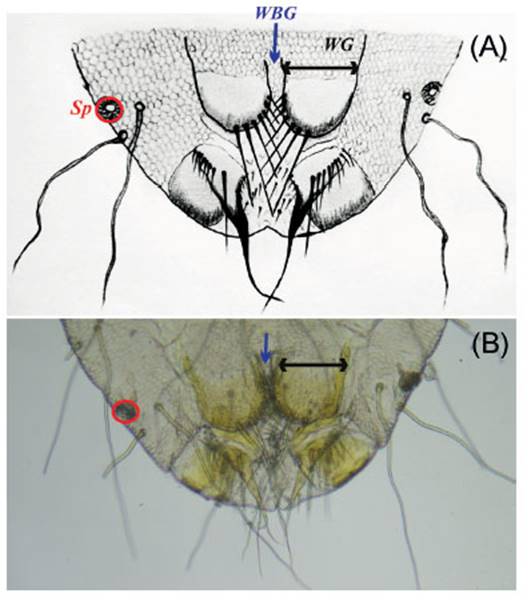
Figura 5 Terminalia abdominal de la hembra de Solenopotes binipilosus. (A) Ilustración. (B) Fotografía. Flecha negra = Ancho de Gonópodo “WG”, Flecha azul = Ancho entre Gonópodos “WBG”, Círculo rojo = Espiráculo “Sp”.
Comentario, en el presente estudio, el piojo Solenopotes binipilosus se registra por primera vez en Perú. Es probable que haya sido introducido a Odocoileus virginianus u otros artiodáctilos a través de animales provenientes de Norteamérica o Panamá (Kellogg et al. 1971; Colwell et al. 2008; Baird & Shipley 2021). Las medidas de las partes o estructuras clave del cuerpo de este piojo son similares, aunque ligeramente mayores al resto de los reportados a lo largo del continente (Tabla 1) (Wenzel & Johnson 1966; Kim & Weisser 1974). Así, la distribución de este piojo chupador va desde Canadá hasta Argentina (GBIF: The Global Biodiversity Information Facility 1980; González-Acuña et al. 2004; Colwell et al. 2008; González-Acuña et al. 2009). Sin embargo, no existen estudios que determinen los factores que propician su dispersión en América, tampoco sobre la posibilidad de subespeciación en cada país o el rol patogénico que cumplen, incluso como vector de enfermedades en los venados de cola blanca.












 uBio
uBio