Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Acta Médica Peruana
versión On-line ISSN 1728-5917
Acta méd. peruana v.23 n.2 Lima mayo/agos. 2006
SIMPOSIO: HIPERTENSIÓN ARTERIAL
Preeclampsia/eclampsia: Reto para el ginecoobstetra
Preeclampsia / eclampsia:challenge for obstetrician-Gynecologist
José Pacheco1
1. Profesor Principal de Obstetricia y Ginecología. Facultad de Medicina de San Fernando, UNMSM. Maestro Latinoamericano de la Obstetricia y Ginecología. Ex Jefe de la Unidad de Reproducción Humana, Hospital Nacional Edgardo Rebagliati Martins, EsSalud.
Resumen
El factor de inicio en la preeclampsia puede ser la reducción de la perfusión uteroplacentaria, secundaria a una anomalía en la invasión de las arterias espirales uterinas por las células citotrofoblásticas extravillosas, asociada a alteraciones locales del tono vascular, del balance inmunológico y del estado inflamatorio, algunas veces con predisposición genética. Se encuentra disfunción de la célula endotelial, dislipidemia (especialmente, hipertrigliceridemia), hiperinsulinemia, hiperleptinemia, disbalance entre antioxidantes y prooxidantes, entre otros. La preeclampsia es una enfermedad temprana del embarazo, caracterizada por hipertensión y proteinuria, que se expresa tarde en el embarazo. Aún no existe una prueba clínicamente útil para predecir el desarrollo de la preeclampsia. Son promisorias el combinar marcadores de insuficiencia placentaria y de función endotelial, y los niveles séricos o urinarios de PlGF y sFlT-1 en el primer trimestre. Tan o más importante es la historia clínica personal y familiar de hipertensión. Las gestantes con hipertensión arterial deben ser manejadas en centros especializados. La terapia antihipertensiva tiene poco efecto sobre el progreso del embarazo. Se sugiere administrar aspirina a dosis bajas en mujeres con preeclampsia previa de inicio precoz. Los bloqueadores de canales de calcio son muy útiles en el manejo de la hipertensión aguda. El tratamiento de la preeclampsia es el nacimiento del feto y placenta, decidiendo el momento de acuerdo a las condiciones maternas y fetales.
Palabras clave: hipertensión arterial, embarazo, preeclampsia, eclampsia, tono vascular.
Abstract
The uterus to placenta blood flow reduction would be the initial factor for preeclampsia, secondary to anomalous spiral uterine arteries invasion by the extravillous cytotrophoblastic cells, associated to both vascular tonus and immunologic and inflammatory balance local alterations, sometimes with genetic predisposition. There is endothelial cell dysfunction, dyslipidemia (especially hypertriglyceridemia), hyperinsulinemia, hyperleptinemia, antioxidant-prooxidant imbalance. Preeclampsia is an early pregnancy disease characterized by hypertension and proteinuria, expressed late in pregnancy. We still do not have a clinical useful test to predict preeclampsia. Combining both placental insufficiency and endothelial markers and PlGF y sFlT-1 serum or urinary levels in the first trimester is promising. Personal and familiar hypertension history is extremely important. Pregnant women with arterial hypertension should be attended in specialized centers. The antihypertensive therapy has little effect on pregnancy outcome. We suggest the use of low doses of aspirin in women with previous early preeclampsia. Calcium channel blockers are very useful in treating acute hypertension. Preeclampsia treatment consists in the birth of both fetus and placenta, the time determined by maternal and fetal conditions.
Key words: Hypertension, pregnancy, preeclampsia, eclampsia, vascular tone.
INTRODUCCIÓN
La revisión frecuente de las enfermedades hipertensivas del embarazo –especialmente, de la preeclampsia- es de suma importancia en el mundo, por las consecuencias maternas y perinatales que ocasionan. La preeclampsia, en el Perú, es la segunda causa de muerte materna, representando 17 a 21% de muertes (1); es la primera causa de muerte materna en los hospitales de EsSalud del país y en Lima Ciudad (2), se relaciona con 17 a 25% de las muertes perinatales y es causa principal de restricción del crecimiento fetal intrauterino (RCIU).
El denominador común del grupo heterogéneo de enfermedades hipertensivas del embarazo (EHE) es el aumento de la presión arterial (PA) igual o mayor a 140/90 mmHg. En la hipertensión crónica, dichas cifras de PA ocurren antes del embarazo o antes de las 20 semanas de gestación, complicando 6 a 8% de los embarazos; en 86% de estos casos se debe a hipertensión esencial y, el resto, es secundaria a trastornos renales, endocrinos o metabólicos, inmunológicos, entre otros. Alrededor de 20 a 25% de mujeres con hipertensión crónica desarrollan preeclampsia. Una presión diastólica mayor de 110 mmHg se asocia con mayor riesgo de restricción del crecimiento fetal intrauterino (RCIU), pero la preeclampsia sobreimpuesta causa la mayor morbilidad.
La más frecuente de las enfermedades hipertensivas del embarazo es la preeclampsia/eclampsia. Se define la preeclampsia como la hipertensión que aparece después de las 20 semanas de gestación y que se acompaña de proteinuria significativa (3), denominándose eclampsia cuando la hipertensión se acompaña de convulsiones y/o coma (4). Es una enfermedad exclusiva del embarazo humano, con predisposición familiar, de herencia principalmente de tipo recesiva. En el Perú, su incidencia fluctúa entre el 10 y el 15 en la población hospitalaria (5) (Tabla 1). La incidencia de EHE es mayor en la costa que en la sierra, pero la mortalidad materna por esta causa es mayor en la sierra; no parecen existir diferencias mayores entre las características de esta enfermedad en ambas regiones (6).

Las investigaciones sobre la etiología de la preeclampsia nos inducen a pensar que en la enfermedad hay una invasión anormal de las arteriolas espirales por el citotrofoblasto –es decir- un defecto en la implantación o placentación- lo que resulta en disfunción endotelial y reducción de la perfusión uteroplacentaria. Por ello, iniciaremos esta revisión con la fisiología de la placentación en el embarazo normal.
Fisiología de la placentación
En el embarazo normal, los citotrofoblastos se diferencian en varias subpoblaciones especializadas, con roles claves en gobernar el crecimiento y desarrollo del feto. De manera de invadir la decidua, las células trofoblásticas necesitan reconocer los diferentes componentes de la membrana de la decidua y de la matriz extracelular (integrinas, cadherina) y separarlos (metaloproteasas). Para controlar esta invasión, el endometrio modifica la composición de su matriz extracelular (MEC), segrega el factor de crecimiento transformante (TGF)- β y los inhibidores de metaloproteasas tisulares (IMPT). Además, la decidua es colonizada por células del sistema inmune (células NK, linfocitos y macrófagos), que son responsables de la producción local de citoquinas, que promueven o inhiben la invasión trofoblástica (16).
En una primera etapa, el citotrofoblasto tiene un fenotipo proliferativo, hasta las 12 semanas de gestación. Existe una hipoxia relativa, con incremento del factor de trascripción inducido por la hipoxia (HIF-1a), del transformador del factor de crecimiento (TGF-β3), de citoquinas inflamatorias y del factor de crecimiento vascular (VEGF).
La capacidad de adhesividad es esencial para prevenir la descamación de la célula trofoblástica por el flujo sanguíneo contracorriente y su diseminación por la sangre a sitios ectópicos del organismo materno (17). La adherencia de las células trofoblásticas extravillosas (CTEV) a los componentes MEC (colágeno IV, laminina, proteoglicanos, heparán sulfato, entactina y fibronectina) requiere la intervención de receptores en la membrana plásmica, que permite a la célula identificarlos y luego unirse a ellos. Estos receptores son las integrinas y cadherinas. Las integrinas son glipoproteínas heterodiméricas con dos subunidades, la a y la b. Su combinación forma muchas integrinas, que se unen a diversos componentes de la MEC. Cuando las células citotrofoblásticas cambian de proliferativas (en la base de las vellosidades de anclaje) a intersticiales (en la porción más profunda de la decidua y de las arterias espirales), varía el perfil de las integrinas. Las CTEV proliferativas expresan solo integrina a6b4 (receptor para laminina, un componente de la membrana basal) y, cuando migran (al volverse invasoras), adquieren la capacidad de expresar integrina a5b1 (receptor de fibronectina).
Cuando las células citotrofoblásticas se vuelven intersticiales, también aparecen las integrinas a1b1 (laminina y receptores de colágeno tipos I y IV), avb1 y avb3 (receptor de vitronectina). Esta segunda etapa empieza a las 12 semanas de gestación. El citotrofoblasto de las vellosidades troncales toma un fenotipo invasor (trofoblasto extravellositario), mediado por cambios de pO2 en el espacio intervelloso, encontrándose disminución del factor inducido por hipoxia (HIF)-1a y del factor de crecimiento transformante (TGF)-β3.
El factor de crecimiento transformante (TGF)-β es un factor de crecimiento expresado en la interfase feto-materna por la decidua, desde el primer trimestre hasta el término de la gestación. Inhibe la proliferación e invasión del trofoblasto. El TGF- β1 es esencialmente expresado por las vellosidades y el TGF-β2 por la decidua. El TGF- β1 promueve la formación de MEC, en especial colágeno y fibronectina, inhibe la producción del activador de plasminógeno, induce la expresión de TIMP-1 y reduce la migración de CTEV, sobreexpresando a5b1. Esta sobreexpresión hace a las CTEV que se adhieran más a la MEC y activa la diferenciación del citotrofoblasto a un sincitiotrofoblasto no invasor (16).
Angiogénesis en el desarrollo del feto
La angiogénesis es el proceso de neovascularización a partir de vasos preexistentes, en respuesta a hipoxia o demanda de sustrato por los tejidos. El endometrio, la decidua y la placenta son fuentes ricas en factores de crecimiento angiogénicos. El proceso angiogénico es iniciado por factores de crecimiento, tales como: a) el factor de crecimiento fibroblástico (FGF)- β, un factor angiogénico poderoso, que aumenta con estradiol y disminuye con progesterona; b) el VEGF, estimulado por los estrógenos y por la hipoxia; es mitogénico para las células endoteliales y aumenta la permeabilidad vascular; y, c) el factor de crecimiento derivado de plaquetas (PDGF), que contribuye a la angiogénesis y al crecimiento de las células musculares lisas. Otros factores, incluyendo al TGF- β, factor de necrosis de tumor (TNF)- α, interleuquina (IL)-1 e IL-6, también participan en la angiogénesis. Recientemente, también se ha encontrado que la hCG tiene función angiogénica, en la adaptación del útero al embarazo temprano y en la invasión tumoral (18).
La familia de VEGF y su sistema de receptores ha demostrado ser un regulador fundamental en el señalamiento celular de la angiogénesis. El receptor VEGF tiene siete dominios de Ig en la región extracelular y un dominio tirosinoquinasa en la región intracelular. Tres miembros de la familia de receptores VEGF -Flt-1, KDR/Flk-1 y Flt-4-, tienen características especiales de transducción de señal y regulan la angiogénesis, linfangiogénesis y la permeabilidad vascular (19). Los receptores de VEGF -Flt-1 y KDR- se expresan en las células trofoblásticas y en las células endoteliales. El factor soluble de Flt-1 (sFlt-1) es el principal inhibidor endógeno de la angiogénesis en la placenta. Cuando circula en el suero, sFlt-1 se puede unir a VEGF y PlGF y evita que ellos se unan a los receptores de superficie de las células. Se ha encontrado concentraciones altas de sFlt-1 en el suero de mujeres preeclámpticas, que induciría la disfunción de la célula endotelial, con disminución de las concentraciones libres de VEGF y PlGF; los niveles de sFlt-1 caen a la línea basal 48 horas después del nacimiento. Por estos hallazgos, se presume que el exceso de sFlt-1 puede conducir a un estado de antiangiogénesis, disfunción endotelial y síndrome clínico de la preeclampsia (20).
La maduración endometrial se relaciona al crecimiento de las arterias espirales, ramas de las arterias uterinas, las que luego transportarán la sangre materna a los espacios intervellosos de la placenta. El crecimiento y estructura de las arterias espirales depende de las secreciones hormonales ováricas o placentarias. Bajo la influencia de los estrógenos, su diámetro aumenta, mientras crecen en longitud y se tuercen progresivamente. Esta proliferación endotelial continúa durante la fase lútea y las primeras semanas de gestación.
El establecimiento del sistema vascular uteroplacentario empieza con la invasión de la decidua materna por las CTEV. Para que ocurra la transformación completa de las arterias espirales por las células trofoblásticas, se requiere de los dos fenómenos de invasión ya aludidos, sucesivos e interdependientes.
Fisiopatología de la preeclampsia
La preeclampsia se caracteriza por hipertensión y proteinuria. Es secundaria a una anomalía en la invasión de las arterias espirales uterinas por las células citotrofoblásticas extravellosas (CTEV), asociada a alteraciones locales del tono vascular, del balance inmunológico y del estado inflamatorio, algunas veces con predisposición genética (Figura 1). La preeclampsia es una enfermedad temprana del embarazo, considerada como una forma de aborto espontáneo incompleto, pero que se expresa tarde en el embarazo (16).
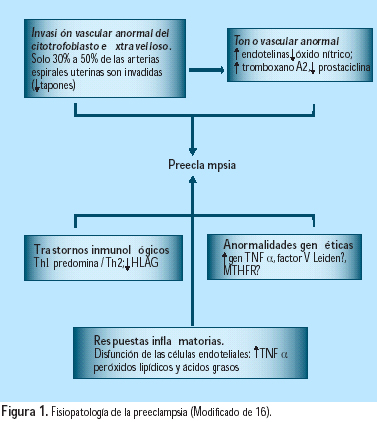
El factor de inicio en preeclampsia sería la reducción de la perfusión uteroplacentaria, como resultado de la invasión anormal de las arteriolas espirales por el citotrofoblasto. El endotelio, importante órgano endocrino, grande y muy activo, responsable de un número de funciones fisiológicas vitales (21), está involucrado en la patogénesis de la preeclampsia.
En la preeclampsia, la resistencia decidual, más poderosa que la invasión trofoblástica, previene a las CTEV de alcanzar las arterias espirales (Figura 2). Las placentas de mujeres con preeclampsia expresan menores niveles de metaloproteinasa de la matriz (MMP)-9, antígeno linfocítico humano (HLA)-G, lactógeno placentario (HPL) y a1b1, que aquellas mujeres con embarazos normales; los niveles de integrina a4b5 se mantienen estables y la a1b1 aumenta. Además, no ocurre el cambio de cadherina E a cadherina VE, ni se producen VCAM-1 y PECAM-1. Estos fenómenos testifican que estos citotrofoblastos han perdido su capacidad de invasión profunda. Las CTEV invasoras se diferencian anormalmente a sincitio (células gigantes), que pierden su poder de penetración (Figura 3). Un hallazgo relacionado es la mayor frecuencia de preeclampsia y RCIU en nulíparas (75% de los casos); esto puede asociarse con el hecho de que las arterias colonizadas en un primer embarazo pueden ser invadidas más fácilmente en embarazos subsiguientes. El rol de las células asesinas naturales deciduales (NK) puede explicar por qué se facilita una invasión subsiguiente; se puede pensar en una memoria endometrial de los anticuerpos paternos. La preeclampsia ocurre de manera similar en nulíparas y multíparas que han cambiado de pareja (3,2 y 3%), pero es menor en multíparas con la misma pareja (1,9%). Un hallazgo similar se nota en embarazos luego de donación de ovocitos, donación de esperma o un largo periodo de anticoncepción. Por ello, se debe considerar a la preeclampsia como una enfermedad más de primipaternidad que de primigravidez (22).
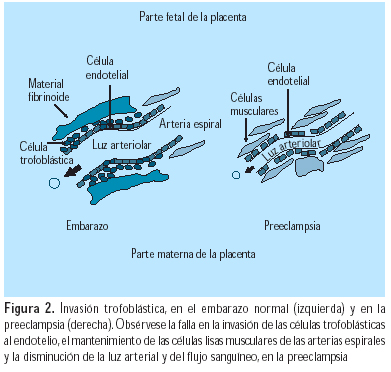

En la preeclampsia, la segunda invasión trofoblástica no occurre o es incompleta, debido a la falta de tapones intravasculares. Esto se expresa por la persistencia de vasoconstricción uterina. El ingreso de sangre a los espacios intervellosos es menor. La consecuencia es la hipoxia, con aumento de la peroxidación lipídica y de la relación tromboxano A2/protaciclina (TXA2/PGI2), lo cual acentúa la vasoconstricción y la agregación de plaquetas, condicionando la RCIU. Frecuentemente, se encuentra trombosis y depósitos de fibrina diseminados en la placenta, en esta enfermedad. Además, la hipoxia aumenta la producción de endotelina (ET)-1 y disminuye la de óxido nítrico (NO).
La ausencia de tapones intravasculares en la preeclampsia explica el por qué la PO2 en las arterias espirales deciduales es menor que la que se observa en presencia de estos tapones; esto resulta en mayor peroxidación lipídica y menor relación PGI2/TXA2, con vasoconstricción y agregación plaquetaria. La disminución de PO2 también ocasiona el aumento de ET-1 y, en combinación con la disminución de las fuerza mecánicas en la pared vascular, una disminución en NO en las arterias espirales del miometrio y la decidua. El efecto estimulante de ET-1 en la liberación de NO parcialmente compensa esta disminución de NO. Además, la ausencia de tapones (que resulta en presión alta relativa en las lagunas sanguíneas) es responsable del aumento en la tasa de abortos espontáneos y la falla en prosperar del feto observada en pacientes con riesgo de desarrollar preeclampsia (23).
Entonces, la preeclampsia se caracteriza por aumento en la resistencia vascular sistémica, presencia de reactividad vascular y modificación en la distribución del flujo sanguíneo en la pelvis, todo lo cual precede el inicio de la hipertensión. Lo anterior sugiere una falla en la regulación de los factores vasomotores normales del embarazo (16).
Finalmente, la hipoxia crónica puede inducir la transcripción de algunos genes (24), como el de ET-1 (vasoconstrictor), de la enzima convertidora de angiotensina (hipertensora), del activador del plasminógeno (que estimula la formación de TGF-B activa, que inhibe la invasión de CTEV) y de la ciclooxigenasa-1 (COX-1, una enzima comprometida en la producción de prostaglandinas).
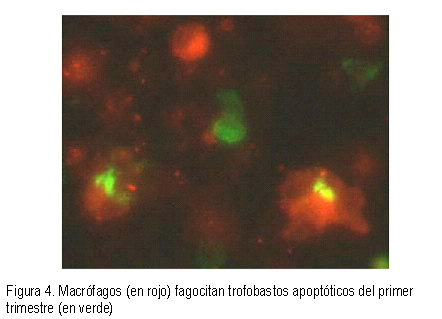
El trofoblasto extravelloso invade los tejidos uterinos maternos, contactando directamente las células estromales con las células inmunes maternas. Un grupo de dicho trofoblasto extravelloso, el trofoblasto endovascular, es el que inicialmente ocluye el lumen de las arterias espirales (tapones) y se pone en contacto directo con la sangre materna. Se conoce que, es importante la apoptosis de ambos tipos de trofoblasto para la función normal del trofoblasto (Figura 4). En la preeclampsia o RCIU, hay alteración de la regulación de la apoptosis en el trofoblasto villoso y/o extravilloso, que resulta en alteración de la invasión y/o derrame del trofoblasto en la circulación materna (25).
Aspecto inmunológico, HLA-G, preeclampsia y desarrollo del embrión
En teoría, un embrión que se implanta podría ser el blanco de varios tipos de agresión inmunológica: lisis estándar mediada por células, lisis por anticuerpos citotóxicos asociados con complemento y lisis por células NK. Durante el embarazo, el embrión está protegido de estos peligros por su propia antigenicidad precoz, por secreción de citoquinas e inmunosupresores locales, resistencia intrínseca a la lisis celular y el sistema MCP-DAF. Ocurren dos fases: una reacción inmunológica inicial materna al aloimplante, seguida del desarrollo de tolerancia alogénica (26).
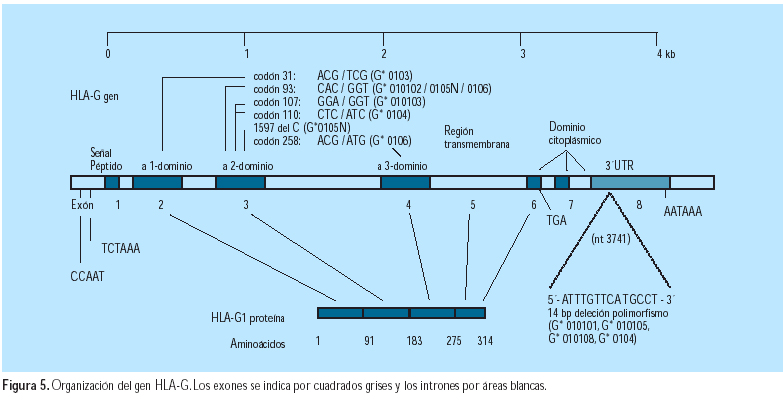
El antígeno G del leucocito humano (HLA-G) (Figura 5) es un gen clase I del complejo mayor de histocompatibilidad (MHC), que tiene expresión específica sobre las células citotrofoblásticas fetales y compromiso en la protección del feto en desarrollo de su destrucción por la respuesta inmune materna y en la prevención de la preeclampsia (27). Se ha observado que, hay menor expresión del HLA-G placentario y menor secreción de esta proteína a la circulación materna, en la preeclampsia (28). Podría ser por el efecto de la molécula HLA-G soluble en remodelar las arterias espirales (29).
También, la PE se asocia con aumento de las células CD4(+)HLA(-)DR(+) y CD3(+)NK, y disminución de linfocitos T y de la subpoblación CD3(+)CD25(+) (30). Se observa niveles elevados de IL-6, TNF- α y neopterina, a diferencia de los controles, especialmente en la PE severa. Se asume la participación de la inmunidad celular (especialmente, monocitos/macrófagos) (31).
Es decir, en la preeclampsia existe activación inmune generalizada. Los neutrófilos polimorfonucleares parecen ser los más afectados, con cambios en la expresión de marcadores de superficie y liberación de enzimas granulares, y cambios en L-selectina (CD62L) sobre los neutrófilos, monocitos y células T. Entre otros, hay aumento en la traslocación nuclear de NF-kappaB y aumento de IL-6 (32). La IL-6 inhibe la expresión de receptores de IL-2, que podrían de otra manera promover la proliferación de células citotóxicas (linfocitos T y células NK), de linfocitos B y de citotoxicidad mediada por células y dependiente de anticuerpos. La IL-10 tiene rol importante al prevenir la resorción del embrión por los antagonistas IFN γ y TNF α (16).
La progesterona también participa en mantener el semiinjerto, por su actividad antiinflamatoria local: puede inhibir la fagocitosis y la proliferación de linfocitos en el útero, directamente al bloquear la actividad y proliferación de LT CD4+ inducidas por IL-1 o, indirectamente, al inducir la liberación de dos factores inmunosupresores por los linfocitos, el factor inducido por la T supresora (TSIF) -cuyos anticuerpos pueden ocasionar el aborto en ratones- y el factor bloqueador inducido por progesterona (PIBF) -que bloquea la lisis de los fibroblastos del embrión por las células NK e inhibe las reacciones mixtas de los linfocitos al prevenir la excreción de TNF- α por las células citotóxicas (LT,NK). La progesterona también tiene una acción inmunosupresora, que funciona en sinergia con la prostaglandina E (PgE) e inhibe la proliferación del linfocito T (16).
Todas estas nociones se relacionan al concepto más general de los sistemas Th1–Th2. El Th1 agrupa las células T de ayuda que segregan IL-2 e IFN- γ (inmunidad mediada por célula), mientras Th2 produce IL-4, IL-6 e IL-10 (inmunidad humoral). Un embarazo exitoso requiere que el sistema Th2 domine. En la preeclampsia, esta relación se invierte (Th1 > Th2), aumentando así la tasa de destrucción de las células trofoblásticas. Estas no pueden así cumplir sus roles necesarios: anclaje del embrión en la decidua (como se demuestra con la alta tasa de abortos espontáneos en las mujeres con preeclampsia), modificación de las arterias espirales uterinas, etc.
Predisposición genética
No existe un solo gen para la preeclampsia, pero probablemente hay un grupo de polimorfismos genéticos maternos que, cuando se asocian con factores ambientales, predisponen a la mujer a esta enfermedad. La hipótesis de transmisión recesiva de genes maternos parece lo más probable (33). Además, los genes del feto también parecen contribuir al desarrollo de la preeclampsia. Factores ambientales pueden afectar la expresión de estos genes predisponentes. Por lo conocido hasta ahora, la preeclampsia puede resultar una enfermedad hereditaria asociada a un gen materno recesivo; la expresión de la enfermedad depende entonces del papá. Las mujeres nacidas de embarazos complicados por preeclampsia tienen ellas mismas mayor riesgo de esta complicación. Lo mismo ocurre en las nueras de mujeres que tuvieron preeclampsia. De manera similar, el riesgo de esta complicación para la mujer cuya pareja ha tenido un niño con otra mujer en un embarazo con preeclampsia es el doble que el riesgo de las mujeres sin historia familiar en ambas familias. Como tal, existe un claro rol paterno en la génesis de esta complicación (34), así como lo hay en el fenómeno de la implantación (embarazos molares, donde se observa una disomía unipaterna paterna). Por ello, es muy probable que la preeclampsia involucra una huella genómica paterna de ciertos genes: IGF2, alele T235 del gen angiotensina, factor V de Leiden y la metil tetra-hidrofolato reductasa (MTHFR). Hay otros genes candidatos, localizados en los cromosomas 1, 3, 4, 9 y 18 (16).
Respuesta inflamatoria en la preeclampsia
La preeclampsia es una enfermedad caracterizada por disfunción generalizada de la célula endotelial, relacionada a varios factores: ácidos grasos, lipoproteínas, peróxido lipídico, TNF- α, productos de degradación de fibronectina y fragmentos de microvillosidades de las células sincitiotrofoblásticas. Todos estos factores juntos resultan de una repuesta inflamatoria intravascular generalizada presente durante el embarazo, pero exacerbada en la preeclampsia. Durante la inflamación, aumentan las proteínas de adhesión de leucocitos en el sistema vascular, estimuladas muy tempranamente por la trombina e histamina y, en las horas que siguen, por IL-1 o TNF- α. La permeabilidad vascular aumenta, entonces, junto con extravasación y quimiotaxis celular con fagocitosis (16).
Magnesio e hipertensión
El magnesio (Mg) afecta la presión arterial, al modular el tono y la reactividad vascular. Actúa como antagonista de los canales de calcio, estimula la producción de prostaciclinas y NO (vasodilatadores) y altera la respuesta vascular a los agonistas vasoactivos. Diversos estudios demuestran una correlación inversa entre la presión arterial y los niveles de Mg en sangre. El Mg también influye en la homeostasis de la glucosa e insulina, y la hipomagnesemia se asocia con el síndrome metabólico (35).
Fenómenos oxidativos en la placenta de PE
En la preeclampsia hay disminución de la actividad de la superóxido dismutasa (SOD) y glutation peroxidasa (GSH-Px), pero incremento de los radicales libres de O2, aniones superóxidos, peróxidos lipídicos y activación de neutrófilos. Los superóxidos inactivan EDRF (NO) y cambian el equilibrio PgI2/TxA2 a favor TxA2 –lo que aumenta la agregación plaquetaria y la vasoconstricción-. Por ser citotóxicos celulares, debido a la conversión oxidativa de los ácidos grasos no saturados de las membranas en peróxidos de lípidos, lesionan el endotelio y son trombogénicos. Pueden dañar al ADN, las proteínas y los lípidos.
Dislipoproteinemia en preeclampsia
En los trastornos metabólicos, las lipoproteínas representan la mayor causa de disfunción endotelial. En la preeclampsia, hay acúmulo de lipoproteínas ricas en triglicéridos. El perfil LDL está dominado por una fracción LDL más activa, con disminución concurrente del LDL denso y aumento de LDL, HDL y triglicéridos (36).
Preeclampsia y resistencia a la insulina
Las mujeres que desarrollan preeclampsia tienen niveles de insulina y de glucosa más elevados, con la prueba postingesta de 50 g de glucosa oral. Las pruebas de tolerancia oral son anormales. Esta intolerancia relativa a la glucosa aparece desde el segundo trimestre del embarazo. La resistencia a la insulina ha sido vinculada a la RCIU (37,38).
La disminución de la sensibilidad a la insulina puede alterar la función de la célula endotelial, al disminuir la producción de PgI2 o al aumentar la producción de ET-1. Otro factor puede ser el efecto de la resistencia a insulina sobre los lípidos y lipoproteínas, tal como aumento en la secreción de VLDL, que afecta la función de la célula endotelial y favorece la vasoconstricción.
La hiperinsulinemia (y puede ser la resistencia a la insulina) se correlaciona negativamente con el colesterol HDL, pero positivamente con los triglicéridos y las presiones arteriales sistólica y diastólica.
La alteración de la angiogénesis y de la resistencia a la insulina -íntimamente relacionadas a nivel molecular- caracterizan a la preeclampsia (39).
La sensibilidad a la insulina en la preeclampsia tiene relación con la leptina, la homocisteína, la relación inhibina/activina. La homocisteína en plasma en preeclámpticas es 1,8 a 4 veces mayor que en la gestante normal. Además, hay relación entre los niveles de homocisteína y la severidad de la preeclampsia y existe correlación inversa entre homocisteína y sensibilidad a la insulina (40).
Resumiendo, en la preeclampsia se encuentra mala adaptación de las arterias espirales, disfunción de la célula endotelial, activación inmune anormal, disbalance entre tromboxano y prostaciclina, dislipidemia (especialmente, hipertrigliceridemia), hiperinsulinemia, hiperleptinemia, disbalance entre antioxidantes y prooxidantes, alteración en síntesis de hormonas, elevación de la alfafetoproteína (AFP) y hCG en sangre materna, entre otros (41).
Estudios sobre preeclampsia en el Perú
Williams y col. (41) han realizado estudios bioquímicos en gestantes limeñas. Los siguientes resumen algunos de los hallazgos:
- Las mujeres con niveles bajos de folatos en plasma aumentan el riesgo de desarrollar preeclampsia, lo que no se asocia con el genotipo T/T (MTHFR C-T677).
- El retinol y el colesterol HDL altos en plasma de la gestante disminuyen el riesgo de PE.
- Los niveles altos de triglicéridos y homocisteína aumentan el riesgo de tener PE.
- El aumento del receptor soluble de citoquina TNF- α (p55) y de TGF- β1 incrementan el riesgo de PE, especialmente en mujeres con evidencia de inflamación sistémica.
- La hCG-β es secretada por el sincitiotrofoblasto villoso, alcanza su pico máximo alrededor de las 11 semanas de gestación, decrece después y forma una meseta entre las semanas 16 a 20. En las gestaciones con preeclampsia, los niveles séricos tienden a seguir aumentando. Ello se debería a la deficiente implantación placentaria en la preeclampsia, lo que genera hipofunción placentaria. La necrosis focal del sincitiotrofoblasto estimula la proliferación del citotrofoblasto, que se trasforma rápidamente (+72 horas) en nuevo sincitiotrofoblasto. El aumento de hCG- β en la preeclampsia se debería a la secreción aumentada de esta hormona por el sincitiotrofoblasto recién formado y por el citotrofoblasto que se halla en gran actividad mitótica. Una investigación en Lima halló que, las pacientes con preeclampsia severa tuvieron un riesgo 8,2 veces mayor de tener hCG- β mayor de 153 000 mU I/mL, que quienes no tuvieron la enfermedad (42).
En un estudio sobre la variación estacional de la preeclampsia en un hospital de Lima, la prevalencia de PE fue 14,2%, 28% de éstas severa. La prevalencia fue mayor en los meses fríos de primavera e invierno (setiembre 17,8%, junio 17,3%, diciembre 11,5%, febrero 11,1%) y más en el invierno (16,6%) que en el verano (12,7%) (P<0,05). Mientras tanto, la preeclampsia severa ocurrió más en el verano (4,8%; 38%) que en la primavera (2,8%; 21,4%) (7).
Preeclampsia en la altura
Un estudio sobre la incidencia y características de la enfermedad hipertensiva en el embarazo, a nivel del mar y en la altura (6), encontró que las cifras de presión arterial sistólica (PAS) y diastólica (PAD) fueron mayores en Huancayo, seguido de Chulec, Lima y Cerro de Pasco. En Puno, no se obtuvo registros de presión arterial (PA). La preeclampsia ocurrió en mayor proporción que la eclampsia en La Oroya y Puno (98% vs. 2%), Cerro de Pasco (92% vs. 8%) y Cusco (87,1% vs. 3,7%), que en Lima (76,7% vs. 3,4%) y Huancayo (73,6% vs. 22,8%). Sin embargo, la presencia de eclampsia fue mayor en el Cusco, luego en Cerro de Pasco y Huancayo. Aunque la edad gestacional en que terminó el embarazo fue significativamente mayor en Lima que en la altura, el peso del recién nacido (RN) de madres preeclámpticas fue mayor en el Cusco (promedio 2500 g), luego en Lima, Huancayo y Cerro de Pasco. En ese entonces, la tasa de mortalidad materna en Lima fue 151,8 por 100 000 nv, en Huancayo 350, en Cusco 81 y en Cerro de Pasco 710, con tasas específicas para enfermedad hipertensiva del embarazo (EHE) de 13,4, 27, 40,4 y 177,6, respectivamente.
En síntesis, en dicho estudio se observó que la incidencia de EHE fue mayor en la costa que en la sierra, pero la mortalidad materna por esta causa fue mayor en la sierra. No se halló diferencias importantes entre las características de esta enfermedad en ambas regiones.
En la altura, el flujo uterino y el peso al nacer disminuyen y el riesgo de preeclampsia aumenta. Se conoce que la restricción del crecimiento fetal intrauterino (RCIU) y la preeclampsia se asocian con menor invasión y remodelamiento de las arterias espirales.
Recordemos que, a nivel del mar, la presión de oxígeno (pO2) arterial normal es 85 a 100 mmHg y la pO2 venosa uterina +40 mmHg. La pO2 de la vena umbilical es 30 a 35 mmHg y de la arteria umbilical 10 a 15 mmHg. Bajo un ambiente de oxígeno (O2), cuando hay buena disociación de O2 y alta afinidad de la hemoglobina fetal por dicho O2, la placenta mantiene una gradiente constante de anhídrido carbónico (pCO2 = 10 mmHg), es relativamente impermeable a los iones bicarbonato (lo que protege al feto de los cambios maternos del ión hidrógeno) y, de esta forma, mantiene un adecuado ambiente de O2 fetal.
Además, existe aumento de la ventilación materna en el embarazo (aún en la altura, la madre es insensible a la hipoxia crónica) y aumenta la extracción de O2 por el feto. El consumo de O2 permanece estable, aún con disminución de hasta 50% en el flujo placentario o contenido de O2. El feto debe evitar tanto una pO2 alta como una pCO2 muy baja, pues la pO2 elevada desencadena una caída en la resistencia vascular pulmonar y el cierre del ducto arterioso (43).
En los residentes nativos de altura (1 830 m), las tensiones en el cordón umbilical arterial y venoso son iguales que a nivel del mar, pero existe ligera disminución de la pCO2 por una leve hiperventilación materna. En la altura mayor de 3 000 m, la respuesta fetal a la hipoxia consiste en aumento del hematocrito (2 a 3% mayor), debido al aumento de la hemoglobina fetal y de la eritropoyetina en sangre del cordón (43,44).
En un estudio de 19 placentas en altura (3 100 m) comparadas con 13 de una altura menor (1 600 m), de embarazos normales, se encontró que las terminales deciduales de las arterias uteroplacentarias en altura tenían 8 veces la posibilidad de estar remodeladas. Se encontró más del doble de arterias uteroplacentarias en las placentas de altura, así como mayor densidad capilar, lo que no se relacionaba al remodelamiento o al peso al nacer. En este modelo in vivo de hipoxia crónica, la remodelación estaba reducida y la angiogénesis vellosa no compensaba totalmente la disminución de pO2 (45).
Las placentas de altura se caracterizan por aumento de la vascularización vellosa, adelgazamiento de las membranas vellosas, proliferación del citotrofoblasto velloso y menor depósito de fibrina perisincitial (46). En la altura se encuentra que, la RCIU no se asocia con mayor morbimortalidad, salvo que se añada prematuridad, lo que indica un aparente efecto regulatorio del O2 en el feto en desarrollo (47).
Dos factores parecen explicar la disminución del flujo en la altura: a) disminuye el incremento de volumen sanguíneo materno por menor dilatación de la arteria uterina; y, b) falla la redistribución apropiada del flujo sanguíneo a la circulación uteroplacentaria, por alteración de la placentación. En estudios experimentales, la hipoxia produce una placentación más superficial y aumento de la resistencia vascular, como sucede en la preeclampsia.
A pesar de factores de riesgo materno similares, la preeclampsia a 3 100 m ocurrió en 16%, mientras solo en 3% a 1 260 m. La presión arterial media disminuye hasta las 20 semanas en madres normotensas a 1 260 m, pero aumenta de manera linear en normotensas a 3 100 m y en preeclámpticas a 1 260 m y 3 100 m. El peso al nacer fue 285 g menor a 3 100 m de altura (48).
En un estudio en Bolivia, realizado a 300 m (Santa Cruz, n = 813) y en altura de 3 600 m (La Paz, n=1607), entre 1996 y 1999, se encontró que los bebes en altura pesan menos (3 084 g vs. 3 366 g, p < 0,01) y se encuentra más RCIU [16,8% vs. 5,9%; p < 0,01]. La preeclampsia y la hipertensión gestacional fueron 1,7 veces más frecuentes en la altura y 2,2 veces en las madres primíparas. Hubo aumento de sufrimiento fetal (OR 7,3) y distrés respiratorio del recién nacido (OR 7,3; p < 0,01). La hipertensión aumentó el riesgo de óbito fetal en la altura (OR 6,0), pero no a una menor altura (OR 1,9) (49).
Patologías asociadas a la preeclampsia
Las patologías que pueden asociarse a la preeclampsia son la hipertensión esencial, la obesidad, diabetes gestacional y diabetes mellitus tipo I, déficit de proteína S, déficit de proteína C, síndrome antifosfolipídico, hiperhomocisteinemia, embarazo múltiple, ciertas malformaciones congénitas, hidropesía fetal, cromosomopatías, mola hidatiforme.
Morbimortalidad materna y fetal
En el país, y en particular en EsSalud y en Lima Ciudad, hay exceso de mortalidad materna asociada a hipertensión arterial en el embarazo, por hemorragia intracerebral, eclampsia o disfunción de órgano terminal. Además, en quienes sobreviven, quedan como secuelas la hipertensión secundaria persistente, morbilidad neurológica y alteración renal. Las complicaciones maternas pueden ocurrir en todos los sistemas y órganos, incluyendo el sistema nervioso central, cardiopulmonar, renal, hematológico, hepático, ocular, uterino, placentario (1).
En una investigación sobre causas de muerte materna en hospitales del Perú, en 349 muertes maternas de 31 hospitales (50), se halló lo que se observa en la Tabla 2.
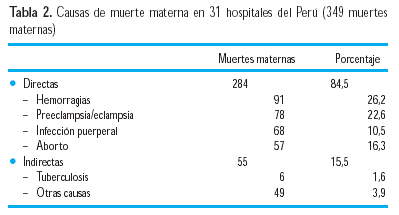
Otro estudio sobre mortalidad materna en el Hospital Nacional Edgardo Rebagliati Martins (HNERM) de EsSalud, entre 1958-2002, en 233 muertes (tasa 42,6/100 000 RNV), la hipertensión –principalmente preeclampsia/eclampsia- representó la primera causa de muerte, con 25,1% del total de muertes maternas (9). En la investigación sobre eclampsia en el mismo hospital, entre 1958 y 1988, hubo 154 casos (0,038%), destacando la asociación con anemia (59,8%) y piuria (46,9%), así como importante asociación con parto pretérmino (34,1%); durante el adecuado cuidado prenatal, solo se había llegado a diagnosticar preeclampsia en 12,9% de los casos que terminaron convulsionando (10). En 59,8% de los casos, la eclampsia ocurrió en el preparto (15,2% antes de las 32 semanas), 16,7% durante el parto y 23,5% en el puerperio.
En el feto, la preeclampsia se asocia con restricción del crecimiento fetal, prematuridad, alteración del bienestar fetal, muerte fetal, especialmente tardía. En el recién nacido, se encuentra hipoglicemia, hipocalcemia, hiperbilirrubinemia, infecciones, muerte neonatal, hipertensión arterial precoz, síndrome metabólico y dificultad para crecer y en el aprendizaje (1).
Complicaciones futuras del embarazo como riesgo de enfermedad metabólica y cardiovascular
Las mujeres con historia de preeclampsia, 17 años después del primer embarazo se caracterizan por insulina en ayunas elevada, repuesta exagerada a insulina en la prueba de tolerancia a la glucosa oral y presiones sistólica y diastólica elevadas. La vasodilatación también está alterada años más tarde, en mujeres con preeclampsia previa. No se observa diferencia en la rigidez arterial por flujometría de la arteria braquial. Esto contribuiría a un mayor riesgo cardiovascular en las mujeres con historia de preeclampsia (51).
Las mujeres con diabetes gestacional, hipertensión del embarazo o preeclampsia tienen mayor riesgo de desarrollar diabetes mellitus tipo 2 y enfermedad cardiovascular. La hipertensión crónica se desarrolla años después de la hipertensión del embarazo, especialmente si aparece en varios embarazos. Las mujeres con preeclampsia en las primeras 36 semanas de embarazo o en varios embarazos tienen mayor riesgo de morbimortalidad cardiovascular más adelante (52).
Predicción de la preeclampsia
Aún no existe una prueba clínicamente útil para predecir el desarrollo de preeclampsia. Son promisorias el combinar marcadores de insuficiencia placentaria y de función endotelial, y los niveles séricos o urinarios de PlGF y sFlT-1 en el primer trimestre.
Son factores que pudieran predecir la aparición de preeclampsia, la historia personal y familiar y ser nulípara (5%). El riesgo aumenta 5 veces si la madre de la gestante sufrió de PE severa. El riesgo disminuye a 1% en el segundo embarazo con mismo esposo (si es que nació de madre sana). El riesgo se incrementa si el esposo o pareja nació de madre con PE. El riesgo se presenta de novo en un embarazo con un nuevo esposo o nueva pareja. También, aparece en casos de fertilización in vitro, en el que la pareja no contribuyó con su eyaculado. Se considera además el uso prolongado de anticoncepción hormonal, las lesbianas que gestan con inseminación.
Hay alto riesgo de recurrencia de la PE, si en la gestación anterior hubo PE severa (hasta 65%),si la PE severa tuvo una presión sistólica >160 mmHg, si hubo PE severa con proteinuria durante más de 10 días, si presentó eclampsia o síndrome Hellp. También debe sospecharse preeclampsia si ha habido trombofilias, antecedente de trombosis venosa y/o embolismo pulmonar, enfermedades autoinmunes -como lupus eritematoso sistémico-, asociadas con tromboembolismo (riesgo de PE 50%).
Manejo terapéutico de la enfermedad hipertensiva en el embarazo
Las gestantes con hipertensión arterial (HTA) deben ser manejadas en centros especializados, donde se les proporcione un régimen higiénico-dietético adecuado y se pueda evaluar adecuadamente a la madre y al feto. Debemos conocer, de inicio, que la terapia antihipertensiva tiene poco efecto sobre el progreso del embarazo (53).
Manejo de la hipertensión crónica
Es recomendable usar tratamiento antihipertensivo en gestantes con HTA severa, para beneficio materno. La metildopa y el labetalol son de primera línea. Ni la metildopa ni la hidralazina se asocian con anormalidades fetales. El tratamiento de mujeres con HTA crónica leve no es de beneficio, porque no mejora el resultado perinatal. El beta-bloqueador atenolol puede asociarse con RCIU y no se recomienda su uso en el embarazo.
No se ha podido determinar la PA óptima para iniciar y mantener el tratamiento antihipertensivo. Sí se ha demostrado que la HTA crónica se asocia con aumento 3 veces del riesgo de mortalidad perinatal y 2 veces el riesgo de desprendimiento prematuro de placenta (DPP); también, aumenta el riesgo de aparición de preeclampsia y de bebes pequeños para la edad gestacional (PEG). Los riesgos son mayores en mujeres con la HTA más severa, con aparente aumento del riesgo fetal, aún sin una preeclampsia sobreimpuesta.
En un ensayo de ácido acetil salicílico 60 mg/d en gestantes con HTA crónica, en 774 mujeres, con inicio antes de las 26 semanas, el manejo profiláctico no redujo la aparición de preeclampsia, RCIU y mortalidad perinatal, ni aumentó la presencia de desprendimiento prematuro de la placenta (DPP), hemorragia posparto y hemorragia intraventricular del neonato (54).
Manejo de la preeclampsia
El tratamiento de la preeclampsia consiste en terminar el embarazo. Lo que queda por decidir es cuándo. Si el feto está a término, saludable y el cuello uterino es favorable, se indica inducir el parto; pero, si hay sufrimiento fetal o RCIU, no queda otra alternativa que la cesárea. Cuando el feto es inmaduro, la condición del feto y de la madre es la que señalará el camino a seguir. Se terminará inmediatamente el embarazo si la hipertensión severa persiste luego de tratamiento por 24 a 48 horas, si hay trombocitopenia, enzimas hepáticas elevadas, disfunción renal progresiva, signos premonitorios de eclampsia, ascitis materna (determinada por ecografía) o evidencia de sufrimiento fetal.
En líneas generales, lo siguiente resume el manejo de la preeclampsia en la actualidad (modificado de 55):
- Aspirina a dosis bajas en mujeres con preeclampsia previa de inicio precoz.
- Los bloqueadores de canales de calcio son muy útiles.
- Los simpatolíticos son usados, especialmente en la hipertensión crónica, pero no influyen en la progresión de la enfermedad.
- No usar diuréticos.
- No usar inhibidores de la enzima convertidora de angiotensina.
- Prevención con aspirina
La aspirina inhibe la ciclooxigenasa (COX). Al disminuir el tromboxano (TXA2), modifica la relación PGI2/TXA2 y tiende a reestablecer el balance fisiológico alterado por la invasión trofoblástica fallida. La administración continua de aspirina a dosis entre 0,3 y 1,5 g/kg por día parece inhibir con más efectividad la actividad COX de las plaquetas que la actividad COX de las células endoteliales.
Las células endoteliales son nucleadas y pueden resintetizar COX, a diferencia de las plaquetas anucleadas, que están permanentemente inactivadas. Solo las nuevas plaquetas formadas de megacariocitos pueden renovar TXA2, pero entonces ellas se vuelven incapaces de producir más, cuando se repite la administración de aspirina. Al revés, las células endoteliales renuevan PGI2 de manera rápida.
De esta manera, es apropiado prescribir un tratamiento preventivo con aspirina en embarazos en mujeres con historia de preeclampsia severa de inicio temprano o RCIU severa, definida como menor al tercer percentil. Además, un resultado anormal para la prueba de angiotensina II (dosis necesaria de angiotensina IV para incrementar la presión diastólica en 20 mm de Hg, prueba anormal si el resultado es <10 ng/(kg min)) o un síndrome antifosfolipídico (donde los anticuerpos anticardiolipina pueden interferir con la síntesis endotelial de PGI2) son indicaciones para la prevención con dosis bajas de aspirina, de 100 a 150 mg (16). Parece necesario empezar el tratamiento preventivo tan temprano como sea posible, a las 13 semanas o aún antes, dependiendo de las bases fisiopatológicas señaladas y la historia obstétrica. El tratamiento se continuará hasta las 35 semanas. Algunas veces, el tratamiento puede iniciarse antes de la concepción (enfermedades autoinmunes, tales como el síndrome antifosfolipídico), combinada con heparina o corticoesteroide. La terapia de prevención con dosis bajas de aspirina no es efectiva en mujeres con enfermedades médicas, como hipertensión crónica, nefropatía crónica o transplante renal, diabetes. No existe información convincente para prescribir aspirina a dosis bajas a pacientes con hallazgos Doppler anormales en arteria uterina, entre las 22 y 24 semanas de gestación.
- Manejo de la hipertensión leve
Idealmente, el manejo de la hipertensión leve debería consistir en una estadía corta en el hospital, de manera de controlar la hipertensión y el bienestar fetal. Se sugiere realizar una velocimetría Doppler de la arteria umbilical (56). La flujometría Doppler anormal de la arteria uterina en el segundo trimestre aumenta 6 veces el riesgo de la aparición de PE. La arteria umbilical se altera +4 semanas antes de la aparición de signos hipóxicos/acidóticos en la monitorización de la frecuencia cardiaca fetal. El grupo hipoxémico con RCIU presenta una redistribución arterial, con inversión de flujos, llegando a existir una relación cerebro/placentaria de <1.
La contracción miocárdica se daña dramáticamente +1 semana antes de que ocurra el óbito fetal. En fetos con restricción del crecimiento severa, el parámetro que tiene mayor correlación con la acidemia y la mortalidad perinatal es el ductus venoso alterado.
- Manejo de la hipertensión severa
El sulfato de magnesio (SO4Mg) sigue siendo el medicamento de primera elección para prevenir la eclampsia, así como disminuye la presión arterial. Se administra 4 a 6 g de inicio en 100 mL de solución salina en un lapso de media hora, seguido de 1 a 2 g IV cada hora. En la preeclampsia severa se emplea durante el trabajo de parto y el parto y por un mínimo de 24 horas en el puerperio. Una alternativa para la hipertensión severa aguda es la solución de SO4Mg al 20%, 4 g IV, en un lapso de 5 minutos, y seguir con la dosis de matenimiento indicada (57). El parto deberá ocurrir de inmediato si el estado materno o fetal no se estabiliza. Hay que hacer un seguimiento posparto por otras enfermedades hipertensivas o cardiovasculares coexistentes (56).
El nifedipino es un antagonista de los canales de calcio útil para el manejo de la hipertensión severa aguda. Al mismo tiempo que permite que se gane más tiempo, se obtiene también una mejor función renal (58). Nuestra experiencia es amplia y exitosa y lo utilizamos 10 mg vía oral, con una sistólica de >110 mmHg. Se sugiere repetir cada 4 horas, hasta en dos oportunidades, si la presión no mejorara. Mientras tanto, se prepara a la gestante para finalizar el embarazo.
Si fuera necesario, la mayoría de agentes antihipertensivos – excepto los inhibidores de la enzima convertidora de angiotensina y los agonistas del receptor de angiotensina II– pueden ser usados en el embarazo (59). Así, en el manejo de la hipertensión severa se emplea sulfato de magnesio IV, diazepán IV, labetalol IV, fenitoína IV, hidralazina EV y PO, nitroprusiato de sodio EV, metildopa PO, nifedipino PO, nitroglicerina EV.
En la UCI del HNERM, la preeclampsia es la causa obstétrica más importante de ingreso a dicha unidad, siendo en 90% de los casos preeclampsia más HTA refractaria y 5,5% eclampsia; de los casos, la mayoría presentó dolor epigástrico (65%), en 36% náuseas y vómitos, 31% cefalea frontal y otros, trastorno visual, sangrado diverso e ictericia.
- Manejo de la eclampsia
El manejo de la eclampsia es similar al de la preeclampsia, con la diferencia que hay que tratar las convulsiones (SO4Mg, fenobarbital), se debe proteger a la mujer de lesiones (bajalenguas acolchado, barandas, vigilancia permanente), aspirar luego de las convulsiones, administrar oxígeno (a veces, intubar, luego de las convulsiones), posicionar a la mujer sobre su costado izquierdo (para reducir el riesgo de aspiración de secreciones, vómitos) y terminar el embarazo tan pronto como sea posible, sin pasar de 4 a 6 horas. Además, y de acuerdo al caso, se dará medicamentos antihipertensivos, se mantendrá vía IV, se cateterizará la vejiga para medir la producción de orina, se mantendrá balance estricto de líquidos, vigilar edema pulmonar, evaluar el estado de coagulación con prueba de tubo al lado de la cama y no dejar sola a la mujer en momento alguno.
- Manejo del síndrome Hellp
El síndrome caracterizado por hemólisis, enzimas hepáticas elevadas y plaquetopenia es un cuadro que puede ocurrir con hipertensión leve o aún sin hipertensión, con plaquetopenia leve, elevaciones mínimas de las enzimas hepáticas y con escasa disfunción renal, para luego progresar rápidamente al grave síndrome Hellp.
El manejo del síndrome Hellp consiste en valorar y estabilizar rápidamente a la madre, corregir la coagulación intravascular diseminada (CID), prevenir las convulsiones con SO4Mg, tratar la hipertensión aguda severa. Se hará la transferencia a una unidad de cuidados intensivos de un centro hospitalario de nivel 3 o 4, en donde se solicitará una tomografía axial computarizada o ultrasonido, ante la sospecha de un hematoma subcapsular del hígado.
Se determinará el bienestar del feto, solicitando un perfil biofísico, biometría, monitorización, establecer la madurez.
El perfil hepático, el perfil de coagulación, el hallazgo de hemólisis, el hematoma subcapsular determinado por la ecografía o TAC abdominal, guiarán el empleo de plasma fresco congelado (que es pasado en 30 minutos a 1 hora). El concentrado de plaquetas será para reponer si los valores son menores a 50,000. Se recuerda que 1 unidad de concentrado de plaquetas eleva los valores en 10 000 plaquetas. Se indica paquete globular si la hemoglobina es menor de 8 gramos. Se iniciará hemodiálisis en los casos de insuficiencia renal aguda hipercatabólica y plasmaféresis en la sospecha de anticuerpos antiendoteliales.
Referencias bibliográficas
1. Pacheco J. Ginecología y Obstetricia. Segunda edición. Lima: MAD Corp SA, 2006. [ Links ]
2. Sánchez S. Análisis de la mortalidad materna en la Disa V Lima Ciudad. Periodo 2000-2004. Dirección de Epidemiología. Disa V Lima Ciudad. [ Links ]
3. National Heart, Lung, and Blood Institute. Report of the Working Group on Research on hypertension during pregnancy. 27 de abril de 2001. [ Links ]
4.Committee on Terminology of the American College of Obstetricians and Gynecologists and National High Blood Pressure Education Program. [ Links ]
5.Pacheco J, Wagner P, Williams N, Sánchez S. Enfermedades hipertensivas de la gestación. En: Pacheco J (Editor). Ginecología y Obstetricia. Segunda edición. Lima: MAD Corp SA, 2006. En prensa [ Links ]
6.Chirinos J. Incidencia y características de la enfermedad hipertensiva en el embarazo: Estudio retrospectivo a nivel del mar y en la altura. Acta Andina. 1995;4(1):25-34. [ Links ]
7.Contreras HM, Espinosa DP, Estremadoyro VB. Variación estacional de la preeclampsia. Hospital Nacional Arzobispo Loayza. Rev Per Ginecol Obstet. 2003;49(2):95-102. [ Links ]
8.Calderón R. Frecuencia de la hipertensión en el embarazo. Ginecol Obstet 1997;43(1):29-32 [ Links ]
9. Farro A, Pacheco J. Mortalidad materna. Experiencia en el Hospital Nacional Edgardo
Rebagliati Martins , EsSalud 1958 – 2002. Rev Per Ginecol Obstet. 2003;49(1):18-30.
10. Pacheco J, Valdivia E, Huaman M, Carrasco N, Yui L. Eclampsia: Experiencia en 30 años en el Hospital Nacional Edgardo Rebagliati Martins - IPSS Ginecol Obstet (Perú). 1989;35:10. [ Links ]
11. Román-Pilco C, Román-Loayza C. Mortalidad materna y perinatal en el síndrome Hellp en el Hospital Nacional Cayetano Heredia. Ginecol Obstet (Perú). 1999(45)3:200-1. [ Links ]
12. Távara L. Contribución de las adolescentes a la muerte materna en el Perú. Rev
Per Ginecol Obstet. 2004;50(2):111-22.
13. Román-Pilco C, Román-Loayza C. Eclampsia. Mortalidad materna y perinatal. Hospital Nacional Cayetano Heredia. Ginecol Obstet (Perú). 1999;45(4):270-3. [ Links ]
14. Pacora P, Oyarzún E, Belmar C, Huiza L, Santibáñez A, Romero R. La preeclampsia-eclampsia es un síndrome multifactorial. Rev Per Ginecol Obstet. 2004:50(4):223-31. [ Links ]
15. Olivencia C, Trelles M, Herrera C, Edwards L, Cornejo G, Olivencia M. Síndrome HELLP. Cinco años de experiencia en el Hospital Víctor Lazarte Echegaray. Rev Per Ginecol Obstet. 2003;49(3):173-9. [ Links ]
16. Merviela P, Carbillon L, Challierb J-C, Rabreaud M, Beaufilse M, Uzan S. Pathophysiology of preeclampsia: links with implantation disorders. Review. Eur J Obstet Gynecol Reprod Biol. 2004;115:134–47. [ Links ]
17. Zybina TG, Zybina EV. Genome multiplication In the tertiary giant trophoblast cells in the course of their endovascular and interstitial invasion into the rat placenta decidua basalis. Early Pregnancy: Biology and Medicine. 2000;4(2):1099-109. [ Links ]
18. Zygmunt M, Herr F, Munstedt K, Lang U, Liang OD. Angiogenesis and vasculogenesis in pregnancy. Eur J Obstet Gynecol Reprod Biol. 2003;110 Suppl 1:S10-8. [ Links ]
19. Shibuya M. structure and function of VEGF/VEGF-receptor system involved in angiogenesis. Cell Struct Funct. 2001;66:25-35. [ Links ]
20. Maynard SE, Min JY, Merchan J, Lim KH, Li J, Mondal S, et al. Excess placental soluble fms-like tyrosine kinase 1 (sFlt1) may contribute to endothelial dysfunction, hypertension, and proteinuria in preeclampsia. J Clin Invest. 2003;111:649-58. [ Links ]
21. Verhaar MC, Rabelink TJ. The endothelium: a gynecological and obstetric point of view. Eur J Obstet Gynecol Reprod Biol. 2001 Feb;94(2):180-5. [ Links ]
22. Walsh SW. Preeclampsia: an imbalance in placental prostacyclin and thromboxane production. Am J Obstet Gynecol. 1985;152:335–40. [ Links ]
23. Jauniaux E, Watson AL, Hempstock J, Bao YP, Skepper JN, Burton GJ. Onset of maternal arterial blood flow and placental oxidative stress. A possible factor in human early pregnancy failure. Am J Pathol. 2000;157:2111–22. [ Links ]
24. Halliwell B. Free radicals, antioxidants, and human diseases: curiosity, cause or consequence? Lancet. 1994;344:721–4. [ Links ]
25. Huppertz B, Kadyrov M, Kingdom JC. Apoptosis and its role in the trophoblast. Am J Obstet Gynecol. 2006;195(1):29-39. Epub 2006 Mar 31. [ Links ]
26. Wegman TG. Foetal protection against abortion: is it immunosuppression or immunostimulation? Am Immunol Inst Pasteur. 1984;135:309–11. [ Links ]
27. Warner CM, Tyas DA, Goldstein C, Comiskey M, Cohen J, Brenner CA. Genotyping: the HLA system and embryo development. Reprod Biomed Online. 2002;4(2):133-9. [ Links ]
28. Yie SM, Li LH, Li YM, Librach C. HLA-G protein concentrations in maternal serum and placental tissue are decreased in preeclampsia. Am J Obstet Gynecol. 2004;191(2):525-9. [ Links ]
29. Emmer PM, Joosten I, Schut MH, Zusterzeel PL, Hendriks JC, Steegers EA. Shift in expression of HLA-G mRNA spliceforms in pregnancies complicated by preeclampsia. J Soc Gynecol Investig. 2004;11(4):220-6. [ Links ]
30. Mahmoud F, Omu A, Abul H, El-Rayes S, Haines D. Lymphocyte subpopulations in pregnancy complicated by hypertension. J Obstet Gynaecol. 2003;23(1):20-6. [ Links ]
31. Schrocksnadel H, Herold M, Steckel-Berger G, Fuchs D, Wachter H, Dapunt O. [Cellular immunity in pregnancy-induced hypertensive diseases] [Article in German]. Geburtshilfe Frauenheilkd. 1992;52(10):592-5. [ Links ]
32. Luppi P, Tse H, Lain KY, Markovic N, Piganelli JD, Deloia JA. Preeclampsia activates circulating immune cells with engagement of the NF-kappaB pathway. Am J Reprod Immunol. 2006 Aug;56(2):135-44. [ Links ]
33. Liston WA, Kilpatrick DC. Is genetic susceptibility to preeclampsia conferred by homozygosity for the same single recessive gene in mother and fetus? Br J Obstet Gynaecol. 1991;98:1079–86. [ Links ]
34. Esplin MS, Fausett MB, Fraser A, et al. Paternal and maternal components of the predisposition to preeclampsia. N Engl J Med. 2001;344:867–72. [ Links ]
35. Sontia B, Touyz RM. Role of magnesium in hypertension. Arch Biochem Biophys. 2006 May 24; [Epub ahead of print]
36. Winkler K1, Wetzka B2, Kinner M2, Hoffmann MM1, Friedrich I1, Baumstark MW3, Wieland H1, März W1, Zahradnik HP2. Remnant disease like dyslipoproteinemia in preeclampsia. 1Abtl. Klinische Chemie, 2Universitätsfrauenklinik II, 3Sportmedizin, Freiburg. [ Links ]
37. Innes KE, Wimsatt JH, McDuffie R. Relative glucose tolerance and subsequent development of hypertension in pregnancy. Obstet Gynecol. 2001;97(6):905-10. [ Links ]
38. Yasuhi I, Hogan JW, Canick J, Sosa MB, Carpenter MW. Midpregnancy serum C-peptide concentration and subsequent pregnancy-induced hypertension. Diabetes Care. 2001;24(4):743-7. [ Links ]
39. Thadhani R, Ecker JL, Mutter WP, Wolf M, Smirnakis KV, Sukhatme VP, Levine RJ, Karumanchi SA. Insulin resistance and alterations in angiogenesis: additive insults that may lead to preeclampsia. Hipertensión. 2004;43(5):988-92. Epub 2004 Mar 15. [ Links ]
40. Laivuori H, Kaaja R, Turpeinen U, Viinikka L, Ylikorkala O. Plasma homocysteine levels elevated and inversely related to insulin sensitivity in preeclampsia. Obstet Gynecol.1999;93(4):489-93. [ Links ]
41. Williams M. Preeclampsia: Consideraciones sobre etiología y mecanismos y estrategias de prevención. Conferencia Asoc Per Med Fetal, 18 abr 2004. [ Links ]
42. Castagnini LA, Manrique C, Mere JF, García-Hjarles MA. Determinación de los niveles séricos de -hCG como predictor de preeclampsia. Rev Per Ginecol Obstet. 2004;50:19-23.
43. Hackett P: High altitude and common medical conditions, En: Hornbein T, Schoene R.: High Altitude: An Exploration of Human Adaptation, NY, NY: Dekker, 2001: 839. [ Links ]
44. Zamudio S, Palmer SK, Droma T, Stamm E, Coffin C, Moore LG. Effect of altitude on uterine artery blood flow during normal pregnancy. J Appl Physiol. 1995;79:7-14. [ Links ]
45. Tissot M, Grilli A, Chapman P, Broad E, Tyson W, Heller DS, Zwerdlinger L, Zamudio S. Remodelling of uteroplacental arteries is decreased in high altitude placentas. High Altitude Med Biol. 2002;3(4):427-60. Posted online on July 6, 2004 (doi:10.1089/15270290260512927) [ Links ]
46. Zamudio S. The placenta at high altitude. High Alt Med Biol. 2003;4(2):171-91. [ Links ]
47. Zamudio S, Palmer SK, Droma T, Stamm E, Coffin C, Moore LG. Effect of altitude on uterine artery blood flow during normal pregnancy. J Appl Physiol. 1995;79:7-14. [ Links ]
48. Palmer SK, Moore LG, Young D, Cregger B, Berman JC, Zamudio S. Altered blood pressure course during normal pregnancy and increased preeclampsia at high altitude (3100 meters) in Colorado. Am J Obstet Gynecol. 1999;180(5):1161-8. [ Links ]
49. Keyes LE, Armaza JF, Niermeyer S, Vargas E, Young DA, Moore LG. Intrauterine growth restriction, preeclampsia, and intrauterine mortality at high altitude in Bolivia. Pediatr Res. 2003;54(1):20-5. Epub 2003 Apr [ Links ]
50. Távara L, Sacsa D, Frisancho O, Urquizo R, Carrasco N, Tavera M. Estado actual de la mortalidad materna en los hospitales del Perú. Ginecol Obstet (Perú). 1999;45(1):38-42. [ Links ]
51. Lampinen KH, Ronnback M, Kaaja RJ, Groop PH. Impaired vascular dilatation in women with a history of pre-eclampsia. J Hypertens. 2006 Apr;24(4):751-6. Comentario en: J Hypertens. 2006;24(4):639-41. [ Links ]
52. Sikkema JM, Bruinse HW, Visser GH, Franx A. [Pregnancy complications as a risk factor for metabolic and cardiovascular disease in later life] [Ned Tijdschr Geneeskd. 2006 Apr 22;150(16):898-902. [ Links ]
53. Mounier Vehier C, Valat Rigot AS, Devos P, Equine O, Carre A. Syndromes hypertensifs de la femme enceinte. Prise en charge diagnostique et therapeutique. Presse Med. 1999;28(16):886-91. [ Links ]
54. American College of Obstetricians & Gynecologists. Management of Chronic Hypertension During Pregnancy. Evidence Report/Technology Assessment: Number 14, 2000. [ Links ]
55. Pipkin FB. Fortnightly Review: The hypertensive disorders of pregnancy. BMJ. 1995;311:609-13. [ Links ]
56. Shear R, Leduc L, Rey E, Moutquin JM. Hypertension in pregnancy: new recommendations for management [In Process Citation] . Curr Hypertens Rep. 1999;1(6):529-39.
57. Organización Mundial de la Salud/Organización Panamericana de la Salud. Manejo de las complicaciones del embarazo y el parto: Guía para obstetrices y médicos. JHPiego, 2002:S-49, A-7. [ Links ]
58. Hall DR, Odendaal HJ, Steyn DW, Smith M. Nifedipine or prazosin as a second agent to control early severe hypertension in pregnancy: a randomised controlled trial. BJOG. 2000 Jun;107(6):759-65. [ Links ]
59. National Heart, Lung, and Blood Institute (NHLBI) of the National Institutes of Health. The National High Blood Pressure Education Program (NHBPEP) Coordinating Committee. The "2000 Working Group Report on High Blood Pressure in Pregnancy. 24 October 2000. [ Links ]













